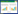文章信息
- 杨健, 张立喜, 史博
- YANG Jian, ZHANG Lixi, SHI Bo
- 石见穿多糖通过PTEN通路对骨肉瘤小鼠的抑瘤作用及对免疫功能的影响
- The anti-tumor effect of polysaccharides from salvia chinensis on osteosarcoma mice and its effect on immune function through PTEN pathway
- 天津中医药, 2022, 39(7): 940-944
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(7): 940-944
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.07.23
-
文章历史
- 收稿日期: 2022-03-02
2. 唐山市丰南区医院骨科, 唐山 063300;
3. 沧州人民医院骨科, 沧州 061000
骨肉瘤每年每百万人中约有4~5人发病,本身发病率不高,但多见于10~20岁青少年,恶性程度及病死率高,近几十年患者生存率并未得到改善,严重危及患病人群生命[1]。化疗结合手术是目前治疗骨肉瘤的主要方式,可提高患者生存质量,但此治疗手段预后较差,探索安全有效的治疗方法有重要意义。随着临床对骨肉瘤研究深入,国内外学者均发现[2-3]免疫疗法或可成为骨肉瘤治疗新前景。石见穿是华鼠尾草地上部分,具有散结消肿、清热利湿之效,被应用于癌症治疗中,并显示出肯定效果[4],而其有效成分石见穿多糖(PSSC)具有抗肿瘤免疫调节作用[5],目前已有研究表明,PSSC可通过Wnt/β-catenin信号通路[6]、增强γδT细胞[7]来发挥骨肉瘤细胞杀伤作用。此外,另有研究发现[8],癌症患者抗肿瘤免疫与骨髓细胞中抑癌基因第10染色体同源丢失性磷酸酶-张力蛋白基因(PTEN)表达相关,但PSSC是否对PTEN表达有影响,临床鲜有研究。基于此,研究建立骨肉瘤小鼠模型,探讨PSSC通过PTEN通路对骨肉瘤小鼠的抑瘤作用及对免疫功能的影响,为临床治疗提供新思路。
1 材料与方法 1.1 材料 1.1.1 实验动物取60只BALB/C雄性裸鼠(北京唯尚立德生物科技有限公司,许可证号:SCXK(京)2016-0009),6周龄,体质量17~22 g,SPF级环境独立通风笼具(IVC)饲养,12 h明-暗交替,23~25 ℃温度,50%~60%湿度,自由摄食饮水。
1.1.2 主要仪器与试剂PSSC(成都彼样生物科技有限公司)、MG-63人骨肉瘤细胞(上海北诺生物科技有限公司)、RPMI 1640培养基(上海跃腾生物技术有限公司)、吖啶橙-溴乙锭染色液(上海麦克林生化科技有限公司);CD4+、CD3+抗体及PTEN、磷酸肌醇3-激酶(PI3K)、磷酸化蛋白激酶B(p-Akt)抗体(Abcam公司);流式细胞仪(Attune NxT,赛默飞世尔科技公司)、转印电泳仪(DYCZ-40D,武汉纯度生物科技有限公司)。
1.2 方法 1.2.1 建立骨肉瘤小鼠模型细胞培养,使用RPMI 1640培养基(含有10%胎牛血清、50 mg/mL链霉素、50 U/mL青霉素)培养MG-63人骨肉瘤细胞,在5% CO2、37 ℃培养箱中培养,定期更换培养液,观察细胞生长情况。
构建模型[9],将小鼠饲养在无菌层流柜中,1周后,乙醇消毒,将对数生长期MG-63细胞皮下注射至小鼠右侧臀部,剂量为0.1 mL(1×107个),观察小鼠成瘤情况,1周后裸鼠长出皮下肿块(肿瘤直径约1 cm)为建模成功,剪脚趾标记,弃去成瘤失败小鼠。
1.2.2 分组与干预方法60只小鼠,取12只为对照组,另外48只建立骨肉瘤小鼠模型,成功建模42只,随机分为模型组(11只)、PSSC低剂量组(11只)、PSSC高剂量组(10只)、顺铂组(10只)。
建模成功第2日开始干预,PSSC低剂量组、PSSC高剂量组分别每日腹腔注射PSSC 10、100 mg/kg;顺铂组腹腔注射顺铂2 mg/kg,于开始干预第1、4、7、10、13天各给药1次;对照组与模型组每日腹腔注射等体积生理盐水,各组小鼠均为每日干预1次,连续注射2周。
1.2.3 移植瘤体积变化干预期间每2 d测量1次小鼠移植瘤最短径、最长径,观察移植瘤生长情况,计算体积(最短径2×最长径/2),绘制小鼠肿瘤生长曲线。
1.2.4 流式细胞仪测定小鼠外周血淋巴细胞亚群末次测量结束后,摘眼球取血,肝素钠震荡抗凝,300×g,离心半径16 cm,离心5 min取血清,磷酸盐缓冲液(PBS)重悬调整细胞浓度,添加抗体,避光孵育30 min(4 ℃),加细胞裂解液,室温孵育5 min,加PBS终止,同上述条件离心,加流式缓冲液洗涤,再次离心,加细胞固定液过夜,并进行筛滤,使用流式细胞仪检测外周血CD4+、CD3+T细胞比例。
1.2.5 天平测定小鼠移植瘤质量取血结束后,断颈处死小鼠,无菌分离出肿瘤组织,使用天平称质量,记录移植瘤质量。
1.2.6 苏木精-伊红(HE)染色观察肿瘤病理组织变化取部分肿瘤组织,4%多聚甲醛溶液固定,梯度乙醇脱水,常规石蜡包埋,制作出4 μm厚度切片,将切片脱蜡、水化,常规HE染色,脱水,二甲苯透明,中性树胶封片,显微镜观察肿瘤病理变化。
1.2.7 统计肿瘤细胞凋亡率取移植瘤组织,制成单细胞悬液,吖啶橙-溴乙锭染色,荧光显微镜扫描,识别细胞类型,阳性凋亡细胞:细胞核呈棕褐色;正常细胞:亮绿色荧光,细胞质均匀,镜下随机选4个视野统计细胞,计算凋亡率。
1.2.8 蛋白免疫印迹(Western Blot)法检测移植瘤组织PTEN、PI3K及p-Akt蛋白表达于移植瘤组织中加入蛋白裂解液,提取细胞总蛋白,离心12 000 r/min,离心半径8 cm,10 min,取上清液,取蛋白样品30 g,与12.5% SDS-PAGE中进行蛋白分离,将蛋白转印于聚偏二氟乙烯(PVDF)膜,并将其放入5%脱脂奶粉中,封闭1 h,TBST洗膜,加入兔抗小鼠PTEN(稀释1∶500)、PI3K(稀释1∶800)、p-Akt(稀释1∶800)、β-actin(稀释1∶1 000)抗体孵育,回收一抗,TBST洗涤,加稀释(均为1∶2 000)山羊抗兔抗体,孵育洗涤,曝光检测,分析蛋白条带,以β-actin为内参,目的蛋白条带灰度值与β-actin内参条带灰度值比值为目的蛋白相对表达量。
1.3 统计学方法采用SPSS 26.0分析数据,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 移植瘤体积生长曲线显示,随干预时间延长,各组小鼠移植瘤体积逐渐增长,干预第2、4天4组小鼠移植瘤体积比较,差异无统计学意义(P>0.05);干预第6、8、10、12、14天PSSC低剂量组、PSSC高剂量组、顺铂组小鼠移植瘤体积低于模型组,且PSSC高剂量组、顺铂组小鼠移植瘤体积低于PSSC低剂量组,差异具有统计学意义(P<0.05);干预第6、8、10、12、14天PSSC高剂量组、顺铂组两组小鼠移植瘤体积比较,差异无统计学意义(P>0.05)。见图 1。
|
| 注:与模型组比较,*P<0.05;与PSSC低剂量组比较,#P<0.05。 图 1 各组小鼠移植瘤体积生长曲线 Fig. 1 Growth curve of transplanted tumor volume of mice in each group |
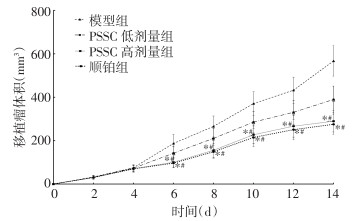
4组小鼠移植瘤质量比较,差异有统计学意义(P<0.05);两两比较显示,PSSC低剂量组、PSSC高剂量组、顺铂组小鼠移植瘤质量低于模型组,差异具有统计学意义(P<0.05);PSSC高剂量组、顺铂组小鼠移植瘤质量低于PSSC低剂量组,差异具有统计学意义(P<0.05);PSSC高剂量组、顺铂组两组小鼠移植瘤质量比较,差异无统计学意义(P>0.05)。见表 1。
|
5组小鼠外周血CD4+、CD3+T细胞比例比较,差异有统计学意义(P<0.05);两两比较显示,模型组外周血CD4+、CD3+T细胞比例低于对照组,差异有统计学意义(P<0.05);PSSC低剂量组、PSSC高剂量组外周血CD4+、CD3+T细胞比例高于模型组,顺铂组外周血CD4+、CD3+T细胞比例低于模型组,差异有统计学意义(P<0.05);PSSC高剂量组外周血CD4+、CD3+T细胞比例高于PSSC低剂量组,顺铂组外周血CD4+、CD3+T细胞比例低于PSSC低剂量组,差异有统计学意义(P<0.05)。见表 2。

|
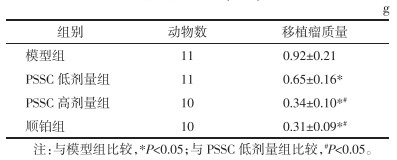
模型组肿瘤细胞核大而深染,核浆比值高,细胞膜完整,整体排列紧密;干预后,PSSC低剂量组、PSSC高剂量组、顺铂组出现不同程度改变,PSSC低剂量组细胞核染色稍浅,细胞膜轮廓不清,部分细胞核分裂,肿瘤细胞密度降低,而PSSC高剂量组、顺铂组上述变化程度进一步加重,细胞核固缩,核分裂明显,细胞结构明显不完整,坏死区域增大。见图 2。
|
| 图 2 各组小鼠HE染色肿瘤病理变化(×200) Fig. 2 Pathological changes of tumor stained with HE in mice of each group(×200) |
4组小鼠肿瘤细胞凋亡率比较,差异有统计学意义(P<0.05);两两比较显示,PSSC低剂量组、PSSC高剂量组、顺铂组小鼠肿瘤细胞凋亡率高于模型组,差异具有统计学意义(P<0.05);PSSC高剂量组、顺铂组小鼠肿瘤细胞凋亡率高于PSSC低剂量组,差异具有统计学意义(P<0.05);PSSC高剂量组与顺铂组小鼠肿瘤细胞凋亡率比较,差异无统计学意义(P>0.05)。见表 3。
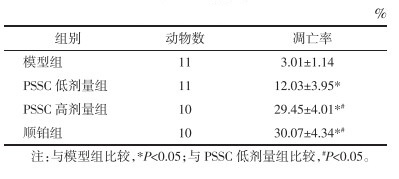
|
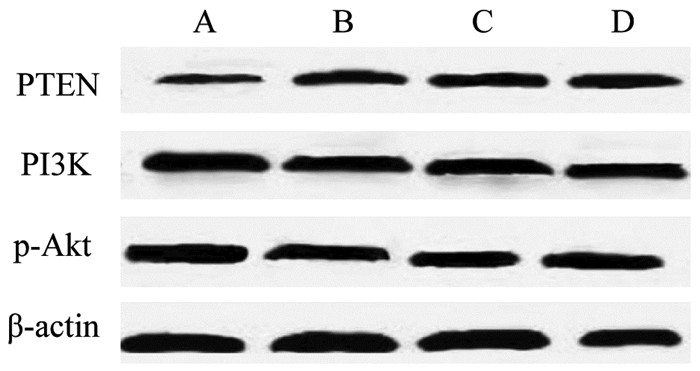
4组小鼠移植瘤PTEN、PI3K、p-Akt蛋白表达比较,差异有统计学意义(P<0.05);两两比较显示,PSSC低剂量组、PSSC高剂量组、顺铂组移植瘤PTEN蛋白表达高于模型组,移植瘤PI3K、p-Akt蛋白表达低于模型组,差异具有统计学意义(P<0.05);PSSC高剂量组、顺铂组移植瘤PTEN蛋白表达高于PSSC低剂量组,移植瘤PI3K、p-Akt蛋白表达低于PSSC低剂量组,差异具有统计学意义(P<0.05);PSSC高剂量组、顺铂组两组移植瘤PTEN、PI3K、p-Akt蛋白表达比较,差异无统计学意义(P>0.05)。见图 3、表 4。
|
| 注:A.模型组;B.PSSC低剂量组;C.PSSC高剂量组;D.顺铂组。 图 3 各组小鼠移植瘤PTEN、PI3K、p-Akt蛋白表达 Fig. 3 Expression of PTEN, PI3K and p-Akt proteins in transplanted tumors of mice in each group |
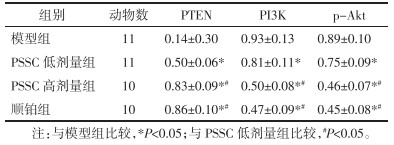
|
近年来,研究发现中药提取物逐渐被应用于骨肉瘤新靶点治疗中,在阻滞细胞周期、诱导肿瘤细胞凋亡等方面显示出独特的优势[10-11]。周文静等[10]学者发现,石见穿治疗肺癌的机制与抗炎、抑制肿瘤血管新生等有关;而另有学者总结发现[11-12]石见穿提取物中的多糖、三萜、多酚等有效成分能抑制肿瘤细胞增殖与转移,诱导凋亡,而PSSC是石见穿主要活性成分,可诱导细胞凋亡、线粒体损伤,可通过阻碍Wnt/β-catenin信号通路来抑制肿瘤转移、侵袭。本研究建立骨肉瘤小鼠模型,予以不同方式干预,结果发现PSSC可阻滞肿瘤细胞周期,诱导骨肉瘤细胞凋亡,肿瘤细胞无法无限制复制繁殖,降低移植瘤体积与质量,减轻小鼠肿瘤病理变化程度,以抑制肿瘤进展。
目前证实PTEN作为抑癌基因,PTEN缺失可使机体不同程度失去抵抗肿瘤的能力[13]。有学者发现[14-15],通过靶向PTEN,可促进骨肉瘤细胞增殖或凋亡,临床或可通过直接靶向骨肉瘤PTEN来研发相关药物,以发挥更为安全有效的用药价值。本研究进一步分析PSSC在骨肉瘤小鼠T淋巴细胞群与PTEN相关蛋白表达中的作用发现PSSC在提高小鼠免疫能力与促进PTEN表达方面有肯定效果,且PSSC高剂量组效果优于低剂量组,另外PSSC高剂量组蛋白表达水平与顺铂组无统计学差异,但顺铂组出现明显免疫抑制,从而表明PSSC可通过激活PTEN、抑制PI3K/p-Akt表达来促进肿瘤细胞凋亡,还可提高小鼠免疫活性,多靶点整体提高抑癌效果。
综上,PSSC可增强骨肉瘤小鼠免疫活性,降低移植瘤体积、质量,提高肿瘤细胞凋亡率,其机制可能是PSSC可激活PTEN通路,促进PTEN蛋白表达,降低PI3K、p-Akt蛋白表达以发挥抑癌作用,为临床骨肉瘤药物研发提供新思路及理论支持。
| [1] |
CORRE I, VERRECCHIA F, CRENN V, et al. The osteosarcoma microenvironment: a complex but targetable ecosystem[J]. Cells, 2020, 9(4): E976. DOI:10.3390/cells9040976 |
| [2] |
HARRISON D J, GELLER D S, GILL J D, et al. Current and future therapeutic approaches for osteosarcoma[J]. Expert Review of Anticancer Therapy, 2018, 18(1): 39-50. DOI:10.1080/14737140.2018.1413939 |
| [3] |
ZHOU Y, YANG D, YANG Q C, et al. Single-cell RNA landscape of intratumoralheterogeneity and immunosuppressive microenvironment in advanced osteosarcoma[J]. Nature Communications, 2020, 11(1): 6322. DOI:10.1038/s41467-020-20059-6 |
| [4] |
WANG N, TAN H Y, CHAN Y T, et al. Identification of WT1 as determinant of heptatocellular carcinoma and its inhibition by Chinese herbal medicine Salvia chinensisBenth and its active ingredient protocatechualdehyde[J]. Oncotarget, 2017, 8(62): 105848-105859. DOI:10.18632/oncotarget.22406 |
| [5] |
程卓, 赵文豪, 黄旭, 等. 石见穿多糖对H22荷瘤小鼠的抗肿瘤免疫调节作用[J]. 天然产物研究与开发, 2016, 28(6): 846-851, 915. CHENG Z, ZHAO W H, HUANG X, et al. Anti-tumor and immunomodulatory effects of polysaccharides from Salvia chinensis Benth.on H22 tumor-bearing mice[J]. Natural Product Research and Development, 2016, 28(6): 846-851, 915. |
| [6] |
李增, 张瑞, 张晓坚, 等. 石见穿多糖通过Wnt/β-catenin信号通路调控骨肉瘤细胞的迁移和侵袭[J]. 中成药, 2020, 42(9): 2324-2328. LI Z, ZHANG R, ZHANG X J, et al. Salvia chinensis Benth.polysaccharides regulate the migration and invasion of osteosarcoma cells via Wnt/β-catenin signaling pathway[J]. Chinese Traditional Patent Medicine, 2020, 42(9): 2324-2328. DOI:10.3969/j.issn.1001-1528.2020.09.014 |
| [7] |
宋建治, 孙智珺. 石见穿多糖增强γδT细胞对骨肉瘤细胞的杀伤作用[J]. 免疫学杂志, 2020, 36(12): 1053-1058. SONG J Z, SUN Z J. Polysaccharides from Salvia chinensisBenth enhance the killing effect of γδT cells against osteosarcoma cells[J]. Immunological Journal, 2020, 36(12): 1053-1058. |
| [8] |
HUANG Y, WANG H Y, HAO Y Z, et al. Myeloid PTEN promotes chemotherapy-induced NLRP3-inflammasome activation and antitumour immunity[J]. Nature Cell Biology, 2020, 22(6): 716-727. DOI:10.1038/s41556-020-0510-3 |
| [9] |
汤小燕, 赵迎春, 金林, 等. 2-甲氧基雌二醇对骨肉瘤MG63细胞荷瘤小鼠的抑瘤作用及其机制[J]. 武汉大学学报(医学版), 2020, 41(2): 215-219. TANG X Y, ZHAO Y C, JIN L, et al. Anticancer effects and the mechanism of 2-methoxyestradiol on human osteosarcomas in vivo[J]. Medical Journal of Wuhan University, 2020, 41(2): 215-219. |
| [10] |
周文静, 马艳苗, 张萌, 等. 石见穿治疗肺癌的网络药理学机制研究[J]. 中药新药与临床药理, 2020, 31(6): 677-684. ZHOU W J, MA Y M, ZHANG M, et al. Network pharmacology study on the mechanism of Salvia chinensis in treatment of lung cancer[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2020, 31(6): 677-684. |
| [11] |
刘媛, 钱荣康, 钱荣华. 石见穿及其提取物抗肿瘤的研究进展[J]. 现代中西医结合杂志, 2018, 27(30): 3417-3420. LIU Y, QIAN R K, QIAN R H. Research progress of Shijianchuan and its extract on anti-tumor[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2018, 27(30): 3417-3420. |
| [12] |
WANG Q, HU Z Q, LI X X, et al. Salviachinensines A-F, antiproliferative phenolic derivatives from the Chinese medicinal plant Salvia chinensis[J]. Journal of Natural Products, 2018, 81(11): 2531-2538. |
| [13] |
JAMASPISHVILI T, BERMAN D M, ROSS A E, et al. Clinical implications of PTEN loss in prostate cancer[J]. Nature Reviews Urology, 2018, 15(4): 222-234. |
| [14] |
YU W, CHEN P B, CHEN F C, et al. microRNA-744 promotes proliferation of osteosarcoma cells by targeting PTEN[J]. Molecular Medicine Reports, 2020, 21(5): 2276-2282. |
| [15] |
ZHENG C X, TANG F, MIN L, et al. PTEN in osteosarcoma: recent advances and the therapeutic potential[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2020, 1874(2): 188405. |
2. Department of Orthopedics, Fengnan District Hospital of Tangshan City, Tangshan 063300, China;
3. Department of Orthopedics, Cangzhou People's Hospital, Cangzhou 061000, China
 2022, Vol. 39
2022, Vol. 39