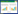文章信息
- 翟留玉, 韩鹦赢, 路玲, 张文玉, 孙娜, 常文秀
- ZHAI Liuyu, HAN Yingying, LU Ling, ZHANG Wenyu, SUN Na, CHANG Wenxiu
- 尿毒清对慢性肾脏病3~4期患者肠道微生态影响的临床研究
- Clinical study of Niaoduqing on intestinal microecology in patients with stage 3~4 chronic kidney disease
- 天津中医药, 2022, 39(8): 976-981
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(8): 976-981
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.08.06
-
文章历史
- 收稿日期: 2022-03-04
慢性肾脏病(CKD)已经成为全球性的公共健康问题,具有患病率和病死率高、知晓率低、预后差及医疗费用高等特点,中国CKD总患病率高达10.8%,其进展严重影响患者的生存和生活质量[1]。CKD进展至终末期肾病(ESRD)阶段,治疗方面主要包括减少合并症及使用替代疗法,如腹膜透析、血液透析和肾脏移植。因此,寻找可控的危险因素进而采取针对性的治疗措施延缓其持续进展,成为近些年来研究的目标和方向。
近年来,肠道菌群被认为参与了慢性肾脏病的发生发展过程,CKD患者肠道功能屏障受到破坏,一些肠源性代谢毒素和细菌移位进入体循环,从而加重CKD全身炎症反应,促进其心脑血管并发症的发生[2-3]。因此,以肠道菌群为靶点延缓慢性肾脏病进展的新型治疗方式越来越受到研究者们的关注。中医药在调节肠道功能及改善肠黏膜屏障方面具有独特的优势,而尿毒清颗粒是治疗肾功能不全的常用中成药。本研究旨在探讨尿毒清颗粒对CKD患者肠道菌群及微炎症状态的影响,为中医药通过肠道干预缓解慢性肾脏病进展提供新的理论依据。
1 材料和方法 1.1 一般资料选取就诊于本院门诊的60例慢性肾脏病3~4期未透析患者作为研究对象,纳入标准:1)符合2012年美国肾脏病基金会(KDIGO)定义的CKD诊断标准:以下任一表现持续 > 3个月,肾脏损伤标志(1个或多个)白蛋白尿[尿白蛋白排泄率(AER)≥30 mg/24 h;尿白蛋白肌酐比值(ACR)≥30 mg/g];尿沉渣异常;肾小管功能紊乱导致的电解质及其他异常;组织学检测异常;影像学检查结构异常;肾移植病史。2)男性及女性。3)年龄20~75岁。4)CKD 3~4期:eGFR 15~60 mL/(min·1.73 m2)。5)无胃肠道疾病,可接受口服药物治疗。6)自愿参与试验并签署知情同意书。
排除标准:1)急性肾损伤、肾病综合征、梗阻性肾病等不稳定患者。2)已接受血液透析、腹膜透析或肾移植患者。3)妊娠或哺乳期妇女。4)合并恶性肿瘤患者。5)3个月内进行其他临床试验的患者。6)腹泻患者。将上述纳入的研究对象随机分为CKD组30例,尿毒清组30例,其中,CKD组和尿毒清组分别有2例和3例失访,最终分别纳入28例和27例,两组临床资料比较见表 1。另外还征集了10例健康志愿者10名作为对照组。本试验已通过本院伦理学委员会审核。
|
CKD组患者给予CKD综合管理包括低蛋白低盐饮食、控制血压、纠正贫血、调节血脂、维持电解质及酸碱平衡等,尿毒清组在CKD一般治疗基础上予以口服常规剂量尿毒清颗粒[GYZ20073256,尿毒清购于汤臣药业(内蒙古)有限责任公司,5 g/袋],每日4次,分别于6、12、18时各服1袋,22时服2袋。
1.3 研究方法 1.3.1 观察指标分别于试验前和试验后3个月进行以下指标检测:1)一般情况:患者性别、年龄、吸烟饮酒史、家族史、基础疾病、血压、脉搏、体重指数(BMI)。2)大便菌群结构及多样性分析:利用16S rRNA基因测序法对各组大便菌群结构及数量比例进行分析。3)血清尿毒素及炎症因子水平:测定各组血清硫酸吲哚酚(IS)及C反应蛋白(CRP)水平。4)肾功能指标:检测各组血清尿素氮(BUN)、肌酐(Scr)水平及ACR的变化。
1.3.2 样本采集1)粪便标本采集:分别于试验前和试验后3个月采集各组研究对象的新鲜粪便置于1.5 mL的无菌EP管中,为了避免污染和微生物生长,立即将粪便标本置于-80 ℃冰箱低温保存。2)血液标本采集:分别于试验前和试验后3个月采集各组研究对象的晨起空腹静脉血,并通过离心处理收集血清置于-20 ℃冰箱保存,采用临床全自动生化分析仪检测各组血清尿毒素、炎症因子及肾功能指标变化。
1.3.3 粪便DNA的提取及16S rRNA测序分析标本检测由天津中正生物科技有限公司完成,利用16S rRNA基因测序法对3组研究对象的大便菌群结构及数量比例进行分析。具体检测方法为:以目的肠道菌群16S rDNA为特异性的引物,以提取的粪便总DNA为模板,特异性进行PCR扩增以获得目的肠道菌群的16S rRNA基因片断,并对其进行测序分析。其定量试剂采用SYBR Green PCR Master Mix,反应体系20 μL。根据所扩增的16S区域特点,构建小片段文库,基于Illumina NovaSeq测序平台对该文库进行双末端测序(Paired_End)。经过Reads拼接过滤,OTUs(Operational Taxonomic Units)聚类,可以进行物种注释及丰度分析;通过α多样性(Alpha Diversity)和β多样性(Beta Diversity)分析,可以得到样品菌群丰富度和多样性以及样本间群落结构的差异。
1.4 统计学方法采用SPSS 23.0软件进行统计学分析,计量资料采用均数±标准差(x±s)表示,服从正态分布的两组间比较采用两样本独立t检验,不服从正态分布的则采用Wilcox秩和检验,计数资料用[n(%)] 表示,采用χ2检验。应用R软件包Vegan进行相似性分析(ANOSIM),并计算R值,R值接近1.0表明组间存在差异。3组间血清学指标数据采用[M(P25,P75)]表示,采用单因素方差分析(one-way ANOVA)及LSD检验进行分析,不服从正态分布或方差不齐的则采用Kruskal-Wallis检验。以上均以P < 0.05表示差异有统计学意义。
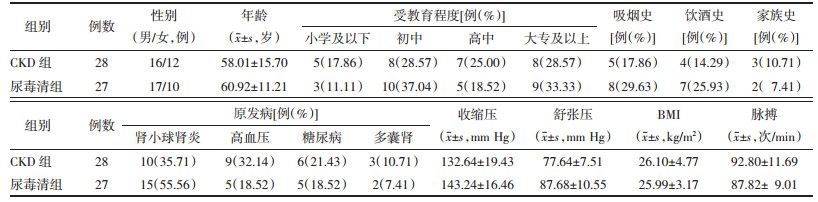
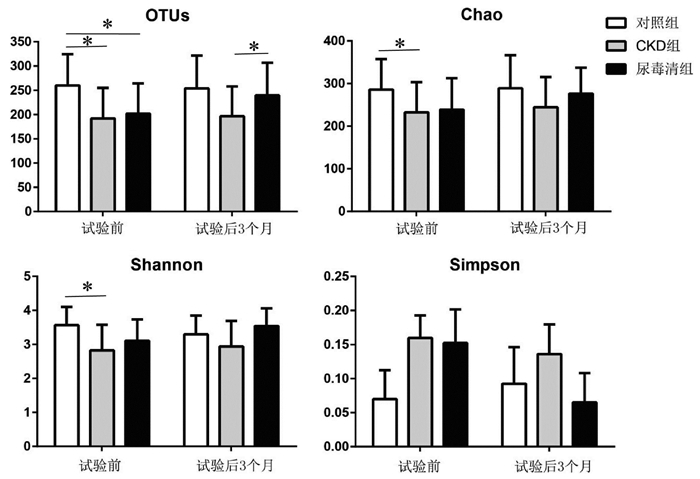
2 结果 2.1 16S rRNA基因测序法对各组肠道菌群进行分析 2.1.1 肠道菌群丰富度和多样性分析α多样性分析结果显示,在试验前的基线水平,与对照组相比,CKD组及尿毒清组两组的OTUs均显著下降(P < 0.05),CKD组较对照组的Chao1指数及Shannon指数也显著下降(P < 0.05);在试验后3个月,尿毒清组较CKD组的OUTs显著升高(P < 0.05),Chao1、Shannon指数及Simpson指数无统计学差异,见图 1。
|
| 注:组间比较*P < 0.05。 图 1 试验前后各组肠道菌群丰富度和多样性分析 Fig. 1 Analysis of intestinal flora richness and diversity in each group before and after the test |
β多样性分析结果显示,主坐标分析(PCoA)二维坐标图显示,在试验前的基线水平,对照组与CKD组、尿毒清组组间呈现显著分离,而尿毒清组和CKD组间未呈现分离;在试验后3个月,尿毒清组与CKD组间呈现分离,而与健康对照组的距离变近。另外,基于Unweighted Unifrac的ANOSIM显示,试验3个月后,尿毒清组与CKD组相比(R=0.89,P=0.034),差异有统计学意义。以上结果表明,慢性肾脏病患者的肠道菌群发生了显著的变化,经尿毒清干预促使CKD患者肠道菌群多样性增加,且更加接近健康对照组的菌群分布。
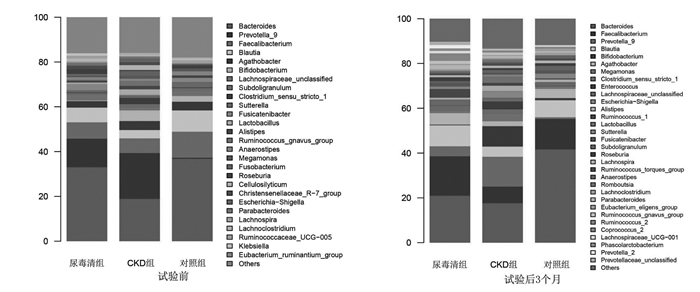
2.1.2 肠道菌群物种组成分析结果显示,在试验前,属水平上,CKD组及尿毒清组较对照组的拟杆菌(Bacteroides)、布劳特氏菌(Blautia)、乳杆菌(Lactobacillus)、罗氏菌(Roseburia)、丁酸菌(Butyricicoccus)的丰度降低,而大肠杆菌-志贺菌(Escherichia-Shigella)、艰难梭菌(Clostridioides)、放线菌属(Actinobacteria)、普雷沃氏菌_9(Prevotella_9)的丰度增加,差异均有统计学意义(P < 0.05)。在试验后3个月,与CKD组相比,尿毒清组Bacteroides、Blautia、Butyricicoccus的丰度明显增加,而Escherichia-Shigella的丰度显著降低,有统计学差异(P < 0.05),见图 2。以上结果表明CKD患者存在肠道菌群失调,尿毒清干预可在一定程度上调节慢性肾脏病患者的这种肠道菌群紊乱。
|
| 图 2 试验前后属水平上各组肠道菌群物种组成分析 Fig. 2 Analysis of species composition of intestinal flora at genus level before and after test |
结果显示,与对照组相比,尿毒清组和CKD组的IS、CRP、BUN、Scr及ACR水平均明显升高,具有统计学差异(P < 0.05);尿毒清组和CKD组组间无统计学差异(P > 0.05)。见表 2。
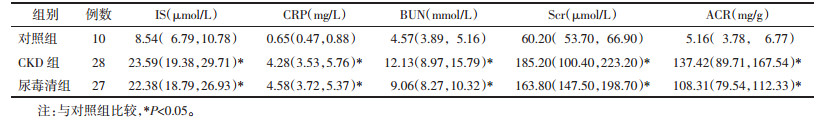
|
结果显示,与CKD组相比,尿毒清组患者,IS及部分肾功能指标如Scr、ACR水平显著下降,具有统计学差异(P < 0.05)。见表 3。
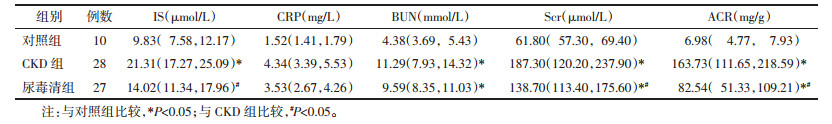
|
肠道菌群作为人体重要的组成部分,其在宿主消化、营养、代谢、免疫等方面均发挥着极其重要的作用[4]。在正常生理条件下,肠道微生物群与人体之间存在动态平衡。当这种动态平衡被打破时,肠道微生物群将使机体致病[5]。目前,越来越多的研究表明,人类多种疾病与肠道菌群的改变或某些细菌的富集有关,如肥胖、抑郁症、恶性肿瘤、炎症性肠病、多发性硬化症、自身免疫性疾病等[6-7]。近年来,肠道菌群微生态失调在CKD进展中的作用逐渐被认识,调节肠道菌群成为延缓CKD进展的新靶向手段。
CKD患者普遍存在肠道菌群紊乱[8]。在一项研究中,Vaziri等[9]发现终末期肾脏病(ESRD)患者的肠道放线菌、变形菌和厚壁菌数量明显增加,他们还观察到CKD患者的致病性肠道细菌定植增加,这些细菌表达尿素酶、色氨酸酶并将芳香族氨基酸转换产生PCS和IS。而肠源性尿毒素PCS、IS水平的升高又会进一步损伤肠道的黏膜屏障结构,继而导致肠黏膜屏障功能受损,细菌及内毒素移位至体循环引起菌血症及内毒素血症,均会加剧CKD患者系统性炎症反应状态,其结果可引起CKD进展、心脑血管疾病发生,最终导致患者预后恶化[10]。由此提示肠道菌群失调在CKD的发生和发展中发挥着一定作用,是导致慢性肾脏病进展的一个重要因素。本研究基于此点,探讨尿毒清颗粒对CKD 3~4期非透析患者肠道菌群和炎症因子水平及肾功能的影响,为CKD患者行肠道干预治疗有效性提供新的理论依据。
在本研究中,与健康对照组相比,CKD组患者的肠道菌群多样性降低,菌群结构也发生了显著的变化。在属水平上,CKD组及尿毒清组较对照组的Bacteroides、Blautia、Lactobacillus、Roseburia、Butyricicoccus的丰度降低,而Escherichia-Shigella、Clostridioides、Actinobacteria、Prevotella_9的丰度增加。Lactobacillus是一种存在于人体内的益生菌,可帮助机体消化,有助于人体肠道健康,被广泛用于制造液态酸奶等[11]。另有研究表明,Blautia是一种具有潜在益生菌特征的厌氧细菌,可促进短链脂肪酸(SCFAs)产生等维持肠道稳态活性[12]。SCFAs是肠道菌群的主要代谢产物,除了维持肠道稳态,SCFAs还参与胃肠生理、免疫功能以及宿主代谢,甚至与中枢神经系统的发育和稳态有关[13-14]。此外,有研究显示SCFAs在CKD中也发挥着重要作用[15]。而Escherichia-Shigella作为一种条件致病菌,与多种疾病的发生密切相关。有研究表明,炎症性肠病患者肠道菌群与健康对照组存在显著差异,主要由变形杆菌和Escherichia-Shigella组成的病原菌数量显著增加[16]。因此,上述结果验证了CKD患者肠道菌群失调的存在,主要为几种相关益生菌数量的减少及致病菌如Escherichia-Shigella的增加,这与既往研究的部分结果是一致的[17]。
CKD患者肠道菌群的改变可能是由于肠道微生态环境改变所致[18],其中可能包括以下几个方面的原因:1)CKD患者饮食结构的改变,如食物中纤维素的摄入量减少可使肠道内益生菌与致病菌之间的平衡被打破。2)CKD患者大多存在便秘症状,其结肠转运时间较长,条件致病菌在结肠内大量繁殖。3)尿毒血症导致肠道对蛋白质的吸收障碍使得结肠内蛋白分解细菌获得的蛋白质量增加、肠道pH值改变以及药物等因素的作用引起结肠内微生物菌群从数量到菌群比例均发生了改变。4)尿毒素在肠道的蓄积导致肠黏膜组织结构损伤,黏膜屏障功能受损,其通透性增加[19]。
尿毒清是国家食品药品监督管理总局(SFDA)最早批准的治疗肾脏病药物,由大黄、黄芪、桑白皮、苦参等16味中药组成,是目前临床上治疗肾功能不全的常用中成药。多项临床研究证实,在慢性肾功能不全、糖尿病肾病等多种肾脏疾病中,尿毒清颗粒可降低肌酐、尿素氮,稳定肾功能,延缓进入肾衰竭的时间,且可改善肾性贫血,但其具体的作用机制尚不明确[20-22]。本研究发现经尿毒清干预有促使CKD患者肠道菌群多样性增加的趋势,可显著改善CKD患者肠道菌群组成,使其更加接近健康人群的菌群分布。由此推测,尿毒清可在一定程度上调节CKD患者的肠道菌群失调,可能是其肾脏保护作用的机制之一。另外,从血清尿毒素、炎症因子及肾功能等指标变化情况,发现尿毒清干预可减少肠源性尿毒素IS的产生,从而减轻CKD患者的微炎症状态,缓解肾功能的进展。综合以上结果分析,尿毒清延缓慢性肾脏病进展的可能机制为尿毒清通过调节肠道菌群紊乱,增加肠道有益菌的含量,减少了肠道微生态失衡导致的肠源性尿毒素产生,抑制了肠道黏膜屏障损伤及继发的菌群移位,从而缓解系统性炎症反应的发生,在一定程度上阻碍了肾功能减退和肠道菌群紊乱之间的恶性循环。
本研究尚有一些局限性,没有阐明肠道菌群失调影响尿毒症毒素生成的具体机制,以及不同菌种与不同炎性因子的相关性,未来需要更多研究进一步证实不同肠道菌群与尿毒症毒素血清浓度之间的相互作用。此外,由于尿毒清是含有多种中药成分的复方制剂,今后将进行单成分提取做进一步的深入研究。综上所述,尿毒清可调节CKD患者肠道菌群紊乱,减轻微炎症状态从而缓解肾功能进展,肠道干预将成为未来延缓CKD进展的新手段。
| [1] |
ZHANG L X, WANG F, WANG L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. The Lancet, 2012, 379(9818): 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [2] |
PLATA C, CRUZ C, CERVANTES L G, et al. The gut microbiota and its relationship with chronic kidney disease[J]. International Urology and Nephrology, 2019, 51(12): 2209-2226. DOI:10.1007/s11255-019-02291-2 |
| [3] |
WANG F Q, JIANG H L, SHI K H, et al. Gut bacterial translocation is associated with microinflammation in end-stage renal disease patients[J]. Nephrology, 2012, 17(8): 733-738. DOI:10.1111/j.1440-1797.2012.01647.x |
| [4] |
O'HARA A M, SHANAHAN F. The gut flora as a forgotten organ[J]. EMBO Reports, 2006, 7(7): 688-693. DOI:10.1038/sj.embor.7400731 |
| [5] |
BARKO P C, MCMICHAEL M A, SWANSON K S, et al. The gastrointestinal microbiome: a review[J]. Journal of Veterinary Internal Medicine, 2018, 32(1): 9-25. DOI:10.1111/jvim.14875 |
| [6] |
ISHⅡ W, KOMINE-AIZAWA S, TAKANO C, et al. Relationship between the fecal microbiota and depression and anxiety in pediatric patients with orthostatic intolerance[J]. The Primary Care Companion for CNS Disorders, 2019, 21(2): 18m02401. |
| [7] |
LAZAR V, DITU L M, PIRCALABIORU G G, et al. Aspects of gut microbiota and immune system interactions in infectious diseases, immunopathology, and cancer[J]. Frontiers in Immunology, 2018, 9: 1830. DOI:10.3389/fimmu.2018.01830 |
| [8] |
闫康博. 肠道菌群与慢性肾脏病的研究进展[J]. 国际泌尿系统杂志, 2020, 40(4): 756-759. YAN K B. Research progress in intestinal flora and chronic kidney disease[J]. International Journal of Urology and Nephrology, 2020, 40(4): 756-759. DOI:10.3760/cma.j.cn431460-20190513-00056 |
| [9] |
VAZIRI N D, WONG J, PAHL M, et al. Chronic kidney disease alters intestinal microbial flora[J]. Kidney International, 2013, 83(2): 308-315. DOI:10.1038/ki.2012.345 |
| [10] |
LEKAWANVIJIT S. Role of gut-derived protein-bound uremic toxins in cardiorenal syndrome and potential treatment modalities[J]. Circulation Journal: Official Journal of the Japanese Circulation Society, 2015, 79(10): 2088-2097. DOI:10.1253/circj.CJ-15-0749 |
| [11] |
LIÉVIN-LE MOAL V, SERVIN A L. Anti-infective activities of Lactobacillus strains in the human intestinal microbiota: From probiotics to gastrointestinal anti-infectious biotherapeutic agents[J]. Clinical Microbiology Reviews, 2014, 27(2): 167-199. DOI:10.1128/CMR.00080-13 |
| [12] |
LIU X M, MAO B Y, GU J Y, et al. Blautia-a new functional genus with potential probiotic properties?[J]. Gut Microbes, 2021, 13(1): 1875796. DOI:10.1080/19490976.2021.1875796 |
| [13] |
王可鑫, 姜宁, 张爱忠. 短链脂肪酸介导的宿主肠道免疫调控机制[J]. 动物营养学报, 2020, 32(4): 1544-1550. WANG K X, JIANG N, ZHANG A Z. Host intestinal immune regulation mechanism mediated by short-chain fatty acids[J]. Chinese Journal of Animal Nutrition, 2020, 32(4): 1544-1550. DOI:10.3969/j.issn.1006-267x.2020.04.010 |
| [14] |
SILVA Y P, BERNARDI A, FROZZA R L. The role of short-chain fatty acids from gut microbiota in gut-brain communication[J]. Frontiers in Endocrinology, 2020, 11: 25. DOI:10.3389/fendo.2020.00025 |
| [15] |
钟晨瑜, 蔡珂丹. 短链脂肪酸在慢性肾脏病中作用及机制的研究进展[J]. 中国病理生理杂志, 2021, 37(10): 1900-1904. ZHONG C Y, CAI K D. Progress in role of short-chain fatty acids in chronic kidney diseases[J]. Chinese Journal of Pathophysiology, 2021, 37(10): 1900-1904. DOI:10.3969/j.issn.1000-4718.2021.10.021 |
| [16] |
ZOU J F, SHEN Y M, CHEN M J, et al. Lizhong Decoction ameliorates ulcerative colitis in mice via modulating gut microbiota and its metabolites[J]. Applied Microbiology and Biotechnology, 2020, 104(13): 5999-6012. DOI:10.1007/s00253-020-10665-1 |
| [17] |
MAFRA D, FOUQUE D. Gut microbiota and inflammation in chronic kidney disease patients[J]. Clinical Kidney Journal, 2015, 8(3): 332-334. DOI:10.1093/ckj/sfv026 |
| [18] |
VAZIRI N D. Effect of synbiotic therapy on gut-derived uremic toxins and the intestinal microbiome in patients with CKD[J]. Clinical Journal of the American Society of Nephrology: CJASN, 2016, 11(2): 199-201. DOI:10.2215/CJN.13631215 |
| [19] |
GONZALEZ A, KRIEG R, MASSEY H D, et al. Sodium butyrate ameliorates insulin resistance and renal failure in CKD rats by modulating intestinal permeability and mucin expression[J]. Nephrology Dialysis Transplantation, 2018, 34(5): 783-794. |
| [20] |
ZHENG Y, CAI G Y, HE L Q, et al. Efficacy and safety of niaoduqing particles for delaying moderate-to-severe renal dysfunction: A randomized, double-blind, placebo-controlled, multicenter clinical study[J]. Chinese Medical Journal, 2017, 130(20): 2402-2409. DOI:10.4103/0366-6999.216407 |
| [21] |
WANG X, YU S Y, JIA Q, et al. Niaoduqing Granule relieve chronic kidney disease symptoms by decreasing renal fibrosis and Anemia[J]. Oncotarget, 2017, 8(34): 55920-55937. DOI:10.18632/oncotarget.18473 |
| [22] |
赖卫国, 周青美, 李韶今. 尿毒清颗粒治疗糖尿病肾病疗效观察[J]. 中国中西医结合肾病杂志, 2011, 12(5): 449. LAI W G, ZHOU Q M, LI S J. Observation of curative effect of Niaoduqing granules on diabetic nephropathy[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2011, 12(5): 449. DOI:10.3969/j.issn.1009-587X.2011.05.027 |
 2022, Vol. 39
2022, Vol. 39