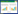文章信息
- 张梦笛, 崔鑫钰, 袁悦莹, 张雨婷, 于雪, 吴晏
- ZHANG Mengdi, CUI Xinyu, YUAN Yueying, ZHANG Yuting, YU Xue, WU Yan
- 麝香通心滴丸通过促血管新生改善糖尿病合并心肌梗死大鼠心功能的作用机制研究
- Mechanism of Shexiang Tongxin Dropping Pill in improving cardiac function in diabetic rat with myocardial infarction by promoting angiogenesis
- 天津中医药, 2022, 39(8): 1043-1051
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(8): 1043-1051
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.08.18
-
文章历史
- 收稿日期: 2022-02-22
2. 证候与方剂基础研究教育部重点实验室, 北京 100029;
3. 证候与方剂基础研究北京市重点实验室, 北京 100029;
4. 北京中医药大学中医药研究院, 北京 100029
糖尿病是全球流行的慢性终身代谢性疾病,近年来,中国糖尿病患者数量急剧增加,经济负担沉重。《中国心血管健康与疾病报告2020》指出,中国心血管疾病的发病率及病死率逐年上升,糖尿病患者发生心血管疾病的比例和严重程度都高于非糖尿病患者,心血管并发症如心肌梗死是糖尿病患者死亡的主要原因[1-3]。微血管病变是糖尿病心血管并发症的一个重要类别,血管生成因子表达减少和血管新生受损是其主要表现。高血糖可破坏微血管内皮细胞完整性,导致毛细血管和小动脉严重受损,同时阻碍新生血管生成,微血管密度降低[4]。心肌微血管数量的逐渐减少导致心肌灌注降低,最终引发不可逆的心脏功能障碍。
心肌梗死(MI)是由于冠状动脉持续性缺血缺氧、心肌灌注不足,心肌细胞大量且不可逆死亡,最终导致心力衰竭,是全球人类健康的主要威胁因素[5]。血管新生是指通过内皮细胞增殖和迁移,在原有血管基础上生成新的血管。MI后,促进血管新生有利于减少梗死面积和细胞死亡,因此血管新生是心肌组织修复的关键过程,在挽救缺血性心脏病和促进心功能方面发挥重要作用[6]。在糖尿病进程中,心脏早期即出现微血管损害,血管内皮生长因子表达降低、微血管生成减少的病理改变[7],对心肌梗死后血管新生十分不利。因此保护心脏微血管对于延缓或减轻糖尿病合并心肌梗死至关重要[8],促进心脏血管新生和改善心肌微循环功能已成为改善糖尿病合并心肌梗死的潜在靶点[9-10]。
麝香通心滴丸可治疗冠心病心绞痛等心血管系统疾病,临床疗效确切[11-13]。本研究旨在探究麝香通心滴丸通过促进血管新生改善心肌微循环障碍,保护糖尿病合并心肌梗死疾病心功能的药效及作用机制。
1 材料与方法 1.1 动物雄性SPF级SD大鼠,体质量(200±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。大鼠饲养在北京中医药大学SPF级动物房[SYXK(京)2020-0033],温度(23±2)℃,湿度55%±5%,每12 h明暗交替,自由饮食水。动物实验全程均严格按照北京中医药大学伦理委员会要求,实验过程符合动物伦理指导原则并通过审批,审批编号为BUCM-4-2021031502-1094。实验全程严格遵循3R原则,给予人道关怀。
1.2 仪器Onetouch Ultraeasy血糖仪与Onetouch Ultra试纸(美国,强生公司);脱水机、包埋机、病理切片机(中国,武汉俊杰电子有限公司);ICC50HD光学显微镜(德国,Leica公司);Pannoramic SCAN数字切片扫描仪(匈牙利,3DHISTECH公司);Wes全自动蛋白质印迹定量分析系统及配套试剂(美国,ProteinSimple公司);Vevo2100小动物超声影像系统(加拿大,Visual Sonics公司);ALC-V8动物呼吸机(中国,奥尔科特公司)。
1.3 药物及试剂麝香通心滴丸(每粒35 mg,国药准字Z20080018,内蒙古康恩贝药业有限公司);戊巴比妥钠(P3761,美国Sigma公司);链脲佐菌素(STZ)(S0130,美国Sigma公司);口服葡萄糖粉剂(国药准字H45021416,广西梧州制药公司);注射用青霉素钠(兽药字030201248,华北制药集团动物保健品有限责任公司);利多卡因(兽药字080231659,哈尔滨三马兽药业有限公司);呋塞米(兽药字190751182,广东万士达动物药业有限公司);柠檬酸钠缓冲液(0.1 mmol/L,pH4.5,C1013,索莱宝公司);Masson染色试剂盒(G1006,中国Servicebio公司);苏木精-伊红(HE)染液(G1005,中国Servicebio公司);β-肌动蛋白(β-actin)鼠单克隆抗体、血管生成素-1(Ang-1)兔多克隆抗体、酪氨酸激酶受体-2(Tie-2)兔多克隆抗体、诱导型一氧化氮合酶(iNOS)兔多克隆抗体(20536-1-AP、23302-1-AP、19157-1-AP、18985-1-AP,美国Proteintech公司);血管内皮生长因子(VEGF)鼠单克隆抗体(sc-7269,美国Santa Cruz公司);磷酸化血管内皮生长因子受体2(p-VEGFR2)兔多克隆抗体、内皮型一氧化氮合酶(eNOS)鼠单克隆抗体(ab5473、ab76198,英国Abcam公司);磷酸化内皮型一氧化氮合酶(p-eNOS)兔多克隆抗体(9570,美国Cell Signaling Technology公司);羊抗兔二抗(BN20601,北京百瑞极生物科技公司);麦胚凝集素(WGA)兔多克隆抗体(L5142,美国sigma公司);血小板-内皮细胞黏附分子-1(CD31)兔多克隆抗体(GB11063-2,中国servicebio公司)。
1.4 动物模型制备及干预大鼠适应性饲养1周后,根据体质量(BW)随机分组,正常血糖假手术组(Sham组)6只,其余为糖尿病组。糖尿病组禁食12 h后予以STZ 55 mg/kg单次腹腔注射造模,7 d后检测空腹血糖(FBG),FBG≥16.7 mmol/L为造模成功;正常组腹腔注射相应剂量的柠檬酸钠缓冲液。
糖尿病模型成功建立的所有动物第2日行冠状动脉左前降支结扎术(LAD)制备心肌梗死模型。大鼠腹腔注射1 %戊巴比妥钠(45 mg/kg)麻醉后仰卧位固定,胸前区备皮消毒,经口行气管插管,接小动物呼吸机辅助呼吸。于胸骨左侧第3、4肋间逐层切开皮肤、分离肌肉并暴露心脏。破除心包膜后在肺动脉圆锥与左心耳下1~2 mm处穿线结扎冠状动脉左前降支,肉眼可见左室前壁心肌颜色变苍白且心电图显示ST段显著抬高时,放回心脏,关闭胸腔,逐层缝合肌肉与皮肤。Sham组大鼠仅穿线,不结扎。严格照看伤口,预防感染。
随机将糖尿病合并心肌梗死模型制备成功的大鼠分为:糖尿病合并心肌梗死组(MI组)、糖尿病合并心肌梗死后麝香通心滴给药组(STDP组),每组6只。大鼠手术苏醒后即可给药。根据成人临床等效剂量换算,STDP组灌胃给予麝香通心滴丸每日20 mg/kg,Sham组与MI组灌胃予同体积蒸馏水。每日灌胃1次,给药第28天处死大鼠并检测FBG与BW。
1.5 心脏功能检测取材前测定大鼠心功能,采用Visual Sonics Vevo 2100小动物超声影像系统进行经胸二维M型超声心动图检查。将大鼠麻醉后置于平台上,经胸骨旁短轴切面在M模式下采集图像,计算左心室射血分数(EF)和左心室短轴缩短率(FS)。使用Vevo 2100分析软件进行数据分析。
1.6 样本收集超声检测后,麻醉大鼠,经腹主动脉取血,处死动物后迅速分离心脏,随后放入预冷的生理盐水中,清理至心脏中无血液,漂净并擦干水分后,迅速取大鼠左心室心肌组织,部分放入4 %多聚甲醛固定,部分立即放入液氮中保存备用。
1.7 HE染色与Masson染色取固定好的心脏组织,常规脱水、包埋、切片,并进行HE染色与Masson染色,于400倍光学显微镜下观察大鼠心肌结构及胶原纤维的含量变化,每个样品选取3个视野(n=6),并采集图像。使用Image J软件分析胶原容积分数(CVF),CVF(%)=(胶原面积/视野心肌组织面积)×100%。
1.8 免疫组化染色法检测心肌组织CD31的表达石蜡切片脱蜡至水,置于柠檬酸抗原修复液中抗原修复,自然冷却后磷酸盐缓冲溶液(PBS)清洗3次,每次5 min,3 %双氧水溶液室温避光孵育25 min,3 % BSA室温封闭30 min,甩除后加一抗CD31 50 μL/片,4 ℃孵育过夜,滴加二抗(HRP标记)覆盖组织,室温孵育50 min,DAB显色,显微镜下控制显色时间,冲洗切片终止显色。苏木素复染,梯度酒精、二甲苯及中性树胶脱水、透明、封片。用数字切片扫描仪(3DHISTECH)扫描染色切片,CD31细胞阳性呈棕黄色,在400倍视野下每张切片随机选取3个视野(n=6)进行毛细血管计数,再除以视野面积(0.18 mm2)即为毛细血管密度(个/mm2)。
1.9 免疫荧光染色法检测心肌组织麦胚凝集素(WGA)的表达石蜡切片脱蜡至水,置于乙二胺四乙酸(EDTA)抗原修复液中抗原修复,自然冷却后PBS洗3次,每次5 min,切片甩干后滴加WGA染液,避光37 ℃恒温孵育30 min,DAPI复染细胞核,用抗荧光淬灭封片剂封片。使用数字切片扫描仪(3DHISTECH)扫描染色切片,绿色表示心肌细胞边界,400倍视野下每张切片随机选取3个视野(n=6),每视野取10个细胞,量化平均心肌细胞面积(μm2),以确定是否存在心肌细胞肥大改变。
1.10 Wes、蛋白免疫印迹法(Western blot)检测心肌组织蛋白中VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS、iNOS、p-eNOS的表达使用美国ProteinSimple公司的Wes全自动蛋白质印迹定量分析系统[14],每个样品上样量为3 μl(包括5×Master Mix 0.6 μL,样品原液与0.1×Sample Buffer共2.4 μL,以95 ℃、10 min条件变性)。一抗使用试剂盒自带的Antibody diluent 2进行稀释。样品及一抗制备好后,按照封闭液、一抗、二抗、样品、发光液、清洗液的顺序逐孔加入12~230 kDa Wes测定板,机器自检无异常后,放入测定板及毛细管,开始检测后,机器通过毛细管抽取400 nL样品,按分子量大小对蛋白质进行电泳分离,然后通过使用HRP偶联的二抗对心肌组织蛋白中VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS、iNOS进行基于过氧化物酶(HRP)的检测。同批次提取的心肌组织蛋白原液加入loadingbuffer混匀后煮沸10 min蛋白变性,后配制10%分离胶进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,5%脱脂奶粉封闭,磷酸化诱导型一氧化碳合酶(p-eNOS)一抗(1∶1 000)4 ℃摇床孵育过夜,TBST洗膜后加入羊抗兔二抗(1∶20 000)室温摇床孵育1 h,洗膜后滴加发光液,凝胶成像显影,使用Image J软件分析各条带灰度值。上述目的蛋白均以β-actin作为内参蛋白,用目的蛋白与内参蛋白的灰度值的比值表示该目的蛋白的表达量。
1.11 统计学方法所有数据采用SPSS 21.0统计软件分析数据,实验数据用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两两比较采用LSD检验,P<0.05为差异具有统计学意义。
2 结果 2.1 一般状态观察注射STZ前,各组大鼠BW量、FBG无统计学差异;注射STZ 7 d后,MI组、STDP组与Sham组比较,FBG显著升高、BW显著降低(P<0.01),并出现明显的多饮多食多尿的症状;Sham组BW稳定上升,MI、STDP组持续下降,但STDP与MI组比较无统计学差异;MI与STDP组持续处于高血糖状态,见表 1。
|
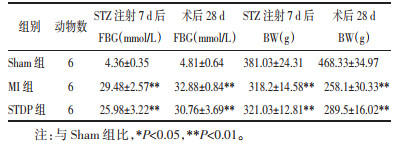
经超声心动图检测大鼠心功能,与Sham组相比,MI组大鼠的EF和FS明显降低(P<0.01),提示模型大鼠已出现明显左心室收缩功能障碍;与MI组相比,STDP组EF、FS均明显增加(P<0.01或P<0.05),见图 1。
|
| 注:与Sham组比较,**P<0.01;与MI组比较,#P<0.05,##P<0.01。 图 1 各组大鼠心功能指标比较 Fig. 1 Comparison of cardiac function indexes of rats in each group |
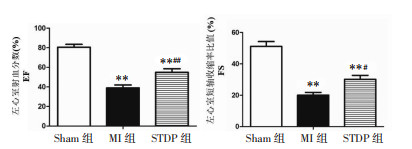
HE染色可见Sham组大鼠心肌细胞排列整齐,细胞形态正常、边界清晰;MI组心肌组织染色不均匀,有明显梗死区,肌束排列紊乱,细胞轮廓不清、破碎,出现大量结缔组织增生;STDP组心肌结构有明显改善,心肌细胞排列大致整齐,组织染色大致均匀,少量组织增生。
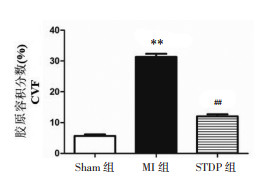
采用Masson染色评估大鼠心肌纤维化情况,图中呈蓝色的为胶原纤维,呈红色的为肌纤维和红细胞。Sham组大鼠心肌组织分布均匀,结构清晰,细胞排列整齐,心肌细胞间质和周围血管无明显蓝色胶原纤维,镜下视野呈红色;与Sham组相比,MI组的心肌组织明显减少,大量胶原纤维沉积,心肌组织结构破坏,镜下视野多呈蓝色,CVF明显升高(P<0.01);与MI组相比,STDP组大鼠心肌完整度较好,胶原纤维减少,镜下视野大致以红色为主,CVF明显降低(P<0.01),见图 2、3。
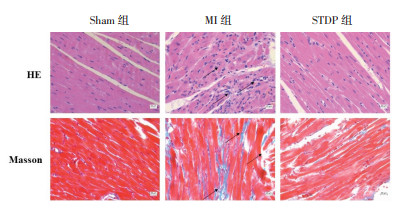
|
| 图 2 各组大鼠心肌组织HE、Masson染色图(×400) Fig. 2 HE, Masson staining of myocardial tissue of rats in each group(×400) |
|
| 注:与Sham组比较,**P<0.01;与MI组比较,##P<0.01。 图 3 各组大鼠基于Masson染色的胶原容积分数柱状图 Fig. 3 Collagen volume fraction histogram based on Masson staining of rats in each group |
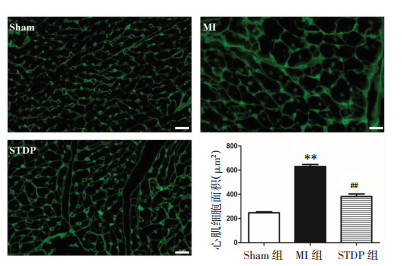
WGA染色结果显示,选取连续完整的细胞膜围成的心肌细胞计算面积,与Sham组[(247.10±19.66)μm2]相比,MI组[(629.94±39.75)μm2]心肌细胞面积明显增加(P<0.01);与MI组相比,STDP组[(381.44±51.87)μm2]心肌细胞面积明显降低(P<0.01),见图 4。
|
| 注:与Sham组比较,**P<0.01;与MI组比较,##P<0.01。 图 4 各组大鼠心肌细胞WGA染色示意图(×400)及面积分析 Fig. 4 WGA staining diagram (×400) and area analysis of rat myocardial cells in each group |
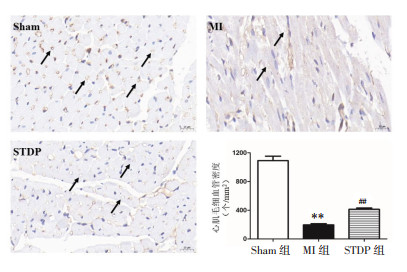
作为内皮细胞的标志物,CD31阳性代表毛细血管密度的变化,因此采用CD31染色检测各组大鼠心肌毛细血管密度。结果显示,与Sham组[(1 090.85±257.97)个/mm2]相比,MI组[(195.37±72.72)个/mm2]心肌组织中CD31阳性细胞密度显著降低(P<0.01);与MI组相比,STDP组[(412.65±74.04)个/mm2]心肌CD31阳性细胞密度升高(P<0.01),见图 5。
|
| 注:与Sham组比较,**P<0.01;与MI组比较,##P<0.01。 图 5 各组大鼠心肌组织CD31染色示意图(×400)及毛细血管密度分析 Fig. 5 CD31 staining diagram (×400) and capillary density analysis of myocardial tissue of rats in each group |
Wes全自动蛋白质印迹定量分析结果表明,与Sham组相比,MI组心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS、p-eNOS蛋白的表达水平显著降低(P<0.01),iNOS表达水平显著增加(P<0.01);与MI组相比,STDP组心肌组织中VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS、p-eNOS蛋白表达升高(P<0.01或P<0.05),iNOS表达降低(P<0.05),见图 6。

|
| 图 6 Wes全自动蛋白质印迹定量分析系统检测心肌组织中相关蛋白表达 Fig. 6 Wes automatic protein blot quantitative analysis system was used to detect the expression of related proteins in myocardial tissue in each group |
流行病学研究表明,心肌缺血、心肌梗死是糖尿病患者发病和死亡的主要原因[15-16]。糖尿病患者MI的发病率明显高于非糖尿病患者[17],同时糖尿病合并心肌梗死患者的重症率及病死率也显著高于单纯MI患者[18]。诸多实验证实糖尿病通过抑制血管生成相关因子表达,阻碍血管新生,造成心肌微循环障碍,使得MI后心肌缺血、心力衰竭情况更加恶化[19-22]。促进血管生成目前被认为是治疗缺血性心脏病的一种创新性治疗方法[23]。因此迫切需要寻找新的药物保护糖尿病合并心肌梗死患者受损的心肌微血管,提高心功能,治疗心力衰竭。
麝香通心滴丸依据“至宝丹”加减化裁而来,由人工麝香、人参茎叶总皂苷、蟾酥、丹参、人工牛黄、熊胆粉、冰片7味中药组成,有芳香益气通脉,活血化瘀止痛之功,可有效缓解胸痛胸闷、心悸气短、神倦乏力等症状,临床用于治疗冠心病稳定型劳累性心绞痛,现已被纳入《冠心病合理用药指南(第2版)》。目前对麝香通心滴丸的研究多集中在冠状动脉慢血流、急性冠脉综合征、稳定型冠心病等方面[24-26],尚未见到对糖尿病合并心肌梗死疾病的临床或药理文献报道。本研究超声结果提示,麝香通心滴丸可明显提高糖尿病合并心肌梗死大鼠EF和FS值,改善心功能,但对其BW及FGB等糖尿病症状无明显治疗作用;同时既往研究报道提示,麝香通心滴丸具有显著的血管内皮保护功效以及明显的促血管新生作用[27-28],由此推测其在糖尿病合并心肌梗死疾病中可以通过改善心肌微循环以保护心功能。
MI后,心肌组织缺血缺氧状态可代偿性诱导冠状动脉侧枝循环产生,为梗死心肌组织提供血液灌注,促血管新生相关因子如VEGF、Ang-1在缺血缺氧诱导的血管新生调节中起关键作用[29]。然而,研究表明在糖尿病动物的心肌组织中,VEGF及其受体水平均明显下降[30]。实验证实,糖尿病可破坏心肌微血管新生,导致心肌微循环障碍,又进一步抑制和阻碍MI后代偿性血管新生。因此,提高血管新生能力,促使内皮细胞生成侧枝循环及复杂血管网,对于糖尿病合并心肌梗死的治疗及预后是十分必要的,但目前此类药物开发尚嫌不足。
治疗性血管新生是通过药物促进和刺激新生血管,包括小动脉和毛细血管,进而形成血管网络,以恢复缺血组织的血流循环[31]。在评价血管新生和微血管密度时,多采用免疫组化法对内皮细胞标志物CD31进行染色。免疫组化染色结果显示,麝香通心滴丸可提高糖尿病合并心肌梗死大鼠CD31表达,提示该中药复方可有效促进血管新生,增加心肌微血管密度,改善心肌微循环。
糖尿病患者血管内皮生长因子发挥生理作用与维持正常的心肌毛细血管密度和正常左心室功能有关[32]。内皮细胞需要接收多种生长因子刺激才能增殖、迁移成新的侧枝循环[33],VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS等参与其中。VEGF对血管新生具有中心调控作用[34],可刺激内皮细胞生长,促进血管新生[35]。VEGFR2是VEGF的主要特异性受体及关键信号传导因子[36]。VEGFR2与VEGF结合后发生磷酸化[37],p-VEGFR2继而调控下游信号通路,通过增殖、迁移和抗凋亡等途径维持内皮细胞生存,促进新生血管形成[38-39]。既往研究结果显示,糖尿病可引起VEGF/p-VEGFR2水平明显下调[40-42],血管新生受损,心肌毛细血管密度降低[35];VEGF表达水平和毛细血管密度的显著降低可导致糖尿病患者左心室功能障碍[43]。Ang-1/Tie-2信号系统在血管成熟与稳定中起关键作用[42]。糖尿病血管新生异常与Ang-1/Tie-2信号通路传导受损密切相关[43-44]。Ang-1募集平滑肌细胞到新生血管中,使其形成肌性小动脉和静脉,促进新生血管在初始阶段进一步发育成熟[45],达到改善心肌血流、修复心肌的目的[46-48]。增加Ang-1/ Tie-2信号通路表达,可显著提高毛细血管密度[44, 49]。eNOS是通过产生一氧化氮(NO)介导VEGF诱导血管新生的重要分子,p-eNOS是其活化状态[50-51]。iNOS可促进eNOS解偶联[52],对内皮功能有消极作用。既往研究表明,通过提高eNOS/iNOS比值能有效增加NO生物利用度,改善氧化应激,抑制血管衰老,促进侧枝循环血管网形成[52-53]。
全自动蛋白定量结果显示,MI组大鼠心肌中VEGF、p-VEGFR2、Ang-1、Tie-2蛋白表达较Sham降低,eNOS/iNOS失衡,提示糖尿病及冠脉结扎复合刺激使血管新生相关蛋白显著减少。麝香通心滴丸可有效提高VEGF、p-VEGFR2、Ang-1、Tie-2蛋白表达量,恢复eNOS/iNOS平衡,提示麝香通心滴丸可通过调节上述蛋白表达,以期促进血管新生。
本研究结果提示,麝香通心滴丸通过促进血管新生,增加微血管密度,修复糖尿病合并心肌梗死大鼠心肌损伤,改善心肌微循环障碍,从而保护心功能。麝香通心滴丸促进血管新生的药理作用可能与上调VEGF、p-VEGFR2、Ang-1、Tie-2、eNOS、p-eNOS蛋白表达水平,降低iNOS表达有关。
| [1] |
RAWSHANI A, SATTAR N, FRANZ?N S, et al. Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: A nationwide, register-based cohort study[J]. Lancet (London, England), 2018, 392(10146): 477-486. DOI:10.1016/S0140-6736(18)31506-X |
| [2] |
VIRANI S S, ALONSO A, BENJAMIN E J, et al. Heart disease and stroke statistics-2020 update: A report from the American heart association[J]. Circulation, 2020, 141(9): e139-e596. |
| [3] |
中国心血管健康与疾病报告2020概要[J]. 中国循环杂志, 2021, 36(6): 521-545. Report on cardiovascular health and diseases burden in China: An updated summary of 2020[J]. Chinese Circulation Journal, 2021, 36(6): 521-545. |
| [4] |
ADAMEOVA A, DHALLA N S. Role of microangiopathy in diabetic cardiomyopathy[J]. Heart Failure Reviews, 2014, 19(1): 25-33. DOI:10.1007/s10741-013-9378-7 |
| [5] |
GOU L P, XUE C, TANG X Y, et al. Inhibition of Exo-miR-19a-3p derived from cardiomyocytes promotes angiogenesis and improves heart function in mice with myocardial infarction via targeting HIF1α[J]. Aging, 2020, 12(23): 23609-23618. DOI:10.18632/aging.103563 |
| [6] |
LIAO Q, QU S, TANG L X, et al. Irisin exerts a therapeutic effect against myocardial infarction via promoting angiogenesis[J]. Acta PharmacologicaSinica, 2019, 40(10): 1314-1321. |
| [7] |
PICCHI A, CAPOBIANCO S, QIU T Y, et al. Coronary microvascular dysfunction in diabetes mellitus: A review[J]. World Journal of Cardiology, 2010, 2(11): 377-390. DOI:10.4330/wjc.v2.i11.377 |
| [8] |
EELEN G, DE ZEEUW P, SIMONS M, et al. Endothelial cell metabolism in normal and diseased vasculature[J]. Circulation Research, 2015, 116(7): 1231-1244. DOI:10.1161/CIRCRESAHA.116.302855 |
| [9] |
HINKEL R, HOWE A, RENNER S, et al. Diabetes mellitus-induced microvascular destabilization in the myocardium[J]. Journal of the American College of Cardiology, 2017, 69(2): 131-143. DOI:10.1016/j.jacc.2016.10.058 |
| [10] |
TENG X M, JI C, ZHONG H T, et al. Selective deletion of endothelial cell calpain in mice reduces diabetic cardiomyopathy by improving angiogenesis[J]. Diabetologia, 2019, 62(5): 860-872. DOI:10.1007/s00125-019-4828-y |
| [11] |
郑云涛, 邓兵, 郑望, 等. 麝香通心滴丸对急性心肌梗死经皮冠状动脉介入治疗患者炎性因子及心功能的有益作用[J]. 国际心血管病杂志, 2021, 48(2): 116-119. ZHENG Y T, DENG B, ZHENG W, et al. Beneficial effects of She Xiang Tong Xin Dropping Pill on cytokines and left ventricular function in patients with acute myocardial infarction undergoing primary percutaneous coronary intervention[J]. International Journal of Cardiovascular Disease, 2021, 48(2): 116-119. DOI:10.3969/j.issn.1673-6583.2021.02.013 |
| [12] |
李蒙, 李金根, 刘佳, 等. 麝香通心滴丸改善冠状动脉慢血流的研究进展[J]. 世界中医药, 2022, 17(8): 1180-1183. LI M, LI J G, LIU J, et al. Research progress of Shexiang Tongxindrop pills in improving slow coronary blood flow of coronary artery[J]. World Chinese Medicine, 2022, 17(8): 1180-1183. DOI:10.3969/j.issn.1673-7202.2022.08.025 |
| [13] |
李文华, 吴晓军, 李桂新, 等. 麝香通心滴丸治疗冠心病心绞痛的系统评价[J]. 西北国防医学杂志, 2018, 39(5): 281-284. LI W H, WU X J, LI G X, et al. Meta-analysis of Musk Tongxin dripping pills in treatment of angina pectoris of coronary heart disease[J]. Medical Journal of National Defending Forces in Northwest China, 2018, 39(5): 281-284. |
| [14] |
NANKI K, FUJII M, SHIMOKAWA M, et al. Somatic inflammatory gene mutations in human ulcerative colitis epithelium[J]. Nature, 2020, 577(7789): 254-259. DOI:10.1038/s41586-019-1844-5 |
| [15] |
BUYKEN A E, VON ECKARDSTEIN A, SCHULTE H, et al. Type 2 diabetes mellitus and risk of coronary heart disease: Results of the 10-year follow-up of the PROCAM study[J]. European Journal of Cardiovascular Prevention and Rehabilitation, 2007, 14(2): 230-236. DOI:10.1097/HJR.0b013e3280142037 |
| [16] |
SONG S H, BROWN P M. Coronary heart disease risk assessment in diabetes mellitus: Comparison of UKPDS risk engine with Framingham risk assessment function and its clinical implications[J]. Diabetic Medicine: a Journal of the British Diabetic Association, 2004, 21(3): 238-245. DOI:10.1111/j.1464-5491.2004.01116.x |
| [17] |
HAFFNER S M, LEHTO S, R?NNEMAA T, et al. Mortality from coronary heart disease in subjects with type 2 diabetes and in nondiabetic subjects with and without prior myocardial infarction[J]. The New England Journal of Medicine, 1998, 339(4): 229-234. DOI:10.1056/NEJM199807233390404 |
| [18] |
KAPUR A, DE PALMA R. Mortality after myocardial infarction in patients with diabetes mellitus[J]. Heart (British Cardiac Society), 2007, 93(12): 1504-1506. |
| [19] |
CHEN J X, STINNETT A. Ang-1 gene therapy inhibits hypoxia-inducible factor-1alpha (HIF-1alpha)-prolyl-4-hydroxylase-2, stabilizes HIF-1alpha expression, and normalizes immature vasculature in db/db mice[J]. Diabetes, 2008, 57(12): 3335-3343. DOI:10.2337/db08-0503 |
| [20] |
CHEN J X, STINNETT A. Disruption of Ang-1/Tie-2 signaling contributes to the impaired myocardial vascular maturation and angiogenesis in type II diabetic mice[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2008, 28(9): 1606-1613. DOI:10.1161/ATVBAHA.108.169235 |
| [21] |
ZENG H, LI L F, CHEN J X. Overexpression of angiopoietin-1 increases CD133+/c-kit+cells and reduces myocardial apoptosis in db/db mouse infarcted hearts[J]. PLoS One, 2012, 7(4): e35905. DOI:10.1371/journal.pone.0035905 |
| [22] |
TUO Q H, ZENG H, STINNETT A, et al. Critical role of angiopoietins/Tie-2 in hyperglycemic exacerbation of myocardial infarction and impaired angiogenesis[J]. American Journal of Physiology Heart and Circulatory Physiology, 2008, 294(6): H2547-H2557. DOI:10.1152/ajpheart.01250.2007 |
| [23] |
AHN A, FRISHMAN W H, GUTWEIN A, et al. Therapeutic angiogenesis: A new treatment approach for ischemic heart disease: Part II[J]. Cardiology in Review, 2008, 16(5): 219-229. DOI:10.1097/CRD.0b013e3181620e50 |
| [24] |
LU Y L, CHU X P, ZHANG J F, et al. Effect of ShexiangTongxin dropping pill on stable coronary artery disease patients with normal fractional flow reserve and coronary microvascular disease: A study protocol[J]. Medicine, 2020, 99(38): e22126. DOI:10.1097/MD.0000000000022126 |
| [25] |
郭丽, 张丽, 于爽. 麝香通心滴丸对男性急性冠脉综合征病人血清睾酮与炎性因子的影响[J]. 中西医结合心脑血管病杂志, 2016, 14(3): 284-286. GUO L, ZHANG L, YU S. Effects of ShexiangTongxin dropping pills on serum testosterone and inflammatory factors in male patients with acute coronary syndrome[J]. Chinese Journal of Integrative Medicine on Cardio-/Cerebrovascular Disease, 2016, 14(3): 284-286. DOI:10.3969/j.issn.1672-1349.2016.03.018 |
| [26] |
杨杰, 张邢炜, 邓亚萍, 等. 麝香通心滴丸对冠心病患者血管内皮功能改善作用的研究[J]. 中华中医药学刊, 2016, 34(9): 2188-2190. YANG J, ZHANG X W, DENG Y P, et al. Effect of Shexiang Tongxindripping pill on endothelial function in patients with coronary heart disease[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(9): 2188-2190. |
| [27] |
吴刚, 余德龙, 李磊, 等. 麝香通心滴丸对缺血性心力衰竭心肌纤维化和血管再生的影响机制[J]. 中国实验方剂学杂志, 2021, 27(1): 141-146. WU G, YU D L, LI L, et al. Influence mechanism of myocardial fibrosis and vascular regeneration of ShexiangTongxin pills to syndrome of qi deficiency and blood stasis in ischemic heart failure[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(1): 141-146. |
| [28] |
LIU H H, ZHAO J J, PAN S L, et al. ShexiangTongxin dropping pill protects against sodium laurate-induced coronary microcirculatory dysfunction in rats[J]. Chung iTsaChih Ying Wen Pan, 2021, 41(1): 89-97. |
| [29] |
ZHANG X T, ZHU D, WEI L P, et al. OSM enhances angiogenesis and improves cardiac function after myocardial infarction[J]. BioMed Research International, 2015, 2015: 317905. |
| [30] |
HUANG D, WANG F B, GUO M, et al. Effect of combined treatment with rosuvastatin and protein kinase Cβ2 inhibitor on angiogenesis following myocardial infarction in diabetic rats[J]. International Journal of Molecular Medicine, 2015, 35(3): 829-838. DOI:10.3892/ijmm.2014.2043 |
| [31] |
MANUEL G E, JOHNSON T, LIU D. Therapeutic angiogenesis of exosomes for ischemic stroke[J]. International Journal of Physiology, Pathophysiology and Pharmacology, 2017, 9(6): 188-191. |
| [32] |
MESSAOUDI S, MILLIEZ P, SAMUEL J L, et al. Cardiac aldosterone overexpression prevents harmful effects of diabetes in the mouse heart by preserving capillary density[J]. FASEB Journal, 2009, 23(7): 2176-2185. DOI:10.1096/fj.08-125302 |
| [33] |
BADIMON L, BORRELL M. Microvasculature recovery by angiogenesis after myocardial infarction[J]. Current Pharmaceutical Design, 2018, 24(25): 2967-2973. DOI:10.2174/1381612824666180629162726 |
| [34] |
WEIDNER K, BEHNES M, SCHUPP T, et al. Type 2 diabetes is independently associated with all-cause mortality secondary to ventricular tachyarrhythmias[J]. Cardiovascular Diabetology, 2018, 17(1): 125. DOI:10.1186/s12933-018-0768-y |
| [35] |
CHOU E, SUZUMA I, WAY K J, et al. Decreased cardiac expression of vascular endothelial growth factor and its receptors in insulin resistant and diabetic States: A possible explanation for impaired collateral formation in cardiac tissue[J]. Circulation, 2002, 105(3): 373-379. DOI:10.1161/hc0302.102143 |
| [36] |
TONGERS J, RONCALLI J G, LOSORDO D W. Therapeutic angiogenesis for critical limb ischemia: Microvascular therapies coming of age[J]. Circulation, 2008, 118(1): 9-16. DOI:10.1161/CIRCULATIONAHA.108.784371 |
| [37] |
DING J, JIA W, CUI Y G, et al. Anti-angiogenic effect of a chemically sulfated polysaccharide from Phellinusribis by inhibiting VEGF/VEGFR pathway[J]. International Journal of Biological Macromolecules, 2020, 154: 72-81. DOI:10.1016/j.ijbiomac.2020.03.068 |
| [38] |
TAKAHASHI H, SHIBUYA M. The vascular endothelial growth factor (VEGF)/VEGF receptor system and its role under physiological and pathological conditions[J]. Clinical Science (London, England: 1979), 2005, 109(3): 227-241. DOI:10.1042/CS20040370 |
| [39] |
WU F T, STEFANINI M O, MAC GABHANN F, et al. A systems biology perspective on sVEGFR1:Its biological function, pathogenic role and therapeutic use[J]. Journal of Cellular and Molecular Medicine, 2010, 14(3): 528-552. |
| [40] |
SASSO F C, TORELLA D, CARBONARA O, et al. Increased vascular endothelial growth factor expression but impaired vascular endothelial growth factor receptor signaling in the myocardium of type 2 diabetic patients with chronic coronary heart disease[J]. Journal of the American College of Cardiology, 2005, 46(5): 827-834. DOI:10.1016/j.jacc.2005.06.007 |
| [41] |
WANG X H, CHEN S F, JIN H M, et al. Differential analyses of angiogenesis and expression of growth factors in microand macrovascular endothelial cells of type 2 diabetic rats[J]. Life Sciences, 2009, 84(7/8): 240-249. |
| [42] |
JESMIN S, ZAEDI S, SHIMOJO N, et al. Endothelin antagonism normalizes VEGF signaling and cardiac function in STZ-induced diabetic rat hearts[J]. American Journal of Physiology Endocrinology and Metabolism, 2007, 292(4): E1030-E1040. DOI:10.1152/ajpendo.00517.2006 |
| [43] |
HAN B, BALIGA R, HUANG H, et al. Decreased cardiac expression of vascular endothelial growth factor and redox imbalance in murine diabetic cardiomyopathy[J]. American Journal of Physiology Heart and Circulatory Physiology, 2009, 297(2): H829-H835. DOI:10.1152/ajpheart.00222.2009 |
| [44] |
KARAMYSHEVA A F. Mechanisms of angiogenesis[J]. Biochemistry Biokhimiia, 2008, 73(7): 751-762. DOI:10.1134/S0006297908070031 |
| [45] |
SINGH A K, GUDEHITHLU K P, PEGORARO A A, et al. Vascular factors altered in glucose-treated mesangial cells and diabetic glomeruli. Changes in vascular factors impair endothelial cell growth and matrix[J]. Laboratory Investigation; a Journal of Technical Methods and Pathology, 2004, 84(5): 597-606. DOI:10.1038/labinvest.3700082 |
| [46] |
SURI C, JONES P F, PATAN S, et al. Requisite role of angiopoietin1, a ligand for the TIE2 receptor, during embryonic angiogenesis[J]. Cell, 1996, 87(7): 1171-1180. DOI:10.1016/S0092-8674(00)81813-9 |
| [47] |
DOBACZEWSKI M, AKRIVAKIS S, NASSER K, et al. Vascular mural cells in healing canine myocardial infarcts[J]. The Journal of Histochemistry and Cytochemistry, 2004, 52(8): 1019-1029. DOI:10.1369/jhc.3A6210.2004 |
| [48] |
FRANGOGIANNIS N G. The mechanistic basis of infarct healing[J]. Antioxidants & Redox Signaling, 2006, 8(11/12): 1907-1939. |
| [49] |
DEWALD O, REN G F, DUERR G D, et al. Of mice and dogs: Species-specific differences in the inflammatory response following myocardial infarction[J]. The American Journal of Pathology, 2004, 164(2): 665-677. DOI:10.1016/S0002-9440(10)63154-9 |
| [50] |
GLIOZZI M, SCICCHITANO M, BOSCO F, et al. Modulation of nitric oxide synthases by oxidized LDLs: Role in vascular inflammation and atherosclerosis development[J]. International Journal of Molecular Sciences, 2019, 20(13): E3294. DOI:10.3390/ijms20133294 |
| [51] |
CHATTERJEE A, CATRAVAS J D. Endothelial nitric oxide (NO) and its pathophysiologic regulation[J]. Vascular Pharmacology, 2008, 49(4/5/6): 134-140. |
| [52] |
GONG X, MA Y, RUAN Y J, et al. Long-term atorvastatin improves age-related endothelial dysfunction by ameliorating oxidative stress and normalizing ENOS/iNOS imbalance in rat aorta[J]. Experimental Gerontology, 2014, 52: 9-17. DOI:10.1016/j.exger.2014.01.015 |
| [53] |
LIU B Y, KUANG L R, LIU J G. Bariatric surgery relieves type 2 diabetes and modulates inflammatory factors and coronary endothelium ENOS/iNOS expression in db/db mice[J]. Canadian Journal of Physiology and Pharmacology, 2014, 92(1): 70-77. DOI:10.1139/cjpp-2013-0034 |
2. Ministry of Education Key Laboratory of traditional Chinese medicine Syndrome and Formula, Beijing 100029, China;
3. BeijingKey Laboratory of traditional Chinese medicine Syndrome and Formula, Beijing 100029, China;
4. Institute of Traditional Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
 2022, Vol. 39
2022, Vol. 39