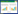文章信息
- 赵磊, 袁庆, 张彤, 贾壮壮, 殷孟兰, 胡利民
- ZHAO Lei, YUAN Qing, ZHANG Tong, JIA Zhuangzhuang, YIN Menglan, HU Limin
- 基于PI3K/AKT通路探讨水蛭、地龙提取物对MCAO/R小鼠脑缺血半暗带神经元的保护作用
- Exploration of the protective effects of Leech and Earthworm extracts on cerebral ischemic penumbra neurons in MCAO/R mice based on PI3K/AKT pathway
- 天津中医药, 2022, 39(8): 1057-1063
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(8): 1057-1063
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.08.20
-
文章历史
- 收稿日期: 2022-02-03
缺血性脑卒中具有高发病率、高病死率和高致残率的特点,是常见的神经系统疾病[1-2]。缺血后血流再通导致脑缺血再灌注损伤(CIRI)是缺血性脑卒中主要的致病原因,其病理机制包括:氧化应激,炎症反应,线粒体损伤、Ca2+超载、细胞凋亡等[3]。
水蛭是破血消癥的代表药,具有破血通经,逐淤消癥的功效。主要含有蛋白质及多肽类大分子、氨基酸等有效成分。现代药理研究表明,水蛭具有改善微循环、抑制血小板聚集、溶栓、降低血液黏稠度等作用[4-5]。地龙是平肝熄风的代表中药,具有清热定惊、通络、平喘的功效。主要含有蛋白质,核苷酸和氨基酸等有效成分。研究表明,地龙具有解热镇痛、抗炎、抗血栓、抗肺纤维化、抗肿瘤及免疫调节等药理作用[6]。水蛭和地龙及其中成药制剂,如复方地龙片、疏血通注射液、脑血康、脑血栓片等广泛用于临床上中风等疾病的治疗[7]。本研究目的在于探讨水蛭地龙通过调节磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)信号通路,进而减轻MCAO/R小鼠脑缺血半暗带神经元损伤的作用及机制。
1 材料和方法 1.1 实验动物SPF级C57BL/cnc小鼠,雄性,体质量(20±5)g;北京维通利华实验动物公司,许可证号:SCXK(京)2016-0006。
1.2 药品与试剂水蛭提取液、地龙提取液由牡丹江友搏药业有限责任公司提供,B淋巴细胞瘤-2(Bcl-2,ab196495)、Bcl-2相关X蛋白(Bax,ab199677)、Cleaved Caspase-3(ab49822)、神经特异核蛋白(NeuN,ab177487)、β-actin(ab179467),英国Abcam公司生产;磷脂酰肌醇3激酶(PI3K,17366)、p-AKT(4060)、蛋白激酶B(AKT,4685),MAP2(4542S)美国Cell Signaling Technology公司生产;TUNEL细胞凋亡检测试剂盒,上海碧云天生物技术有限公司生产。
1.3 主要仪器蛋白免疫印迹(Western-blot)电泳仪,美国Bio-Rad公司;Trans-Blot转膜仪,美国Invitrogen公司;全自动封闭脱水机,德国LEICA公司;病理切片机,德国LEICA公司;Leica 750生物显微镜,德国LEICA公司;Eclipse Ti倒置荧光显微镜,日本Nikon公司;Amersham imager 600超灵敏多功能成像仪,美国General Electric公司。
1.4 分组与给药将40只C57BL/cnc小鼠采用随机数字表法分为,假手术组(Sham组)、脑缺血再灌注组(MCAO/R组)、水蛭提取液组(Leech组,0.8 g生药/kg)、地龙提取液组(Earthworm组,0.8 g生药/kg)共4组,尾静脉注射给药,每日1次,连续给药7 d,Sham组与MCAO/R组给予相同容积生理盐水。
1.5 MCAO/R模型制备手术前,小鼠被禁食12 h,可自由获取饮用水。2%异氟烷持续麻醉小鼠,线栓法[8]建立大脑中动脉闭塞/再灌注(MCAO/R)模型,手术过程中小鼠肛温保持(37.0±0.5)℃,室温维持(27.0±0.5)℃。消毒备皮后,沿颈部正中切开皮肤,暴露颈总动脉、颈外动脉,夹闭颈总及颈外动脉,在颈外动脉近心端剪一V型切口,钝性分离颈内动脉,将线栓沿颈外动脉经颈内动脉推至距离分叉(10±3)mm,插至大脑中动脉,系紧颈外动脉游离端,缺血1.5 h后拔出线栓,实现再灌。Sham组不做插线栓处理,其余操作同MCAO/R组。
1.6 观察指标及检测方法 1.6.1 神经行为学评分采用mNSS评分[9],连续给药7 d后,观察各组小鼠神经功能缺损情况,包括运动测试、感觉测试、平衡测试、反射测试和异常运动5个方面,共18分,分数越高说明神经功能缺损越严重。
1.6.2 苏木精-伊红(HE)染色及Nissl染色异氟烷麻醉处死小鼠,心脏灌注生理盐水及4%多聚甲醛溶液,取出的脑组织经固定、脱水、包埋及切片。脑切片进行常规HE染色及Nissl染色,Leica 750生物显微镜下观察。
1.6.3 TUNEL染色检测脑缺血半暗带细胞凋亡情况各组小鼠脑石蜡切片参照试剂盒操作说明进行TUNEL染色,于倒置荧光显微镜下观察缺血半暗带细胞凋亡情况。细胞凋亡率(%)=凋亡细胞数量/总细胞数量×100%。
1.6.4 免疫荧光法检测脑缺血半暗带Bcl-2、Bax阳性细胞表达小鼠断头取脑,心脏灌注生理盐水及4%多聚甲醛溶液,固定、脱水及包埋,制备石蜡切片。切片经脱蜡,水化,磷酸盐缓冲溶液(PBS)清洗10 min,3%H2O2孵育8 min,放入柠檬酸钠溶液中抗原修复,滴加山羊血清封闭,4 ℃孵育Bcl-2、Bax一抗过夜,次日加入相应FITC标记的二抗,37 ℃避光孵育40 min,DAPI避光染核10 min,封片;镜下观察,随机选取5个高倍视野拍照,统计阳性细胞表达数。
1.6.5 Western-Blot法检测脑缺血半暗带PI3K、p-AKT、AKT、Bcl-2、Bax、Cleaved Caspase-3、Caspase-3、NeuN、MAP2蛋白表达情况提取各组小鼠脑缺血半暗带总蛋白,BCA测定蛋白浓度。蛋白样品添加至SDS-PAGE凝胶孔道,在电压100 V下电泳25 min后,换80 V电压电泳60 min,将蛋白转移至PVDF转膜,5%脱脂奶粉室温下封闭2 h,将PVDF膜与PI3K、p-AKT、AKT、Bcl-2、Bax、Cleaved Caspase-3、Caspase-3、β-actin、NeuN、MAP2一抗结合,4 ℃孵育过夜。次日,用对应HRP标记二抗于室温下孵育1 h,TBST洗膜,显影。Image J软件分析目的蛋白/β- actin的相对表达情况。
1.7 统计学方法采用SPSS 21.0软件进行数据分析,实验数据以均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较用LSD法,P<0.05为差异具有统计学意义。
2 结果 2.1 对MCAO/R小鼠神经功能缺损的影响给药7 d后,与Sham组比较,MCAO/R组mNSS评分升高(P<0.01);与MCAO/R组比较,水蛭和地龙给药组mNSS评分显著下降(P<0.01),神经功能缺损情况得到改善。见图 1。
|
| 注:与MCAO/R组比较,**P<0.01;与Sham组比较,##P<0.01。 图 1 各组小鼠神经功能评分(n=10,x±s) Fig. 1 mNSS of mice in each group (n=10, x±s) |
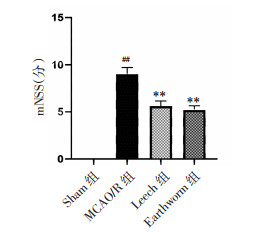
HE染色结果表明,与Sham组相比,MCAO/R组细胞排列不齐、间隙疏松,组织结构松散、损伤严重;与MCAO/R组相比,水蛭和地龙给药组细胞排列整齐,组织形态明显改善。见图 2。
|
| 图 2 各组小鼠脑缺血半暗带HE染色情况 Fig. 2 HE staining image of cerebral ischemic penumbra of mice in each group |
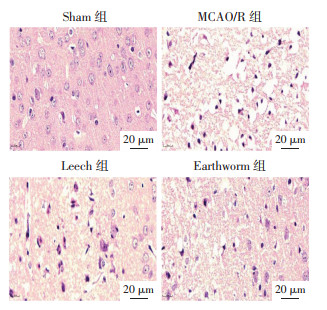
Nissl染色表明,与Sham组相比,MCAO/R组受损神经元数目增多,Nissl体数目减少(P<0.01);与MCAO/R组相比,水蛭和地龙给药组神经元形态相对正常,受损尼氏体数目减少(P<0.01)。Western-blot结果表明,与Sham组比较,MCAO/R组小鼠脑缺血半暗带NeuN和MAP2蛋白表达降低(P<0.01),与MCAO/R组比较,水蛭和地龙给药组小鼠脑缺血半暗带NeuN和MAP2蛋白表达显著上升(P<0.05或P<0.01)。见图 3、4。
|
| 注:与MCAO/R组比较,**P<0.01;与Sham组比较,##P<0.01。 图 3 各组小鼠脑缺血半暗带尼氏染色情况(n=5,x±s) Fig. 3 Nissl staining image of cerebral ischemic penumbra of mice in each group (n=5, x±s) |

|
| 注:与MCAO/R组比较,*P<0.05,**P<0.01;与Sham组比较,##P<0.01。 图 4 各组小鼠脑缺血半暗带NeuN、MAP2表达情况(x±s,n=3) Fig. 4 Expression of NeuN, MAP2 of cerebral ischemic penumbra of mice in each group(x±s, n=3) |
TUNEL染色结果表明,Sham组大脑皮层几乎无细胞凋亡;MCAO/R组TUNEL阳性细胞表达增多(P<0.01);与MCAO/R组相比,水蛭和地龙给药组TUNEL阳性细胞减少,细胞凋亡率下降(P<0.05或P<0.01)。见图 5。
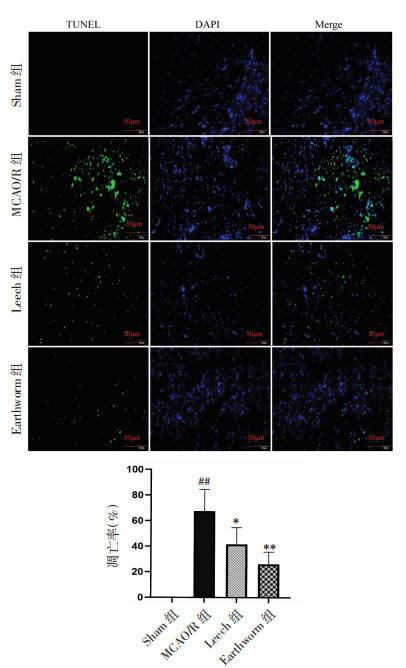
|
| 注:与MCAO/R组比较,*P<0.05,**P<0.01;与Sham组比较,##P<0.01。 图 5 各组小鼠脑缺血半暗带细胞凋亡率(n=5,x±s) Fig. 5 Apoptois of cerebral ischemic penumbra of mice in each group (n=5, x±s) |
免疫荧光结果显示,与Sham组比较,MCAO/R组小鼠脑缺血半暗带Bcl-2阳性细胞减少(P<0.01),Bax阳性细胞显著增加(P<0.01);与MCAO/R组比较,水蛭和地龙给药组Bax阳性细胞数表达降低(P<0.01),Bcl-2阳性细胞数表达升高(P<0.01)。Western-blot结果表明,与Sham组比较,MCAO/R组小鼠脑缺血半暗带Bcl-2/Bax相对蛋白表达降低(P<0.01);与MCAO/R组相比,水蛭和地龙给药组Bcl-2/Bax相对蛋白表达升高(P<0.05)。见图 6、7。

|
| 注:与MCAO/R组比较,**P<0.01;与Sham组比较,##P<0.01。 图 6 各组小鼠脑缺血半暗带Bcl-2、Bax阳性细胞数(x±s,n=5) Fig. 6 The positive expression of Bcl-2, Bax of cerebral ischemic penumbra of mice in each group(x±s, n=5) |
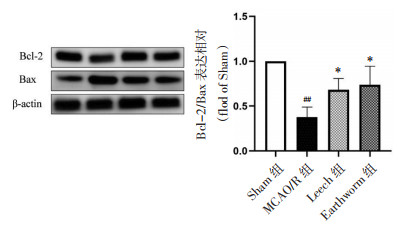
|
| 注:与MCAO/R组比较,*P<0.05;与Sham组比较,##P<0.01。 图 7 各组小鼠脑缺血半暗带Bcl-2、Bax表达情况(x±s,n=3) Fig. 7 Expression of Bcl-2, Bax of cerebral ischemic penumbra of mice in each group(x±s, n=3) |
Western-blot结果表明,与Sham组比较,MCAO/R组小鼠脑缺血半暗带Cleaved Caspase-3/Caspase-3相对蛋白表达升高(P<0.05);与MCAO/R组比较,水蛭和地龙给药组Cleaved Caspase-3/Caspase-3相对蛋白表达降低(P<0.05或P<0.01)。见图 8。
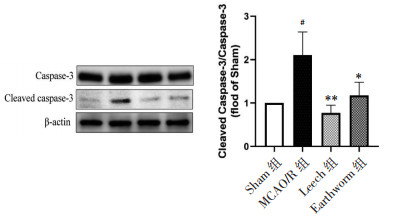
|
| 注:与MCAO/R组比较,*P<0.05,**P<0.01;与Sham组比较,#P<0.05。 图 8 各组小鼠脑缺血半暗带Cleaved Caspase-3、Caspase-3表达情况(x±s,n=3) Fig. 8 Expression of Cleaved-Caspase-3/Caspase-3 of cerebral ischemic penumbra of mice in each group(x±s, n=3) |
Western-blot结果表明,与Sham组相比,MCAO/R组小鼠脑缺血半暗带PI3K蛋白表达下降(P<0.05);p-AKT/AKT相对蛋白表达降低(P<0.05),与MCAO/R组比较,水蛭和地龙给药组p-AKT/AKT相对蛋白表达升高(P<0.05),PI3K蛋白表达上升(P<0.05)。见图 9。
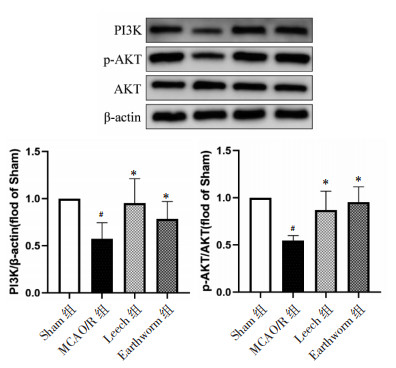
|
| 注:与Sham组比较,#P<0.05;与MCAO/R组比较,*P<0.05。 图 9 各组小鼠脑缺血半暗带PI3K、p-AKT、AKT表达情况(x±s,n=3) Fig. 9 Expression of PI3K、p-AKT/AKT of cerebral ischemic penumbra of mice in each group(x±s, n=3) |
缺血性脑卒中后再灌注损伤,可能诱发钙离子超载、炎症反应、氧化应激、凋亡过度等,影响机体稳态[10]。在正常状况下,受损及死亡的细胞在凋亡作用下被清除,维持体内正常细胞数量的稳态,但当受到过度刺激或者处于不利环境下,凋亡水平将发生改变,进而影响机体稳态[11]。脑缺血再灌注后神经元主要以细胞凋亡的方式受损并死亡,其中以迟发性神经元损伤为主[12]。线粒体是细胞凋亡的早期场所,脑缺血再灌注损伤会导致线粒体结构破坏,释放细胞色素C(Cyt-c),凋亡酶激活因子(Apaf-1)与Cytochrome-C形成复合物,加速Caspase-9与其结合形成凋亡小体,Caspase-3经切割后的Caspase-9激活,导致细胞凋亡发生。Caspase-3是诱导凋亡的最终效应蛋白,在凋亡途径中扮演重要角色。Bcl-2家族中抗凋亡蛋白(Bcl-2)与促凋亡蛋白(Bax)在体内的比例处于动态变化中,调节线粒体膜通透性,从而进一步调控细胞凋亡。下调抗凋亡蛋白(Bcl-2)或上调促凋亡蛋白(Bax)导致线粒体膜通透性增加,使细胞色素c释放,并进入胞质,激活Caspase-3[13-14]。PI3K/AKT信号途径可参与调节细胞增殖、迁移、凋亡等途径,并在MCAO/R损伤中发挥重要调节作用[15-17]。
课题组前期研究表明,水蛭和地龙提取液均具有较好的脑保护作用。本研究发现,通过应用水蛭及地龙干预小鼠脑缺血再灌注损伤,改善MCAO/R小鼠脑缺血半暗带神经元损伤,减少受损尼氏体数目,上调脑缺血半暗带NeuN、MAP2蛋白表达水平,降低神经元凋亡率,降低Cleaved Caspase-3/Caspase-3相对蛋白表达水平,上调Bcl-2/Bax相对蛋白表达水平,上调PI3K、p-AKT/AKT相对蛋白表达,激活PI3K/AKT信号通路。水蛭和地龙提取液成分复杂,水蛭提取液中主要是水蛭素,地龙提取液中主要是蚓激酶,同时两者中还含有一定多肽类成分和谷氨酸等。对于上述指标,水蛭和地龙都表现出很好的药理作用,但在Cleaved Caspase-3和PI3K等相关指标上水蛭和地龙作用趋势存在差异,表明水蛭和地龙对脑缺血再灌注后神经元保护作用有不同侧重。在临床上,由水蛭和地龙组成的疏血通注射液在缺血性脑卒中方面已有较广泛应用[18]。本研究分别考察水蛭、地龙提取物单独应用对MCAO/R小鼠脑缺血半暗带神经元的保护作用,为进一步研究各自在发挥神经保护作用方面的特定靶点,探讨疏血通注射液对脑缺血再灌注后神经元的保护作用奠定了实验基础。
| [1] |
VIRANI S S, ALONSO A, BENJAMIN E J, et al. Heart disease and stroke statistics-2020 update: A report from the American heart association[J]. Circulation, 2020, 141(9): e139-e596. |
| [2] |
BENJAMIN E J, VIRANI S S, CALLAWAY C W, et al. Heart disease and stroke statistics-2018 update: a report from the American heart association[J]. Circulation, 2018, 137(12): e67-e492. |
| [3] |
XIE W J, ZHOU P, SUN Y F, et al. Protective effects and target network analysis of ginsenoside Rg1 in cerebral ischemia and reperfusion injury: A comprehensive overview of experimental studies[J]. Cells, 2018, 7(12): 270. |
| [4] |
欧阳罗丹, 胡小松, 牛明, 等. 基于网络药理学的水蛭活血化瘀的作用机制研究[J]. 中国中药杂志, 2018, 43(9): 1901-1906. OUYANG L D, HU X S, NIU M, et al. Mechanisms of Hirudo in promoting blood circulation and removing stasis based on network pharmacology[J]. China Journal of Chinese Materia Medica, 2018, 43(9): 1901-1906. |
| [5] |
瞿新艳. 水蛭的抗凝血作用研究[J]. 现代中西医结合杂志, 2010, 19(13): 1582-1583. QU X Y. Study on anti-thrombin function of medicinal leech[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2010, 19(13): 1582-1583. DOI:10.3969/j.issn.1008-8849.2010.13.010 |
| [6] |
徐坤元, 邸莎. 地龙的临床应用及其用量探究[J]. 吉林中医药, 2020, 40(7): 937-940. XU K Y, DI S. Clinical application and dosage of Pheretima aspergillum[J]. Jilin Journal of Chinese Medicine, 2020, 40(7): 937-940. |
| [7] |
刘璇, 高美风, 孔毅. 水蛭化学成分及药理作用的研究进展[J]. 药物生物技术, 2017, 24(1): 76-80. LIU X, GAO M F, KONG Y. Bioactive constituents and pharmacological effects of leech[J]. Pharmaceutical Biotechnology, 2017, 24(1): 76-80. |
| [8] |
LUO Y, MA H J, ZHOU J J, et al. Focal cerebral ischemia and reperfusion induce brain injury through α2δ-1-bound NMDA receptors[J]. Stroke, 2018, 49(10): 2464-2472. |
| [9] |
GUEKHT A, SKOOG I, EDMUNDSON S, et al. ARTEMIDA trial (A randomized trial of efficacy, 12 months international double-blind actovegin): a randomized controlled trial to assess the efficacy of actovegin in poststroke cognitive impairment[J]. Stroke, 2017, 48(5): 1262-1270. |
| [10] |
CHEN B, WANG G X, LI W W, et al. Memantine attenuates cell apoptosis by suppressing the calpain-caspase-3 pathway in an experimental model of ischemic stroke[J]. Experimental Cell Research, 2017, 351(2): 163-172. |
| [11] |
JIAO S J, ZHU H C, HE P, et al. Betulinic acid protects against cerebral ischemia/reperfusion injury by activating the PI3K/Akt signaling pathway[J]. Biomedicine & Pharmacotherapy, 2016, 84: 1533-1537. |
| [12] |
NAKKA V P, GUSAIN A, MEHTA S L, et al. Molecular mechanisms of apoptosis in cerebral ischemia: Multiple neuroprotective opportunities[J]. Molecular Neurobiology, 2008, 37(1): 7-38. |
| [13] |
PUYAL J, GINET V, CLARKE P G H. Multiple interacting cell death mechanisms in the mediation of excitotoxicity and ischemic brain damage: A challenge for neuroprotection[J]. Progress in Neurobiology, 2013, 105: 24-48. |
| [14] |
LOVE S. Apoptosis and brain ischaemia[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 2003, 27(2): 267-282. |
| [15] |
CHEN J, ZHANG W, WU Y Q, et al. LncRNA SNHG1 inhibits neuronal apoptosis in cerebral infarction rats through PI3K/Akt signaling pathway[J]. European journal of pharmacology, 2019, 23(12): 5366-5373. |
| [16] |
李雪花, 王莹, 孙广大, 等. Anti-miR-146b对海马神经元OGD/R损伤的凋亡抑制作用[J]. 海南医学院学报, 2018, 24(20): 1783-1786. LI X H, WANG Y, SUN G D, et al. Apoptosis inhibitory effect of anti-miR-146b on hippocampal neurons of OGD/R-induced injury[J]. Journal of Hainan Medical University, 2018, 24(20): 1783-1786. |
| [17] |
李韵歆, 汤轶波, 郑燕飞, 等. 从PI3K/Akt和MAPK/Erk信号通路探讨复方当归注射液对拟缺血神经元的作用[J]. 天津中医药, 2020, 37(4): 442-449. LI Y X, TANG Y B, ZHENG Y F, et al. Exploration of the mechanism of Compound Angelica Injection on mimicischemic neurons from PI3K/Akt and MAPK/Erk signal pathways[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(4): 442-449. |
| [18] |
GU H Q, XIE X W, JING J, et al. Shuxuetong for Prevention of recurrence in acute cerebrovascular events with Embolism (SPACE) trial: rationale and design[J]. Stroke and Vascular Neurology, 2020, 5(3): 311-314. |
 2022, Vol. 39
2022, Vol. 39