文章信息
- 梁栋, 杨洪涛
- LIANG Dong, YANG Hongtao
- 栀子苷对高糖诱导肾小管上皮细胞转分化中TGF-β/Smad通路的影响
- Effect of geniposide on TGF-β/Smad pathway in high glucose-induced trans-differentiation of renal tubular epithelial cells
- 天津中医药, 2022, 39(8): 1064-1068
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(8): 1064-1068
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.08.21
-
文章历史
- 收稿日期: 2022-03-12
2. 国家中医针灸临床医学研究中心, 天津 300381
随着生活饮食习惯的改变,糖尿病全球患病率程上升趋势,目前已成为威胁人类寿命的严重疾病。据相关流调显示,目前中国成人2型糖尿病的患病率已达10.9%[1]。糖尿病肾病是糖尿病最常见的微血管并发症。在全球范围内,糖尿病肾病是导致慢性肾脏病(CKD)甚至终末期肾病(ESRD)的主要继发性因素。在中国,既往慢性肾小球肾炎是导致慢性肾脏病发病的首要原因,随着糖尿病发病率的持续上升,相关研究证实,糖尿病肾病已经取代慢性肾小球肾炎成为中国导致慢性肾脏病的主要原因[2-3]。肾小管间质纤维化是糖尿病肾病主要的病理特征,而在糖尿病肾病相关病程进展中,肾小管上皮细胞向间充质细胞转分化(EMT)不仅促进肾间质纤维化,而且是糖尿病肾病肾脏损伤的主要机制[4]。而转化生长因子β1是公认的致纤维化因子[5],其过度表达可诱导糖尿病肾病,激活其下游相关因子,加速肾间质纤维化。最近的研究也证实抑制转化生长因子-β1和Smad相关蛋白(TGF-β1/Smad)可抑制肾纤维化和上皮细胞转分化。既往的研究证实,高糖环境、持续炎症状态均可激活相关信号通路导致糖尿病持续肾损伤[6-7]。而其中白细胞介素(IL)-1β、IL-6、肿瘤坏死因子-α(TNF-α)是具有代表性的相关炎症因子,其激活中性粒细胞并使其聚集,进一步向炎症部位迁移、吞噬细胞、释放卵清蛋白酶、促进细胞凋亡等,促进炎症进一步发展,影响糖尿病患者免疫调节[8]。
栀子苷(GE)作为环烯醚萜葡萄糖苷,易溶于水,是栀子中主要活性成分,具有降血糖、抗氧化、抗炎等多种生物学作用[9],在糖尿病肾病小鼠中可改善疾病状态[10],有研究表明,栀子苷可以降低脂多糖诱导的小鼠巨噬细胞相关炎症状态中TNF-α和IL-1β、IL-6等的表达和释放[11]。但是否通过改善肾小管上皮细胞转分化发挥作用尚不清楚。因此,高糖诱导人近端肾小管上皮细胞HK2,探讨GE对肾小管上皮细胞转分化是否发挥作用,以初步探讨GE缓解糖尿病肾病的机制。
1 材料与方法 1.1 细胞人近端肾小管上皮细胞HK2,购自中国医学科学院基础医学研究所细胞资源中心,资源编号:3111C0001CCC000160。
1.2 药品、试剂及仪器GE(纯度>98%,上海源叶生物科技有限公司,CAS:24512-63-8);胎牛血清、无糖DMEM培养液(美国Sigma公司,货号分别为:F8318、90113);IL-1β、IL-6、TNF-α酶联免疫吸附(ELISA)试剂盒,一抗TGF-β1、Smad3、α-平滑肌肌动蛋白(α-SMA,英国Abcam公司,货号分别为:ab215715、ab40854、ab21027)磷酸化Smad3(Phospho-Smad3,p-Smad3)(美国CST公司,批号9520);RNA提取试剂盒、TIANScript cDNA第一条链合成试剂盒、2×SYBR qPCR Mix(北京TAINGEN公司,货号分别为:DP419、KR104、KR108)。实时荧光定量聚合酶链反应(qRT-PCR)仪(美国ABI公司,型号:7500);蛋白凝胶成像仪(美国BIO-RAD公司,型号:GelDoc 2000)。
1.3 方法 1.3.1 实验分组及处理实验分为对照组、高糖组、GE 1、10、50、100 μmol/L组。HK2细胞在含10%胎牛血清DMEM培养液中置于37 ℃、5% CO2培养箱中培养,待细胞密度达到90%左右时进行传代,细胞处于对数期时进行实验。
对照组在5.5 mmol/L低糖DMEM培养液中培养,除对照组外,其余各组均于25 mmol/L高糖DMEM培养液中培养,GE 1、10、50、100 μmol/L组同时添加GE,使GE终浓度分别为1、10、50、100 μmol/L,干预48 h。
1.3.2 显微镜下观察HK2细胞形态倒置显微镜下观察HK2细胞的形态学情况。
1.3.3 qRT-PCR检测细胞中纤连蛋白(FN)、E-钙黏素(E-cad)、Ⅳ型胶原(COLⅣ)mRNA水平RNA提取试剂盒提取细胞总RNA,cDNA第一条链合成试剂盒合成cDNA。qRT-PCR仪对FN、E-cad、COLⅣ、内参GAPDH扩增,FN F:5’-CGAAATCACAGCCAG TAG-3’、R:5’-ATCACATCCACACGGTAG-3’,E-cad F:5’-CTGAGAACGAGGCTAACG-3’、R:5’-TTCAA TCCAGCACATCC-3’,COLⅣ F:5’-TATTCCTTCCT CATGCACACGGCG-3’、R:5’-CCAATTTTTGGGTT GGCACC-3’,内参GAPDH F:5’-AGTTCACTGGCGT CTTCAC-3’、R:5’-GCTTGACAAAGTGGTCGTTGAG-3’。20 μL反应体系:1 μL 40 ng/μL cDNA、10 μL 2×Mix、0.5 μL/0.5μL(F/R)、8 μL ddH2O;反应条件:95 ℃、40 s;95 ℃、30 s,(FN 59 ℃、45 s,E-cad 61 ℃、40 s,COLⅣ 57 ℃、45 s),40个循环。2-ΔΔCt法计算FN、E-cad、COLⅣ mRNA相对表达水平。
1.3.4 ELISA检测细胞上清液中IL-1β、IL-6、TNF-α水平收集细胞培养液,3 000 r/min离心5 min收集上清,离心半径为32.3 cm。严格按照人IL-1β、IL-6、TNF-α ELISA试剂盒说明书检测上清液中IL-1β、IL-6、TNF-α水平。
1.3.5 蛋白免疫印迹检测细胞中TGF-β1、Smad3、p-Smad3、α-SMA蛋白水平收集细胞,添加蛋白裂解液冰上裂解10 min,14 000 r/min、4 ℃离心20 min提取总蛋白,离心半径为11.09 cm。10%凝胶电泳分离蛋白,280 mA 40 min PVDF膜转膜;PVDF膜经5%脱脂奶粉室温封闭2 h;对应加入一抗TGF-β1、Smad3、p-Smad3、α-SMA,4 ℃孵育过夜;加入对应二抗,室温孵育1 h。避光显色,蛋白凝胶成像仪拍照和定量分析。条带灰度值通过image J软件分析获得。
1.4 统计学方法统计学软件GraphPad 8.0进行数据分析,计量数据以均数±标准差(x±s)描述,多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。P<0.05时表示差异有统计学意义。
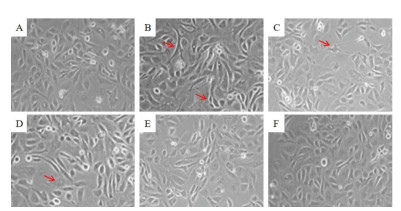
2 结果 2.1 各组细胞形态对照组细胞呈多边形或卵圆性,分布均匀;高糖组细胞部分呈现长梭形、胞核呈梭形变;随着GE剂量的升高,细胞形态逐渐恢复正常。见图 1。
|
| 注:A.对照组;B.高糖组;C.GE 1 μmol/L组;D.GE 10 μmol/L组;E.GE 50 μmol/L组;F.GE 100 μmol/L组。红色箭头:形态改变细胞。 图 1 各组细胞形态情况(×200) Fig. 1 Cell morphology of each group (×200) |
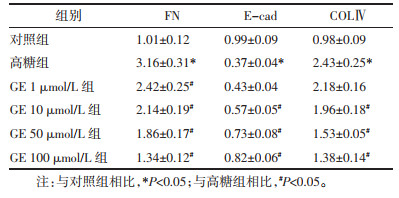
与对照组相比,高糖组细胞中FN、COLⅣ mRNA水平升高,E-cad mRNA水平降低(P<0.05);与高糖组相比,GE 1 μmol/L组细胞中FN mRNA水平降低(P<0.05),GE 10、50、100 μmol/L组细胞中FN、COLⅣ mRNA水平降低,E-cad mRNA水平升高(P<0.05)。见表 1。
|
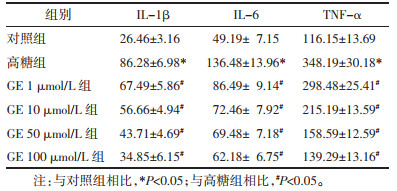
与对照组相比,高糖组上清液中IL-1β、IL-6、TNF-α水平升高(P<0.05);与高糖组相比,GE 1、10、50、100 μmol/L组上清液中IL-1β、IL-6、TNF-α水平降低(P<0.05)。见表 2。
|
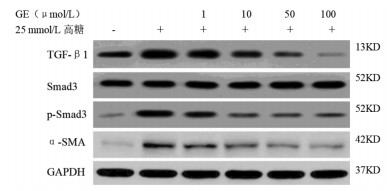
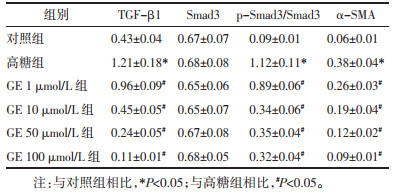
与对照组相比,高糖组细胞中TGF-β1、p-Smad3/Smad3、α-SMA蛋白水平升高(P<0.05);与高糖组相比,GE(1、10、50、100)μmol/L组细胞中TGF-β1、p-Smad3/Smad3、α-SMA蛋白水平降低(P<0.05)。见图 2、表 3。
|
| 图 2 6组细胞中TGF-β1、Smad3、p-Smad3、α-SMA蛋白水平情况 Fig. 2 TGF-β1、Smad3、p-Smad3、α- SMA protein level in 6 groups of cells |
|
栀子是茜草科植物栀子的果实,是中国的传统中草药,具有泻火除烦、凉血解毒、清热利湿、消肿止痛等作用。GE作为栀子重要活性成分,在糖尿病中具有保护胰岛β细胞结构,从而达到降血糖目的。在肾小管上皮细胞中是否亦发挥类似功效抑制肾小管上皮细胞转分化进而缓解糖尿病肾病,目前尚不清楚。
肾小管上皮细胞转分化是细胞在病理条件下的形态、结构、功能改变现象,与肿瘤转移、细胞修复、脏器纤维化关系密切,特别是脏器纤维化会引发肾衰竭[12]。FN、COLⅣ均是细胞外基质主要成分,在肾脏疾病早期即可出现,诱导胶原的分泌和沉积,进而促进肾间质纤维化过程[13]。正常情况下肾小管上皮细胞通过多种黏附蛋白紧密连接,E-cad作为黏附蛋白,在细胞膜上表达较多,具有维持细胞稳定性和完整性作用[14],E-cad在肾小管上皮细胞上表达降低,肾小管上皮细胞间黏附性丧失,变成单个细胞,促进肾小管上皮细胞转分化,E-cad是肾小管上皮细胞转化的第一道屏障[15]。本研究发现,与对照组相比,高糖组部分细胞呈长梭形、形态发生改变,细胞中FN、COLⅣ mRNA水平升高,E-cad mRNA水平降低,提示高糖可诱导肾小管上皮细胞之间的黏附作用降低、肾小管上皮细胞转分化,且促进胶原的分泌和沉积,促进纤维化过程;与高糖组相比,GE各剂量组均可在一定程度上降低FN、COLⅣ mRNA水平,升高E-cad mRNA水平,从而增加肾小管上皮细胞黏附、减少胶原沉积,实现对肾小管上皮细胞转分化的缓解作用。
炎症损伤是肾小管间质纤维化的关键,病理情况下产生各种炎症因子,炎症因子又通过旁分泌、自分泌等过程扩大炎症效应,产生炎症级联反应,促进糖尿病肾脏疾病的发展,导致肾纤维化过程[16]。本研究发现,与对照组相比,高糖组上清液中IL-1β、IL-6、TNF-α水平升高,提示高糖可促进肾小管上皮细胞炎症过程,加速炎症反应。与高糖组相比,GE各剂量组上清液中IL-1β、IL-6、TNF-α水平降低,提示GE具有抑炎作用,抑制肾小管上皮细胞炎症反应。
TGF-β1作为细胞增殖、分化的调控基因,亦可调节细胞外基质分泌[17],TGF-β信号通路已经公认作为肾小管上皮细胞转分化的关键介质,在血管内皮损伤、肾小管萎缩、足细胞损伤等多方面影响糖尿病肾病[18],TGF-β信号通路中Smad蛋白亦参与这一过程[19]。α-SMA作为肌成纤维标志蛋白,可促进细胞纤维肌丝的形成,TGF-β可通过Smad过程诱导成纤维细胞标志物α-SMA的表达从而成纤维细胞向肌成纤维细胞的转分化,促进FN、COLⅣ的分泌[20];TGF-β/Smad通路亦可参与炎症免疫信号通路过程[21]。本研究发现,与对照组相比,高糖组细胞中TGF-β1、p-Smad3/Smad3、α-SMA蛋白水平升高,提示高糖诱导肾小管上皮细胞TGF-β/Smad通路处于激活状态,促进细胞纤维肌丝形成和肾小管上皮细胞转分化。与高糖组相比,GE各剂量组细胞中TGF-β1、p-Smad3/Smad3、α-SMA蛋白水平降低,提示GE可抑制TGF-β/Smad通路,促进细胞间黏附作用、降低炎症反应,从而抑制肾小管上皮细胞转分化,抑制肾小管间质纤维化。
综上所述,GE可能通过降低FN、COLⅣ mRNA水平,升高E-cad mRNA水平,从而增加肾小管上皮细胞黏附、减少胶原沉积,实现对肾小管上皮细胞转分化的缓解,同时抑制肾小管上皮细胞炎症反应,从而抑制肾小管上皮细胞转分化,抑制肾小管间质纤维化。其是否通过其他途径影响肾小管上皮细胞转分化,尚需进一步研究。
| [1] |
中国2型糖尿病防治指南(2017年版)[J]. 中国实用内科杂志, 2018, 38(4): 292-344. Guidelines for the prevention and control of type 2 diabetes in China (2017 Edition)[J]. Chinese Journal of Practical Internal Medicine, 2018, 38(4): 292-344. |
| [2] |
The US Renal Data System (USRDS)[EB/OL]. (2021-09-20)[202109-20]. https://www.usrds.org/data-query-tools/esrd-incident-count/.
|
| [3] |
ZHANG L X, ZHAO M H, ZUO L, et al. China kidney disease network (CK-NET)2016 annual data report[J]. Kidney International Supplements, 2020, 10(2): e97-e185. DOI:10.1016/j.kisu.2020.09.001 |
| [4] |
孙兰, 田平平, 张帆, 等. 丹酚酸B对高糖诱导的大鼠肾小管上皮细胞转分化的影响及其机制研究[J]. 中国中药杂志, 2020, 45(16): 3922-3930. SUN L, TIAN P P, ZHANG F, et al. Effect of salvianolic acid B on high-glucose induced renal tubular epithelial-mesenchymal transition in rats and its mechanism[J]. China Journal of Chinese Materia Medica, 2020, 45(16): 3922-3930. |
| [5] |
SUN F, YU P F, WANG D, et al. microRNA-488 regulates diabetic nephropathy via TGF-β1 pathway[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(10): 4333-4340. |
| [6] |
HE J, JIANG Y L, WANG Y, et al. p0019microvesicles from mesenchymal stem cells overexpressing mir-34a inhibit tgf-beta-1-induced epithelial-mesenvhymal transition in renal tubular epithelial cells in vitro[J]. Nephrology Dialysis Transplantation, 2020, 35(Supplement_3): gfaa142. P0019.
|
| [7] |
王紫涵, 何洋, 王梦婷, 等. 肾小管上皮细胞-间充质转化在糖尿病肾病中作用的研究进展[J]. 新医学, 2021, 52(12): 897-902. WANG Z H, HE Y, WANG M T, et al. Research progress on the role of renal tubular epithelial cell-epithelial mesenchymal transition in diabetic nephropathy[J]. Journal of New Medicine, 2021, 52(12): 897-902. DOI:10.3969/j.issn.0253-9802.2021.12.002 |
| [8] |
SAHAKYAN K, KLEIN B E K, LEE K E, et al. Inflammatory and endothelial dysfunction markers and proteinuria in persons with type 1 diabetes mellitus[J]. European Journal of Endocrinology, 2010, 162(6): 1101-1105. DOI:10.1530/EJE-10-0049 |
| [9] |
YANG S Q, CHEN Y D, LI H, et al. Geniposide and gentiopicroside suppress hepatic gluconeogenesis via regulation of AKT-FOXO1 pathway[J]. Archives of Medical Research, 2018, 49(5): 314-322. DOI:10.1016/j.arcmed.2018.10.005 |
| [10] |
陈君, 潘晓琼, 禹博威, 等. 栀子苷对糖尿病肾病小鼠的改善作用[J]. 温州医科大学学报, 2019, 49(9): 644-648. CHEN J, PAN X Q, YU B W, et al. The effect of geniposide on mice with diabetic nephropathy[J]. Journal of Wenzhou Medical University, 2019, 49(9): 644-648. DOI:10.3969/j.issn.2095-9400.2019.09.005 |
| [11] |
SHI Q H, CAO J J, FANG L, et al. Geniposide suppresses LPSinduced nitric oxide, PGE2 and inflammatory cytokine by downregulating NF-κB, MAPK and AP-1 signaling pathways in macrophages[J]. International Immunopharmacology, 2014, 20(2): 298-306. DOI:10.1016/j.intimp.2014.04.004 |
| [12] |
花慧莲, 凌亚, 李进冬. 基于mTOR通路的大黄素对肾小管上皮细胞转分化的干预作用机制研究[J]. 中国医院药学杂志, 2019, 39(17): 1729-1733. HUA H L, LING Y, LI J D. Intervention mechanism of emodin on renal tubular epithelial cells transdifferentiation based on mTOR pathway[J]. Chinese Journal of Hospital Pharmacy, 2019, 39(17): 1729-1733. |
| [13] |
WEI Q Q, SU J, DONG G E, et al. Glycolysis inhibitors suppress renal interstitial fibrosis via divergent effects on fibroblasts and tubular cells[J]. American Journal of Physiology Renal Physiology, 2019, 316(6): F1162-F1172. DOI:10.1152/ajprenal.00422.2018 |
| [14] |
张乐. 非小细胞肺癌组织中抑癌基因RUNX3启动子甲基化与肿瘤侵袭相关基因E-Cad、MMP-7和TIMP-1蛋白表达的关系[J]. 中国免疫学杂志, 2019, 35(3): 316-319, 324. ZHANG L. Relationship between methylation of tumor suppressor gene RUNX3 and expression of E-Cad, MMP-7 and TIMP-1 in tumor invasive non-small cell lung cancer tissues[J]. Chinese Journal of Immunology, 2019, 35(3): 316-319, 324. DOI:10.3969/j.issn.1000-484X.2019.03.013 |
| [15] |
NI J, HOU X Y, WANG X Q, et al. 3-deazaneplanocin A protects against cisplatin-induced renal tubular cell apoptosis and acute kidney injury by restoration of E-cadherin expression[J]. Cell Death & Disease, 2019, 10(5): 355. |
| [16] |
王高明, 蔡伟, 龚向楠, 等. 促红细胞生成素预处理对大鼠体外循环所致急性肾损伤的影响[J]. 中华实验外科杂志, 2019, 36(4): 695-697. WANG G M, CAI W, GONG X N, et al. Effects of erythropoietin preconditioning on acute renal injury induced by cardiopulmonary bypass in rats[J]. Chinese Journal of Experimental Surgery, 2019, 36(4): 695-697. DOI:10.3760/cma.j.issn.1001-9030.2019.04.034 |
| [17] |
LODYGA M, HINZ B. TGF-β1-A truly transforming growth factor in fibrosis and immunity[J]. Seminars in Cell & Developmental Biology, 2020, 101: 123-139. |
| [18] |
BAI Z X, LU J, YANG Y B. Role of TGF-β1/ILK/FSP1 signaling pathway in cyclosporin A-induced epithelialmesenchymal transition in cultured renal tubular epithelial cells[J]. Journal of Southern Medical University, 2019, 39(7): 804-809. |
| [19] |
WANG Y N, ZHAO S L, SU Y Y, et al. Astragaloside IV attenuates high glucose-induced EMT by inhibiting the TGF-β/Smad pathway in renal proximal tubular epithelial cells[J]. Bioscience Reports, 2020, 40(6): BSR20190987. DOI:10.1042/BSR20190987 |
| [20] |
BRETON J D, HEYDET D, STARRS L M, et al. Molecular changes during TGFβ-mediated lung fibroblast-myofibroblast differentiation: Implication for glucocorticoid resistance[J]. Physiological Reports, 2018, 6(7): e13669. DOI:10.14814/phy2.13669 |
| [21] |
ZHONG H, FAN X L, FANG S B, et al. Human pluripotent stem cell-derived mesenchymal stem cells prevent chronic allergic airway inflammation via TGF-β1-Smad2/Smad3 signaling pathway in mice[J]. Molecular Immunology, 2019, 109: 51-57. DOI:10.1016/j.molimm.2019.02.017 |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China
 2022, Vol. 39
2022, Vol. 39