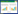文章信息
- 许艳玲, 赵玉珠, 付裕, 穆中一
- XU Yanling, ZHAO Yuzhu, FU Yu, MU Zhongyi
- 青蒿琥酯通过PI3K/GSK-3β通路对1型糖尿病小鼠胰岛素抵抗的改善作用研究
- Effect of artesunate on insulin resistance in type 1 diabetic mouse through PI3K/GSK-3β pathway
- 天津中医药, 2022, 39(8): 1077-1081
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(8): 1077-1081
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.08.23
-
文章历史
- 收稿日期: 2022-01-05
2. 辽宁省肿瘤医院泌尿外科, 沈阳 110000
糖尿病是胰岛素相对或绝对不足而导致的新陈代谢慢性紊乱综合征[1],1型糖尿病是由于胰岛β细胞破坏导致的自身免疫缺陷[2]。研究表明,肥胖和胰岛素抵抗是1型糖尿病的显著特征,其患者的所有慢性并发症与胰岛素抵抗密切相关[3]。目前,治疗1型糖尿病的主要药物为免疫抑制剂如环孢素,但长期使用会机体造成不良反应[4]。因此,寻找对1型糖尿病有效且不良反应少的药物成为研究热点。
青蒿琥酯是青蒿素的半合成水溶性衍生物之一,具有抗炎抗菌、调节免疫、抗肿瘤等药理作用[5]。研究表明,青蒿琥酯可抑制1型糖尿病大鼠的心血管并发症[6]、视网膜病变[7]等。但青蒿琥酯对1型糖尿病的胰岛素抵抗的研究较少。因此,本研究通过建立1型糖尿病动物模型,观察青蒿琥酯对1型糖尿病的胰岛素抵抗作用以及磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/糖原合成酶激酶-3β(GSK3β)/肝糖原合成酶(GS)信号通路的变化,为临床应用提供实验依据。
1 材料与方法 1.1 实验动物SPF级的雄性Balb/c小鼠60只[南方医科大学实验动物中心提供,许可证号:SCXK(粤)2016-0041],12周龄,体质量(20±5)g。所有小鼠均饲养于恒温(25±2)℃,湿度50%~60%的无特殊病原体环境中,高压灭菌的水和饲料随意进食。本实验方案通过本校实验动物中心的批准,并且在国家卫生研究所关于保护和使用实验动物的方针指导下进行。
1.2 试剂及试剂盒青蒿琥酯(60 mg,桂林南药股份有限公司生产,批号:LA150444);链脲佐菌素(STZ)(美国Sigma,CA-OOS-105),胰岛素(3 mL,赛诺菲制药有限公司,批号:113439);尿蛋白试剂盒(Merck,批号:232-917-9);福尔马林(济南百博生物技术股份有限公司);戊巴比妥钠(上海信裕生物科技有限公司);葡萄糖测定试剂盒(Merck,批号:MAK013-1KT);胰岛素酶联免疫吸附法(ELISA)试剂盒(上海碧云天生物技术有限公司,批号:PI608);硫代巴比妥酸试剂盒(齐一生物科技有限公司,批号:QY-R2814);游离脂肪酸测定试剂盒(Merck,批号:MAK044-1KT);Trizol试剂、RIPA缓冲液、PMSF、BSA和BCA试剂(上海碧云天生物技术有限公司,批号:R0016,P0013B,ST505,P0007,P0012S);PrimeScript TM RT试剂盒(Takara Biotechnology,批号:RR037B);SYBR-Green qPCR Master Mix(北京康润诚业生物科技有限公司,批号:4309155);兔抗鼠磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、糖原合成酶激酶-3(GSK3β)、谷氨酰胺合成酶(GS)和GAPDH单分子抗体(Abcam,批号:ab278545,ab38449,ab8805,ab32391,ab81230,ab9485);兔抗鼠p-PI3K和p-GSK3β(CST,批号:17366,9322)山羊抗兔二抗(CST,批号:7074);UltraSignal超敏ECL化学发光底物(4A Biotech,批号:4AW011-100)。
1.3 实验方法 1.3.1 实验动物分组和建模适应饲养1周后,将小鼠随机分为4组:健康对照组、模型组、青蒿琥酯组和胰岛素组,每组15只。除健康对照组外,其余各组小鼠单次空腹腹腔注射STZ 60 mg/kg[8]。48 h后尾静脉采血测血糖,血糖含量≥10.0 nmol/L,认定为糖尿病模型构建成功。健康对照组空腹注射等量的生理盐水。青蒿琥酯干预浓度选取100 mg/kg,每次灌胃前将青蒿琥酯与生理盐水涡旋成青蒿琥酯混悬液[9]。血糖检测完毕后,青蒿琥酯组按100 mg/kg青蒿琥酯混悬液灌胃,每日1次。健康对照组和模型组每日灌胃等量生理盐水,连续4周。胰岛素组皮下注射4 U/kg甘精胰岛素注射液[10],每日1次,连续5 d。造模、干预期间死亡大鼠随后补齐。
1.3.2 空腹血糖(FBG)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)、肝脏三酰甘油(TG)、丙二醛(MDA)、血清游离脂肪酸(FFA)的检测药物干预结束12 h,所有小鼠给予10%水合氯醛(3 mL/kg)腹腔注射,待麻醉后,将小鼠仰卧于解剖板上固定,分离腹主动脉,采取3 mL全血,3 000 r/min离心10 min分离血清,离心半径为10 cm,于-20 ℃冰箱保存。葡萄糖测定试剂盒检测血清中FBG含量,胰岛素ELISA试剂盒检测血清中FINS含量。HOMA-IR=(FBG×FINS)/22.5。TG由日立7020全自动生化分析仪检测。MDA由硫代巴比妥酸试剂盒检测。FFA由游离脂肪酸测定试剂盒(酶法)检测。
1.3.3 苏木精-伊红(HE)染色观察小鼠胰腺组织病理学所有小鼠取血后,安乐死小鼠,摘取完整胰腺组织,取部分组织置入4%多聚甲醛中固定24 h,脱水、石蜡包埋、切片,进行HE染色,镜下观察小鼠胰岛病理学。
1.3.4 Western blot检测迅速剥离出肝组织,放入冰PBS洗去血水后。称取所有组小鼠肝组织0.5 mg,放入低温匀浆机100 Hz匀浆10 min后,RIPA缓冲液和苯甲基磺酰氟(PMSF)抑制蛋白降解液(100∶1)将样本裂解后提取各组总蛋白。通过BCA试剂检测蛋白质的总浓度,将各组的总蛋白浓度调为一致后,将其于100 ℃进行变性后保存至-20 ℃。聚丙烯酰酶凝胶电泳(SDS-PAGE)分离总蛋白后,将其转膜至聚偏二氟乙烯(PVDF)膜。然后用5%脱脂牛奶封闭2 h,TBST洗涤3次,每次10 min后,将其放入对应的一抗(PI3K、p-PI3K、Akt、p-Akt、GSK3β、p-GSK3β、GS和GAPDH)和一抗稀释混悬液(1∶1 000)中,4 ℃孵育过夜。TBST洗涤3次,放入二抗和二抗稀释液(1∶4 000)混悬液中,室温孵育2 h。TBST洗涤3次,每次10 min,将超敏发光液ECL滴在膜上,放入化学发光成像仪(USA)进行蛋白显影。通过Image J软件进行分析,相对蛋白表达以GAPDH标准化。
1.3.5 统计学方法应用SPSS 20.0软件进行数据分析,资料以均数±标准差(x±s)表示,多组数据间的比较采用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,P<0.05表示差异有统计学意义。
2 结果 2.1 青蒿琥酯对糖尿病小鼠空腹血糖的影响STZ注射前,各组小鼠FBG值均差异无显著性。STZ注射后7 d,与健康对照组比较,模型组、青蒿琥酯组和胰岛素组的FBG值显著增加(P<0.05)。药物干预4周后,与健康对照组比较,模型组的FBG含量显著增加(P<0.05)。与模型组比较,青蒿琥酯组和胰岛素组的FBG含量显著降低(P<0.05)。与青蒿琥酯组比较,胰岛素组的FBG含量显著降低(P<0.05)。见表 1。
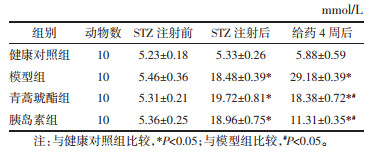
与健康对照组比较,模型组的FINS和HOMA-IR显著增加(P<0.05)。与模型组比较,青蒿琥酯组和胰岛素组FINS和HOMA-IR显著降低(P<0.05)与青蒿酯组比较,胰岛素组的FINS和HOMA-IR显著降低(P<0.05)。见表 2。
健康对照组小鼠胰岛形态规则,呈圆形细胞团,边界清晰,胰岛数和胰岛内细胞数量多且致密,细胞胞体饱满、大小一致,核染清晰;模型组小鼠胰岛明显萎缩,轮廓变形、扭曲,边界模糊,胰岛数与胰岛内细胞数量减少,排列紊乱,分布稀疏,细胞核固缩、分裂甚至缺失,胰岛周围可见炎症细胞浸润;与模型组比较,青蒿琥酯组和胰岛素组小鼠胰岛形态、细胞体以及胰岛数等病理明显减轻,尤其是胰岛素组病理学,更接近健康对照组。见图 1。
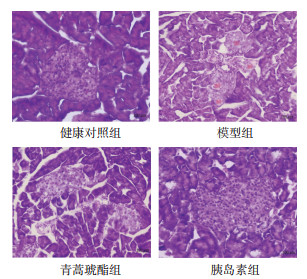
|
| 图 1 糖尿病小鼠胰岛病理学(HE染色,×400) Fig. 1 Pathology of pancreatic islets in diabetic mice(HE staining, ×400) |
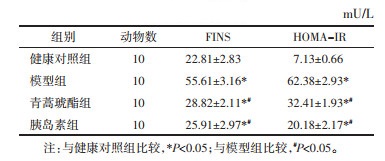
与健康对照组比较,模型组的TG、MDA和FFA含量显著增加(P<0.05)。与模型组比较,青蒿琥酯组、胰岛素组TG、MDA和FFA含量显著降低(P<0.05)。与青蒿琥酯组比较,胰岛素组TG、MDA和FFA含量显著降低(P<0.05)。见表 3。
与健康对照组比较,模型组小鼠肝组织中p-PI3K/PI3K和p-Akt/ Akt蛋白表达量比值显著降低(P<0.05),p-GSK3β/GSK3β蛋白表达量比值显著增加(P<0.05),GS蛋白表达量显著减低(P<0.05)。与模型组比较,青蒿琥酯组和胰岛素组小鼠肝组织中p-PI3K/PI3K和p-Akt/ Akt蛋白表达量比值显著增加(P<0.05),p-GSK3β/GSK3β蛋白表达量比值显著降低(P<0.05),GS蛋白表达量显著增加(P<0.05)。与青蒿琥酯组比较,胰岛素组小鼠肝组织中p-PI3K/PI3K和p-AKT/AKT蛋白表达量比值显著增加(P<0.05),p-GSK3β/GSK3β蛋白表达量比值显著降低(P<0.05),GS蛋白表达量显著增加(P<0.05)。见图 2、表 4。
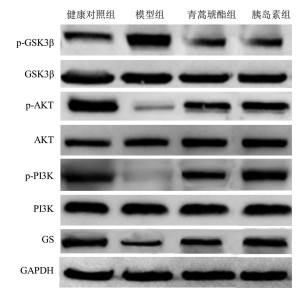
|
| 图 2 各组小鼠肝组织PI3K、Akt、GSK3β和GS蛋白表达情况 Fig. 2 Expression of PI3K, Akt, GSK3β and GS protein in liver tissues of mice in each group |

|
糖尿病是由于致病因素引起的胰岛素分泌缺乏或胰岛素抵抗,从而引发糖代谢紊乱的疾病[11]。其中1型糖尿病是胰腺β细胞被破坏,致使胰岛素分泌不足,导致机体多个器官处于高血糖环境,继而诱发严重的并发症[12]。本实验采用STZ损伤胰岛β细胞,制备1型糖尿病动物模型成功。
目前1型糖尿病主要治疗手段是胰岛素注射,但长期使用会增加感染、低血糖以及视网膜、神经、心血管等疾病的风险[13-14]。因此,寻找有效且不良反应少的药物非常重要。青蒿琥酯是具有过氧桥结构的半倍萜内酯类化合物,主要具有抗疟疾作用,在自身免疫性疾病、过敏性炎症疾病以及感染性疾病中发挥抗炎作用[15]。研究表明,青蒿琥酯可降低糖尿病大鼠中的血糖,从而抑制糖尿病的并发症[16-17]发生。本研究结果显示,青蒿琥酯可降低小鼠血糖浓度,改善小鼠胰岛病理表现,并且对空腹胰岛素抵抗具有抑制作用。青蒿琥酯还可减少1型糖尿病小鼠血清中TG、MDA和FFA含量,说明青蒿琥酯对降低1型糖尿病小鼠的血糖、减轻胰岛素抵抗和改善胰岛病理学具有一定的效果。
肝糖原含量对机体血糖水平的稳定非常重要,PI3K/GSK3β是胰岛素促进葡萄糖合成肝糖原的重要信号通路[18]。PI3K和AKT是GSK3β上游重要因子,PI3K磷酸化后活性增强,进一步激活AKT,然后直接磷酸化GSK3β丝氨酸位点,使其失去活性[19]。GSK3β可抑制GS的活性,导致糖原合成减少[21]。GSK3β与1型糖尿病的病理相关,GSK3β过表达或激活异常均可导致1型糖尿病[21]。本研究结果显示,青蒿琥酯干预1型糖尿病小鼠4周后,小鼠胰腺中p-PI3K/PI3K和p-AKT/AKT蛋白表达量比值降低,GSK3β蛋白表达量增加,磷酸化水平减弱,且上述作用仅次于胰岛素,表明青蒿琥酯可能通过激活1型糖尿病胰腺组织PI3K/GSK3β信号通路实现降糖、减轻胰岛素抵抗和改善胰岛病理学的目标。
综上所述,青蒿琥酯具有降低血糖、减轻胰岛素抵抗程度、增加肝糖原含量的作用,其机制与增强PI3K/GSK3β信号通路有关。这为探讨糖尿病胰岛素抵抗的发病机制和防治措施提供新的思路。然而,青蒿琥酯对糖尿病胰岛素抵抗的改善作用,仍需更多动物模型进一步研究。
| [1] |
KOYE D N, MAGLIANO D J, NELSON R G, et al. The global epidemiology of diabetes and kidney disease[J]. Advances in Chronic Kidney Disease, 2018, 25(2): 121-132. DOI:10.1053/j.ackd.2017.10.011 |
| [2] |
VIRTANEN S M, KNIP M. Type 1 diabetes-origins and epidemiology[J]. The Lancet Diabetes & Endocrinology, 2020, 8(5): 368-369. |
| [3] |
LIM A, SONG Y. The role of psychological insulin resistance in diabetes self-care management[J]. Nursing Open, 2020, 7(3): 887-894. DOI:10.1002/nop2.462 |
| [4] |
HONG J R, LEE Y W, CHOE Y B, et al. Risk factors for increased serum creatinine level in patients with psoriasis treated with cyclosporine in a real-world practice[J]. Dermatologic Therapy, 2019, 32(3): e12875. |
| [5] |
岑彦艳, 赵祎博, 李攀, 等. 青蒿琥酯的药代动力学以及相关药理作用研究进展[J]. 中国中药杂志, 2018, 43(19): 3970-3978. CEN Y Y, ZHAO Y B, LI P, et al. Research progress on pharmacokinetics and pharmacological activities of artesunate[J]. China Journal of Chinese Materia Medica, 2018, 43(19): 3970-3978. |
| [6] |
CHEN Y, LI W, NONG X L, et al. Role of Artesunate on cardiovascular complications in rats with type 1 diabetes mellitus[J]. BMC Endocrine Disorders, 2021, 21(1): 19. DOI:10.1186/s12902-021-00682-0 |
| [7] |
LI L, CHEN J, ZHOU Y, et al. Artesunate alleviates diabetic retinopathy by activating autophagy via the regulation of AMPK/SIRT1 pathway[J]. Archives of Physiology and Biochemistry, 2021, 8. |
| [8] |
SAYED N, ABDALLA O, KILANY O, et al. Effect of dapagliflozin alone and in combination with insulin in a rat model of type 1 diabetes[J]. The Journal of Veterinary Medical Science, 2020, 82(4): 467-474. DOI:10.1292/jvms.19-0450 |
| [9] |
LI Z X, SHI X J, LIU J B, et al. Artesunate prevents type 1 diabetes in NOD mice mainly by inducing protective IL-4-producing T cells and regulatory T cells[J]. The FASEB Journal, 2019, 33(7): 8241-8248. DOI:10.1096/fj.201900146R |
| [10] |
魏滋鸿, 李薇, 武卫党, 等. 新型国产重组甘精胰岛素对1型糖尿病模型大鼠的降糖作用研究[J]. 药物评价研究, 2018, 41(8): 1446-1449. WEI Z H, LI W, WU W D, et al. Study on hypoglycemic effect of novel domestic recombinant insulin glargine injection on diabetic model rats[J]. Drug Evaluation Research, 2018, 41(8): 1446-1449. |
| [11] |
BERNSTEIN C M, STOCKWELL M S, GALLAGHER M P, et al. Mental health issues in adolescents and young adults with type 1 diabetes: Prevalence and impact on glycemic control[J]. Clinical Pediatrics, 2013, 52(1): 10-15. DOI:10.1177/0009922812459950 |
| [12] |
NERY C, DE MORAES S R A, NOVAES K A, et al. Effectiveness of resistance exercise compared to aerobic exercise without insulin therapy in patients with type 2 diabetes mellitus: A meta-analysis[J]. Brazilian Journal of Physical Therapy, 2017, 21(6): 400-415. DOI:10.1016/j.bjpt.2017.06.004 |
| [13] |
CAI L, LI X, CUI W L, et al. Trends in diabetes and pre-diabetes prevalence and diabetes awareness, treatment and control across socioeconomic gradients in rural southwest China[J]. Journal of Public Health, 2017, 40(2): 375-380. |
| [14] |
RAMESH A, CHHABRA P, BRAYMAN K L. Pancreatic islet transplantation in type 1 diabetes mellitus: An update on recent developments[J]. Current Diabetes Reviews, 2013, 9(4): 294-311. DOI:10.2174/15733998113099990063 |
| [15] |
马里程, 农晓琳. 青蒿琥酯抗肿瘤作用机制研究进展[J]. 中华肿瘤防治杂志, 2020, 27(11): 921-926. MA L C, NONG X L. Progress in the study of the anti-tumor mechanism of artesunate[J]. Chinese Journal of Cancer Prevention and Treatment, 2020, 27(11): 921-926. |
| [16] |
李铁英, 关晓海, 曹福源, 等. 青蒿琥酯对糖尿病视网膜病变组织中Bcl-2和Hsp27表达的影响[J]. 基因组学与应用生物学, 2016, 35(2): 248-253. LI T Y, GUAN X H, CAO F Y, et al. The effect of artesunate on bcl2 and Hsp27 expression in the diabetic retinal pathological tissue[J]. Genomics and Applied Biology, 2016, 35(2): 248-253. |
| [17] |
梁晨, 李维, 陈怡, 等. 青蒿琥酯对糖尿病大鼠肾脏的保护作用及机制[J]. 山东医药, 2020, 60(14): 9-12. LIANG C, LI W, CHEN Y, et al. Protective effect and mechanism of artesunate on kidneys in diabetic rats[J]. Shandong Medical Journal, 2020, 60(14): 9-12. DOI:10.3969/j.issn.1002-266X.2020.14.003 |
| [18] |
OWINO S, S ÁNCHEZ-BRETAÑO A, TCHIO C, et al. Nocturnal activation of melatonin receptor type 1 signaling modulates diurnal insulin sensitivity via regulation of PI3K activity[J]. Journal of Pineal Research, 2018, 64(3): 10.1111/jpi. 12462.
|
| [19] |
BENCHOULA K, PARHAR I S, WONG E H. The crosstalk of hedgehog, PI3K and Wnt pathways in diabetes[J]. Archives of Biochemistry and Biophysics, 2021, 698: 108743. DOI:10.1016/j.abb.2020.108743 |
| [20] |
KHALED M, LARRIBERE L, BILLE K, et al. Glycogen synthase kinase 3beta is activated by cAMP and plays an active role in the regulation of melanogenesis[J]. The Journal of Biological Chemistry, 2002, 277(37): 33690-33697. DOI:10.1074/jbc.M202939200 |
| [21] |
MAFFEI A, LEMBO G, CARNEVALE D. PI3Kinases in diabetes mellitus and its related complications[J]. International Journal of Molecular Sciences, 2018, 19(12): 4098. DOI:10.3390/ijms19124098 |
2. Department of Urology, Liaoning Cancer Hospital, Shenyang 110000, China
 2022, Vol. 39
2022, Vol. 39