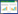文章信息
- 张毅, 赵丹丹, 莫芳芳, 高思华
- ZHANG Yi, ZHAO Dandan, MO Fangfang, GAO Sihua
- 降糖消渴颗粒对糖尿病小鼠肝脏内质网应激及脂质代谢的影响
- Effects of Jiangtang Xiaoke Granule on hepatic lipid metabolism and endoplasmic reticulum stress in diabetic mice
- 天津中医药, 2022, 39(9): 1157-1162
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(9): 1157-1162
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.09.16
-
文章历史
- 收稿日期: 2022-03-25
2. 北京中医药大学, 北京 100029
2型糖尿病(T2DM)是由于机体各靶器官对胰岛素的敏感性下降,产生的一系列代谢综合征,受遗传、环境、饮食、压力等多方面因素的影响[1]。肝脏是胰岛素的靶器官之一,也是脂质代谢的重要场所,当机体对胰岛素敏感性下降时,肝脏内可出现弥漫的脂肪变性,排除明确可致肝损害的诱因后,都可归为非酒精性脂肪性肝病(NAFLD)范畴[2]。T2DM患者因胰岛素抵抗常伴有脂质代谢紊乱甚至出现NAFLD,这与肝细胞内质网在脂质代谢中发挥的作用密切相关[3]。在机体感受到影响蛋白折叠或脂质稳态的信号刺激时,一定程度的内质网应激可帮助细胞加速折叠未折叠蛋白、降解错误折叠的蛋白,从而维持内环境稳态。但长时间、持续的ERS会引发机体糖脂代谢紊乱、脂质异位沉积甚至细胞凋亡[4-6]。肝细胞富含内质网,ERS参与了NAFLD、肝硬化、病毒性肝炎等的过程,亦可加剧T2DM患者的脂质代谢紊乱和肝脏的脂肪变性[7]。由此可见,对于T2DM合并NAFLD的患者而言,调控内质网应激尤为重要。噻唑烷二酮类药物是胰岛素增敏剂,可增强外周组织对胰岛素的敏感性,从而发挥降低血糖的效果。吡格列酮是临床较常用于治疗T2DM的噻唑烷二酮类药物,吡格列酮除可降糖外,还具有纠正脂质代谢紊乱、抗炎等多种作用,也是临床上用于治疗NAFLD的常用药物之一。
降糖消渴颗粒是以肝脾肾同调理论为指导,结合多年临床经验创制的中药复方制剂[8-9]。前期实验研究发现[10-12],高脂饲料诱导成T2DM模型的KK-Ay小鼠,除血糖、血脂升高外,其肝脏HE染色均出现组织结构的改变及脂肪性空泡,表现出不同程度的脂肪变性,即出现了NAFLD。降糖消渴颗粒一方面可降低2型糖尿病KK-Ay小鼠空腹血糖水平、糖化血红蛋白含量,提高葡萄糖耐量;另一方面还可减少血清和肝脏中三酰甘油、胆固醇、高/低密度脂蛋白的含量,改善肝脏组织结构,降低肝脏氧化应激、内质网应激的程度。但其改善脂质代谢,减轻NAFLD的机制是否通过调控内质网应激实现的,仍需进一步验证。
本实验选用高脂饲料诱导的T2DM(已出现NAFLD)KK-Ay小鼠为研究对象[10],在前期研究的基础上,进一步对肝脏中脂质代谢及内质网应激相关指标基因和蛋白的表达进行检测,探讨降糖消渴颗粒改善糖尿病小鼠肝脏脂质代谢的可能机制。
1 材料 1.1 动物及饲料雄性8周龄KK-Ay小鼠、C57/6J小鼠,购自北京华阜康生物科技有限公司,审批号:SCXK(京)2012-0001。饲养于北京中医药大学屏障环境动物实验室,合格证号:SCXK(京)2011-0024。环境温度维持在22~24 ℃,相对湿度维持在40%±10%,光照为12 h/12 h明暗周期。每日为动物提供充足的饲料和新鲜的饮用水,高脂饲料(20%蔗糖、2.5%胆固醇、10%猪油、1%胆酸钠、66.5%基础饲料)及普通饲料购于北京科澳协力饲料有限公司。饲养期间,实验动物自由进食、饮水。
本动物实验经北京中医药大学医学与实验动物伦理委员会准许。
1.2 药物降糖消渴颗粒及制备方法详见前期文献[10-11],规格:5.01 g生药/g颗粒。吡格列酮片由北京太洋药业有限公司生产。给药药品均保存于4 ℃条件下,用前去离子水配制成所需浓度混悬液,超声30 min使其充分溶解。
1.3 主要试剂与仪器光学显微镜(日本奥林帕斯)、Trizol试剂(美国Invitrogen公司)、SYBR Mix试剂盒(美国ABI公司)、Step One PLUS荧光定量PCR仪器(美国ABI公司)、电动匀浆器(德国IKA仪器设备有限公司)、SAM超微紫外分光光度计[岛津国际贸易(上海)有限公司]、半裙边PCR板及封板膜(美国ABI公司)、PCR引物设计合成(上海生工生物工程有限公司)、10%中性缓冲液福尔马林固定液(北京益利精细化学品有限公司)、兔抗p-eIF2α抗体(CST)、兔抗GRP78抗体(Abcam)、兔来源超敏免疫组化试剂盒(北京中杉金桥生物技术有限公司)、小鼠来源超敏免疫组化试剂盒(北京中杉金桥生物技术有限公司)、山羊血清工作液(北京中杉金桥生物技术有限公司)。
2 方法 2.1 动物模型制备本实验选取40只雄性KK-Ay小鼠诱导T2DM模型,8只雄性C57BL/6J小鼠作为正常对照组。所有小鼠适应性饲养1周后,给予KK-Ay小鼠高脂饲料饲养造模,期间C57BL/6J小鼠给予普通饲料。4周后,禁食不禁水12 h,检测各组小鼠空腹血糖水平,以空腹血糖≥13.9 mmol/L为成模标准。经过4周高脂饲料诱导,本实验中所有KK-Ay小鼠均成模。
2.2 分组及给药方法将成模后的小鼠按照体质量和空腹血糖水平随机分为5组,分别为模型组,吡格列酮组,降糖消渴颗粒高、中、低(7,3.5,1.75 g/kg)剂量组,每组8只,其中中剂量由人鼠等效剂量换算得出,高、低剂量分别为人鼠等效剂量的2倍和0.5倍。中药治疗各组小鼠给予不同浓度(体积相等)降糖消渴颗粒混悬液灌胃,吡格列酮组实验小鼠灌胃剂量计算如下:给药剂量=6.5 mg/kg体质量×给药体积(0.1 mL/10 g体质量),模型组和正常组予等体积蒸馏水灌胃。治疗时长为10周,期间每日上午灌胃1次,实验期间各组小鼠延续造模期间的饮食模式。
2.3 指标检测 2.3.1 内质网应激相关指标基因检测治疗周期结束后,麻醉实验动物,开腹暴露肝脏并摘除,4 ℃预冷的生理盐水清洗后分装,液氮保存备用。剪取约100 mg肝组织,Trizol法提取肝组织总RNA,使用SAM紫外微量分光光度计检测所提取RNA的纯度及浓度。将提取的总RNA稀释成0.1 μg/μL,按照反转录试剂盒说明书建立20 μL反应体系,将总RNA反转录成cDNA,-20℃保存备用。进一步以SYBR Mix(10 μL)+c DNA模板(2 μL)+上/下游引物(各1μL)+RNase free water(6 μL),反应总体积为20 μL的反应体系,使用荧光定量PCR仪进行扩增反应,反应条件如下:50 ℃,2 min;95 ℃,10 min;95 ℃,20 s;60 ℃,15 s,40个循环,结束后4 ℃保存。每组取4个样本,各样本设2个复孔进行上样,结果用相对定量分析,采用2-ΔΔCT计算,ΔCT=Ct目的基因-Ctβactin,ΔΔCT=ΔCT实验组-ΔCT正常组,RQ=(2-ΔΔCT)。引物序列见表 1。
实验操作及结果计算方法同2.3.1,引物序列见表 2。
肝组织切片依次浸入二甲苯Ⅰ、Ⅱ中充分脱蜡,梯度浓度乙醇复水,去离子水冲洗干净。在组织表面滴加30%过氧化氢溶液封闭组织内的内源性过氧化氢酶,然后加入适量抗原修复液修复,再加入10%山羊血清工作液封闭后,按照抗体说明书步骤,依次孵育Ⅰ抗、Ⅱ抗。将新鲜配置、避光保存的DAB工作液滴加到玻片上的肝组织表面,电镜下观察,当组织表面呈现棕色后立刻终止反应,然后用苏木素对肝细胞核进行染色。将载有肝组织的玻片依次浸入梯度浓度乙醇脱水,二甲苯透明,中性树脂封片,干燥后镜检并拍摄图片。
2.4 统计方法实验结果用SPSS 19.0软件进行数据分析处理,计量资料以均值±标准差(x±s)表示。多组间比较采用单因素方差分析(One-Way ANOVA),组间两两比较采用LSD检验。P < 0.05表示差异性具有统计学意义。使用Graph Pad Prism 6.0软件绘制结果图,使用Image Pro Plus软件分析各组IOD/Area值的变化。
3 结果 3.1 降糖消渴颗粒对糖尿病小鼠肝脏IRE1α、XBP1基因表达的影响糖尿病小鼠肝组织IRE1α、XBP1的mRNA表达较正常小鼠显著上调(P<0.01)。中剂量降糖消渴颗粒可下调IRE1α的mRNA表达(P<0.05)。见表 3。
|
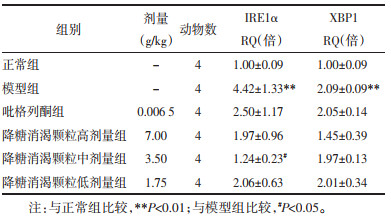
糖尿病小鼠肝脏中SREBP-1c、SREBP2、Insig-1的mRNA表达较正常小鼠显著上调(P<0.01),FAS也有所升高(P<0.05)。吡格列酮体现出了良好的降低SREBP2(P<0.01)和Insig-1(P<0.05)的基因表达量的作用。各浓度降糖消渴颗粒均下调了糖尿病小鼠肝脏SREBP-1c的mRNA表达(P<0.01)。中、低剂量中药还具有减少SREBP2的mRNA表达(P<0.01)和FAS的mRNA表达(P<0.05)的作用。除此之外,中剂量降糖消渴颗粒还可下调Insig-1的mRNA表达(P<0.05)。见表 4。
|
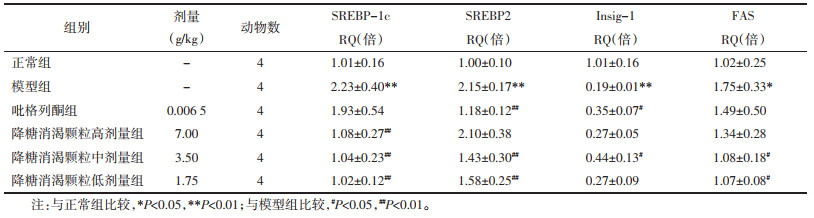
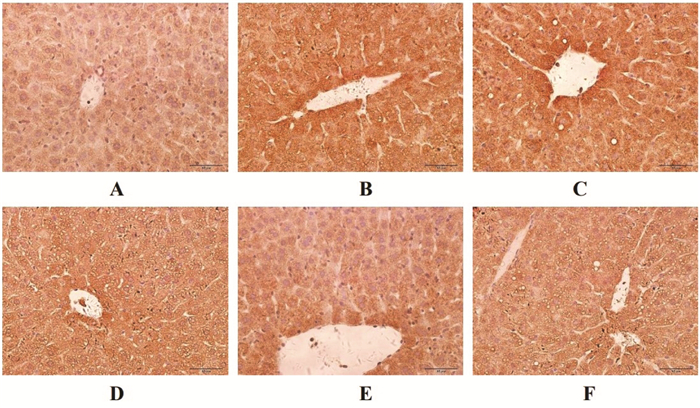
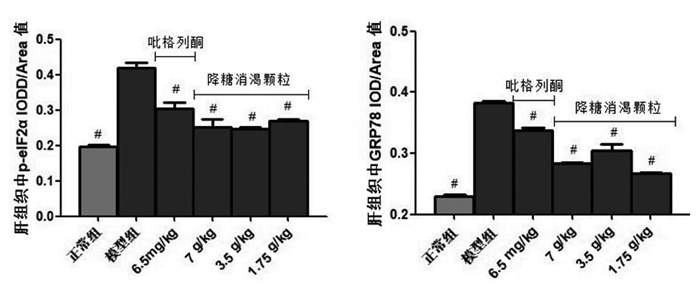
正常小鼠肝细胞内p-eIF2α(见图 1A)和GRP78(见图 2A)的含量很少。糖尿病小鼠肝脏内出现大量棕色阳性颗粒,IOD/Area值较正常小鼠变化明显(P<0.01),eIF2α磷酸化水平(见图 1B)和GRP78(见图 2B)含量显著升高。经吡格列酮及各剂量降糖消渴颗粒治疗后,肝脏内eIF2α的磷酸化水平(见图 1 C-F)和GRP78(见图 2 C-F)表达量都有不同程度的降低(P<0.01),说明吡格列酮和降糖消渴颗粒均降低了肝脏内质网应激的水平,对肝脏起到一定的保护作用。

|
| 注:A正常组;B模型组;C吡格列酮组;D降糖消渴颗粒高剂量组;E降糖消渴颗粒中剂量组;F降糖消渴颗粒低剂量组。 图 1 各组小鼠肝脏中p-eIF2α免疫组化结果(×40) Fig. 1 Immunohistochemical results of p-eIF2α in liver of mice in each group(×40) |
|
| 注:A正常组;B模型组;C吡格列酮组;D降糖消渴颗粒高剂量组;E降糖消渴颗粒中剂量组;F降糖消渴颗粒低剂量组。 图 2 各组小鼠肝脏中GRP78免疫组化结果(×40) Fig. 2 Immunohistochemical results of GRP78 in liver of mice in each group(×40) |
|
| 注:与模型组比较,#P<0.01。 图 3 各组小鼠肝脏中p-eIF2α、GRP78的IOD/Area值 Fig. 3 IOD/area value of p-eIF2α, GRP78 in liver of mice in each group |
降糖消渴颗粒[10-12]由生地黄、山萸肉、生晒人参、茯苓、丹参、黄连等10味药按照一定的比例组成,是在“肝脾肾三脏同调,辨证治疗2型糖尿病”学术思想指导下创立的系列复方之一,针对T2DM最常见的“肝脾肾气阴两虚,挟热挟瘀”证型而设。肝主疏泄、脾主运化、肾主藏精,三脏协同作用,共同维持人体气血津精等精微物质的生成、流通、敷布以及转化,肝、脾、肾任何一脏失常,都会渐次波及其余两脏,出现三脏同病的局面,最终导致糖尿病的发生[8]。中医学中的水谷精微转化过程与现代医学中的糖脂代谢类似,肝脾肾三脏各司其职则精微物质得以正常转化,相当于现代医学的糖脂代谢平衡状态。三脏同病,则痰浊、瘀血等病理产物丛生,相当于现代医学的糖脂代谢紊乱状态,异位沉积在肝脏中则导致NAFLD的发生。
肝脏在胰岛素的作用下,通过维持循环和储存脂质的动态平衡来调节机体的脂质代谢过程[13]。内质网应激的3条信号通路,由3种不同的跨膜蛋白介导,均可调控肝脏脂质含量。正常情况下,跨膜蛋白与分子伴侣GRP78结合处于失活状态,当内质网应激发生后,GRP78与跨膜蛋白解离转而与未折叠蛋白结合,因此,GRP78可作为内质网应激的标志物[14]。内质网应激信号通路之一的PERK-eIF2α通路可调控脂质生成和肝脏脂肪变性,参与了胰岛素抵抗状态下脂质在肝脏的异位沉积[15]。肝脏中的SREBP-1c可调节脂肪酸和三酰甘油的合成,SREBP2主要调控胆固醇的合成和摄取[16]。当SREBP-1c和SREBP2被激活时,与Insig1脱离,由内质网膜释放,激活FAS,入核后增加脂肪酸、三酰甘油和胆固醇的合成[17]。在内质网应激状态下,未折叠蛋白同样可激活SREBPs生成更多的脂类供内质网膜利用以减轻应激环境下造成的膜损伤,缓解内质网应激[18]。
本实验造模所用方法为高脂饲料喂养诱导2型糖尿病模型,前期实验结果显示[10],实验动物空腹血糖远远超出正常值且已出现了胰岛素抵抗,肝脏也出现了明显的脂肪变性。降糖消渴颗粒可改善高脂饮食诱导T2DM合并NAFLD小鼠糖脂代谢,减少肝脏脂肪含量,减轻肝脏脂肪变性程度及内质网应激反应。因此本实验是在胰岛素抵抗的状态下进一步探索肝脏内影响脂质代谢的可能通路的,拟在此基础上进一步探索降糖消渴颗粒改善T2DM合并NAFLD状态下的肝脏内脂质代谢是否是通过调控肝细胞内质网应激实现的。
本实验中,糖尿病小鼠肝脏中IRE1α、XBP1的mRNA表达较正常组均升高,p-eIF2α、GRP78的蛋白表达量显著增加,提示糖尿病状态下小鼠肝脏内质网应激的发生。通过对脂质代谢调节相关转录因子SREBP-1c、SREBP2、Insig-1及其下游FAS的mRNA表达量进行分析,发现由高脂饮食诱导的糖尿病小鼠肝脏中SREBP-1c和SREBP2的mRNA表达量均有所上调,反映糖尿病小鼠肝脏中脂质合成旺盛,这是肝脏脂质堆积,最终发展成为NAFLD的重要原因之一。结合肝脏内质网应激指标,提示糖尿病状态下,肝脏内质网应激与脂质沉积具有一定的正相关性。经吡格列酮治疗后,糖尿病小鼠肝组织中SREBP2的表达降低,Insig-1的表达升高,提示肝脏脂质合成作用有所减低;p-eIF2α、GRP78的蛋白表达量明显下降,而IRE1α、XBP1的mRNA表达变化不明显,除了进一步验证了肝脏内质网应激与脂质合成具有相关性外,还提示吡格列酮可能通过内质网应激中的p-eIF2α通路起作用的。降糖消渴颗粒对肝脏脂质代谢紊乱和内质网应激反应的改善作用均较明显,不仅中、低剂量组显著降低了SREBP-1c和SREBP2的mRNA表达量,免疫组化结果也显示各剂量组显著降低肝脏内eIF2α的磷酸化水平,减少GRP78含量,减轻了肝组织内质网应激水平。因此推测降糖消渴颗粒可降低糖尿病状态下肝脏内质网应激反应,减少脂质在肝脏中的过度合成的。
综上所述,T2DM(合并NAFLD)KK-Ay小鼠肝脏的脂质合成作用与内质网应激反应具有相关性。低、中(1.75,3.5 g/kg)剂量降糖消渴颗粒可在一定程度上下调实验小鼠肝脏中脂质代谢相关因子SREBPs的表达,以减少肝脏脂质的过度合成,同时减轻肝脏内质网应激反应,共同起到改善糖尿病肝脏脂质代谢紊乱的作用。
| [1] |
庞国明, 吕志刚, 叶乃菁, 等. 现代中药复方治疗糖尿病及其并发症相关机制研究进展[J]. 江西中医药, 2020, 51(5): 70-73. PANG G M, LYU Z G, YE N J, et al. Research progress on the mechanism of diabetes mellitus and its complications treated by modern Chinese medicine[J]. Jiangxi Journal of Traditional Chinese Medicine, 2020, 51(5): 70-73. |
| [2] |
JIANG S, ZHANG E, ZHANG R, et al. Altered activity patterns of transcription factors induced by endoplasmic Reticulum stress[J]. BMC Biochemistry, 2016, 17: 8. DOI:10.1186/s12858-016-0060-2 |
| [3] |
ASHRAF N U, SHEIKH T A. Endoplasmic Reticulum stress and Oxidative stress in the pathogenesis of Non-alcoholic fatty liver disease[J]. Free Radical Research, 2015, 49(12): 1405-1418. DOI:10.3109/10715762.2015.1078461 |
| [4] |
LI S J, JIANG W, HU S W, et al. Fucosylated chondroitin sulphate from Cusumariafrondosa mitigates hepatic endoplasmic Reticulum stress and inflammation in insulin resistant mice[J]. Food & Function, 2015, 6(5): 1547-1556. |
| [5] |
ZHANG Q, LI Y, LIANG T T, et al. ER stress and autophagy dysfunction contribute to fatty liver in diabetic mice[J]. International Journal of Biological Sciences, 2015, 11(5): 559-568. DOI:10.7150/ijbs.10690 |
| [6] |
KRATOCHVÍLOVÁ K, MORÁŇ L, PAĎOUROVÁ S, et al. The role of the endoplasmic Reticulum stress in stemness, pluripotency and development[J]. European Journal of Cell Biology, 2016, 95(3): 115-123. |
| [7] |
MAIERS J L, MALHI H. Endoplasmic Reticulum stress in metabolic liver diseases and hepatic fibrosis[J]. Seminars in Liver Disease, 2019, 39(2): 235-248. DOI:10.1055/s-0039-1681032 |
| [8] |
高思华, 龚燕冰, 倪青, 等. 肝脾肾同治法辨证治疗2型糖尿病的临床研究[J]. 中华中医药杂志, 2009, 24(8): 1007-1010. GAO S H, GONG Y B, NI Q, et al. Clinical study on treatment of type 2 diabetes from aspects of liver, spleen and kidney[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2009, 24(8): 1007-1010. |
| [9] |
赵丹丹, 高思华, 穆倩倩, 等. 肝脾肾同调辨治2型糖尿病的理论依据与特色[J]. 中医杂志, 2014, 55(3): 205-208. ZHAO D D, GAO S H, MU Q Q, et al. Theoretical study on treating type 2 diabetes by regulating the liver, spleen and kidney[J]. Journal of Traditional Chinese Medicine, 2014, 55(3): 205-208. DOI:10.3969/j.issn.0411-8421.2014.03.037 |
| [10] |
ZHANG Y, MO F F, ZHANG D W, et al. Jiangtang Xiaoke Granule attenuates glucose metabolism disorder via regulating endoplasmic Reticulum stress in the liver of type 2 diabetes mellitus mice[J]. Journal of Traditional Chinese Medicine, 2018, 38(4): 570-578. DOI:10.1016/S0254-6272(18)30889-6 |
| [11] |
张毅, 穆倩倩, 于娜, 等. 降糖消渴颗粒对自发性2型糖尿病KKAy小鼠肝脏功能和氧化应激的影响[J]. 世界中医药, 2016, 11(9): 1849-1851. ZHANG Y, MU Q Q, YU N, et al. Effect of Jiangtang Xiaoke Granule on hepatic function and oxidative stress in type 2 diabetic KKAy mice[J]. World Chinese Medicine, 2016, 11(9): 1849-1851. DOI:10.3969/j.issn.1673-7202.2016.09.053 |
| [12] |
张毅, 于娜, 穆倩倩, 等. 降糖消渴颗粒对自发性2型糖尿病KKAy小鼠肝脏脂质代谢的影响[J]. 中华中医药学刊, 2016, 34(11): 2626-2629. ZHANG Y, YU N, MU Q Q, et al. Effect of Jiangtang Xiaoke Granule on hepatic lipid metabolism in type 2 diabetic KKAy mice[J]. Chinese Archives of Traditional Chinese Medicine, 2016, 34(11): 2626-2629. |
| [13] |
YOUNOSSI Z, TACKE F, ARRESE M, et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. Hepatology, 2019, 69(6): 2672-2682. DOI:10.1002/hep.30251 |
| [14] |
CUI J H, LIU Y, CHANG X, et al. Acetaldehyde induces neurotoxicity in vitro via oxidative stress-and Ca2+ imbalance-mediated endoplasmic Reticulum stress[J]. Oxidative Medicine and Cellular Longevity, 2019, 2593742. |
| [15] |
李艳, 曹美群, 陶文聪, 等. 黄芪散对高脂饮食诱导肥胖大鼠肝脏内质网应激信号通路的影响[J]. 中国实验方剂学杂志, 2019, 25(21): 6-11. LI Y, CAO M Q, TAO W C, et al. Effect of huangqisan on endoplasmic reticulum stress signaling pathway in liver tissues of high-fat diet-induced obese rats[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(21): 6-11. |
| [16] |
BROWN M S, GOLDSTEIN J L. The SREBP pathway: Regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor[J]. Cell, 1997, 89(3): 331-340. |
| [17] |
YANG T, ESPENSHADE P J, WRIGHT M E, et al. Crucial step in cholesterol homeostasis: Sterols promote binding of SCAP to INSIG-1, a membrane protein that facilitates retention of SREBPs in ER[J]. Cell, 2002, 110(4): 489-500. |
| [18] |
ZHENG Z, SHANG Y X, TAO J H, et al. Endoplasmic Reticulum stress signaling pathways: Activation and diseases[J]. Current Protein & Peptide Science, 2019, 20(9): 935-943. |
2. Beijing University of Chinese Medicine, Beijing 100029, China
 2022, Vol. 39
2022, Vol. 39