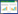文章信息
- 石露露, 韩卫南, 王强, 许宁宁
- SHI Lulu, HAN Weinan, WANG Qiang, XU Ningning
- 灯盏花素调控Nrf2/Gpx4通路对MIRI模型心肌凋亡的影响及作用机制研究
- Breviscapine regulates the effect of Nrf2/Gpx4 pathway on myocardial apoptosis in MIRI model and its mechanism
- 天津中医药, 2022, 39(9): 1182-1186
- Tianjin Journal of Traditional Chinese Medicine, 2022, 39(9): 1182-1186
- http://dx.doi.org/10.11656/j.issn.1672-1519.2022.09.20
-
文章历史
- 收稿日期: 2022-03-09
临床治疗心肌梗死方法包括溶栓治疗、冠状动脉介入治疗和支架置入术以恢复心肌血流[1]。然而,急性心肌梗死发作后的心脏再灌注通常导致心肌细胞损伤,这被称为心肌缺血再灌注损伤(MIRI),是急性动脉闭塞和随后的再疏通后的重要并发症[2]。MIRI过程会产生大量的活性氧自由基,导致氧化应激反应引起心肌细胞损伤和凋亡。谷胱甘肽过氧化物酶4(Gpx4)是一种磷脂氢过氧化物酶起作用,其可以抑制细胞内脂肪过氧化[3]。Gpx4的表达受到Nrf2的靶向调节,近年来有研究发现激活核因子E2相关因子2(Nrf2)/Gpx4信号通路可以缓解MIRI引起的心肌细胞铁死亡[4],但是其在氧化应激和细胞凋亡中的作用仍不明确。灯盏花素是一种来源于芹菜的黄酮类化合物[5],最新研究发现灯盏花素对大鼠肝MIRI具有保护作用[6]。本文主要基于Nrf2/Gpx4途径探讨灯盏花素对MIRI动物模型心肌细胞损伤和凋亡的调控机制。
1 资料与方法 1.1 实验动物与材料SD大鼠(220~250 g,SPF级,上海克莱斯动物中心,中国)。小动物呼吸机(Inspira ASV,哈佛仪器公司,美国)。灯盏花素片(Z53020121,云南植物药业)。超声心动图(GE公司,美国)。HE试剂(H8070,DH0050,北京Solarbio公司,中国)。ELISA(S0086,S0131M)和TUNEL(C1098)试剂盒(Neyotime公司,中国)。RNAspin Mini试剂盒(GE Healthcare,美国)。Bestar qPCR RT和BestarTMqPCR试剂盒(DBI Bioscience公司,德国)。Agilent Stratagene Mx3000P序列检测系统(Santa公司,美国)。兔单克隆Gpx4一抗(ab125066)、兔多克隆Nrf2一抗(ab92946)和山羊抗兔HRP-IgG二抗(ab205718,Abcam公司,美国)。PVDF膜(JS0344,JSENB公司,中国香港)。ECL显色试剂盒(Thermo Fisher公司,美国)。
1.2 动物分组、建模和干预45只大鼠随机分为Sham组、MIRI组和MIRI+灯盏花素组,每组15只。MIRI的构建方法简要叙述如下:大鼠麻醉(1%戊巴比妥,40 mg/kg)后连接呼吸机,切开心脏正上方的肌肉打开心包,然后将左前降支冠状动脉结扎,通过观察心电图(ECG)待ST抬高30min后取出结扎线。建模24 h后,MIRI+灯盏花素组使用灯盏花素灌胃,每次剂量按灯盏花素计算为200 mg/kg,每日1次,连续7 d。Sham组和MIRI组使用等量的溶剂灌胃作为对照。
首先腹腔注射1%戊巴比妥(剂量为40 mg/kg)使大鼠麻醉,将针电极皮下插入四肢,并使用心电图通过四肢导线进行监测。在第3和第4肋间隙开胸手术后,将大鼠插管并连接呼吸机(潮气量:3 mL/kg,呼吸频率:60~70次/min)。在皮肤,浅筋膜和深筋膜上切开,暴露左胸腔并打开心包,然后使用6-0线结扎左前降支冠状动脉,此时ECG改变,心脏表面立即由深红色变为白色,心电图ST段抬高。保持结扎30 min;然后取出丝线进行再灌注。为了防止感染,大鼠在手术后肌肉注射了80万单位的青霉素。Sham组的大鼠进行相同的暴露操作但不结扎。建模24 h后,MIRI+灯盏花素组使用灯盏花素灌胃,根据文献报道[7],每次剂量按灯盏花素计算为200 mg/kg,每日1次,连续7 d。Sham组和MIRI组使用等量的溶剂灌胃作为对照。
1.3 观察指标及检测方法 1.3.1 心功能指标检测大鼠麻醉后(40 mg/kg的戊巴比妥,腹膜内注射),通过14 MHz相控阵线性仪检测左室收缩末期压力(LVESP)和左室舒张末期压力(LVEDP)大上升和下降速率(±dP/dt max)。
1.3.2 HE染色梗死边缘组织在室温下用4%多聚甲醛固定6 h。用乙醇脱水(从低浓度到高浓度)后,将组织包埋在石蜡中。然后将石蜡包埋的小鼠肌肉组织切成5 μm切片,并将这些切片固定在载玻片上。将载玻片在室温下放入苏木精中染色10 min。用自来水洗涤1~2 min后,将玻片置于10%冰醋酸中10 s,然后置于1%氨水中,直到切片变蓝。随后用自来水清洗1~2 min后,将玻片放入曙红中10 s。在乙醇(浓度分别为70%、90%、95%和100%,每个浓度处理5 min)中脱水后,将玻片置于二甲苯中2 min,重复此步骤一次。最后,用中性胶密封玻片。在倒置显微镜下观察载玻片。
1.3.3 TUNEL染色采用4%的聚甲醛固定梗死部位边缘的心肌组织并用梯度乙醇脱水,包埋在石蜡中,制成厚度为5 μm的组织玻片标本,根据试剂盒说明书加入TUNEL染色,洗涤后加入苏木精复染。高倍镜下随机选择5个视野观察凋亡情况计算凋亡指数(=TUNEL阳性细胞数/总细胞核数目×100%)。
1.3.4 ELISA检测取血液样本通过静置(室温,30 min)和离心(3 000 rpm,半径8 cm,20 min)分离并收集上层血清,根据说明书加入抗体和显色剂,根据450 nm下检测吸光度和标准曲线计算超氧化歧化酶(SOD)和丙二醛(MDA)浓度。
1.3.5 RT-qPCR检测使用RNAspin Mini试剂盒从组织中提取RNA,然后使用Bestar qPCR RT试剂盒将其逆转转录为cDNA,条件如下:37 ℃/15 min;98 ℃/5 min。然后使用BestarTMqPCR预混液进行qPCR实验,条件如下:95 ℃/2 min,94 ℃/20 s,58 ℃ 20 s,72 ℃/20 s,40个循环,最后在72 ℃下延伸4 min。使用Agilent Stratagene Mx3000P序列检测系统进行RT-qPCR分析。GAPDH作为内源参照,通过比较循环阈值评估梗死区域边缘心肌组织中mRNA水平。
1.3.6 蛋白印迹法(Western blot)检测将心肌组织研磨后萃取总蛋白并检测浓度。然后分别取总量为40 μg的总蛋白进行分离,分离条件为10%的聚丙烯酰胺凝胶、80~120 V、90 min。然后通过湿法进行转膜,在100 mV下将分离的蛋白转移到聚偏二氟乙烯膜(PVDF)上。将一抗稀释500倍后分别加入膜中并在4 ℃下孵育过夜。洗涤后加入山羊抗兔HRP-IgG二抗(1∶2 000稀释)室温孵育1 h。本次研究内参为GAPDH,分析目标蛋白条带相对于GAPDH的灰度值分析梗死区域边缘心肌组织中蛋白表达水平。
1.4 统计学方法统计分析使用SPSS 19软件。数据以均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 灯盏花素对MIRI大鼠心功能的影响3组大鼠心功能指标比较差异显著(P < 0.05)。MIRI组的LVESP、±dP/dt max显著低于Sham组,而LVEDP显著高于Sham组(P < 0.05),MIRI+灯盏花素组的LVESP、±dP/dt max显著高于MIRI组,而LVEDP显著低于MIRI组(P < 0.05)。见表 1。
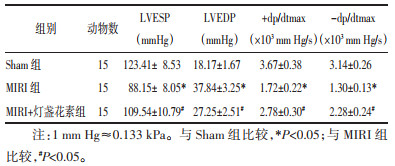
如图 1所示,红色和蓝色分别为细胞质和细胞核。Sham组细胞质染色均匀且细胞核染色清晰,心肌细胞排列有序。MIIR组细胞质染色较轻,细胞质大小不一,心肌细胞正常形态被破坏并出现细胞丢失。MIRI+灯盏花素组的心肌细胞染色基本正常,排列基本有序。
|
| 图 1 HE染色检测灯盏花素对MIRI大鼠心肌组织损伤的影响 Fig. 1 HE staining to detect the effect of breviscapine on myocardial tissue damage in MIRI rats |
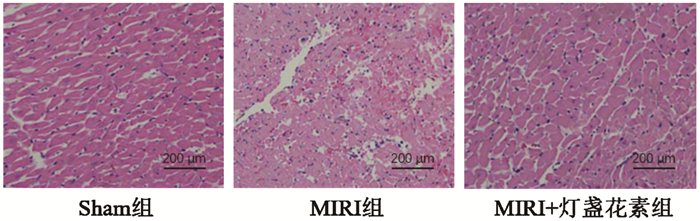
如图 2所示,蓝色和棕色分别为所有细胞核和凋亡细胞的细胞核。3组的心肌细胞凋亡情况比较差异显著(P < 0.05)。Sham组的凋亡指数为(1.86±0.26)%,MIRI组的凋亡指数(24.62±2.89)%显著高于Sham组(1.86±0.26)%,P < 0.05,MIRI+灯盏花素组的凋亡指数(12.05±1.57)%显著低于MIRI组(P < 0.05)。
|
| 图 2 TUNEL染色检测灯盏花素对MIRI大鼠心肌细胞凋亡的影响 Fig. 2 TUNEL staining to detect the effect of breviscapine on myocardial cell apoptosis in MIRI rats |
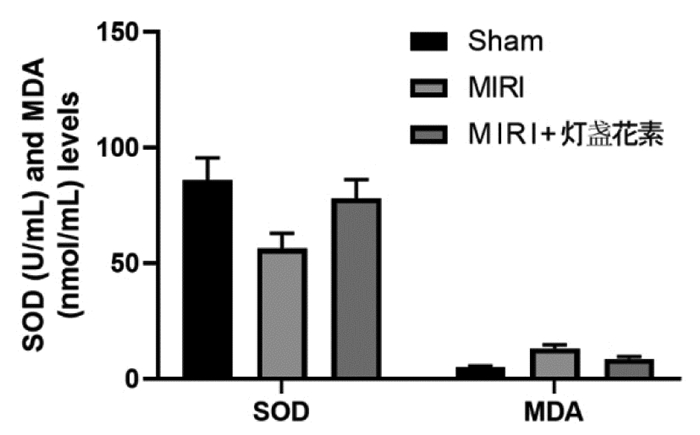
3组的氧化应激水平比较差异显著(P < 0.05)。MIRI组的SOD(56.42±6.49)U/mL显著低于对照组,MDA(13.23±1.46)nmol/mL显著高于对照组(P < 0.05)。MIRI+灯盏花素组的SOD(78.05±8.12)U/mL显著高于MIRI组,MDA(8.74±0.95)nmol/mL显著低于MIRI组(P < 0.05),见图 3。
|
| 注:与Sham组比较,*P<0.05;与MIRI组比较,#P<0.05 图 3 灯盏花素对MIRI大鼠氧化应激水平的影响 Fig. 3 Effects of breviscapine on the level of oxidative stress in MIRI rats |
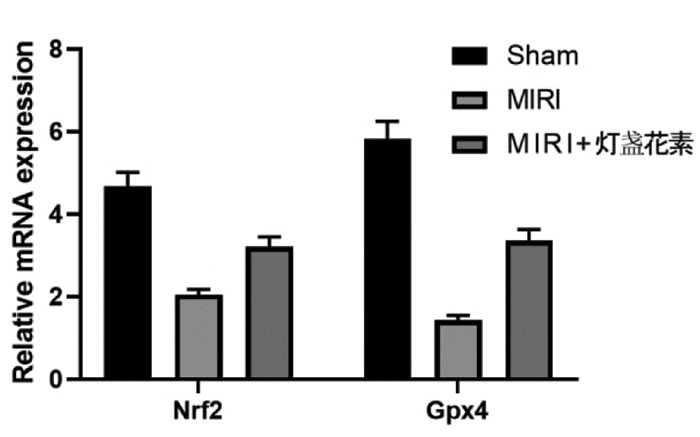
3组大鼠心肌组织Nrf2/Gpx4通路转录水平比较差异显著(P < 0.05)。MIRI组的Nrf2(2.05±0.13)和Gpx4(1.44±0.11)mRNA水平显著低于Sham组(P < 0.05),MIRI+灯盏花素组的Nrf2(3.21±0.24)mRNA和Gpx4(3.36±0.27)mRNA水平显著高于MIRI组(P < 0.05)。见图 4。
|
| 注:与Sham组比较,*P<0.05;与MIRI组比较,#P<0.05。 图 4 灯盏花素对MIRI大鼠Nrf2/Gpx4通路转录水平的影响 Fig. 4 Effects of Breviscapine on the transcription level of Nrf2/Gpx4 pathway in MIRI rats |
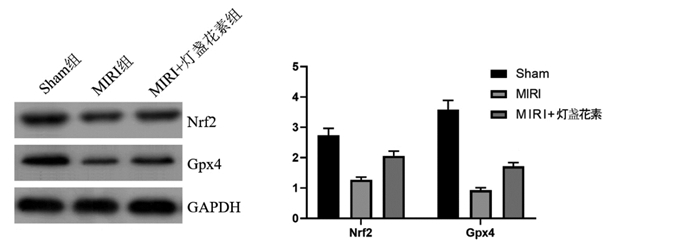
3组大鼠心肌组织Nrf2/Gpx4通路中蛋白表达水平比较差异显著(P < 0.05)。MIRI组的Nrf2(1.27±0.09)和Gpx4(0.93±0.08)蛋白水平显著低于Sham组(P < 0.05),MIRI+灯盏花素组的Nrf2(2.06±0.16)和Gpx4(1.72±0.12)蛋白水平显著高于MIRI组(P < 0.05)。见图 5。
|
| 图 5 Western blot检测灯盏花素对MIRI大鼠心肌组织Nrf2/Gpx4通路中蛋白表达水平的影响 Fig. 5 Western blot detection of the effect of breviscapine on the protein expression level of the Nrf2/Gpx4 pathway in the myocardial tissue of MIRI rats |
在心肌组织的缺血/再灌注过程中,心肌细胞会大量凋亡,而这会严重影响心功能甚至导致心脏纤维化,影响日常生活和生命安全[8],但是目前临床上暂时没有缓解心肌MIRI的有效方法。
灯盏花素(其分子式为4,5,6-三羟基黄酮-7-葡萄糖醛酸)是一种来自于传统中草药灯盏花的黄酮类化合物,在临床用于治疗心血管疾病和脑血管损伤[9]。本次研究结果显示灯盏花素可以有效的缓解MIRI引起的心肌组织损伤和细胞凋亡,并提高MIRI后的心脏收缩和射血功能。
为进一步分析灯盏花素缓解MIRI引起的心肌细胞凋亡的机制,笔者检测了心肌组织中氧化应激水平以及Nrf2/Gpx4通路表达水平。已知MIRI引起的继发性过氧化损伤和ROS升高会引起心肌细胞内质网应激损伤和线粒体途径凋亡,而SOD和MDA分别是体内主要的抗氧化和氧化应激指标[10-11]。SOD和MDA的水平受到机体脂质氧化水平的调控,Gpx4是关键的氧化调控蛋白,其可通过抑制细胞膜脂质的过氧化抑制细胞死亡和凋亡[12]。Gpx4的转录水平受到Nrf2的调控,作为转录调节因子,Nrf2被激活后可进入细胞核激活包括Gpx4、SOD在内的抗氧化基因的转录[13]。研究已经证实了激活Nrf2在缓解MIRI损伤和抑制凋亡中的关键作用[14]。本次研究结果显示灯盏花素可以促进MIRI模型心肌组织中Nrf2和Gpx4转录和翻译的水平,提高SOD的水平并抑制MDA。有研究发现灯盏花素可促进Nrf2信号通路并护肝细胞免受缺氧/复氧诱导的氧化损伤[15]。灯盏花素也可通过提高Nrf2 mRNA和蛋白的水平抑制脂质过氧化[16]。此外,一项最新研究结果也发现灯盏花素可通过调节Nrf2信号通路在颅脑损伤后提供神经保护作用[17]。这提示灯盏花素可通过促进Nrf2的表达提高Gpx4的转录和翻译,进而减轻脂质过氧化水平缓解氧化应激反应,进而抑制MIRI引起的心肌细胞损伤和凋亡。
综上所述,灯盏花素具有缓解MIRI模型大鼠心肌细胞凋亡的功能,并且其保护心功能的机制可能与促进Nrf2/Gpx4通路有关。但是关于灯盏花素对MIRI的影响以及调控Nrf2/Gpx4通路的机制仍需要进一步研究。
| [1] |
VALGIMIGLI M, BUENO H, BYRNE R A, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTSThe Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS)[J]. European Heart Journal, 2017, 39(3): 213-260. |
| [2] |
MOKHTARI-ZAER A, MAREFATI N, ATKIN S L, et al. The protective role of curcumin in myocardial ischemia-reperfusion injury[J]. Journal of Cellular Physiology, 2019, 234(1): 214-222. DOI:10.1002/jcp.26848 |
| [3] |
ALTAMURA S, VEGI N M, HOPPE P S, et al. Glutathione peroxidase 4 and vitamin E control reticulocyte maturation, stress erythropoiesis and iron homeostasis[J]. Haematologica, 2020, 105(4): 937-950. DOI:10.3324/haematol.2018.212977 |
| [4] |
梅胜兰, 夏中元, 吴晓静, 等. Nrf2-Gpx4信号通路在参麦注射液减轻大鼠心肌缺血再灌注损伤中的作用: 与铁死亡的关系[J]. 中华麻醉学杂志, 2019, 39(11): 1395-1398. MEI S L, XIA Z Y, WU X J, et al. Role of Nrf2-Gpx4 signaling pathway in Shenmal injection-induced reduction of myocardial ischemi-a-reperfusion injury: relationship with ferroptosis in rats[J]. Chinese Journal of Anesthesiology, 2019, 39(11): 1395-1398. DOI:10.3760/cma.j.issn.0254-1416.2019.11.031 |
| [5] |
LIU X N, CHENG J, ZHANG G H, et al. Engineering yeast for the production of breviscapine by genomic analysis and synthetic biology approaches[J]. Nature Communications, 2018, 9: 448. DOI:10.1038/s41467-018-02883-z |
| [6] |
BAO Z, CHEN W J, PAN F, et al. Role of mitofusin 2 in the protective effect of breviscapine against hepatic ischemia/reperfusion injury in rats[J]. Experimental and Therapeutic Medicine, 2018, 15(4): 3582-3588. |
| [7] |
杨迎春, 任占川, 陈新骥. 大鼠脑缺血再灌注后环氧合酶-2促进E-选择素表达增多及灯盏花素的脑保护作用[J]. 解剖学报, 2018, 49(6): 703-707. YANG Y C, REN Z C, CHEN X J. Cyclooxygenase-2 promoting the expression of E-selectin and the cerebral protective effects of breviscapine after cerebral ischemic-reperfusion injury in rats[J]. Acta Anatomica Sinica, 2018, 49(6): 703-707. |
| [8] |
GUO J J, ZHU J B, MA L L, et al. Chronic kidney disease exacerbates myocardial ischemia reperfusion injury: role of endoplasmic reticulum stress-mediated apoptosis[J]. Shock (Augusta, Ga), 2018, 49(6): 712-720. DOI:10.1097/SHK.0000000000000970 |
| [9] |
周世玲. 奥扎格雷钠联合灯盏花素治疗老年短暂性脑缺血发作的疗效回顾[J]. 中国全科医学, 2019, 22(S2): 160-162. ZHOU S L. Review of efficacy of ozagrel sodium combined with breviscapine in the treatment of transient ischemic attack in the elderly[J]. Chinese General Practice, 2019, 22(S2): 160-162. |
| [10] |
XU Y Q, XU Y, WANG S H. Effect of exosome-carried miR-30a on myocardial apoptosis in myocardial ischemia-reperfusion injury rats through regulating autophagy[J]. European Review for Medical and Pharmacological Sciences, 2019, 23(16): 7066-7072. |
| [11] |
孙立峰, 郭华, 孟剑锋, 等. 绞股蓝总黄酮通过抑制氧化应激反应抗心肌缺血保护作用的研究[J]. 中华中医药学刊, 2018, 36(10): 2513-2515. SUN L F, GUO H, MENG J F, et al. Protective effects of gynostemma flavonoids on myocardial ischemia by inhibiting oxidative stress[J]. Chinese Archives of Traditional Chinese Medicine, 2018, 36(10): 2513-2515. |
| [12] |
LI W Y, LI W, LENG Y, et al. Ferroptosis is involved in diabetes myocardial ischemia/reperfusion injury through endoplasmic Reticulum stress[J]. DNA and Cell Biology, 2020, 39(2): 210-225. DOI:10.1089/dna.2019.5097 |
| [13] |
LIU Q, WANG K Z. The induction of ferroptosis by impairing STAT3/Nrf2/GPx4 signaling enhances the sensitivity of osteosarcoma cells to cisplatin[J]. Cell Biology International, 2019, 43(11): 1245-1256. DOI:10.1002/cbin.11121 |
| [14] |
XU G P, ZHAO X, FU J, et al. Resveratrol increase myocardial Nrf2 expression in type 2 diabetic rats and alleviate myocardial ischemia/reperfusion injury(MIRI)[J]. Annals of Palliative Medicine, 2019, 8(5): 565-575. DOI:10.21037/apm.2019.11.25 |
| [15] |
WU H Y, JIA L. Scutellarin attenuates hypoxia/reoxygenation injury in hepatocytes by inhibiting apoptosis and oxidative stress through regulating Keap1/Nrf2/ARE signaling[J]. Bioscience Reports, 2019, 39(11): BSR20192501. DOI:10.1042/BSR20192501 |
| [16] |
ZHANG X X, JI R P, SUN H J, et al. Scutellarin ameliorates nonalcoholic fatty liver disease through the PPARγ/PGC-1α-Nrf2 pathway[J]. Free Radical Research, 2018, 52(2): 198-211. DOI:10.1080/10715762.2017.1422602 |
| [17] |
LI F Y, WANG X D, ZHANG Z J, et al. Breviscapine provides a neuroprotective effect after traumatic brain injury by modulating the Nrf2 signaling pathway[J]. Journal of Cellular Biochemistry, 2019, 120(9): 14899-14907. |
 2022, Vol. 39
2022, Vol. 39