文章信息
- 安娜, 王庆利, 周贝
- AN Na, WANG Qingli, ZHOU Bei
- 已上市中药说明书安全性内容的修订要求
- Requirements in the revision of the safety content of marketed traditional Chinese medicine labeling
- 天津中医药, 2023, 40(1): 63-68
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 63-68
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.13
-
文章历史
- 收稿日期: 2022-11-18
药品说明书是指导安全、合理使用药品的重要法定文件,国家高度重视已上市药品的安全性监管。2019年11月1日,新修订的《中华人民共和国药品管理法》[1]发布实施,以立法的形式要求“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制”,这在药品监管史上具有里程碑式的意义。此外,其第三十条提出“药品上市许可持有人应当依照本法规定,对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测及报告与处理等承担责任”[1]。2020年7月1日施行的《药品注册管理办法》第八十四条提出药品注册证书有效期内持有人不能履行持续考察药品质量、疗效和不良反应责任的,不予再注册[2]。2020年12月21日发布的《国家药监局关于促进中药传承创新发展的实施意见》要求“强化中药不良反应监测,对监测中发现的风险信号及时组织评估并采取风险控制措施。加强中药说明书和标签管理,推进对已上市中药说明书中【禁忌】【不良反应】【注意事项】等相关内容的修改完善。” [3]2021年12月1日起施行的《药物警戒治疗管理规范》[4]明确上市许可持有人应当建立药物警戒体系,将药物警戒定位为贯穿与药品全生命周期的实践活动,涵盖了上市后药物警戒的要求。
有研究收集了某医院门诊药房2018年使用的中成药说明书435份,统计其中标注不明确或缺失内容。结果显示注意事项不明确12种,占比2.8%、不良反应不明确307种,占比70.6%、禁忌不明确257种,占比59.1%[5],可能影响安全合理用药。目前随着《中华人民共和国药品管理法》的发布实施,这种状况正在积极改善。近年来修订中药说明书安全性内容的补充申请逐年增多,国家药品监督管理局发布的中药说明书修订公告亦增加。
为促进上市许可持有人(以下简称持有人)落实药物警戒主体责任,加强上市后中药安全性研究与评价,完善已上市中药说明书安全性内容,指导医师和患者合理用药,保障公众用药安全,本文着重探讨了已上市中药说明书安全性内容的修订要求及常见问题。
1 修订路径和注册事项《药品注册管理办法》[3]第七十六条提出了已上市药品说明书修订的2条路径,要求“药品批准上市后,持有人应当持续开展药品安全性和有效性研究,根据有关数据及时备案或者提出修订说明书的补充申请,不断更新完善说明书和标签。药品监督管理部门依职责可以根据药品不良反应监测和药品上市后评价结果等,要求持有人对说明书和标签进行修订。”
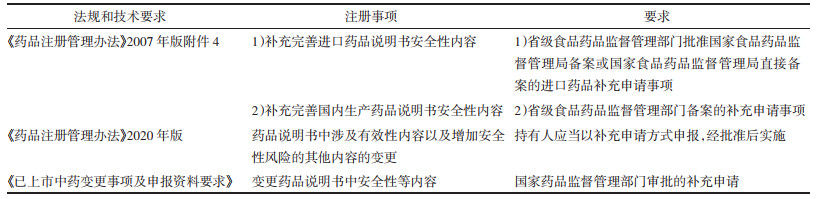
2021年2月23日发布了《已上市中药变更事项及申报资料要求》,将说明书安全性内容修订等归属于国家药品监督管理部门审批的补充申请事项,包括修订警示语、【不良反应】【禁忌】【注意事项】【药理毒理】、特殊人群用药信息、【药物相互作用】等项目[6]。法规要求的变化见表 1。
|
修订已上市中药说明书安全性内容,应在中医药理论指导下,以来源清晰的研究数据为基础,通过科学合理的分析形成并提交修订依据。如拟删除【注意事项】中“不宜长期反复用药”的表述,应在申报资料中提供处方适合长期反复应用的中医药理论分析,长期反复用药的有效性和安全性证据,以及长期用药风险和获益的综合评估等。此外,在提交的说明书相关资料方面,建议提交现行说明书、历次说明书修订情况的证明性资料和汇总表,表格内容至少包括:时间、修订机构、修订内容。对于非处方药,建议提交说明书范本。
应根据最新的技术要求修订说明书,现阶段可参考的技术要求有:《药品说明书和标签管理规定(局令第24号)》[7]《中药、天然药物处方药说明书格式内容书写要求及撰写指导原则》[8]《中成药非处方药说明书规范细则》[9]《个例药品不良反应收集和报告指导原则》[10]《古代经典名方中药复方制剂说明书撰写指导原则(试行)》[11]《已上市中药说明书安全信息项内容修订技术指导原则(试行)》[12]等。说明书各项安全性内容修订的常见问题分述如下。
2.1 警示语警示语是指对药品严重不良反应及其潜在的安全性问题的警告,还可以包括药品禁忌、注意事项及剂量过量等需提示用药人群特别关注的事项[8]。需要注意的是,警示语用于强调的是特别重要的警告信息,应综合分析药品风险后确定是否需要增加警示语及其增加的内容。审评中常见未纳入特别重要的警告信息的情形,如某片,上市后监测到4例中、重度药物性肝损伤,其中3例合并肝病史,无死亡病例;基于此,警示语增加了“肝功能不全者禁用”的字样。
2.2 不良反应根据相关技术要求,上市前不良反应是指任何剂量下发生的,任何有害和非期望的药物反应;上市后不良反应是指在人体上使用正常剂量来预防、诊断、治疗或改善生理功能时出现的有害和非期望的对药品的反应[13]。不良反应信息来源包括持有人自主收集、监测机构的药品不良反应监测数据、Ⅳ期临床试验及上市后临床研究收集的不良反应信息、文献资料或其他途径获知的不良反应信息和同品种的文献及说明书安全信息。
2.2.1 对重要安全性风险的提示不充分除不良事件与药物关联性评价“可能无关”和“肯定无关”的情况外,通常均应列入说明书【不良反应】。若无确凿医学证据,原则上持有人不应降级初始报告人的关联性评价结果[10]。对于严重不良反应/事件仅有个案报告的,一般也应作风险提示[12]。对于新出现的不良事件,是否纳入【不良反应】项应有依据。对于尚无充分的依据排除产品与不良事件相关性者,一般结合产品处方、剂量、功能主治、工艺,是否涉及心脏、肝脏、肾脏等重要脏器,发生例次等综合评价,视情况列入【不良反应】或表述为个例病案报告;如有需要申请人加强关注的用药风险,会通过补充申请通知书告知。
应采用统一、标准的不良反应编码惯例或词典,如国际医学用语词典(Med DRA)等[13]。对于新出现的不良反应,术语的合并、拆分应具有充分依据。以不同术语报告但医学意义相同时,建议将这些术语进行合并:如心悸、心慌可合并为心悸;对于同一医学现象的不同类型,建议使用特定的术语,如不同类型的皮疹(全身皮疹、斑丘疹、丘疹样皮疹、脓疱疹等)无需合并[12]。
多种因素可能会干扰因果关系判断,如患者病情的进展、合并用药、其他治疗等,但不可盲目将这些因素作为排除中药与不良反应相关性的理由。如产品与A药联合使用后出现“出血”的症状,A药说明书中未提示出血的风险,却将“出血”归因为A药;不良反应的出现与单独使用的中药具有时间相关性,但未列入【不良反应】。常见未将涉及多个系统的一组过敏或过敏样症状组合在一起表述。对于与过敏反应相关的皮肤、鼻眼部、呼吸、消化道和心血管系统症状体征,如皮肤潮红、皮疹、瘙痒、喷嚏、鼻塞、咳嗽、喘息、呼吸困难、心悸、发绀、喉头水肿、苍白、血压下降等,应将相关症状全部归类至过敏反应,以加强对过敏反应的安全性提示。此外,症状笼统、指代不明的表述欠合理,如腹部不适,建议结合原始病例进一步明确不适的具体症状,如胃痛、腹胀、腹泻等[14]。
2.2.2 撰写内容超出范围误将上市后使用人群和发生的不良反应/事件总例数、使用时需注意的问题写入说明书。如一般按照器官系统、严重性、报告频率的顺序或分类列出不良反应名称,由于上市后监测到的不良反应/事件通常不能准确判断其发生率,一般只列出不良反应/事件名称,不对发生率进行表述[12]。“本品性凉,可能导致胃肠不适,建议饭后服用。”的内容应列入说明书【注意事项】。
2.3 禁忌禁忌需包括禁止使用药品的各种情形:特殊人群、性别、生理状态、疾病状态、伴随治疗、合并用药、中医证候或体质、严重过敏反应和出现不可接受的严重不良反应等。禁忌项常见遗漏禁用人群的情形。如对于含乙醇(酒精)的合剂,可能需提示:“对乙醇(酒精)过敏者禁用。”
2.4 注意事项注意事项可从多个方面考虑是否需要进行提示,包括中医病机、体质、饮食调护、配伍/药物相互作用、所含药味或辅料、给药途径、用法用量、需观察或监测的症状、出现不良反应等异常时的处理措施、实验室检查指标、贮藏和特殊工种或运动员等。
非处方药还应当考虑增加保障患者自我药疗安全用药、影响药物疗效因素、特殊人群用药等注意事项内容[12],如皮肤破伤处不宜使用、不宜在服药期间服感冒药等。必须注明[9]“对本品过敏者禁用”“本品性状发生改变时禁止使用。”“如正在使用其他药品,使用本品前请咨询医师或药师。”“请将本品放在儿童不能接触的地方。”可用于儿童的药品必须注明“儿童必须在成人监护下使用。”
2.4.1 未对潜在用药风险进行提示以某片为例,有2例受试者进行了抗过敏性休克的抢救,但处方工艺非传统工艺,不良反应监测数据中未报告发生不良事件前使用的其他药物、食物等其他可能诱发过敏性休克的情况,基于此,需在【注意事项】项下增加“监测数据显示本品有用药后出现过敏性休克的个例病案报告,尚无法排除与本品的相关性,如用药后出现心悸、面色苍白、恶心、晕厥等过敏反应,应立即停药并至医院就诊。”以指导临床使用。
对于含水杨酸甲酯的品种,可考虑在注意事项中提示[15]:“对于服用华法林药物的患者过量使用该药可能引起出血的风险,增加遗传性葡萄糖-6-磷酸脱氢酶缺乏症患者以及对水杨酸类药物过敏的患者。”对于含乙醇(酒精)的合剂,需提示:“服药后不得驾驶机、车、船、从事高空作业、机械作业及操作精密仪器。”
2.4.2 未考虑处方药和非处方药的不同对于非处方药,患者自身可能难以辨证,因此【注意事项】中表述“根据病情辨证使用”欠合理。对于非处方药注意事项中“服药3天症状无缓解,应去医院就诊。”“如正在使用其他药品,使用本品前请咨询医师或药师。”等表述,不宜用在处方药说明书中。
2.4.3 内容缺乏针对性的指导根据中药“十八反”“十九畏”的理论进行风险提示是有价值的,但有些表述缺乏指导性,如“本品含人参、丹参、郁金,应遵循中药十八反、十九畏配伍理论。”建议明确不宜同时服用的药味名称,可表述为“本品含人参、丹参、郁金,不宜和含藜芦、五灵脂、丁香的中药方剂或成药同时服用。”
2.5 特殊人群用药信息处方药应单独列项,非处方药不要求单独列项,但相关信息须包含在【注意事项】【禁忌】等项目中。如处方药未进行相关研究,可不撰写该部分内容。如某胶囊,申请增加【特殊人群用药】项,并在该项下中增加:孕妇禁用;运动员禁用。以上撰写内容非特殊人群用药信息的内容,应在【禁忌】项说明。
2.6 药物相互作用该项应列出与该药品产生相互作用的药品,并说明相互作用的结果及合并用药的情况。中药注射剂应明确有无药物相互作用的研究结果。其他中药处方药如未进行该项相关研究,可不列此项。非处方药如无研究数据,必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师。”
对于含乙醇(酒精)的合剂,基于现有研究数据,可考虑在【药物相互作用】中提示:本品含乙醇(酒精)X%,与头孢类药物或易产生双硫仑反应的药物合用可使血中乙酰醛浓度上升,出现双硫仑反应,故服药期间不得与头孢菌素类(如头孢氨苄、头孢呋辛、头孢他啶等)、甲硝唑、替硝唑、酮康唑、呋喃唑酮等药联合使用,以免导致双硫仑样反应。
2.7 药理毒理药理毒理包括药理作用和毒理研究两部分内容,应是与已明确的临床疗效密切相关的非临床有效性研究数据和对临床用药安全有参考意义的非临床安全实验阳性结果。非处方药无该项内容,处方药未进行相关研究的,可不列此项。
某栓,申请人在【药理毒理】中列出“促进炎症等损伤组织的更新修复,促进异常增生组织萎缩,直接抑制和破坏癌细胞”等,与其临床适应症相关性较低,且多以文献为主,对临床适应症药效的直接提示有限,如果纳入说明书可能会误导用药,故不写入说明书。此外,列出了单次给药毒性实验、重复给药毒性实验、过敏实验、刺激性实验、生殖毒性实验的阴性结果。通常情况下,单次和重复给药毒性实验、局部安全性实验结果对本品临床使用的指导作用有限,故均不写入说明书;生殖毒性实验符合研究规范,结果对本品临床用药具有较强的指导作用,故写入说明书。
2.8 其他 2.8.1 变相扩大适用人群未批准的功能主治或用法用量,在说明书的其他内容部分予以暗示或建议。某口服液,无儿童适用人群,拟单列儿童患者不良反应,【注意事项】增加“儿童用量应咨询医师或药师。”无缺血型心脏病、高血压的适应症,而拟在【注意事项】增加“在用于缺血型心脏病、高血压等疾病合并焦虑、抑郁、失眠等症状时建议使用疗程为8~12周及以上。”对于这些人群均无合理用药的支持性信息。
2.8.2 未突出显示产品重要安全性风险对于具备较充分的临床和基础研究数据的情形,建议在说明书多个项目中针对性的进行安全性风险提示。以何首乌为例,研究发现,何首乌肝损伤多见于免疫亢进类人群证属中医阴虚火旺、热毒内蕴者,多为偶发性的免疫特异质肝损伤[16-17]。因此,应视不良反应监测数据和功能主治情况修订,考虑【禁忌】中包括:1)肝功能不全者禁用。2)已知有本品或组方药物肝损伤个人史的患者不宜使用。【注意事项】中包括:1)服药期间应注意监测肝生化指标,如发现肝生化指标异常或出现全身乏力、食欲不振、厌油、恶心、尿黄、目黄、皮肤黄染等可能与肝损伤有关的临床表现时,或原有肝生化检查异常、肝损伤临床症状加重时,应立即停药并就医。2)严格按用法用量服用,不超剂量、长期连续服用。3)老年人及肝生化指标异常、有肝病史者慎用[18]。应将重要安全性风险信息、较为特殊的信息前置,以突出显示,便于指导临床安全用药。如【注意事项】中以下排序欠合理:1)药物性状发生改变时禁止使用。2)过敏体质者慎用。3)运动员慎用。建议调整为:1)运动员慎用。2)过敏体质者慎用。3)药物性状发生改变时禁止使用。
2.8.3 境外已上市境内未上市产品说明书安全性内容更新不及时、全面进口中药、天然药物或同类品种全球任一销售国家或地区出现重大安全性风险事件,应立即按补充申请报告国家药品审评机构。说明书安全性内容中还需注意保留原产地说明书中的所有安全性信息并保持同步更新。
3 讨论中药获批上市并不是安全性评价的终点,而是安全性评价的重新开始[19]。《药物警戒治疗管理规范》[4]要求:申报者负责对可疑且非预期严重不良反应和其他潜在的严重安全性风险信息进行快速报告;当药品不良反应的性质、严重程度、特征或结果与持有人药品说明书中的表述不符时,应当判定为非预期不良反应。因此,持有人开展已上市中药说明书安全性内容修订工作的关键第一步是与时俱进、转变理念。此外,做好已上市中药说明书安全性内容修订的重要基石是构建中药安全性风险管理体系,进行制剂的风险识别、不良事件因果关系分析和严重程度评价,注意临床应用合理性等的影响,最后进行风险防控;对于发现的风险信号,鼓励开展临床和实验室再评价,建立风险研究的闭环机制[20]。在此过程中,应以临床价值为导向,不断积累临床和非临床研究数据,关注特殊人群的用药安全,研究预警信号和量效关系等,为中药说明书安全性内容的撰写提供数据支撑,不断提升已上市中药安全性风险防控的水平。
尚有一些关键问题需学术界、产业界和监管部门共同探讨。如服用中药后出现的症状提示疾病向愈时,不良反应与正常服药后反应的判定问题:服小青龙汤已渴者,此寒去欲解也;柴胡桂枝干姜汤,初服微烦,此时,口渴、心烦是否为其安全性风险等。此外,基原、工艺、辅料和外源性污染物如农药等因素可能影响中药安全性,因此处方相同,不同剂型和规格的说明书安全性内容是否需要相互借鉴统一。如对于具有药材标准的特殊辅料,其功能主治与药品功能主治或安全性相关时,可能影响制剂安全性。某已上市中药丸剂,处方含附子,用于慢性心力衰竭心肾阳衰者,拟申请在大蜜丸、水蜜丸基础上,增加水丸。中医传统认为,蜂蜜能解乌头毒,单次用炼蜜量为水蜜丸2.70~3.08 g,变更后水丸0.044~0.049 g。在大鼠重复给药6个月毒性实验中,可见相同剂量下(3 g生药/kg)水丸较水蜜丸组肾小管上皮细胞内棕色颗粒变程度加重、发生率增加,且不能完全恢复,多发于雌性。诱导肾小管上皮细胞凋亡是附子肾毒性的常见反应,提示水丸减少炼蜜用量后,较原水蜜丸有肾毒性增加的风险。此外,对于长期未销售、未收集到不良反应报告者的修订考虑亦需进一步研究。
已上市中药变更说明书安全性内容的情形非常复杂,对于本文未涵盖的问题,鼓励申请人充分利用现有沟通交流渠道,与药品技术审评机构密切沟通,共同推动中药传承创新发展。
| [1] |
全国人民代表大会常务委员会. 中华人民共和国药品管理法[EB/OL]. (2019-08-26)[2022-10-30]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm?tdsourcetag=s_pcqq_aiomsg. Standing Committee of the National People's Congress. Drug administration law of the people's republic of China[EB/OL]. (2019-08-26)[2022-10-30]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm?tdsourcetag=s_pcqq_aiomsg. |
| [2] |
国家市场监督管理总局. 药品注册管理办法[EB/OL]. (2020-09-28)[2022-10-30]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm?tdsourcetag=s_pcqq_aiomsg. State Market Regulatory Administration. Drug registration regulation[EB/OL]. (2020-09-28)[2022-10-30]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm?tdsourcetag=s_pcqq_aiomsg. |
| [3] |
国家药品监督管理局. 国家药监局关于促进中药传承创新发展的实施意见[EB/OL]. (2020-12-21)[2021-03-16]. http://www.gov.cn/zhengce/zhengceku/2020-12/26/content_5573463.htm. National Medical Products Administration. Implementation opinions of the state food and drug administration on promoting the inheritance, innovation and development of traditional Chinese medicine[EB/OL]. (2020-12-21)[2021-03-16]. http://www.gov.cn/zhengce/zhengceku/2020-12/26/content_5573463.htm. |
| [4] |
国家药品监督管理局. 国家药监局关于发布《药物警戒质量管理规范》的公告(2021年第65号)[EB/OL]. (2021-05-13)[2022-10-30]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html. National Medical Products Administration. Announcement of the national medical products administration on the good pharmacovigilance management (No. 65 in 2021)[EB/OL]. (2021-05-13)[2022-10-30]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html. |
| [5] |
王文青, 韩仙鸽, 刘津, 等. 我院门诊435种中成药说明书信息调查与分析[J]. 中国药房, 2019, 30(9): 1288-1292. WANG W Q, HAN X G, LIU J, et al. Investigation and analysis of 435 kinds of Chinese patent medicine instructions in outpatient department of our hospital[J]. China Pharmacy, 2019, 30(9): 1288-1292. |
| [6] |
国家药品监督管理局. 已上市中药变更事项及申报资料要求[EB/OL]. (2021-02-23)[2022-10-30]. https://baijiahao.baidu.com/s?id=1692597832839764934&wfr=spider&for=pc. National Medical Products Administration. Classification of changes items of marketed traditional Chinese medicine and dossier requirements[EB/OL]. (2021-02-23)[2022-10-30]. https://baijiahao.baidu.com/s?id=1692597832839764934&wfr=spider&for=pc. |
| [7] |
国家食品药品监督管理局. 药品说明书和标签管理规定[EB/OL]. (2006-03-15)[2022-10-30]. http://www.gov.cn/ziliao/flfg/2006-03/16/content_228465.htm. State Food and Drug Administration. Provisions for drug insert sheets and labels[EB/OL]. (2006-03-15)[2022-10-30]. http://www.gov.cn/ziliao/flfg/2006-03/16/content_228465.htm. |
| [8] |
国家食品药品监督管理局. 中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知[EB/OL]. (2006-06-22)[2022-10-30]. https://www.nmpa.gov.cn/directory/web/nmpa/zhuanti/lshzht/jl24zhl/jl24zhlxggd/20060622010101502_3.html. State Food and Drug Administration. Writing requirements guidance for the format and content of the instructions for the prescription of traditional Chinese medicine and natural medicine[EB/OL]. (2006-06-22)[2022-10-30]. https://www.nmpa.gov.cn/directory/web/nmpa/zhuanti/lshzht/jl24zhl/jl24zhlxggd/20060622010101502_3.html. |
| [9] |
国家食品药品监督管理局. 国家食品药品监督管理局关于印发非处方药说明书规范细则的通知[EB/OL]. (2006-10-20)[2022-10-30]. http://law.pharmnet.com.cn/laws/detail_1623.html. State Food and Drug Administration. Notice of the state food and drug administration on printing and distributing the detailed rules for the specifications of OTC drug instructions[EB/OL]. (2006-10-20)[2022-10-30]. http://law.pharmnet.com.cn/laws/detail_1623.html. |
| [10] |
国家药品监督管理局. 国家药品监督管理局个例药品不良反应收集和报告指导原则[EB/OL]. (2018-12-21)[2022-10-30]. https://amr.hainan.gov.cn/himpa/adr/zcfg/gzgfxwj/202103/t20210316_2946319.html. National Medical Products Administration. Guidance for collection and reporting of individual adverse drug reactions of the national medical products administration[EB/OL]. (2018-12-21)[2022-10-30]. https://amr.hainan.gov.cn/himpa/adr/zcfg/gzgfxwj/202103/t20210316_2946319.html |
| [11] |
国家药品监督管理局药审中心. 国家药监局药审中心关于发布《中药新药复方制剂中医药理论申报资料撰写指导原则(试行)》《古代经典名方中药复方制剂说明书撰写指导原则(试行)》的通告[EB/OL]. (2021-10-15)[2022-10-30]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220107173828189.html. Center for Drug Evaluation, National Medical Products Administration. Center for drug evaluation of the national medical products administration on the issuance of the guidance for the writing of materials for the theoretical application of traditional Chinese medicine for new traditional Chinese medicine compound preparations (trial) and the guidance for the writing of instructions for ancient classic and famous traditional Chinese medicine compound (trial)[EB/OL]. (2021-10-15)[2022-10-30]. ttps://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20220107173828189.html. |
| [12] |
国家药品监督管理局. 国家药监局关于发布《已上市中药说明书安全信息项内容修订技术指导原则(试行)》的通告[EB/OL]. (2022-01-04)[2022-10-30]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20220107145808154.html. National Medical Products Administration. Circular of the national medical products administration on the issuance of the technical guidelines for the revision of the safety information items in the instructions of listed traditional Chinese medicine (Trial)[EB/OL]. (2022-01-04)[2022-10-30]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/qtggtg/20220107145808154.html. |
| [13] |
ICH. E2A: clinical safety data management: definitions and standards for expedited reporting[EB/OL]. (1994-10-27)[2022-11-3]. https://www.cde.org.cn/ichWeb/guideIch/toGuideIch/3/0.
|
| [14] |
安娜, 韩玲. 中药新药临床试验报告安全性分析方面的常见问题[J]. 中国中药杂志, 2021, 46(17): 4581-4584. AN N, HAN L. Common issues in safety analysis of clinical trail reports for new drugs of traditional Chinese medicine[J]. China Journal of Chinese Materia Medica, 2021, 46(17): 4581-4584. |
| [15] |
安娜, 周贝, 唐健元. 我国进口植物药再注册期间临床相关问题及思考[J]. 中国新药杂志, 2018, 27(18): 2121-2123. AN N, ZHOU B, TANG J Y. Related issues and consideration on China's import of plant medicine registration[J]. Chinese Journal of New Drugs, 2018, 27(18): 2121-2123. |
| [16] |
HE L Z, YIN P, MENG Y K, et al. Immunological synergistic mechanisms of trans-/cis-stilbene glycosides in induces immunologicalidiosyncratic hepatotoxicity by suppressing PPAR-yin a lipopolysaccharide mode[J]. Science Bulletin, 2017, 62(11): 748-751. DOI:10.1016/j.scib.2017.04.020 |
| [17] |
郭玉明, 涂灿, 何琴, 等. 基于药性功能认知的何首乌安全用药对策研究[J]. 中医杂志, 2018, 59(9): 721-724. GUO Y M, TU C, HE Q, et al. Safety administration strategy for Heshouwu (polygoni multiflori radix) based on properties and actions of Chinese medicine[J]. Journal of Traditional Chinese Medicine, 2018, 59(9): 721-724. |
| [18] |
国家食品药品监督管理总局办公厅. 食品药品监管总局办公厅关于修订养血生发胶囊等6个含何首乌中药口服制剂说明书的通知[EB/OL]. (2013-10-23)[2022-11-3]. https://www.nmpa.gov.cn/xxgk/ggtg/ypshmshxdgg/20131023145901511.html. General Office of the State Food and Drug Administration. Notice of the general office of the state food and drug administration on revising the instruction manual of six oral preparations of Chinese medicine containing polygonum multiflorum, including Yangxue Shengfa Capsule[EB/OL]. (2013-10-23)[2022-11-3]. https://www.nmpa.gov.cn/xxgk/ggtg/ypshmshxdgg/20131023145901511.html. |
| [19] |
韩玲, 孙祖越, 杨威, 等. 全程式中药安全性评价和监管[J]. 中国药理学与毒理学杂志, 2020, 34(11): 801-810. HAN L, SUN Z Y, YANG W, et al. The whole-process safety evaluation and supervision of traditional Chinese medicine[J]. Chinese Journal of Pharmacology and Toxicology, 2020, 34(11): 801-810. |
| [20] |
安娜, 吕佳康, 韩玲. 中药安全性认识和中药新药研发的风险管理策略[J]. 中国药理学与毒理学杂志, 2021, 35(2): 90-95. AN N, LYU J K, HAN L. Traditional ideas of Chinese medicine and risk management strategies for new traditional Chinese medicine safety[J]. Chinese Journal of Pharmacology and Toxicology, 2021, 35(2): 90-95. |
 2023, Vol. 40
2023, Vol. 40