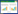文章信息
- 李华南, 王毓岩, 张小凡, 张玮, 马菲, 董桦, 王金贵
- LI Huanan, WANG Yuyan, ZHANG Xiaofan, ZHANG Wei, MA Fei, DONG Hua, WANG Jingui
- 腹部推拿调控Tryptase-PAR2-PKCε通路防治IBS-D内脏痛的机制研究
- Mechanism of abdominal massage regulating Tryptase-PAR2-PKCε pathway to prevent and treat visceral pain in IBS-D
- 天津中医药, 2023, 40(1): 75-81
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 75-81
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.15
-
文章历史
- 收稿日期: 2022-10-12
2. 国家中医药管理局推拿手法生物效应三级实验室, 天津 300381;
3. 天津市中医药研究院附属医院, 天津 300120
肠易激综合征(IBS)是消化系统疾病中最常见的慢性非炎症性疾病之一,主要以腹痛和排便习惯的改变为特征。根据异常的排便表现,IBS分为4个亚型:腹泻型(IBS-D)、便秘型、混合型和不定型。全球的IBS发病率为10%~17%[1],其中IBS-D占比为23.4%,超过其他亚型[2]。随着生活和工作压力的增加,近年来IBS-D患病人群逐渐年轻化,且男性多于女性,给患者和家庭造成巨大的经济和精神负担。
由于IBS-D发病复杂,其机制至今尚未完全明确。随着现代研究的深入,内脏高敏感被认为是其重要病理生理发生机制之一[3],主要反映出对疼痛刺激的敏感性增强,或对低于疼痛阈值的刺激量感到不适或反应强烈,症状表现为腹痛和(或)腹部不适。由于无法确定疾病的主要病因,因此临床上多对症治疗,包括:缓泻剂、解痉剂及肠道微生态药物等。腹部推拿疗法作为中医药的重要分支,其施用于腹部,通过对人体脏腑经络的调节,在本病的治疗上取得了很好的疗效[4]。
近年来,肥大细胞(MC)在IBS-D发病机制中的作用逐渐受到研究者们的关注。MC在IBS-D发病中作用重要,而引人关注的是MC在IBS-D内脏敏感性方面的作用,MC活化也被认为是内脏高敏感发生的始动环节,是生理学和病理学疼痛途径的重要调节剂。研究显示当多种机械、化学刺激或神经递质作用于神经末梢,引起外周神经损伤后会产生炎性反应,激发免疫细胞如MCs活化脱颗粒,分泌释放类胰蛋白酶(Tryptase)、白细胞介素5、5-羟色胺、组胺以及神经生长因子,进而引起蛋白酶激活受体2(PAR2)的过度表达,且进一步激活蛋白激酶Cε(PKCε),PKCε活化可介导辣椒素受体1磷酸化[5-6],最终导致内脏高敏感的发生。基于上述研究基础,本文采用母婴分离联合慢性应激刺激(强迫游泳+束缚应激+夹尾刺激法)造模方式构建IBS-D大鼠模型,观察腹部推拿对IBS-D大鼠模型肠道敏感化的影响,探讨其可能的作用机制,为腹部推拿的临床应用提供实验参考。
1 材料 1.1 实验动物健康Spargue-Dawle(SD)孕鼠购置于北京华阜康有限公司,实验动物许可证书号:SCXK(京)2020-004。大鼠饲养于中国医学科学院放射医学研究所实验动物中心,适应性饲养1周,恒温恒湿,每日自由饮食水。通过1周的常规适应性喂养,待孕鼠正常生产之后,将子鼠中雌鼠剔除,留雄性SD幼鼠。
1.2 主要仪器血压表式血压测量计购于江苏鱼跃医疗设备股份有限公司;干燥消毒烤箱(DHG-9246A)、水浴恒温箱(DK-8)均购于上海精宏试验设备有限公司;倒置显微镜购于日本OLYMPUS公司;TS-1性脱色摇床购于江苏海门市其林贝尔仪器制造有限公司;Tanon凝胶成像系统购于上海天能公司;VE-386购于北京原平皓生物技术有限公司;DYCZ-24DN型垂直电泳装置购于北京六一仪器厂。
1.3 主要试剂酮替芬粉剂购于奥默生物技术(上海)有限公司;Anti-Tryptase、Anti-PAR2 antibody、Anti-PKCε antibody均购于美国Abcam公司;Anti-β-actin antibody购于天津创科生物科技有限公司;Anti-GAPDH antibody购于天津创科生物科技有限公司;PVDF膜(0.22 μm)购于苏州净化设备有限公司;HRP标记的驴抗兔IgG二抗购于天津创科生物科技有限公司;HRP标记的羊抗兔IgG/HP聚合物二抗购于美国Abcam公司;DAB显色试剂盒购于北京中杉金桥公司。
2 方法 2.1 动物分组采用随机数字表法将40只雄鼠随机分为空白组、模型组、腹部推拿组、西药组,每组10只。分组情况如下,空白组:不予任何处理,自由进食饮水;模型组:造模,不予治疗;腹部推拿组:造模后,予以腹部推拿14 d;西药组:造模后,给予以腹腔注射酮替芬溶液(0.8 mg/kg)14 d。酮替芬可有效抑制MC中过敏介质的释放,用于IBS-D的常规干预治疗。
2.2 造模方法采取母婴分离联合慢性应激刺激(强迫游泳+束缚应激+夹尾刺激法)复制IBS-D大鼠模型[7],具体实施如下:1)母婴分离实验将SD雄性幼鼠从出生第1天开始,与母鼠一起饲养在同一个鼠笼,自出生后第2天到第21天,每日随机时间和母鼠分开3 h,分离时子鼠不能看到母鼠,自出生第22天起彻底分离,单笼饲养,46日龄即可进行慢性应激刺激。2)慢性应激刺激实验将SD大鼠放入小型裱花袋,将其嘴部置于裱花袋口部,并用皮筋将大鼠尾部与裱花袋后部固定,使大鼠不能活动,每日束缚3 h。第2天将SD大鼠放入盛有5 ℃水的桶中,6 min后取出。第3天用止血钳(外裹棉花)夹住鼠尾距尾根4 cm处,不间断夹尾2 min。上述3种刺激方式,3 d为1个循环,直至14 d后结束造模,应用粪便性状(Bristol)评分评价造模是否成功。
2.3 干预方法选用津沽脏腑推拿中核心手法“按腹法”“摩腹法”作为主要治疗手法。将实验大鼠束缚于实验台取仰卧位。1)腹部摩法:手法操作者拇指指面着力于腹部施术部位,并以中脘穴为圆心,做顺时针方向摩动,频率宜缓,每分钟20~30次,如此反复操作6 min。2)腹部按法:手法操作者以右手拇指按置于中脘穴上主动施力,力量向下且宜由轻而重,直至能够清晰感觉到大鼠腹部动脉搏动,停留2 min,而后手法操作者拇指徐徐上提,直至完全离开受压部位。如此反复操作3次,共9 min。腹部摩法和腹部按法均每日治疗1次,连续治疗14 d。
3 取材及观察指标 3.1 腹壁撤退反射评分(AWR)的检测应用AWR评分[8]评价各组大鼠内脏痛情况。SD大鼠水合氯醛麻醉后,将抹有甘油的橡胶气囊(采用5寸圆形乳胶气球)从肛门插入结直肠内(深度约为8 cm),使用医用胶布固定导管和大鼠尾根部,随后将大鼠置入透明亚克力板固定盒中,只可以前后移动,无法转身,当其苏醒适应30 min后开始实验,每只大鼠分别给予4种压力刺激,分别为20、40、60、80 mm Hg(1 mm Hg≈0.133 kPa,下同),后维持20 s,每次间隔4 min。主要观察大鼠对于扩张刺激的反应、是否存在短暂的头部运动后停滞、腹部肌肉收缩、腹部收缩并提起、弓背并抬起骨盆等表现。
AWR的评分标准如下:1分:CRD刺激时,无任何反应或仅有头部活动增多;2分:CRD时腹部肌肉收缩;3分:CRD时腹部收缩并抬离桌面;4分:CRD时腹部肌肉明显收缩使身体呈弓形抬起。
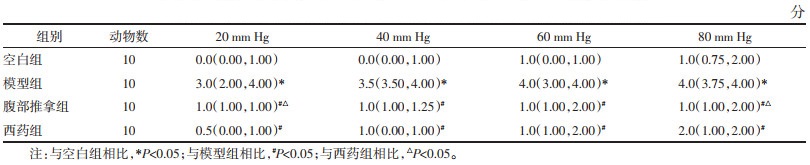
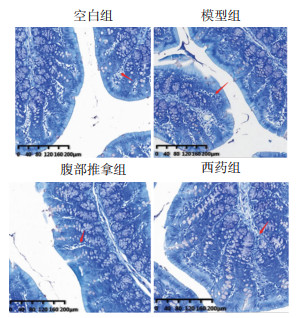
3.2 结肠组织甲苯胺蓝染色将结肠组织立即固定在4%的多聚甲醛里,进行冲洗、脱水、透明、浸蜡、包埋,开始持续切片(厚度为5 μm,相邻2片间隔为30 μm),并于脱蜡后进行甲苯胺蓝染色,最后在高倍显微镜(200倍)下拍照、观察。
3.3 免疫组化检测Tryptase的表达情况取大鼠结肠组织脱蜡,梯度乙醇水化;磷酸盐缓冲溶液(PBS)清洗4次,每次5 min;抗原煮沸热修复:将0.01 mol/L枸橼酸钠缓冲溶液(pH6.0)使用水浴锅加热至95 ℃左右,将结肠组织切片置入加热15~20 min,随后用PBS冲洗5 min;注入正常山羊血清封闭液,正常室温环境下孵育20 min;PBS冲洗后滴加Ⅰ抗;4 ℃孵育10 h后PBS冲洗滴加Ⅱ抗;二氨基联苯胺(DAB)显影,自来水冲洗,苏木素复染,梯度乙醇(50%、70%、85%、95%、100%)脱水,二甲苯透明,中性树胶封片,每个样本使用200倍显微镜观察,分别取3个视野进行拍照,观察蛋白阳性表达情况并用Image pro-Plus软件分析计算平均光密度值。
3.4 蛋白质印迹法(Western blot)检测大鼠结肠组织中PAR2和PKCε蛋白表达利用蛋白浓度定量试剂盒(BCA法)对样品蛋白含量进行测定,分别配制SDS变性10%聚丙烯酰胺凝胶(下层分离胶,单面),5%聚丙烯酰胺凝胶(上层积层胶,单面)均匀混合后,取适量的蛋白样品上样,采取SDS变性10%聚丙烯酰胺凝胶电泳(SDS-PAGE),最终使目的蛋白完全分离后停止电泳。再经转膜(半干转法)、封闭,对抗体进行稀释,封闭对应的一抗,4 ℃过夜孵育;回收一抗,用PBS在水平摇床上洗涤NC膜3次,每次10 min;稀释二抗,稀释比为1∶5 000,然后加入跟一抗相同属性荧光标记的二抗,在水平摇床避光孵育2 h;回收二抗,用PBS在水平摇床上洗涤NC膜3次,每次洗10 min,注意避光,采用凝胶成像系统扫膜。
3.5 统计学分析采取SPSS 22.0统计软件进行数据分析,进行组间比较时,计量资料呈现出正态分布时,数据以均数±标准差(x±s)表示,组间采用单因素方差分析;计量资料呈现出非正态分布时,数据则以中位数(下四分位数,上四分位数)表示,组间比较采用非参数检验,P<0.05表示差异具有统计学意义。
4 结果 4.1 各组大鼠腹壁撤退评分比较由各组大鼠腹壁撤退评分(表 1)可见,与空白组同期比较,模型组AWR分数升高(P < 0.05)。与模型组同期比较,腹部推拿组、西药组大鼠AWR分数明显降低(P < 0.05)。腹部推拿组、西药组两组组间比较,腹部推拿组撤退评分在20 mm Hg压力刺激时劣于西药组、80 mm Hg压力刺激时优于西药组,差异有统计学意义(P < 0.05),其余压力测定时评分接近。
|
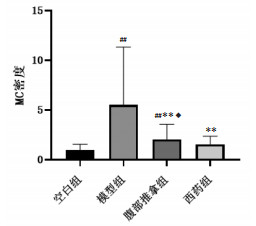
甲苯胺蓝染色后MC呈紫红色颗粒,可在光学显微镜下观测MC形态学结构和计数。镜下显示,模型组MC形态不规则,计数及密度显著高于空白组,差异有统计学意义(P < 0.01);与模型组相比,腹部推拿组、西药组MC计数降低、密度减少,差异有统计学意义(P < 0.01)。腹部推拿组、西药组两组比较,腹部推拿组MC计数及密度高于西药组,差异有统计学意义(P < 0.05)。见图 1、图 2。
|
| 图 1 结肠组织甲苯胺蓝染色 Fig. 1 Toluidine blue staining of colon tissue |
|
| 注:与空白组相比,##P<0.01;与模型组相比,**P<0.01;与西药组相比,◆P<0.05。 图 2 各组大鼠结肠组织中MC密度的变化(x±s) Fig. 2 Changes of MC density in colon tissue of rats in each group(x±s) |
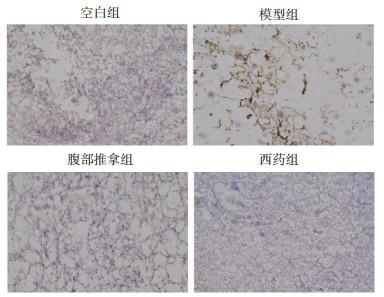
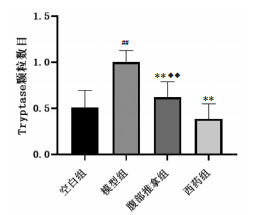
由各组大鼠Tryptase免疫组化检测(图 3,图 4)可见,与空白组相比,模型组MC Tryptase颗粒分布显著增加(P < 0.01);与模型组相比,腹部推拿组、西药组MC Tryptase颗粒分布明显降低(P < 0.01);腹部推拿组、西药组两组比较,腹部推拿组MC Tryptase颗粒高于西药组(P < 0.01)。
|
| 图 3 各组大鼠Tryptase免疫组化表达 Fig. 3 Tryptase immunohistochemical expression of rats in each group |
|
| 注:与空白组相比,##P<0.01;与模型组相比,**P<0.01;与西药组相比,◆◆P<0.01。 图 4 各组大鼠Tryptase免疫组化检测(x±s) Fig. 4 Tryptase immunohistochemical test of rats in each group(x±s) |
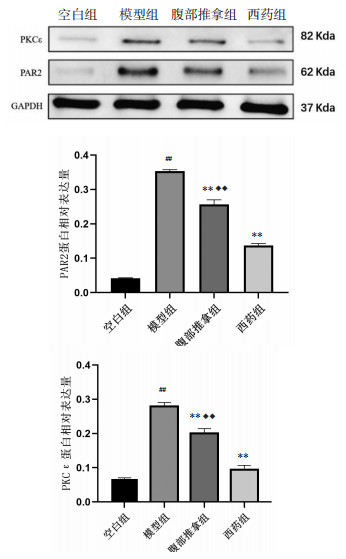
由各组大鼠PAR2和PKCε蛋白灰度比值可见,与空白组相比,模型组PAR2和PKCε蛋白灰度比值和表达量显著升高(P < 0.01);与模型组相比,腹部推拿组和西药组的PAR2和PKCε的蛋白灰度比值和表达量均显著降低(P < 0.01);腹部推拿组、西药组两组比较,腹部推拿组大鼠肠道PAR2和PKCε表达率高于西药组(P < 0.01)。见图 5。
|
| 注:与空白组相比,##P<0.01;与模型组相比,**P<0.01;与西药组相比,◆◆P<0.01。 图 5 各组大鼠PAR2和PKCε蛋白相对表达量(x±s) Fig. 5 Relative protein expression of PAR2 and PKCε of rats in each group(x±s) |
IBS-D属中医学“便秘”“泄泻”“腹痛”等范畴,本病的中医治疗手段丰富。中医认为脾胃作为人体气机升降枢纽,气机不通则痛,腹部推拿通调脾胃气机为治疗IBS-D内脏痛提供了有力的理论依据。民间素有风俗“腹痛揉腹来止痛”。由此可见,腹部推拿可以为病患解决胃肠问题,消除腹部疼痛。本研究中腹部推拿重点作用于中脘穴,中脘为调节中焦气化的要穴,刺激该穴可健运脾土,一方面固护中州,一方面运化水湿,使补而不滞,能守能走。同时,选择层按中脘穴,通过深层激发伏冲之脉,灌注气血于周身,以血行载气行,以气运摄血运,中医认为通则不痛,经络气血通畅则痛自减。
内脏高敏感一直被认为是IBS-D的重要发病原因之一,它的发生主要途径可以分为:外周神经系统、中枢神经系统、肠神经系统3个方面[9]。本研究从外周敏化诱发中枢敏化的角度出发,结合伤害感受器敏化与免疫炎性反应之间的相互作用,探讨腹部推拿治疗IBS-D内脏高敏感的作用机制。
外周敏化是人体疼痛感受器受多种因素影响,导致的传入神经刺激敏感性增强而产生的表现[10]。在这个过程中,外周神经产生炎性反应,激发免疫细胞如MCs活化脱颗粒。Tryptase作为MC活化后的基本标志产物之一,研究表明在IBS患者的肠道黏膜中发现的Tryptase密度和MC数量比正常非IBS人群普遍要高,此外Tryptase密度与腹部不适程度或(和)腹部疼痛、粪便频率、性状改变等临床症状呈正相关[11]。同时,Tryptase还参与了肠道黏膜的内分泌-神经-免疫系统的交互作用[12]。当MCs被激活并通过活化脱颗粒的形式分泌出Tryptase后,会级联激活Tryptase神经表面蛋白酶激活受体2(PAR2),调控邻近的肠道伤害感受器神经元,发送疼痛性信号,并能引起内脏感觉的变化[13]。Lee等[14]研究表明,IBS-D患者直肠黏膜组织中Tryptase激活明显高于正常组,并且Tryptase表达和PAR2水平显著增高。PAR2集中分布在消化道神经中,协同参与肠道运动、肠道内分泌、内脏超敏反应等病生理反应[15]。另外,PKCε是PAR2的下游物质之一,过往的研究表明,PAR2-PKCε是产生疼痛并加以维持的重要通路[16-17]。研究显示[18],应用前列腺素(PG)E2建立痛觉敏化诱发模型,给予注射PAR2拮抗剂,结果发现不论在PGE2注射前还是注射后给予PAR2抑制剂,均能显著改善由PGE2诱发的慢性疼痛,并明显抑制PKCε在外周神经元中的表达,说明了抑制PAR2能降低PKCε的活化[19],从而改善内脏敏感性,降低痛觉敏化。
IBS-D作为一种功能性的胃肠疾病,通常以腹痛、腹部不适、腹泻为主要临床表现,并常伴随精神心理症状。由于IBS-D的发病并非单一因素,所以造模方法尚无统一的标准。总体要求同时模拟出IBS-D内脏高敏感性、腹泻和精神症状,因此采用多因素复合的造模方法。有研究采用番泻叶灌胃或乙酸灌肠的方法造成模型大鼠腹泻症状[20]。但本研究认为这类方法会把内脏高敏感性和肠道功能紊乱割裂开,一方面易造成肠黏膜的损伤(如乙酸灌肠),另一方面番泻叶性寒,纯泻无补,易导致虚寒性而非肝脾不和引起的粪便异常,同时也否认了应激事件在造成内脏高敏感的同时又影响着粪便的性状。而中医整体思维指导下的辨证观点认为同一病机会引发不同的症状,肝郁脾虚型IBS-D,多在精神因素应激下出现腹痛,并同时伴随急迫欲泻的症状。在这一理论的启发下,本研究尝试以加强应激事件的方法,采用束缚、冰水、夹尾3种应激方法配合并巩固母婴分离实验,造成模型大鼠抑郁状态、提升大鼠内脏敏感性并引发腹泻症状[21]。
在本研究,笔者通过应用腹壁撤退评分实验,验证了腹部推拿对于模型大鼠内脏高敏感的效果。同时,应用光镜下观察大鼠结肠组织MC形态学及数量变化,采用免疫组化检测Tryptase颗粒分布,应用Western blot法检测大鼠结肠组织中PAR2和PKCε蛋白含量。研究结果显示与模型组比较,AWR评分明显降低,这说明腹部推拿能降低IBS-D模型大鼠的内脏高敏感性。镜下显示,模型组MC形态不规则,计数及密度显著高于空白组;腹部推拿组与模型组相比,则表现为MC计数降低、密度减少,这说明腹部推拿可以降低肠道局部的免疫反应。MC Tryptase颗粒免疫组化:与模型组相比,腹部推拿组分布也呈现降低趋势,PAR2、PKCε表达量检测结果显示:与模型组相比,腹部推拿组显著降低。结果充分表明,腹部推拿能有效改善IBS-D模型大鼠内脏高敏感症状,特别是降低肠道Tryptase、PAR2、PKCε异常表达,说明其对调节Tryptase-PAR2-PKCε通路是有效的。为深化腹部推拿防治IBS-D的基础研究,促进推拿学科发展及推广提供了依据。另外,本研究还设置了西药对照组,该组选取的酮替芬作为主要干预手段,酮替芬是一种全身性抗组胺药,通过对抗组胺H1受体和抑制过敏反应介质的释放来治疗过敏性鼻炎、过敏性支气管炎、肠道炎症等疾病[22]。结果显示腹部推拿组的干预效果趋近于西药组。随着腹部推拿研究的更加深入,一方面腹部推拿是否可以替代酮替芬等西药治疗值得思考?另一方面,是否其可与酮替芬结合达到更优效果,也是未来研究探讨的问题。
当然本研究也存在一定的局限性。首先是样本量较低,研究的偏倚性存在。其次是,研究中的干预手法还有待进一步的客观化、规范化,比如用机器操作代替人去操作,这样减少干预量的影响。另外,因为当实验操作者对大鼠进行腹部推拿时,其行为本身可能会对大鼠造成心理压力,其可能影响整体治疗效果。这些因素均可能导致实验结果的偏差,这也为笔者今后的研究提出了新的要求,尽量去规避此部分的影响使结果更具有客观、科学性。另外,研究展示的通路可能是推拿手法众多靶点中的一条,未来还需要进一步研究,不能以偏概全的定义推拿干预作用机制。
| [1] |
SPERBER A D, BANGDIWALA S I, DROSSMAN D A, et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome foundation global study[J]. Gastroenterology, 2021, 160(1): 99-114.e3. DOI:10.1053/j.gastro.2020.04.014 |
| [2] |
LOVELL R M, FORD A C. Global prevalence of and risk factors for irritable bowel syndrome: a meta-analysis[J]. Clinical Gastroenterology and Hepatology, 2012, 10(7): 712-721. DOI:10.1016/j.cgh.2012.02.029 |
| [3] |
SHUTE A, BIHAN D G, LEWIS I A, et al. Metabolomics: the key to unraveling the role of the microbiome in visceral pain neurotransmission[J]. Frontiers in Neuroscience, 2022, 16: 917197. DOI:10.3389/fnins.2022.917197 |
| [4] |
周艳. 腹部推拿治疗腹泻型肠易激综合征的临床研究[D]. 广州: 广州中医药大学, 2018. ZHOU Y. Abdominal massage for the treatment of diarrhea-predominant irritable bowel syndrome and its clinical study[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2018. |
| [5] |
WICKLEY P J, YUGE R, RUSSELL M S, et al. Propofol modulates agonist-induced transient receptor potential vanilloid subtype-1 receptor desensitization via a protein kinase Cepsilon-dependent pathway in mouse dorsal root ganglion sensory neurons[J]. Anesthesiology, 2010, 113(4): 833-844. DOI:10.1097/ALN.0b013e3181eaa9a0 |
| [6] |
ZAN Y, KUAI C X, QIU Z X, et al. Berberine ameliorates diabetic neuropathy: TRPV1 modulation by PKC pathway[J]. The American Journal of Chinese Medicine, 2017, 45(8): 1709-1723. DOI:10.1142/S0192415X17500926 |
| [7] |
林雨康, 陈涛, 李幸展, 等. 腹泻型肠易激综合征动物模型研究进展[J]. 深圳中西医结合杂志, 2022, 32(1): 133-136. LIN Y K, CHEN T, LI X Z, et al. Research progress in animal model of diarrhea irritable bowel syndrome[J]. Shenzhen Journal of Integrated Traditional Chinese and Western Medicine, 2022, 32(1): 133-136. DOI:10.16458/j.cnki.1007-0893.2022.01.042 |
| [8] |
侯雨君, 赵映, 蒋慧灵, 等. 联合法诱导内脏高敏感模型的比较研究[J]. 中国实验动物学报, 2022, 30(3): 343-349. HOU Y J, ZHAO Y, JIANG H L, et al. Visceral hypersensitivity model of irritable bowel syndrome established by combined methods: a comparative study[J]. Acta Laboratorium Animalis Scientia Sinica, 2022, 30(3): 343-349. DOI:10.3969/j.issn.1005-4847.2022.03.006 |
| [9] |
陈颖, 赵妍, 罗丹妮, 等. 基于内脏高敏论针刺治疗IBS的机制研究进展[J]. 湖南中医杂志, 2019, 35(10): 169-173. CHEN Y, ZHAO Y, LUO D N, et al. Research progress on mechanism of acupuncture treatment of IBS based on visceral hypersensitivity theory[J]. Hunan Journal of Traditional Chinese Medicine, 2019, 35(10): 169-173. DOI:10.16808/j.cnki.issn1003-7705.2019.10.067 |
| [10] |
WOOLF C J, MA Q F. Nociceptors: noxious stimulus detectors[J]. Neuron, 2007, 55(3): 353-364. DOI:10.1016/j.neuron.2007.07.016 |
| [11] |
彭媛媛, 努尔麦麦提·叶尔逊, 阿孜古力·阿不来提, 等. 肥大细胞活化及类胰蛋白酶的变化对IBS-D的作用研究[J]. 河北医药, 2018, 40(18): 2819-2821, 2825. PENG Y Y, NUERMAIMAITI Y, AZIGULI A, et al. The effects of mast cell activation and changes of tryptase on IBS-D[J]. Hebei Medical Journal, 2018, 40(18): 2819-2821, 2825. DOI:10.3969/j.issn.1002-7386.2018.18.024 |
| [12] |
司鹤华, 陆高, 裴丽霞, 等. 肠道黏膜免疫应答在腹泻型肠易激综合征中的作用机制研究进展[J]. 现代医药卫生, 2016, 32(13): 2006-2009. SI H H, LU G, PEI L X, et al. Research progress on the mechanism of intestinal mucosal immune response in diarrhea predominant irritable bowel syndrome[J]. Journal of Modern Medicine & Health, 2016, 32(13): 2006-2009. DOI:10.3969/j.issn.1009-5519.2016.13.018 |
| [13] |
段园志, 唐旭东, 王凤云, 等. PAR-2信号通路与功能性胃肠病[J]. 世界华人消化杂志, 2017, 25(13): 1159-1165. DUAN Y Z, TANG X D, WANG F Y, et al. PAR-2 mediated signaling pathways and functional gastrointestinal diseases[J]. World Chinese Journal of Digestology, 2017, 25(13): 1159-1165. |
| [14] |
LEE H, PARK J H, PARK D I, et al. Mucosal mast cell count is associated with intestinal permeability in patients with diarrhea predominant irritable bowel syndrome[J]. Journal of Neurogastroenterology and Motility, 2013, 19(2): 244-250. DOI:10.5056/jnm.2013.19.2.244 |
| [15] |
CENAC N. Protease-activated receptors as therapeutic targets in visceral pain[J]. Current Neuropharmacology, 2013, 11(6): 598-605. DOI:10.2174/1570159X113119990039 |
| [16] |
AMADESI S, GRANT A D, COTTRELL G S, et al. Protein kinase D isoforms are expressed in rat and mouse primary sensory neurons and are activated by agonists of protease-activated receptor 2[J]. The Journal of Comparative Neurology, 2009, 516(2): 141-156. DOI:10.1002/cne.22104 |
| [17] |
HUANG Z J, LI H C, COWAN A A, et al. Chronic compression or acute dissociation of dorsal root ganglion induces cAMP-dependent neuronal hyperexcitability through activation of PAR2[J]. PAIN, 2012, 153(7): 1426-1437. DOI:10.1016/j.pain.2012.03.025 |
| [18] |
房军帆, 王思思, 孙海榉, 等. 抑制外周神经元PAR2-PKA/PKCε通路对痛转化模型大鼠痛阈的影响[J]. 中国实验动物学报, 2018, 26(1): 13-19. FANG J F, WANG S S, SUN H J, et al. Effect of inhibition of PAR2-PKA/PKCε signaling pathway in periphery neurons on the transition from acute to chronic pain[J]. Acta Laboratorium Animalis Scientia Sinica, 2018, 26(1): 13-19. |
| [19] |
CHEN Y, YANG C, WANG Z J. Proteinase-activated receptor 2 sensitizes transient receptor potential vanilloid 1, transient receptor potential vanilloid 4, and transient receptor potential ankyrin 1 in paclitaxel-induced neuropathic pain[J]. Neuroscience, 2011, 193: 440-451. DOI:10.1016/j.neuroscience.2011.06.085 |
| [20] |
赵迎盼, 唐旭东, 卞兆祥, 等. IBS-D肝郁脾虚型病证症结合大鼠模型的建立与评价的初步研究[J]. 中国中西医结合杂志, 2013, 33(11): 1507-1514. ZHAO Y P, TANG X D, BIAN Z X, et al. Preliminary study of establishing and assessing IBS-D model rats of liver stagnation and spleen deficiency syndrome[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2013, 33(11): 1507-1514. |
| [21] |
王一程, 穆芳园, 王曼宇, 等. 母婴分离联合3种应激致腹泻型肠易激综合征大鼠模型的建立和评价[J]. 中华中医药杂志, 2018, 33(6): 2314-2317. WANG Y C, MU F Y, WANG M Y, et al. Development and evaluation of a rat model of diarrhea irritable bowel syndrome by neonatal maternal separation combined with three kinds of stress[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(6): 2314-2317. |
| [22] |
董佳梓, 荣培晶, 马铁明, 等. 电针"足三里"对功能性消化不良内脏高敏感大鼠肥大细胞/瞬时受体电位香草酸亚型1通路的影响[J]. 针刺研究, 2022, 47(7): 592-597. DONG J Z, RONG P J, MA T M, et al. Influence of electroacupuncture of "Zusanli"(ST36) on mast cells/TRPV1 signaling pathway in visceral hypersensitivity rats with functional dyspepsia[J]. Acupuncture Research, 2022, 47(7): 592-597. |
2. Level 3 Laboratory of Biological Effects of Tuina Manipulation, State Administration of Traditional Chinese Medicine, Tianjin 300193, China;
3. Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China
 2023, Vol. 40
2023, Vol. 40