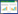文章信息
- 吕清波, 王彩君, 舒乐新, 王玉晶, 徐津鹏, 王怡
- LYU Qingbo, WANG Caijun, SHU Lexin, WANG Yujing, XU Jinpeng, WANG Yi
- 通脉养心丸减轻阿霉素致小鼠急性心脏毒性的作用研究
- Effect of Tongmai Yangxin Pills on alleviating acute cardiotoxicity induced by doxorubicin in mice
- 天津中医药, 2023, 40(1): 88-94
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 88-94
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.17
-
文章历史
- 收稿日期: 2022-09-01
2. 津药达仁堂集团股份有限公司乐仁堂制药厂,天津 300112
心脏毒性是指治疗期间或治疗结束后出现直接损伤心血管系统或加速心血管疾病发展的毒性现象[1]。阿霉素(DOX)是一种广谱的蒽环类抗肿瘤药物[2],临床上常用于治疗乳腺癌、胃癌、肺癌、卵巢癌、膀胱癌、淋巴瘤等多种实体瘤以及造血系统恶性肿瘤白血病[3-4]。DOX可诱导严重的心脏毒性,表现为心肌细胞损伤、细胞凋亡、坏死细胞死亡,以及出现危及生命的左心室功能障碍、心律失常以及心力衰竭等[5]。DOX诱导的心脏毒性分为急性、慢性和迟发性[6],以急性和慢性心脏毒性为主[7]。急性心脏毒性多在给药期间或给药2~3 d内发生,通过适当的药物治疗是可逆的[8]。慢性心脏毒性呈进展性且不可逆,通常在用药后1年左右发生[9]。目前,DOX诱导心脏毒性的确切机制仍不明确,较为公认的机制包括氧化应激、线粒体损伤、DNA损伤、钙超载、细胞自噬和凋亡等[10-13]。
中医虽然没有心脏毒性相对应病名,但根据其临床表现出的心悸、乏力、面色淡白、气短等主要症状,可将其归为中医的“心悸”“胸痹”范畴。其病位在心,病性虚实夹杂,以虚为主[14]。证候学研究结果显示,虽然心脏毒性辨证分型众多,但以气阴两虚证为主,占比高达43%[15]。因此,治法当以益气养阴为主。通脉养心丸作为临床治疗心血管疾病常用药物,具有益气养阴,通脉止痛之功。临床研究证实,通脉养心丸能够改善DOX化疗患者的心肌酶(CK)异常,缓解患者心悸、气短、胸闷、胸痛等心脏损伤症状,表明通脉养心丸可有效改善DOX诱导的心脏损伤,提高患者生活质量[16]。此外,课题组前期动物研究发现,通脉养心丸能够减轻DOX诱导的慢性心脏毒性[17]。急性心脏毒性发生较早,且通过适当的药物治疗可逆,因此,本研究将通过对小鼠单次腹腔注射20 mg/kg DOX,建立DOX致小鼠急性心脏毒性模型,探究通脉养心丸是否具有减轻DOX诱导急性心脏毒性的作用。
1 材料和方法 1.1 实验材料 1.1.1 实验动物139只SPF级健康雄性C57BL/6J小鼠(年龄:8~9周,体质量:21~23 g)购于北京斯贝福生物技术有限公司,合格证号:SCXK(京)2019-0010。小鼠购入后饲养于天津中医药大学实验动物中心,分笼饲养,每笼4只,普通饮食,自由饮水,环境温度为(23±2)℃,环境湿度为35%±5%,24 h昼夜更替。适应性饲养一周后进行分组。
1.1.2 主要药品及试剂DOX(北京索莱宝科技有限公司,货号:D8740)、通脉养心丸(津药达仁堂集团股份有限公司乐仁堂制药厂,货号:1070353)、羧甲基纤维素钠(北京索莱宝科技有限公司,货号:C8621)、0.9%生理盐水(石家庄四药有限公司,货号:2201071905)、总超氧化物歧化酶(SOD)测定试剂盒(南京建成生物工程研究所,货号:A001-3-2)、小鼠心肌肌钙蛋白(cTn-I)酶联免疫吸附剂测定(ELISA)试剂盒(武汉华美生物工程有限公司,货号:CSB-E08421m)、小鼠N端前脑钠素(NT-proBNP)ELISA试剂盒(武汉华美生物工程有限公司,货号:CSB-E05153m)等。
1.1.3 主要仪器电子天平(上海衡平科学仪器有限公司,型号JA1003)、离心机(Thermo Scientific公司,型号Legend Micro 17)、小动物超声实时影像系统(VisualSonics公司,型号:Vevo2100)、全自动生化仪(荷兰威图公司,型号:Microlab300)、多功能酶标仪(PERKinElmer公司,型号:Enpire)、组织切片机(上海徕卡仪器有限公司,型号:RM2016)、病理切片扫描仪(匈牙利3D HIES TECH公司,型号:Pannoramic MIDI)。
1.2 实验方法 1.2.1 动物模型的建立、分组及给药动物分组:将139只C57BL/6J小鼠随机分为5组,分别为空白对照组、DOX组、DOX+通脉养心丸低剂量组(0.5 g/kg)、DOX+通脉养心丸中剂量组(1.0 g/kg)、DOX+通脉养心丸高剂量组(2.0 g/kg),其中空白对照组15只,其余4组均31只。所有小鼠均适应性饲养1周后进行实验。药物配制:使用粉药器将通脉养心丸充分粉碎,再用浓度为0.5%羧甲基纤维素钠(CMC-Na)配制通脉养心丸低、中、高剂量灌胃水溶液。使用0.9%生理盐水配制DOX注射液。灌胃剂量为0.01 mL/g,腹腔注射剂量为0.01 mL/g。模型建立及给药:首先,通脉养心丸各剂量组小鼠进行通脉养心丸预给药5 d,空白对照组及DOX组灌胃同等剂量0.5%CMC-Na 5 d。预给药结束后转天,除空白对照组外,其余各组给予DOX单次腹腔注射20 mg/kg,建立DOX致急性心脏毒性模型,空白对照组腹腔注射同等剂量0.9%生理盐水。腹腔注射DOX或0.9%生理盐水1 h后,通脉养心丸各剂量组立即给予灌胃通脉养心丸溶液,空白对照组及DOX组灌胃同等剂量的0.5%CMC-Na,持续给予12 d,并于第3天和第12天进行各项指标检测。
1.2.2 一般状况观察DOX给药后每日称量所有小鼠体质量,记录体质量变化,并观察小鼠的精神状态、毛色变化、饮食饮水量以及死亡情况。
1.2.3 超声心动图DOX给药后第3天、第12天对所有小鼠进行超声检测。小鼠麻醉异氟烷诱导,麻醉后平卧,胸前区备皮。选用高频矩阵探头MS400,探头垂直于左胸壁,并与胸骨成10~30°夹角,显示心脏沿二尖瓣口至心尖方向的左室长轴像。在左室长轴像引导下,左室内径最大处(即乳头肌水平)显示M型图像,测量左室内径及室壁厚度,进行左室功能分析。所有参数至少测量3次。测量指标包括左室射血分数(EF)及左室短轴缩短率(FS)。
1.2.4 苏木精-伊红(HE)染色DOX给药后第3天将部分小鼠进行处死,第12天将全部小鼠处死采用磷酸盐缓冲溶液(PBS)进行心脏灌注,冲洗量大于40 mL,以确保心脏完全灌注,随后取下心脏置于福尔马林溶液中进行组织固定,3 d后进行组织包埋及HE染色。
1.2.5 血清CK、LDH检测DOX给药后第3天对所有小鼠进行目内眦取血,第12天进行摘眼球取血,静置0.5 h后,于3 500 r/min离心机离心15 min,离心半径8.3 cm,吸取上清,分装于1.5 μL离心管中,取血后4 h内于全自动生化分析仪检测CK、LDH。
1.2.6 血清cTn-I检测DOX给药后第3天对所有小鼠进行目内眦取血,第12天进行摘眼球取血,静置0.5 h后,于3 500 r/min离心机离心15 min,离心半径8.3 cm,吸取上清,分装于1.5 μL离心管中。根据试剂盒说明书进行cTn-I检测。
1.2.7 血清SOD检测DOX给药后第3天对所有小鼠进行目内眦取血,第12天进行摘眼球取血,静置0.5 h后,于3 500 r/min离心机离心15 min,离心半径8.3 cm,吸取上清,分装于1.5 μL离心管中。根据试剂盒说明书进行SOD检测。
1.3 统计学方法采用SPSS 23.0统计软件包进行资料分析,实验结果采用均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
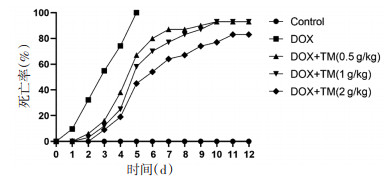
2 实验结果 2.1 通脉养心丸对DOX致急性心脏毒性小鼠死亡率和体质量变化的影响空白对照组小鼠状况良好,无死亡。与空白对照组小鼠相比,DOX组小鼠普遍精神状况较差,出现体质量下降,精神萎靡、食欲不振、活动强度减弱,喜聚居喜蜷缩,毛色粗糙无光泽等现象,DOX组小鼠死亡率较高。与DOX组小鼠相比,通脉养心丸低、中、高剂量组小鼠的体质量增加,一般情况均明显改善,死亡率较DOX组下降且死亡时间延后。见图 1、图 2。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。 图 1 通脉养心丸减轻DOX致急性心脏毒性小鼠的死亡率(x±s) Fig. 1 Death rate of acute cardiotoxicity mice induced by DOX reduced by Tongmai Yangxin Pills(x±s) |
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。 图 2 通脉养心丸减轻DOX致急性心脏毒性小鼠的体质量变化率(x±s) Fig. 2 Rate of weight change of acute cardiotoxicity mice induced by DOX reduced by Tongmai Yangxin Pills(x±s) |
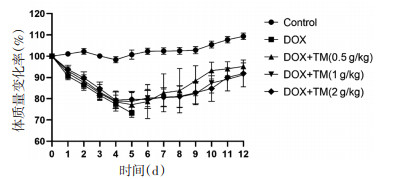
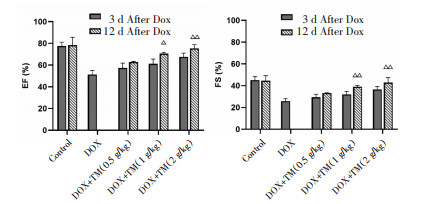
与空白对照组相比,DOX组小鼠EF、FS值显著降低,差异有统计学意义(P < 0.01);与DOX模型组比较,通脉养心丸低剂量组小鼠EF、FS值升高,差异有统计学意义(P < 0.05),通脉养心丸中、高剂量组小鼠EF、FS值显著升高,差异有统计学意义(P < 0.01)。见图 3。与DOX干预后第3天相比,DOX干预后第12天通脉养心丸中、高剂量组小鼠EF、FS值均升高,差异有统计学意义(P < 0.05),通脉养心丸低剂量组小鼠EF、FS值呈升高趋势,差异无统计学意义(P > 0.05)。见图 4。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与空白组比较,**P < 0.01;与DOX组比较,#P < 0.05,##P < 0.01。 图 3 DOX干预后第3天小鼠EF、FS比较(x±s) Fig. 3 Comparison of the EF and FS of mice on the third day after DOX intervention(x±s) |
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与DOX干预后第3天比较,△P < 0.05,△△P < 0.01。 图 4 DOX干预后第12天小鼠EF、FS比较(x±s) Fig. 4 Comparison of the EF and FS of mice on the twelfth day after DOX intervention(x±s) |
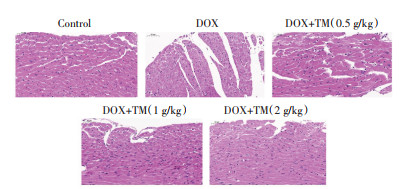
DOX干预后第3天,空白对照组小鼠心肌细胞排列整齐、紧密、纵横交错,结构清晰,细胞核、细胞浆完整等。与空白对照组相比,DOX组小鼠心肌细胞排列紊乱,肌原纤维丢失,核周空泡化和细胞质空泡化。与DOX组相比,通脉养心丸低、中、高剂量组心肌细胞较为完整,心肌损伤程度减轻,心肌组织明显改善,这表明通脉养心丸能够减轻DOX诱导的急性心脏毒性。见图 5。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。 图 5 DOX干预后第3天小鼠心肌组织病理变化(HE,×400) Fig. 5 Pathological changes of myocardial tissue of mice on the third day after DOX intervention (HE, ×400) |
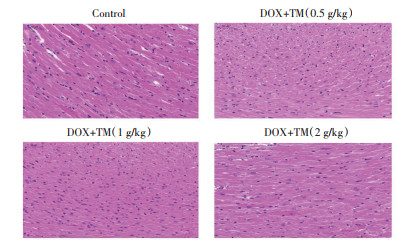
与DOX干预后第3天相比,DOX干预后第12天通脉养心丸各剂量组小鼠的心肌细胞均排列整齐、结构清晰,细胞核、细胞浆完整。这表明通脉养心丸能够逆转DOX诱导的急性心脏毒性,促进受损的心肌组织恢复。见图 6。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。 图 6 DOX干预后第12天小鼠心肌组织病理变化(HE,×400) Fig. 6 Pathological changes of myocardial tissue of mice on the twelfth day after DOX (HE, ×400) |
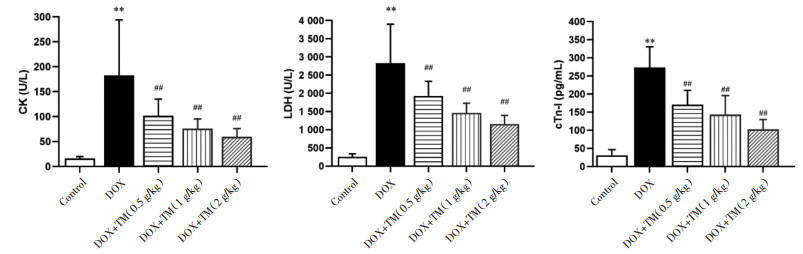
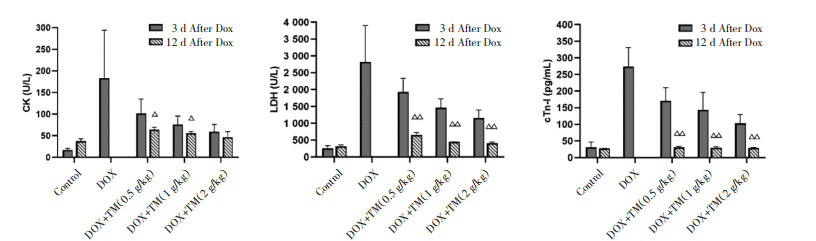
与空白对照组相比,DOX组小鼠CK、LDH值和血清cTn-I含量均显著升高,差异有统计学意义(P < 0.01);与DOX模型组比较,通脉养心丸低、中、高剂量组小鼠CK、LDH值和血清cTn-I含量显著降低,差异有统计学意义(P < 0.01)。见图 7。与DOX干预后第3天相比,DOX干预后第12天通脉养心丸低、中、高剂量组小鼠CK值均呈下降趋势,其中通脉养心丸低、中剂量组差异有统计学意义(P < 0.05)。LDH均和血清cTn-I含量均显著降低,差异均有统计学意义(P < 0.01)。见图 8。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与空白组比较,**P < 0.01;与DOX组比较,##P < 0.01。 图 7 DOX干预后第3天小鼠CK、LDH、cTn-I的含量比较(x±s) Fig. 7 Comparison of the CK、LDH and cTn-I in mice on the third day after DOX intervention(x±s) |
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与DOX干预后第3天比较,△P < 0.05,△△P < 0.01。 图 8 DOX干预后第12天小鼠CK、LDH、cTn-I的含量比较(x±s) Fig. 8 Comparison of the CK、LDH and cTn-I in mice on the twelfth day after DOX intervention(x±s) |
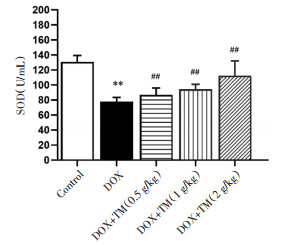
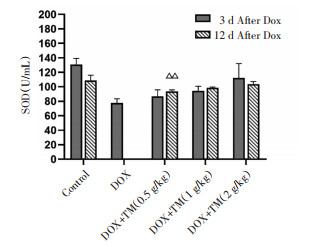
与空白对照组相比,DOX组小鼠血清SOD含量显著降低(P < 0.01),差异有统计学意义;与DOX模型组相比,通脉养心低、中、高剂量组血清SOD含量均显著升高,差异有统计学意义(P < 0.01)。见图 9。与DOX干预后第3天相比,DOX干预后第12天通脉养心丸低剂量组小鼠SOD含量显著升高,差异有统计学意义(P < 0.01),通脉养心丸中剂量组小鼠SOD含量呈升高趋势。见图 10。
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与空白组比较,**P < 0.01;与DOX组比较,##P < 0.01。 图 9 DOX干预后第3天小鼠SOD的含量比较(x±s) Fig. 9 Comparison of SOD in mice on the third day after DOX intervention(x±s) |
|
| 注:Control:空白对照组;DOX:阿霉素;DOX+TM:阿霉素+通脉养心丸。与DOX干预后第3天比较,△△P < 0.01。 图 10 DOX干预后第12天小鼠SOD的含量比较(x±s) Fig. 10 Comparison of SOD in mice on the twelfth day after DOX intervention(x±s) |
模拟人类心脏毒性损伤的实验动物模型是开发其治疗方法的重要要素。研究表明,小鼠和大鼠两种鼠种在DOX心脏毒性模型中的病理变化没有差异,并且雌性和雄性两种性别亦没有差异[18-19]。通过文献调研,笔者发现小鼠单次累积30 mg/kg DOX是绝对致死的,而单次累积20 mg/kg DOX是可能致死的[20-21]。结合前期预实验结果[22],采用DOX单次腹腔注射20 mg/kg,建立DOX致小鼠急性心脏毒性模型进行研究。DOX干预后第3天结果表明,DOX对小鼠造成严重的心肌损伤,并且DOX组小鼠均在5 d内死亡,表明接受单次腹腔注射DOX 20 mg/kg的实验造模方法成功。DOX组小鼠全部死亡后,通过对其他4组继续灌胃通脉养心丸1周发现,通脉养心丸能够减轻甚至逆转DOX造成的心肌损伤,其中以通脉养心丸高剂量为优。
蒽环类药物诱导的心脏毒性可使左心室EF值出现明显下降,并且较基线降低至少5%~10%[1, 23]。这与本实验研究结果一致,DOX第3天时,与空白对照组相比,DOX组小鼠均出现EF、FS值降低,差异有统计学意义。给予通脉养心丸干预后,各组小鼠EF、FS值较DOX组均升高。DOX第12天时,与DOX第3天相比,通脉养心丸各组小鼠均明显恢复。这表明通脉养心丸能够减轻DOX诱导的急性心脏毒性,改善心脏功能。血清CK、LDH在临床上常用于诊断和监控急性心肌损伤。心肌损伤发生时,CK会从受损细胞中释放入血,使血清CK水平迅速提高。笔者研究结果表明,DOX可使血清中的CK、LDH水平升高,这表明DOX能够造成心肌损伤,而通脉养心丸能够降低血清CK、LDH水平,减轻DOX诱导的心肌损伤。cTn-I从心肌细胞中释放,并且与心脏组织损伤程度成正比。cTn-I是蒽环类化疗药物诱发左心室功能障碍最敏感和最常用的生物标志物[24]。与空白对照组相比,DOX组小鼠、大鼠血清cTn-I含量均呈上升趋势,这表明DOX对心脏组织造成了广泛损伤,然而通脉养心丸各剂量组cTn-I值均呈下降趋势,这表明通脉养心丸具有减轻DOX引起的心肌细胞损伤的能力。但cTn-I并不是确诊DOX致心脏毒性的唯一指标,因为其缺乏临界值、停药时间、随访持续时间和心脏终点的定义[25]。
3.2 通脉养心丸保护心脏的临床及药理研究目前,通脉养心丸保护心脏功能的作用机制已得到证实。本课题组既往药理实验研究结果发现,通脉养心丸水提物可减轻缺氧/复氧条件下的H9c2细胞凋亡;降低H9c2细胞内钙离子(Ca2+)浓度;抑制线粒体膜电位降低及线粒体通透性转换孔(mPTP)开放等。现代药理研究发现,通脉养心丸具有较好的氧自由基清除能力,可减轻氧化应激造成的心肌细胞损伤,可通过抑制炎症因子表达发挥抗炎作用,可通过抑制钙超载来减少心肌细胞凋亡,保护心脏功能。
同时,临床研究证实,通脉养心丸能够改善DOX化疗后患者的CK异常,缓解患者心悸、气短、胸闷、胸痛等心脏损伤症状,表明通脉养心丸可有效改善DOX诱导的心脏损伤,提高患者生活质量[16]。基于通脉养心丸的临床和现代药理研究结果,以及其减轻DOX致心脏毒性的作用机制尚不明确,笔者从动物层面对其减轻DOX心脏毒性进行药效及机制研究,为通脉养心丸的临床应用提供科学依据。
3.3 DOX致心脏毒性的作用机制研究DOX诱导心脏毒性的确切机制仍不明确,较为公认的作用机制包括氧化应激、线粒体损伤、DNA损伤、钙超载、细胞自噬和凋亡等。中国蒽环类药物心脏毒性防治指南(2013年版)指出:蒽环类药物引起心脏毒性的主要机制是铁介导的活性氧物质(ROS)产生及促进心肌的氧化应激发生;蒽环类药物螯合铁离子后触发氧自由基生成,导致心肌细胞膜脂质过氧化和心肌线粒体DNA的损伤等[23]。生理情况下,机体的氧自由基与清除氧自由基系统维持动态平衡状态,当心肌发生损伤时,心肌组织ROS过量生成、堆积,使细胞内的重要抗氧化酶,如超氧化物歧化酶SOD活性降低,清除氧自由基能力下降,导致脂质过氧化物代谢产物生成增多,进一步破坏以脂质为主要成分的生物膜的结构与功能,损伤血管内皮细胞及心肌细胞[1, 26-27]。SOD酶活性和能反映体内氧自由基代谢水平,同时也可作为评价心功能及心肌受损程度的指标,本研究显示,单纯给予DOX会导致小鼠SOD含量升高,造成氧化损伤,相比之下,给予通脉养心丸后小鼠SOD含量降低,这表明通脉养心丸能够改善DOX诱导的氧化损伤,减轻急性心脏毒性。
总之,笔者发现通脉养心丸可通过降低DOX致急性心脏毒性小鼠的死亡率,延长其生存时间,降低CK、LDH值和cTn-I含量,升高EF、FS值及SOD含量,改善DOX造成的核周空泡化和细胞质空泡化,减轻DOX诱导的心脏损伤,改善心脏功能,且其减轻急性心脏毒性可能与氧化损伤有关,后续笔者将针对通脉养心丸减轻DOX致急性、慢性心脏毒性的作用机制进行研究,为通脉养心丸的临床应用提供科学依据。
| [1] |
ZAMORANO J L, LANCELLOTTI P, RODRIGUEZ MUÑOZ D, et al. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines[J]. European Journal of Heart Failure, 2017, 19(1): 9-42. DOI:10.1002/ejhf.654 |
| [2] |
ELBLEHI S S, EL-SAYED Y S, SOLIMAN M M, et al. Date palm pollen extract avert doxorubicin-induced cardiomyopathy fibrosis and associated oxidative/nitrosative stress, inflammatory cascade, and apoptosis-targeting bax/bcl-2 and caspase-3 signaling pathways[J]. Animals: an Open Access Journal from MDPI, 2021, 11(3): 886. |
| [3] |
RUSSO M, BONO E, GHIGO A. The interplay between autophagy and senescence in anthracycline cardiotoxicity[J]. Current Heart Failure Reports, 2021, 18(4): 180-190. DOI:10.1007/s11897-021-00519-w |
| [4] |
HU H M, ZHANG W L, HUANG D S, et al. Cardiotoxicity of anthracycline (ANT) treatment in children with malignant tumors[J]. Pediatric Hematology and Oncology, 2018, 35(2): 111-120. DOI:10.1080/08880018.2018.1459983 |
| [5] |
LI W L, WANG X P, LIU T H, et al. Harpagoside protects against doxorubicin-induced cardiotoxicity via P53-parkin-mediated mitophagy[J]. Frontiers in Cell and Developmental Biology, 2022, 10: 813370. DOI:10.3389/fcell.2022.813370 |
| [6] |
WANG A J, ZHANG J J, XIAO M J, et al. Molecular mechanisms of doxorubicin-induced cardiotoxicity: novel roles of sirtuin 1-mediated signaling pathways[J]. Cellular and Molecular Life Sciences: CMLS, 2021, 78(7): 3105-3125. DOI:10.1007/s00018-020-03729-y |
| [7] |
CARDINALE D, COLOMBO A, LAMANTIA G, et al. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy[J]. Journal of the American College of Cardiology, 2010, 55(3): 213-220. DOI:10.1016/j.jacc.2009.03.095 |
| [8] |
石远凯, 巴一, 冯继锋, 等. 中国蒽环类药物特性专家共识[J]. 中国肿瘤临床, 2018, 45(3): 110-112. SHI Y K, BA Y, FENG J F, et al. Chinese expert consensus on anthracycline properties[J]. Chinese Journal of Clinical Oncology, 2018, 45(3): 110-112. |
| [9] |
马军, 朱军, 石远凯, 等. 脂质体阿霉素治疗恶性淋巴瘤和多发性骨髓瘤的中国专家共识(2019年版)[J]. 临床肿瘤学杂志, 2019, 24(5): 445-453. MA J, ZHU J, SHI Y K, et al. China experts consensus on liposome adriamycin for malignant lymphoma and multiple myeloma (2019)[J]. Journal of Clinical Oncology, 2019, 24(5): 445-453. DOI:10.3969/j.issn.1009-0460.2019.05.012 |
| [10] |
TIMM K N, TYLER D J. The role of AMPK activation for cardioprotection in doxorubicin-induced cardiotoxicity[J]. Cardiovascular Drugs and Therapy, 2020, 34(2): 255-269. DOI:10.1007/s10557-020-06941-x |
| [11] |
ZHANG X, HU C, KONG C Y, et al. FNDC5 alleviates oxidative stress and cardiomyocyte apoptosis in doxorubicin-induced cardiotoxicity via activating AKT[J]. Cell Death and Differentiation, 2020, 27(2): 540-555. DOI:10.1038/s41418-019-0372-z |
| [12] |
WALLACE K B, SARDÃO V A, OLIVEIRA P J. Mitochondrial determinants of doxorubicin-induced cardiomyopathy[J]. Circulation Research, 2020, 126(7): 926-941. DOI:10.1161/CIRCRESAHA.119.314681 |
| [13] |
YAO L, GUI M T, LI J H, et al. Shengxian Decoction decreases doxorubicin-induced cardiac apoptosis by regulating the TREM1/NF-κB signaling pathway[J]. Molecular Medicine Reports, 2021, 23(3): 219. DOI:10.3892/mmr.2021.11858 |
| [14] |
张越, 杨焱, 马伊锐. 化疗前后肿瘤患者的证候规律[J]. 中国老年学杂志, 2015, 35(10): 2724-2726. ZHANG Y, YANG Y, MA Y R. Syndrome regularity of tumor patients before and after chemotherapy[J]. Chinese Journal of Gerontology, 2015, 35(10): 2724-2726. DOI:10.3969/j.issn.1005-9202.2015.10.061 |
| [15] |
杨慧芳, 黄庞宁, 刘增慧, 等. 蒽环类药物急性心脏毒性的中医证候、证素特点探析[J]. 中国中医急症, 2020, 29(12): 2092-2096. YANG H F, HUANG P N, LIU Z H, et al. A preliminary study on TCM syndromes and syndrome elements of anthracyclines acute cardiotoxicity[J]. Journal of Emergency in Traditional Chinese Medicine, 2020, 29(12): 2092-2096. DOI:10.3969/j.issn.1004-745X.2020.12.007 |
| [16] |
黄景玉, 黄博. 通脉养心丸治疗阿霉素所致心脏损伤的疗效观察[J]. 中西医结合心脑血管病杂志, 2019, 17(14): 2186-2188. HUANG J Y, HUANG B. Observation on the therapeutic effect of Tongmai Yangxin Pill on adriamycin induced cardiac injury[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2019, 17(14): 2186-2188. DOI:10.12102/j.issn.1672-1349.2019.14.033 |
| [17] |
吕清波, 潘均华, 王玉晶, 等. 通脉养心丸对阿霉素慢性心脏毒性大鼠的保护作用研究[J]. 天津中医药, 2021, 38(12): 1602-1608. LYU Q B, PAN J H, WANG Y J, et al. Study on the protective effect of Tongmai Yangxin Pill on doxorubicin rats with chronic cardiac toxicity[J]. Tianjin Journal of Traditional Chinese Medicine, 2021, 38(12): 1602-1608. DOI:10.11656/j.issn.1672-1519.2021.12.23 |
| [18] |
PODYACHEVA E Y, KUSHNAREVA E A, KARPOV A A, et al. Analysis of models of doxorubicin-induced cardiomyopathy in rats and mice. A modern view from the perspective of the pathophysiologist and the clinician[J]. Frontiers in Pharmacology, 2021, 12: 670479. DOI:10.3389/fphar.2021.670479 |
| [19] |
CHATTERJEE K, ZHANG J Q, HONBO N, et al. Doxorubicin cardiomyopathy[J]. Cardiology, 2010, 115(2): 155-162. DOI:10.1159/000265166 |
| [20] |
ALHOWAIL A. Varenicline enhances the survival of doxorubicin-treated mice[J]. European Review for Medical and Pharmacological Sciences, 2020, 24(21): 11350-11355. |
| [21] |
MIZUTA Y, TOKUDA K, GUO J, et al. Sodium thiosulfate prevents doxorubicin-induced DNA damage and apoptosis in cardiomyocytes in mice[J]. Life Sciences, 2020, 257: 118074. DOI:10.1016/j.lfs.2020.118074 |
| [22] |
吕清波, 潘均华, 李帅, 等. 阿霉素急性心脏毒性大鼠造模方法研究[J]. 药物评价研究, 2022, 45(2): 301-307. LYU Q B, PAN J H, LI S, et al. Study on model establishment of adriamycin induced acute cardiotoxicity in rats[J]. Drug Evaluation Research, 2022, 45(2): 301-307. |
| [23] |
马军, 秦叔逵, 沈志祥. 蒽环类药物心脏毒性防治指南(2013年版)[J]. 临床肿瘤学杂志, 2013, 18(10): 925-934. MA J, QIN S K, SHEN Z X. Guidelines for cardiotoxicity prevention and treatment of anthracyclines(2013 edition)[J]. Chinese Clinical Oncology, 2013, 18(10): 925-934. DOI:10.3969/j.issn.1009-0460.2013.10.014 |
| [24] |
SANDAMALI J A N, HEWAWASAM R P, JAYATILAKA K A P W, et al. Cardioprotective potential of Murraya koenigii (L.) spreng. leaf extract against doxorubicin-induced cardiotoxicity in rats[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2020, 2020: 6023737. |
| [25] |
LÓPEZ-SENDÓN J, ÁLVAREZ-ORTEGA C, ZAMORA AUÑON P, et al. Classification, prevalence, and outcomes of anticancer therapy-induced cardiotoxicity: the CARDIOTOX registry[J]. European Heart Journal, 2020, 41(18): 1720-1729. DOI:10.1093/eurheartj/ehaa006 |
| [26] |
DELEMASURE S, VERGELY C, ZELLER M, et al. Preventing the cardiotoxic effects of anthracyclins. From basic concepts to clinical data[J]. Annales De Cardiologie et d'Angeiologie, 2006, 55(2): 104-112. DOI:10.1016/j.ancard.2006.02.005 |
| [27] |
WENNINGMANN N, KNAPP M, ANDE A, et al. Insights into doxorubicin-induced cardiotoxicity: molecular mechanisms, preventive strategies, and early monitoring[J]. Molecular Pharmacology, 2019, 96(2): 219-232. DOI:10.1124/mol.119.115725 |
2. Lerentang Pharmaceutical Factory, Jinyao Darentang Group Co. Ltd., Tianjin 300112, China
 2023, Vol. 40
2023, Vol. 40