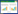文章信息
- 王芳, 王誉程, ODURO Patrick Kwabena, 仝婉昱, 冷玲, 黎瑞巧, 王启隆, 刘二伟
- WANG Fang, WANG Yucheng, ODURO Patrick Kwabena, TONG Wanyu, LENG Ling, LI Ruiqiao, WANG Qilong, LIU Erwei
- 基于网络药理学和分子对接技术探讨糖网明目颗粒治疗糖尿病视网膜病变的作用机制
- Mechanism of Tangwang Mingmu Granules in treating diabetic retinopathy based on network pharmacology and molecular docking
- 天津中医药, 2023, 40(1): 95-103
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 95-103
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.18
-
文章历史
- 收稿日期: 2022-10-12
2. 组分中药国家重点实验室,天津 301617
糖尿病视网膜病变(DR)作为糖尿病最常见的微血管病变之一,是造成糖尿病患者视力障碍的主要原因[1]。研究表明,炎症和氧化应激可以促进非增殖性DR向增殖性DR的转变[2-3],血-视网膜屏障(BRB)完整性的破坏会加剧视网膜血管生成,进而损伤视力[4]。临床常用的激光疗法或者玻璃体内注射血管内皮生长因子(VEGF)抗体治疗[5]具有成本高昂,不良反应多,治疗时间长等局限性[6-7]。
中药对糖尿病血管并发症的保护作用受到越来越多关注,为DR的防治提供了新的途径。糖网明目颗粒是基于治疗DR的临床经验方——密蒙花方而开发的中药6类新药[8-9]。密蒙花方是在长期防治DR的临床基础上,在“心肾论治早期DR”的新思路指导下,以益气养阴、交通心肾、和血明目为组方原则,用于防治非增殖期DR的经验方。临床研究表明该方对于早期DR患者,具有改善其全身及眼睛症状的功效,包括提高DR患者的视力、改变视疲劳、改善眼底血管状态等,且证实了该方临床长期用药的安全性[10-11]。方中黄芪益气健脾生血,乌梅收敛生津止血,两者共为君药以益气养阴;黄连,肉桂能引火归源,交通心肾,为臣药;益母草、女贞子益肝肾明目、和血化瘀共为佐药;密蒙花清热泻火、养肝明目,又可引药上行,为使药[9, 12]。糖网明目颗粒利用现代工艺制药,将以预防和早期治疗为主要目的参与DR治疗。
网络药理学是基于系统生物学理论,通过建立“药物-靶点-疾病网络”,从多角度分析药物治疗疾病的潜在机制[13]。分子对接技术通过模拟药物分子和靶蛋白之间的潜在连接方式,预测药物配体和蛋白质受体的对接模式和结合亲和力,为中药多成分、多靶点的药物作用机制探索提供研究策略[14]。本文利用网络药理学和分子对接技术初步探讨糖网明目颗粒治疗DR的活性成分和作用机制并通过体外细胞实验进行验证,旨在为进一步研究糖网明目颗粒治疗DR的机制以及临床应用提供一定参考。
1 材料与方法 1.1 糖网明目颗粒的化学成分以及靶标数据库的构建依据糖网明目颗粒所含的中药,借助中药系统药理分析平台(TCMSP,https://tcmsp-e.com/)查询化学成分,按照口服生物利用度(OB)≥30%,类药性(DL)≥0.18的条件筛选具有活性成分的化合物,并结合文献报道,补充含量较高、有药理作用的活性成分纳入表中。
通过PharmMapper服务器(http://lilab-ecust.cn/pharmmapper/)对活性成分进行模拟分子-靶蛋白对接,构建活性成分靶点库。将糖网明目颗粒化学成分的Mol2格式结构文件,上传至PharmMapper服务器,以活性小分子为探针,搜寻潜在药物靶点,进行虚拟筛选和预测化合物生物活性,得到活性成分的靶点预测结果,根据Norm Fit值由高到低排序,选择前10个靶点作为活性成分的重要靶标,导入UniProt数据库(http://www.uniprot.org/)中,限定物种为“人”,查询对应的UniProtKB编码和基因名称。
1.2 DR靶基因数据库的构建在数据库Disgenet(https://www.disgenet.org/)和GeneCards数据库(https://www.genecards.org/)中以“Diabetic retinopathy”作为关键词构建疾病靶点库。
1.3 靶点筛选绘制维恩图(http://bioinformatics.psb.ugent.be/webtools/Venn/),对糖网明目颗粒的药物靶点与DR靶基因数据库进行匹配,选择交集靶点作为糖网明目颗粒治疗DR的潜在靶点。
1.4 蛋白互作网络的构建与分析使用STRING数据库(https://string-db.org/,version11.5),输入潜在靶点,在organism项设置物种为“Homo sapiens”,隐藏单独靶点得到蛋白互作网络(PPI)。将PPI数据导入Cytoscape 3.6.0软件中,利用MCODE功能筛选连接最为紧密的功能模块。
1.5 中药调控网络的构建将中药、药物有效成分、核心靶点文件导入Cytoscape 3.6.0软件构建中药-活性成分-核心靶点网络图。
1.6 基因富集分析和通路注释研究基因本体论(GO)是注释基因及其表达产物的常用方法。使用R-4.1.1,导入作用靶点,引用“Stringr”“tidyr”“ggpubr”等程序包,设定阈值P≤0.05筛选具有显著性差异的生物过程,并可视化GO富集分析结果。
京都基因与基因组百科全书(KEGG)可对药物作用靶点或差异表达基因进行信号通路分析。将作用靶点导入R-4.1.1,运用“DOSE”“clusterProfiler”“pathview”等程序包进行KEGG通路富集分析,设定阈值P≤0.05筛选具有显著性差异的可靠靶点通路。
1.7 分子对接从RSCB PDB数据库(https://www.rcsb.org/)下载核心靶点的3D结构保存为PDB格式文件,从TCMSP数据库下载药物活性成分的3D结构,保存为mol2格式。使用AutoDockTools 1.5.6软件,以靶蛋白作为受体,将核心活性成分作为配体,根据靶蛋白复合物中配体的坐标确定活性位点,设置活性口袋,运行AutoDock Vina进行对接,用PyMol 2.2.0和Discovery Studio 2019进行结果分析。
1.8 体外实验验证 1.8.1 药物糖网明目颗粒,实验使用该药浸膏粉,3.5 g生药/g,由北京红太阳药业有限公司提供,溶于无菌超纯水中配制成300 mg/mL的母液。
1.8.2 细胞人视网膜母细胞瘤细胞株Y79购自北纳生物河南省工业微生物菌种工程技术研究中心(BNCC341293)。
1.8.3 试剂RPMI-1640培养基,胎牛血清(FBS),青链霉素混合液购于美国Gibco公司;CCK8试剂盒,5×蛋白上样缓冲液购于北京索莱宝科技有限公司;BCA蛋白定量试剂盒和SDS-PAGE凝胶制备试剂盒购于北京康为世纪生物科技有限公司;表皮生长因子受体(EGFR,货号:0407-21)、丝裂原活化蛋白激酶(MAPK)14(货号:R1308-3)购于杭州华安生物技术有限公司;Tubulin(货号:AC007)购于武汉爱博泰克生物科技有限公司。
1.8.4 仪器CO2恒温培养箱(HF240,力康生物医疗科技控股有限公司)、电泳仪(PowerPACTMHC,美国Bio-Rad公司);Amershan Imager 600凝胶成像系统(日本GE公司)等。
1.8.5 细胞培养Y79细胞在RPMI-1640培养基(10%胎牛血清、1%青链霉素混合液)中,于37 ℃、5%CO2的培养箱中培养。待培养瓶中细胞融合至80%~90%时,可进行传代培养。
1.8.6 糖网明目颗粒的细胞毒性实验将Y79细胞以3×104个/孔的细胞密度,接种于96孔板中培养12 h。加入不同浓度的糖网明目颗粒(0.2、0.4、0.8、1.0 mg/mL)干预24 h。利用CCK8试剂盒测定细胞的生存率以探究糖网明目颗粒是否对该细胞具有毒性作用。
1.8.7 细胞分组及处理细胞造模:在6孔板中均匀接种生长良好的Y79细胞,按5×105个/mL细胞密度加入2 mL完全培养基,每孔加入25 mmol/L高糖培养液培养12 h建立高糖损伤模型。细胞分组:正常对照组(NG组),高糖模型组(HG组),等渗对照组(DS组),0.4 mg/mL糖网明目颗粒干预高糖组(HG-TWMM G组),0.2 mg/mL糖网明目颗粒干预高糖组(HG-TWMM L组)。去掉原高糖培养液,各组中加入含药培养基或空白对照培养基,培养48 h。
1.8.8 蛋白免疫印迹法(Western blot)检测细胞中EGFR和MAPK14蛋白表达药物干预48 h后,提取细胞蛋白并利用BCA试剂盒测定各样品蛋白浓度,稀释配平变性后进行Western blot实验。细胞蛋白上样量为10 μg/孔;电泳转膜完成后封闭2 h,按照蛋白分子量裁取条带,一抗孵育过夜。第2天洗膜进行二抗孵育1.5 h,洗膜。AI600凝胶成像系统曝光,统计条带灰度值。目的蛋白相对表达量为蛋白灰度值/内参灰度值/正常组,采用SPSS 25.0统计软件进行分析,组间比较采用单因素方差分析检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 糖网明目颗粒活性成分的筛选糖网明目颗粒中包含的活性成分信息表见OSID码。根据TCMSP数据库获取黄芪,黄连,密蒙花,女贞子,乌梅,益母草所含成分。由于肉桂中没有符合OB≥30%,DL≥0.18的活性成分,通过查阅文献补充肉桂中的有效成分(如:肉桂酸,异甘草素,醋酸桂皮酯等)[15-16]纳入到活性成分表中,最终得到黄芪化学成分20个,黄连化学成分14个,密蒙花化学成分4个,女贞子化学成分13个,乌梅化学成分8个,益母草化学成分8个,肉桂化学成分5个。
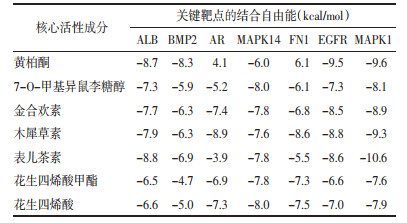
2.2 靶点预测以及PPI网络分析将活性成分在PharmMapper中返回的前300个潜在作用靶点依据Norm Fit值由高到低排序,选择前10个作为活性成分的重要靶标。在Uniprot数据库的检索功能中输入靶标的PDB ID,限定物种为“人”,对应得到靶点的基因名称,去除重复后得到271个靶点。将获得的271个靶点与Disgenet及GeneCards数据库中与DR相关的疾病靶标对比分析,交集归纳得到62个与糖网明目颗粒治疗DR相关联的潜在作用靶点,见图 1。
|
| 图 1 糖网明目颗粒-DR共同靶基因韦恩图 Fig. 1 Venn diagram of Tangwang Mingmu Granules-DR common target gene |
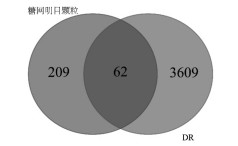
将62个潜在作用靶点导入到STRING数据库中,建立PPI网络。将PPI网络导入Cytoscape 3.6.0软件,得到56个相互作用的节点和297条边。利用MCODE功能筛选出连接最为紧密的功能模块(Score=12.333),得到19个核心靶点,111条边(图 2)。核心靶点信息见表 1。
|
| 图 2 作用靶点的PPI网络构建 Fig. 2 PPI network construction of action target |
使用Cytoscape 3.6.0软件构建糖网明目颗粒活性成分-核心靶点的网络模型,如图 3所示。图中共产生87个节点,185条边。不同颜色的节点分别代表中药、活性成分、调节的核心靶点,边代表活性成分和靶点间的相互作用。结果表明了糖网明目颗粒多成分、多靶点的协同作用模式。
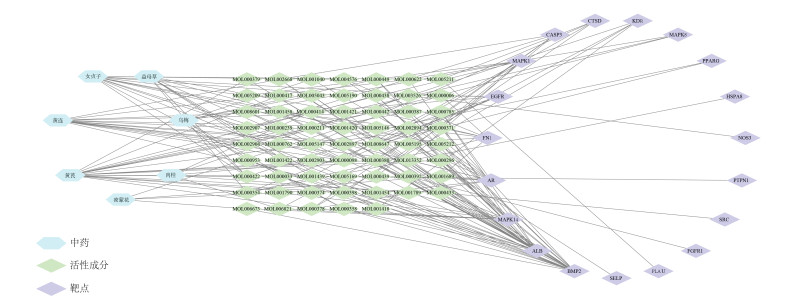
|
| 图 3 中药-活性成分-核心靶点网络图 Fig. 3 Network diagram of Chinese medicine, active ingredients and core targets |
GO生物功能注释分为3个方面:生物过程(BP)、细胞组成(CC)和分子功能(MF)。对62个潜在作用靶点进行GO富集分析,得到147条BP相关,31项CC相关,48条MF相关。将最显著的前10条进行展示。见图 4。其中,糖网明目颗粒作用靶点在BP中的富集包括细胞过程、凋亡过程、蛋白代谢过程、RNA生物合成过程、化学反应、细胞蛋白修饰过程等主要生物过程,富集条目如:信号转导(signal transduction),占总富集数目的18.03%;抗细胞凋亡(negative regulation of apoptotic process),占总富集数目的14.75%;RNA聚合酶Ⅱ对转录的正调控(positive regulation of transcription from RNA polymeraseⅡ promoter),占总富集数目的14.75%。在CC中,富集条目分布于细胞质基质(cytosol)、细胞质(cytoplasm),分别各占据总富集数目的49.18%与47.54%。MF中,富集条目主要是蛋白质结合(protein binding),占总富集数目的78.68%。
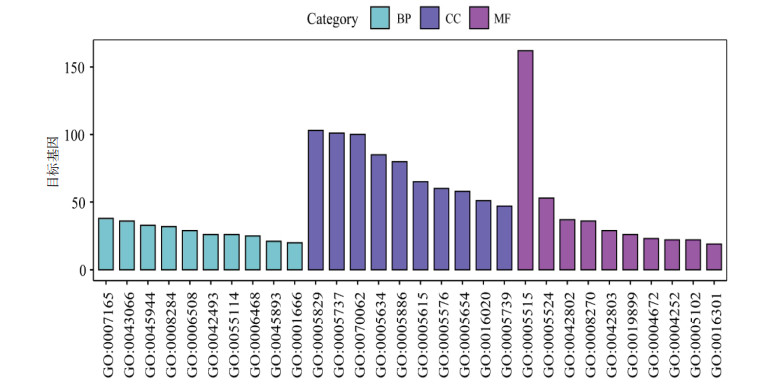
|
| 图 4 GO富集分析 Fig. 4 GO enrichment analysis |
运用R语言,对糖网明目颗粒的潜在作用靶点进行KEGG通路分析,以P≤0.05为筛选条件,得到163条生物通路,取前20条生物通路进行可视化分析(图 5),涉及糖尿病并发症中的晚期糖基化产物(AGE)-晚期糖基化终末产物受体(RAGE)信号通路、肿瘤坏死因子(TNF)信号通路、内分泌抵抗、FoxO信号通路、白细胞介素-17(IL-17)信号通路等。
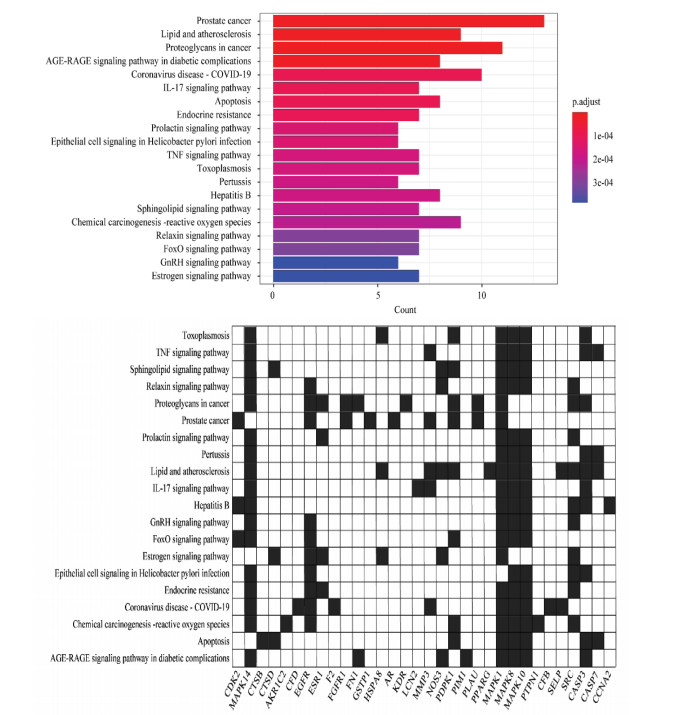
|
| 图 5 KEGG通路富集分析 Fig. 5 KEGG pathway enrichment analysis |
选取中药-活性成分-核心靶点网络中,度值>5的靶点作为受体,每味药中度值最高的活性成分作为配体,进行分子对接验证,结合自由能如表 3所示。普遍认为,Affinity>-4 kcal/mol,结合力极弱或认为无结合;-7 kcal/mol < Affinity≤ -4 kcal/mol,结合力中等;Affinity≤-7 kcal/mol,结合力较强。选取每个靶点与活性成分结合自由能最低的对接结果用PyMol进行可视化分析图见OSID码。结果显示靶点与活性成分之间均可以稳定结合,相互影响,表明糖网明目颗粒对DR多成分,多靶点的协同治疗作用。
糖网明目颗粒浓度在0.2~0.8 mg/mL范围对Y79细胞没有毒性。故选择0.2 mg/mL,0.4 mg/mL为糖网明目颗粒的细胞给药剂量。见图 6。
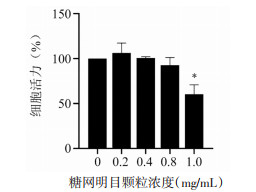
|
| 注:*P < 0.05。 图 6 糖网明目颗粒对Y79细胞活力的影响(n=3) Fig. 6 Impacts of Tangwang Mingmu Granules on the expression of EGFR and MAPK14 proteins (n=3) |
与NG组相比,HG组的EGFR、MAPK14蛋白表达水平明显增高(P<0.05),但给药组可显著降低EGFR、MAPK14蛋白表达水平。见图 7。
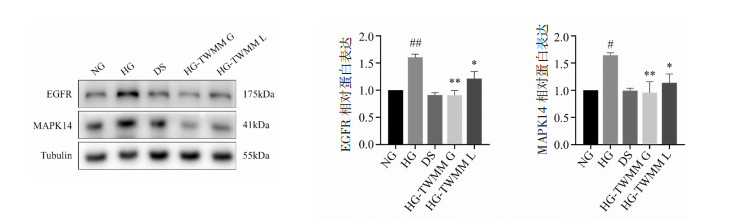
|
| 注:与NG组比较,#P<0.05,##P<0.01;与HG组比较,*P<0.05,**P<0.01。 图 7 糖网明目颗粒对EGFR和MAPK14蛋白表达的影响(n=3) Fig. 7 Impacts of Tangwang Mingmu Granules on the expression of EGFR and MAPK14 proteins(n=3) |
糖网明目颗粒中黄柏酮,7-O-甲基异鼠李糖醇,金合欢素,木犀草素,表儿茶素,花生四烯酸甲酯,花生四烯酸与PPI核心靶点具有良好的结合能力,提示其可能是治疗DR的关键成分。其中木犀草素可抑制VEGF诱导的血管生成,有助于抑制早产儿视网膜病变的发病[17-18]。表儿茶素显著减少高糖诱导的人视网膜上皮细胞ARPE-19细胞活性氧的产生,并减少细胞凋亡和炎症相关因素[19]。花生四烯酸的多种代谢产物被证实与DR期间的微血管功能障碍有关[20-21];黄柏酮可以调节细胞的增殖和凋亡[22]等。
骨形态发生蛋白2(BMP2)是PPI网络筛选出的核心靶点之一。研究表明,BMP2的水平在DR患者和DR小鼠视网膜中升高,破坏了内皮屏障功能,上调视网膜中VEGF水平,诱导内皮-白细胞黏附并上调炎症标志物和细胞因子,如细胞间黏附分子-1(ICAM-1)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)[23-24]。类固醇激素受体辅激活子(SRC)在细胞增殖,分化等细胞进程中发挥重要作用,可以直接与VE-钙黏蛋白结合,从而调节VE-钙黏蛋白酪氨酸磷酸化和内皮通透性[25]。纤维连接蛋白1(FN1)参与调节细胞黏附、迁移或肿瘤转移等,研究表明,纤维连接蛋白在视网膜血管化活动区中上调,并可能参与DR中病理性血管的生成[26-27]。
GO富集分析结果表明,糖网明目颗粒治疗DR机制主要涉及的关键生物过程包括凋亡过程的负调控,细胞增殖的正调控,RNA转录调控等,分子功能涉及蛋白质结合,受体结合,激酶活性等方面。KEGG富集分析说明,糖网明目颗粒的主要活性成分可能是通过介导AGE-RAGE信号通路、TNF信号通路、内分泌抵抗、FoxO信号通路、IL-17信号通路等途径来治疗DR。其中AGE-RAGE信号通路可激活蛋白激酶C(PKC)和MAPKs等多个细胞内信号通路,导致细胞核转录因子(NF-κB)激活,促进多种促炎细胞因子如白细胞介素-1(IL-1),IL-6和肿瘤坏死因子-α(TNF-α)的表达,可引起视网膜毛细血管细胞凋亡,血管通透性增加,破坏血-视网膜屏障,促进DR的发展[28-30]。研究显示,AGEs可以通过RAGE/Src/ERK信号通路发挥血管生成作用,激活的SRC参与引起内皮细胞存活和血管生成刺激的信号通路,表明SRC可能是预防和治疗AGEs相关微血管病变的合适靶点[31]。AGEs还可导致DR中的病理性血管生成,提示AGE是糖网明目颗粒治疗DR的靶点[32],此推测需要通过体内外研究进一步验证。
分子对接结果表明,糖网明目颗粒中木犀草素、金合欢素等活性成分与EGFR、BMP2、MAPK1、MAPK14等靶点具有良好的结合作用,能够与氨基酸形成较强的氢键相互作用。该结果进一步验证了网络药理学筛选结果,表明糖网明目颗粒治疗DR的主要作用机制在于木犀草素、金合欢素、表儿茶素等活性成分通过EGFR、BMP2、MAPK1、MAPK14等靶点对肿瘤坏死因子、FoxO等信号通路进行调控,从而参与DR的治疗过程。
上述结果在细胞模型中进行了验证。高糖环境刺激Y79细胞可增加EGFR、MAPK14蛋白表达,而糖网明目颗粒有效抑制了EGFR和MAPK14蛋白表达。MAPK14是MAP激酶信号转导途径的重要组成部分,MAPK信号通路与TNF信号通路相关联;EGFR则会激活下游的PI3激酶(PI3K)-丝氨酸/苏氨酸激酶(AKT)、转录活化因子(STATs)等模块[33],涉及到炎症反应、细胞增殖与凋亡、氧化应激等。该结果进一步验证了糖网明目颗粒治疗DR的作用机制。但是,本研究仅通过数据挖掘对糖网明目颗粒治疗DR的机制进行了预测以及简单验证,仍然存在局限性,尚需要进行基础实验深入研究。
4 结论本研究通过网络药理学和分子对接的方法筛选糖网明目颗粒中的有效成分和治疗DR的作用靶点,继而以细胞实验对所预测机制中的相关蛋白进行检验,结果表明糖网明目颗粒有效抑制了EGFR和MAPK14蛋白表达。推测糖网明目颗粒通过参与调节机体氧化应激,炎症反应,细胞增殖和凋亡等生物过程,达到对DR的治疗作用。本研究充分体现了糖网明目颗粒治疗DR具有多成分,多靶点,多途径协同发挥药效的特点,为糖网明目颗粒对DR的治疗及后续深入研发提供指导与依据。
| [1] |
DING J, WONG T Y. Current epidemiology of diabetic retinopathy and diabetic macular edema[J]. Current Diabetes Reports, 2012, 12(4): 346-354. DOI:10.1007/s11892-012-0283-6 |
| [2] |
LYU P L, YU J N, XU X Y, et al. Eriodictyol inhibits high glucose-induced oxidative stress and inflammation in retinal ganglial cells[J]. Journal of Cellular Biochemistry, 2019, 120(4): 5644-5651. DOI:10.1002/jcb.27848 |
| [3] |
TENCONI P E, BERMDEZ V, ORESTI G M, et al. High glucose-induced phospholipase D activity in retinal pigment epithelium cells: new insights into the molecular mechanisms of diabetic retinopathy[J]. Experimental Eye Research, 2019, 184: 243-257. DOI:10.1016/j.exer.2019.04.028 |
| [4] |
AI X P, YU P L, HOU Y, et al. A review of traditional Chinese medicine on treatment of diabetic retinopathy and involved mechanisms[J]. Biomedecine & Pharmacotherapie, 2020, 132: 110852. |
| [5] |
GARCIA-MEDINA J J, RUBIO-VELAZQUEZ E, FOULQUIE-MORENO E, et al. Update on the effects of antioxidants on diabetic retinopathy: in vitro experiments, animal studies and clinical trials[J]. Antioxidants (Basel, Switzerland), 2020, 9(6): E561. |
| [6] |
KHANANI A M, PATEL S S, FERRONE P J, et al. Efficacy of every four monthly and quarterly dosing of faricimab vs ranibizumab in neovascular age-related macular degeneration: the STAIRWAY phase 2 randomized clinical trial[J]. JAMA Ophthalmology, 2020, 138(9): 964-972. DOI:10.1001/jamaophthalmol.2020.2699 |
| [7] |
MANIADAKIS N, KONSTANTAKOPOULOU E. Cost effectiveness of treatments for diabetic retinopathy: a systematic literature review[J]. Pharmaco Economics, 2019, 37(8): 995-1010. DOI:10.1007/s40273-019-00800-w |
| [8] |
蒿长英, 陈明霞, 郭平, 等. 糖网明目颗粒对缺氧/高糖状态下血管内皮细胞相关因子表达的影响[J]. 中国药理学与毒理学杂志, 2015, 29(3): 404-410. HAO C Y, CHEN M X, GUO P, et al. Effect of Tangwang Mingmu Granules on expression of hypoxic/high glucose induced vascular endothelial cell-associated factors[J]. Chinese Journal of Pharmacology and Toxicology, 2015, 29(3): 404-410. |
| [9] |
栾兆倩. 密蒙花方抑制缺氧状态下人脐静脉内皮细胞增殖及其作用机制的实验研究[D]. 北京: 中国中医科学院, 2010. LUAN Z Q. Experimental study on the inhibition effect and the mechanism of mimeng flower decoction on the proliferation of human umbilical vein endothelial cells induced by chronic hypoxia in vitro[D]. Beijing: China Academy of Chinese Medical Sciences, 2010. |
| [10] |
严京, 高健生, 接传红, 等. 密蒙花方改善早期糖尿病视网膜病变中医症状及其用药安全性的研究[J]. 北京中医药大学学报, 2010, 33(11): 773-776. YAN J, GAO J S, JIE C H, et al. Effects of Mimenghua Formula on TCM symptoms of early diabetic retinopathy and safety[J]. Journal of Beijing University of Traditional Chinese Medicine, 2010, 33(11): 773-776. |
| [11] |
胡晓丹, 任芳, 南洋. 密蒙花方联合羟苯磺酸钙胶囊治疗非增殖期糖尿病视网膜病变疗效观察[J]. 现代中西医结合杂志, 2017, 26(18): 1945-1947, 1951. HU X D, REN F, NAN Y. Clinical observation on treating non proliferative diabetic retinopathy with Mimeng Flower prescription and calcium dobesilate capsules[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2017, 26(18): 1945-1947, 1951. |
| [12] |
蒿长英, 陈明霞, 郭平, 等. 糖网明目颗粒对糖尿病大鼠视网膜病变防治作用及机制研究[J]. 中国中医药信息杂志, 2015, 22(1): 62-66. HAO C Y, CHEN M X, GUO P, et al. Preventive and therapeutic effects and mechanism of Tangwang Mingmu Granule on rats with diabetic retinopathy[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2015, 22(1): 62-66. |
| [13] |
YANG X, WANG Y F, BYRNE R, et al. Concepts of artificial intelligence for computer-assisted drug discovery[J]. Chemical Reviews, 2019, 119(18): 10520-10594. DOI:10.1021/acs.chemrev.8b00728 |
| [14] |
ZHANG M X, YANG J W, ZHAO X L, et al. Network pharmacology and molecular docking study on the active ingredients of qidengmingmu capsule for the treatment of diabetic retinopathy[J]. Scientific Reports, 2021, 11: 7382. DOI:10.1038/s41598-021-86914-8 |
| [15] |
侯小涛, 郝二伟, 秦健峰, 等. 肉桂的化学成分、药理作用及质量标志物(Q-marker)的预测分析[J]. 中草药, 2018, 49(1): 20-34. HOU X T, HAO E W, QIN J F, et al. Chemical components and pharmacological action for cinnamomum cassia and predictive analysis on Q-marker[J]. Chinese Traditional and Herbal Drugs, 2018, 49(1): 20-34. |
| [16] |
杨释岑, 刘志强, 刘和波, 等. 利用网络药理学方法研究交泰丸治疗糖尿病的作用机制[J]. 中国药房, 2018, 29(19): 2656-2661. YANG S C, LIU Z Q, LIU H B, et al. Study on the mechanism of Jiaotai Pills in the treatment of diabetes by using network pharmacology[J]. China Pharmacy, 2018, 29(19): 2656-2661. DOI:10.6039/j.issn.1001-0408.2018.19.15 |
| [17] |
BAGLI E, STEFANIOTOU M, MORBIDELLI L, et al. Luteolin inhibits vascular endothelial growth factor-induced angiogenesis; inhibition of endothelial cell survival and proliferation by targeting phosphatidylinositol 3'-kinase activity[J]. Cancer Research, 2004, 64(21): 7936-7946. DOI:10.1158/0008-5472.CAN-03-3104 |
| [18] |
PARK S W, CHO C S, JUN H O, et al. Anti-angiogenic effect of luteolin on retinal neovascularization via blockade of reactive oxygen species production[J]. Investigative Ophthalmology & Visual Science, 2012, 53(12): 7718-7726. |
| [19] |
LIU S W, FANG Y, YU J C, et al. Hawthorn polyphenols reduce high glucose-induced inflammation and apoptosis in ARPE-19 cells by regulating miR-34a/SIRT1 to reduce acetylation[J]. Journal of Food Biochemistry, 2021, 45(2): e13623. |
| [20] |
ZHOU Y, KHAN H, XIAO J B, et al. Effects of arachidonic acid metabolites on cardiovascular health and disease[J]. International Journal of Molecular Sciences, 2021, 22(21): 12029. |
| [21] |
IBRAHIM A S, ELSHAFEY S, SELLAK H, et al. A lipidomic screen of hyperglycemia-treated HRECs links 12/15-Lipoxygenase to microvascular dysfunction during diabetic retinopathy via NADPH oxidase[J]. Journal of Lipid Research, 2015, 56(3): 599-611. |
| [22] |
KIM J, JAYAPRAKASHA G K, PATIL B S. Obacunone exhibits anti-proliferative and anti-aromatase activity in vitro by inhibiting the p38 MAPK signaling pathway in MCF-7 human breast adenocarcinoma cells[J]. Biochimie, 2014, 105: 36-44. |
| [23] |
HUSSEIN K A, CHOKSI K, AKEEL S, et al. Bone morphogenetic protein 2:a potential new player in the pathogenesis of diabetic retinopathy[J]. Experimental Eye Research, 2014, 125: 79-88. |
| [24] |
ELMASRY K, HABIB S, MOUSTAFA M, et al. Bone morphogenetic proteins and diabetic retinopathy[J]. Biomolecules, 2021, 11(4): 593. |
| [25] |
LI J N, XIE R T, JIANG F, et al. Tumor necrosis factor ligand-related molecule 1A maintains blood-retinal barrier via modulating SHP-1-Src-VE-cadherin signaling in diabetic retinopathy[J]. The FASEB Journal, 2021, 35(11): e22008. |
| [26] |
GRANT M B, CABALLERO S, BUSH D M, et al. Fibronectin fragments modulate human retinal capillary cell proliferation and migration[J]. Diabetes, 1998, 47(8): 1335-1340. |
| [27] |
CHEN S L, CHAKRABARTI R, KEATS E C, et al. Regulation of vascular endothelial growth factor expression by extra domain B segment of fibronectin in endothelial cells[J]. Investigative Ophthalmology & Visual Science, 2012, 53(13): 8333-8343. |
| [28] |
ABDELKADER N F, IBRAHIM S M, MOUSTAFA P E, et al. Inosine mitigated diabetic peripheral neuropathy via modulating GLO1/AGEs/RAGE/NF-κB/Nrf2 and TGF-β/PKC/TRPV1 signaling pathways[J]. Biomedecine & Pharmacotherapie, 2022, 145: 112395. |
| [29] |
YAMAZAKI Y, WAKE H, NISHINAKA T, et al. Involvement of multiple scavenger receptors in advanced glycation end product-induced vessel tube formation in endothelial cells[J]. Experimental Cell Research, 2021, 408(1): 112857. |
| [30] |
CHEN Y, CHEN Y H, TANG C H, et al. RPS4Y1 promotes high glucose-induced endothelial cell apoptosis and inflammation by activation of the p38 MAPK signaling[J]. Diabetes, Metabolic Syndrome and Obesity: targets and Therapy, 2021, 14: 4523-4534. |
| [31] |
LI P X, CHEN D S, CUI Y, et al. Src plays an important role in AGE-induced endothelial cell proliferation, migration, and tubulogenesis[J]. Frontiers in Physiology, 2018, 9: 765. |
| [32] |
XU J, CHEN L J, YU J, et al. Involvement of advanced glycation end products in the pathogenesis of diabetic retinopathy[J]. Cell Physiol Biochem, 2018, 48(2): 705-717. |
| [33] |
ZHANG Q H, SODERLAND D, STEINLE J J. TNFα inhibits IGFBP-3 through activation of p38α and casein kinase 2 in human retinal endothelial cells[J]. PLoS One, 2014, 9(7): e103578. |
2. State Key Laboratory of Component-Based Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40