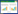文章信息
- 柴士伟, 高建, 厍立鹤, 于俏, 庞旭, 韩立峰
- CHAI Shiwei, GAO Jian, SHE Lihe, YU Qiao, PANG Xu, HAN Lifeng
- 反式和顺式二苯乙烯苷在大鼠体内的药代动力学比较研究
- Comparison of pharmacokinetic parameters of trans- and cis-2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside on rats
- 天津中医药, 2023, 40(1): 104-109
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 104-109
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.19
-
文章历史
- 收稿日期: 2022-09-08
2. 国家中医针灸临床医学研究中心, 天津 300193;
3. 天津市中药化学与分析重点实验室, 天津 301617
何首乌为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根,味苦,归肝、心和肾经[1]。现代研究表明,2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷(二苯乙烯苷,TSG)是何首乌的主要活性成分[2],中国药典在2000年将其作为何首乌的定量指标,一直沿用至今[3]。现代药理研究发现:该化合物具有抗炎[4-5]、抗衰老[6]、抗氧化[7]、抗动脉粥样硬化[8]、保肝[9-10]和抗肿瘤[11]等多种生物活性。由结构可知,TSG具有反式和顺式两种构型[12],反式二苯乙烯苷(trans-TSG)可以在光异构的作用下转变为顺式二苯乙烯苷(cis-TSG)。有文献报道cis-TSG可能是何首乌造成肝损伤的潜在毒性成分[13],而trans-TSG目前为止未见任何肝毒性报道。由于trans-/cis-TSG的结构可以相互转变,而体内安全性差异显著,因此它们是否会表现出不同的体内药代动力学行为,值得进一步研究。前期已有文献报道trans-/cis-TSG的药代动力学参数,但主要是以中药制剂和提取物为主[14-15],而这些制剂中的其他成分可能会对trans-/cis-TSG的体内药代动力学行为产生影响。因此,本实验以trans-/cis-TSG单体化合物为研究对象,建立了超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,考察了单次给药后,trans-/cis-TSG在大鼠体内的药代动力学行为,为后续何首乌致肝损伤物质基础及作用机制研究提供参考依据。
1 实验材料 1.1 实验动物12只雄性SD大鼠(200±20)g,购自北京维通利华生物科技股份有限公司,实验动物许可证号为SCXK(京)2016-0011,实验已通过天津中医药大学伦理委员会批准,伦理审批编号为TCM-LAEC2021151。
1.2 药品与试剂trans-TSG(纯度,HPLC面积归一化法:99.13%),cis-TSG(纯度,HPLC面积归一化法:100%)为实验室自制,虎杖苷(上海源叶生物科技有限公司,ZM0530LA14,HPLC≥98%)。色谱乙腈、色谱甲醇(Thermo Fisher Scientific,美国),色谱甲酸(Anaqua Chemicals Supply,美国)。
1.3 仪器Acquity H-Class UPLC超高效液相色谱系统和Xevo TQ-S质谱系统联用仪(Waters,美国);KQ-1000DE数控超声波清洗器(昆山市超声仪器有限公司);XW-80A型涡旋混合器(上海沪西分析仪器厂);微量移液器(Eppendorf,德国);Centrifuge冷冻台式高速离心机(Eppendorf,德国);BP121S型天平(Sartorius,德国);Millipore纯水器(Millipore,美国)。
2 实验方法 2.1 色谱条件色谱柱为ACQUITY UPLC BEH C18 Column(2.1 mm×50 mm,1.7 μm,Waters,美国)。乙腈(A)和0.1%甲酸水(B)作为流动相,梯度洗脱,0~8 min,5%~45% B。柱温设置为30 ℃,进样体积为3 μL,流速为0.3 mL/min。
2.2 质谱条件负离子模式下,仪器方法的毛细管电压、锥孔电压和去溶剂化温度分别设置为2.5 kV,30 V和650 ℃;氮气作为去溶剂气体,流速设置为800 L/h;多反应监测(MRM)模式和其他关键参数设置如表 1所示,基于Masslynx 4.1和TargetLynx软件,同时采集和分析大鼠血浆中trans-TSG和cis-TSG的定量信息。
12只大鼠随机分为两组,trans-TSG组和cis-TSG组,每组6只。严格按照天津中医药大学动物中心管理规范饲养,在室温(20±5)℃,相对湿度55%~65%,通风良好,环境安静,定期消毒的环境下适应性饲养一周,期间自由饮水和饮食。分别单次给药60 mg/kg的trans-TSG和cis-TSG [16],在给药后按照时间点:0,0.033,0.083,0.17,0.25,0.33,0.5,1,2,4,8,10,24 h,眼眶内眦取血,取至预先加入10 μL肝素钠(100单位)的1.5 mL离心管中,4 ℃离心10 min(6 600×g),取上层血浆于-80 ℃冰箱冷冻保存。
2.4 血浆样本的处理取出-80 ℃冰箱冷冻保存的大鼠血浆样品各100 μL,于4 ℃环境下解冻,分别加入600 μL冰甲醇和10 μL的内标溶液,涡旋震荡5 min,4 ℃下离心20 min(13 200×g),取出上清,氮吹干。加入100 μL 50%的甲醇水溶液复溶,涡旋震荡5 min,4 ℃下离心20 min(13 200×g),取出上清,待测。
2.5 对照品溶液的配制精确称量trans-TSG、cis-TSG和虎杖苷(内标)各1 mg分别溶解于1 mL的甲醇溶液中得1 mg/mL的溶液,然后用甲醇分别进行稀释得10 μg/mL的trans-TSG、cis-TSG和虎杖苷储备液。
2.6 统计学方法trans-TSG、cis-TSG的药代动力学参数使用DAS药代动力学软件(版本1.0,中国药理学会,中国)进行计算。将数据导入graphpad prism 8.0进行分析,计算结果使用均数±标准差(x±s)表示,组间比较采用独立样本t检验,相关分析采用线性相关与回归分析,P < 0.05为差异有统计学意义。
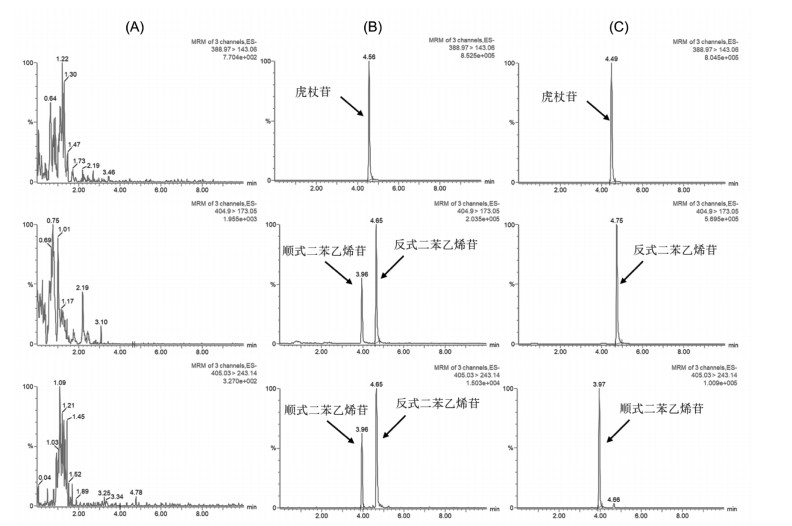
2.7 方法学考察 2.7.1 专属性按照“1.2.4血浆样本的处理”项下的实验方法对空白血浆(A)、空白血浆加入对照品溶液及内标溶液(B)和血浆样品加入内标溶液(C)进行分析。分别得到空白血浆色谱图、血浆对照品色谱图和血浆样品色谱图。
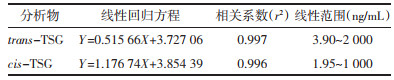
2.7.2 线性关系精密吸取适量浓度为10 μg/mL的trans-TSG、cis-TSG储备液,加入适量甲醇,cis-TSG分别稀释为3.90,7.81,15.62,31.25,62.5,125,250,500,1 000和2 000 ng/mL一系列对照品溶液;trans-TSG稀释浓度为1.95,3.90,7.81,15.62,31.25,62.5,125,250,500和1 000 ng/mL一系列对照品溶液。分别吸取上述对照品溶液100 μL,氮气吹干溶剂,加入100 μL空白血浆,按“1.2.4血浆样本的处理”项下操作,然后进样分析。纵坐标表示标准品峰面积与内标峰峰面积比值,横坐标表示标准品浓度,绘制回归曲线,计算得线性回归方程。
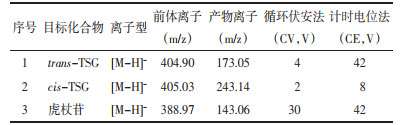
2.7.3 日内和日间精密度各取空白血浆100 μL按照“1.2.4血浆样本的处理”项下的制备方法,配制“表 3”中低、中、高3个浓度水平的混合标准品血浆样品。日内精密度即测定低、中、高3个浓度水平的混合标准品血浆样品,水平重复6次。日间精密度即连续3 d测定“日内精密度的样品”,根据随行标准曲线来确定浓度。计算相对标准偏差(RSD),并用测定浓度和已知浓度的百分比来评价准确度。
|
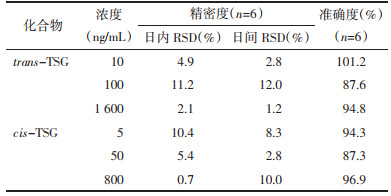
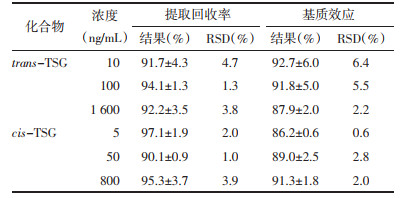
配制低、中、高质量浓度的trans-TSG(10、100和1600 ng/mL)和cis-TSG(5、50和800 ng/mL)的标准溶液,各取100 μL,平行6份,分别加入10 μL内标溶液和100 μL空白血浆,样品预处理后测定,所得峰面积结果记为A;另取同样份数的空白血浆,加入10 μL内标溶液,经样品前处理后测定,所得峰面积结果记为B;准备高、中、低3个浓度的标准溶液各100 μL,平行6份,分别加入10 μL内标溶液,氮吹干后,用100 μL 50%甲醇复溶,所得峰面积结果记为C。A/B×100%为提取回收率,A/C×100%为基质效应。
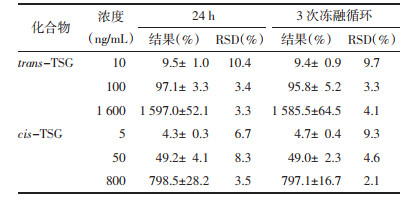
2.7.5 稳定性按照“1.2.4血浆样本的处理”项下制备方法,制备的低、中、高3个浓度水平的标准品血浆样品,分别考察其稳定性。稳定性评价包括样品盘内24 h稳定性、3次冻融循环稳定性。
3 结果 3.1 方法学验证 3.1.1 专属性空白血浆色谱图(A),血浆对照品色谱图(B),血浆样品色谱图(C),如图 1所示,结果表明样品色谱峰不受溶剂和内标的干扰,专属性良好。
|
| 注:A.空白血浆;B.空白血浆加入对照品溶液及内标溶液;C.血浆样品加入内标溶液。 图 1 MRM模式下大鼠血浆中目标化合物的专属性色谱图 Fig. 1 Specificity chromatogram of the target compounds in rat plasma with the MRM mode |
目标分析化合物的线性回归方程、相关系数和线性范围如表 2所示。结果表明,大鼠血浆中trans-TSG在3.90~2 000 ng/mL的范围内线性关系良好,cis-TSG在1.95~1 000 ng/mL的范围内线性关系良好。
3.1.3 精密度和准确度trans-TSG和cis-TSG的低、中、高3个浓度的日内精密度和日间精密度结果如表 3所示,RSD值均小于12%,准确度在87.3~101.2,表明所建方法的精密度和准确度良好。
3.1.4 提取回收率和基质效应实验结果如表 4所示,trans-TSG低、中、高3个浓度的平均回收率分别为91.7%、94.1%和92.2%;cis-TSG的低、中、高3个浓度的平均回收率分别为97.1%、90.1%和95.3%。两者的各个浓度的平均提取回收率均大于91%,且RSD均小于4.7%,表明trans-TSG和cis-TSG的回收率较高。
trans-TSG和cis-TSG在样品盘放置24 h后以及3次冻融循环之后进行处理的状态下,低、中、高3个浓度的测定结果如图表 5所示,显示出良好的稳定性。
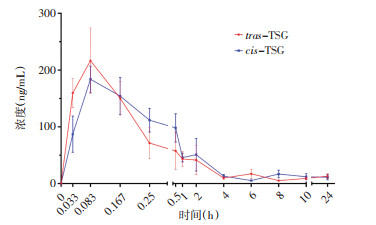
如图 2所示,大鼠单次灌胃60 mg/kg的trans-TSG和cis-TSG后,cis-TSG的血药浓度高于trans-TSG。
|
| 图 2 trans-TSG和cis-TSG的血药浓度-时间曲线 Fig. 2 Plasma concentration time curves of trans-TSG and cis-TSG |
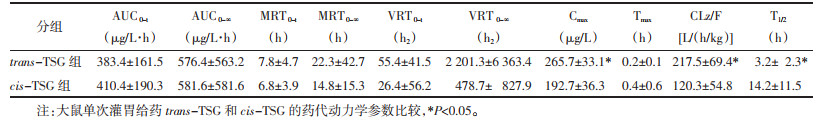
trans-TSG和cis-TSG药代动力学参数使用DAS药代动力学软件进行计算,符合一室模型,分析所得的药-时曲线如图 2所示,药代动力学参数如表 6所示,单次给药trans-TSG和cis-TSG后,cis-TSG在大鼠体内的AUC0-t、AUC0-∞和Tmax均大于trans-TSG,但无统计学差异。cis-TSG在大鼠体内的半衰期(T1/2)显著大于trans-TSG(P < 0.05)。而trans-TSG在大鼠体内的达峰浓度(Cmax)和清除率(CLz/F)则显著高于cis-TSG(P < 0.05)。
|
具有顺反结构的化合物,在一定条件下可以实现相互转化。顺反异构化过程及其机制,通常包括光异构化[17]、热致异构化[18]和催化异构化[19]。而何首乌中trans-TSG向cis-TSG的转化属于光致异构化。一般来说,对于热力学稳定的二苯乙烯类的反式结构,通过加热条件是难以实现构型转换,但在光照射下,反式异构体易转变为顺式异构体[20]。同时,二苯乙烯苷是多酚类化合物,意味着很容易发生氧化反应,因此二苯乙烯苷的降解除了可以通过光和热的条件而引发之外,氧气和碱性pH条件也应该格外注意[21]。因此,本研究在实验操作过程中全程避光,所配制的溶液也存放在低温避光环境,避免了trans-TSG和cis-TSG的相互转化。同时,由于trans-TSG和cis-TSG的质谱碎裂方式相同,因此,在提取离子流色谱图时,如果发生体内转化,将会同时出现trans-/cis-TSG的色谱峰,但在本研究中,未发现有转化现象(图 1C)。
单次灌胃给药相同剂量的trans-TSG和cis-TSG后,cis-TSG在大鼠的AUC 0-t大于trans-TSG,但未发现显著性差异(P > 0.05)。trans-TSG在大鼠体内的Cmax和CLz/F均显著高于cis-TSG(P < 0.05),同时cis-TSG在大鼠体内的达峰时间(Tmax)和半衰期(T1/2)均大于trans-TSG,其中T1/2约为trans-TSG的4.4倍,具有统计学差异(P < 0.05)。以上结果表明,cis-TSG在大鼠体内的暴露量高于trans-TSG,并且具有更低的清除率和较长的半衰期(P < 0.05),这表明cis-TSG在大鼠体内更容易出现蓄积,而有研究发现cis-TSG可能是何首乌中潜在的肝损伤风险成分[22],这是否与cis-TSG在体内的蓄积有关,值得进一步的研究。
综上所述,本研究建立了UPLC-MS/MS分析方法,研究比较了何首乌中trans-TSG和cis-TSG在大鼠体内的药代动力学行为,为后续trans-/cis-TSG的进一步研究提供参考依据。
| [1] |
国家药典委员会. 中华人民共和国药典: 2015年版. 一部[M]. 中国医药科技出版社, 2015, 175-176. National Pharmacopoeia Committee. Pharmacopoeia of the people's republic of China: 2015 edition, volume I[M]. Beijing: China Medical Science Press, 2015, 175-176. |
| [2] |
沈晓静, 张敢娟, 吕奇, 等. 何首乌化学成分及其药理活性的研究进展(英文)[J]. 热带亚热带植物学报, 2021, 29(4): 439-450. SHEN X J, ZHANG G J, LYU Q, et al. Advances in chemical constituents and pharmacological activities of pleuropterus multiflorus[J]. Journal of Tropical & Subtropical Botany, 2021, 29(4): 439-450. |
| [3] |
QIAN J, HOU M Q, WU X, et al. A review on the extraction, purification, detection, and pharmacological effects of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-d-glucoside from polygonum multiflorum[J]. Biomedecine & Pharmacotherapie, 2020, 124: 109923. |
| [4] |
WANG X M, ZHAO L B, HAN T Z, et al. Protective effects of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-beta-d-glucoside, an active component of polygonum multiflorum thunb, on experimental colitis in mice[J]. European Journal of Pharmacology, 2008, 578(2/3): 339-348. |
| [5] |
HE X L, LIU J Y, LONG G H, et al. 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside, a major bioactive component from polygoni multiflori radix (Heshouwu) suppresses DSS induced acute colitis in BALb/c mice by modulating gut microbiota[J]. Biomedecine & Pharmacotherapie, 2021, 137: 111420. |
| [6] |
YU Y, LANG X Y, LI X X, et al. 2, 3, 5, 4'-Tetrahydroxystilbene-2-O-β-d-glucoside attenuates MPP+/MPTP-induced neurotoxicity in vitro and in vivo by restoring the BDNF-TrkB and FGF2-Akt signaling axis and inhibition of apoptosis[J]. Food & Function, 2019, 10(9): 6009-6019. |
| [7] |
LI X X, YU Y, LANG X Y, et al. 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-d-glucoside restores BDNF-TrkB and FGF2-Akt signaling axis to attenuate stress-induced depression[J]. Neuroscience, 2020, 430: 25-33. DOI:10.1016/j.neuroscience.2020.01.025 |
| [8] |
YAO W J, FAN W J, HUANG C, et al. Proteomic analysis for anti-atherosclerotic effect of tetrahydroxystilbene glucoside in rats[J]. Biomedecine & Pharmacotherapie, 2013, 67(2): 140-145. |
| [9] |
YU W H, ZHAO J Z, LI W L, et al. 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-d-glucoside alleviated the acute hepatotoxicity and DNA damage in diethylnitrosamine-contaminated mice[J]. Life Sciences, 2020, 243: 117274. DOI:10.1016/j.lfs.2020.117274 |
| [10] |
WANG M J, ZHAO R H, WANG W G, et al. Lipid regulation effects of polygoni multiflori radix, its processed products and its major substances on steatosis human liver cell line LO2[J]. Journal of Ethnopharmacology, 2012, 139(1): 287-293. DOI:10.1016/j.jep.2011.11.022 |
| [11] |
ZHANG Y Z, SHEN J F, XU J Y, et al. Inhibitory effects of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-beta-D-glucoside on experimental inflammation and cyclooxygenase 2 activity[J]. Journal of Asian Natural Products Research, 2007, 9(3/4/5): 355-363. |
| [12] |
KIM H K, CHOI Y H, CHOI J S, et al. A new stilbene glucoside gallate from the roots of polygonum multiflorum[J]. Archives of Pharmacal Research, 2008, 31(10): 1225-1229. DOI:10.1007/s12272-001-2100-7 |
| [13] |
张乐, 柏兆方, 李春雨, 等. 制首乌中顺式二苯乙烯苷转化量与特异质肝损伤的相关性研究[J]. 药学学报, 2017, 52(7): 1041-1047. ZHANG L, BAI Z F, LI C Y, et al. Study on idiosyncratic liver injury and content of Cis-2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside in radix polygoni multiflori preparata[J]. Acta Pharmaceutica Sinica, 2017, 52(7): 1041-1047. |
| [14] |
LYU G Y, GU H, CHEN S H, et al. Pharmacokinetic profile of 2, 3, 5, 4'-tetrahydroxystilbene-2-O-β-D-glucoside in mice after oral administration of polygonum multiflorum extract[J]. Drug Development and Industrial Pharmacy, 2012, 38(2): 248-255. DOI:10.3109/03639045.2011.597763 |
| [15] |
WANG L L, SANG M M, LIU E W, et al. Rapid profiling and pharmacokinetic studies of major compounds in crude extract from polygonum multiflorumby UHPLC-Q-TOF-MS and UPLC-MS/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 140: 45-61. DOI:10.1016/j.jpba.2017.03.016 |
| [16] |
GAO Y, LI J T, LI X, et al. Tetrahydroxy stilbene glycoside attenuates acetaminophen-induced hepatotoxicity by UHPLC-Q-TOF/MS-based metabolomics and multivariate data analysis[J]. Journal of Cellular Physiology, 2021, 236(5): 3832-3862. DOI:10.1002/jcp.30127 |
| [17] |
霍春艳. 推拉式二苯乙烯衍生物的光异构化反应机理的研究[D]. 西安: 西北大学, 2017. HUO C Y. Theoretical study of the isomerization mechanism of push-pull P, P'-disubstituted stilbene derivatives[D]. Xi'an: Northwest University, 2017. |
| [18] |
冼啟志, 林劲冬, 周应芳, 等. 天然叶黄素转化的虾青素的热异构化研究[J]. 中国食品添加剂, 2019, 30(3): 87-93. XIAN Q Z, LIN J D, ZHOU Y F, et al. Study on thermal isomerization of astaxanthin transformed from natural lutein[J]. China Food Additives, 2019, 30(3): 87-93. |
| [19] |
聂小安, 夏建陵, 常侠. 光皮树油催化异构化反应产物结构分析[J]. 生物质化学工程, 2009, 43(2): 11-14. NIE X A, XIA J L, CHANG X. Structure-analysis of isomerized products of comus wilsoniana fruit oil[J]. Biomass Chemical Engineering, 2009, 43(2): 11-14. |
| [20] |
夏天, 孟庆华, 耿彦朝, 等. 二苯乙烯型分子的光化学行为及功能应用[J]. 染料与染色, 2007, 44(6): 37-42. XIA T, MENG Q H, GENG Y C, et al. Photochemistry and functional application of stilbene type molecules[J]. Dyestuffs and Coloration, 2007, 44(6): 37-42. |
| [21] |
BAUGH S, IGNELZI S. Hydrolysis and redox factors affecting analysis of common phenolic marker compounds in botanical extracts and finished products[J]. Journal of AOAC International, 2000, 83(5): 1135-1140. |
| [22] |
MENG Y K, LI C Y, LI R Y, et al. Cis-stilbene glucoside in polygonum multiflorum induces immunological idiosyncratic hepatotoxicity in LPS-treated rats by suppressing PPAR-Γ[J]. Acta Pharmacologica Sinica, 2017, 38(10): 1340-1352. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
3. Key Laboratory of Traditional Chinese Medicinal Chemistry and Analytical Chemistry of Tianjin, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40