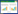文章信息
- 袁鑫怡, 曾淑欣, 杨润, 李羿
- YUAN Xinyi, ZENG Shuxin, YANG Run, LI Yi
- 基于网络药理学与分子对接的蒲公英抗乳腺癌的机制研究
- Network pharmacology and molecular docking-based research on the mechanism of dandelion against breast cancer
- 天津中医药, 2023, 40(1): 110-116
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 110-116
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.20
-
文章历史
- 收稿日期: 2022-10-12
中国每年女性乳腺癌发病率约7.7%,且病死率达8.12例/10万[1],目前已位列女性癌症发病率首位。乳腺癌受多基因多靶点控制,发病机制复杂且不明确,晚期可出现多器官病变,威胁患者的生命。乳腺癌的治疗手段多以放化疗和根治性手术治疗为主[2],治疗效果佳,但并发症较多,且现有的治疗乳腺癌的药物毒副作用大,容易产生耐受性。因此,亟待寻找新的乳腺癌治疗药物。
蒲公英为菊科植物蒲公英Taraxacum mongolicum Hand.Mazz、碱地蒲公英Taraxracum borealisinense Kitam或同属数种植物的干燥全草,含有黄酮类、多糖、萜类、酚类[3]等多种活性成分。现代研究表明,蒲公英黄酮通过调节基质金属蛋白酶(MMP)-2、MMP-9、基质金属蛋白酶组织抑制剂(TIMP)-1及TIMP-2的表达来抑制乳腺癌MCF-7细胞的迁移和侵袭能力[4];蒲公英多糖通过促进P53和Bax蛋白表达、抑制B淋巴细胞瘤-2(Bcl-2)蛋白表达来诱导乳腺癌细胞凋亡,抑制其增殖[5];蒲公英萜醇能够显著抑制T47D乳腺癌细胞增殖、迁移并可诱导其凋亡[6]。但这些研究多聚焦于单一或指标成分,而蒲公英抗乳腺癌的分子机制尚不明确,有待进一步深入研究。本研究拟利用网络药理学整体性、系统性与中药多成分、多靶点一致性的特点,预测蒲公英抗乳腺癌作用可能的作用靶点和作用通路,结合分子对接法验证其结果的可靠性,为蒲公英临床深入研究和资源开发提供参考。
1 材料与方法 1.1 蒲公英活性成分和靶点的收集在Batman-TCM数据库(http://bionet.ncpsb.org.cn/batman-tcm/)里以“TARAXACUM MONGOLICUM”为检索词,以“Scorecutoff>20,AdjustedP-value<0.05”为条件,获取蒲公英有效成分及其作用靶点信息,在TCMID数据库(http://47.100.169.139/tcmid/search/)以“PU GONG YING”为检索词筛选有效成分,在TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)以“OB(%)≥30,DL(%)≥0.18”为条件获取TCMID数据库中符合条件的蒲公英有效成分及其作用靶点信息。以CancerHSP数据库(https://old.tcmsp-e.com/CancerHSP.php)中的蒲公英有效成分及其靶点作为补充,检索词为“蒲公英”。
1.2 “有效成分-作用靶点”网络的构建将1.1中得到的蒲公英有效成分和作用靶点导入Cytoscape软件,构建“有效成分-作用靶点”网络。
1.3 乳腺癌靶点的收集及药物-疾病靶点的获取在GeneCards数据库(https://www.genecards.org/Search/Keyword?queryString=Breast%20Carcinoma)、OMIM数据库(https://omim.org/)、TTD数据库(db.idrblab.net/ttd/)和DisGeNET数据库(https://www.disgenet.org/home/)中以“Breast Carcinoma”为检索词收集乳腺癌相关靶点信息。在Malacards数据库(https://www.malacards.org)以“Breast Cancer”为检索词收集。在Pharmgkb数据库(https://www.pharmgkb.org)里没有“Breast Carcinoma”和“Breast Cancer”的信息,因此以“Carcinoma,ductal,breast”为检索词收集乳腺癌相关靶点信息。蒲公英有效成分作用靶点与乳腺癌疾病靶点通过venny2.1.1在线数据库(https://bioinfogp.cnb.csic.es/tools/venny/index.html)取交集,得到蒲公英抗乳腺癌的相关基因。
1.4 蛋白互作网络(PPI)的构建将1.3获得的交集靶点基因导入String数据库,物种选择“Homosapiens”,参数Interactionscore设定为0.40,保存结果并对原始数据进行处理,分别建立network文件和type文件。将network文件和type文件信息依次导入Cytoscape3.8.0软件绘制蛋白相互作用网络并进行参数设置和调整,运用CentiScaPe2.2计算得到Degree值、Betweenness值和Closeness值,在Excel中以“Degree>8.05,BetweennessunDir>40.00,ClosenessunDir>0.01”为条件筛选关键靶点,最终获得蛋白-蛋白相互作用网络和核心靶点网络。
1.5 GO和KEGG通路富集分析将1.4中得到的关键靶点导入DAVID数据库(https://david.ncifcrf.gov/),依次点击“Official-Gene-Symbol”和“GeneList”,物种选择“Homosapicns”。上传数据后进行KEGG通路富集分析,并从生物学过程BP(biologicalprocess)、细胞组分CC(cellularcomponent)、分子功能MF(molecularfunction)3个方面进行GO分析,P<0.05表示差异具有统计学意义。将数据导出至Excel处理后导入微生信网站(http://www.bioinformatics.com.cn/)作图得到GO分析柱状图和KEGG通路分析气泡图。
1.6 分子对接验证将PPI网络中度值排名靠前的靶点作为受体,以“有效成分-靶点”网络图中度值排名靠前的蒲公英活性成分作为配体,对两者进行结合能力预测,结合能数值越低表明结合能力越好。在uniprot数据库(https://www.uniprot.org/)输入关键靶点蛋白的基因名称,查找得到靶点蛋白的uniprot号;在RCSBPDB数据库(https://www.rcsb.org/)中输入靶点蛋白的uniprot号,找到相对应的靶点蛋白并下载其2D结构保存为pdb格式;导入pymol软件进行去水和去配体操作,通过AntoDock软件进行加氢处理并导出为pdbqt文件;通过PubChem下载蒲公英活性成分2D结构并保存为sdf格式,通过OpenBabel转换为pdb格式文件,利用AntoDock软件进行检测扭转键和中心等预处理并导出为pdbqt文件;将pdbqt格式的配体和受体文件导入AntoDock软件,并采用半柔性对接方法进行对接预测分析,分析结果通过Pymol进行可视化处理。
2 结果 2.1 蒲公英活性成分及其靶点在Batman-TCM数据库里得到蒲公英14种成分,其中6种没有靶点数据。在TCMSP数据库中筛选了72种活性成分,只有5种活性成分符合条件,其中4种成分没有目标信息,1种活性成分在CancerHSP数据库进行筛选后得到。最后,总共获得了10种活性成分,136个作用靶点,基本信息见表 1。
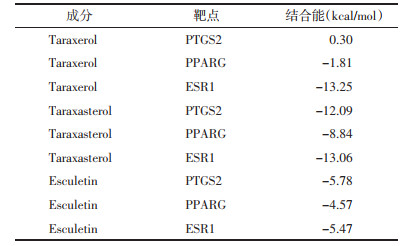
“有效成分-作用靶点”图如图 1所示,图中黄色代表药物,红色椭圆形代表作用靶点,绿色长方形代表有效成分,边代表成分与靶点之间的关系。
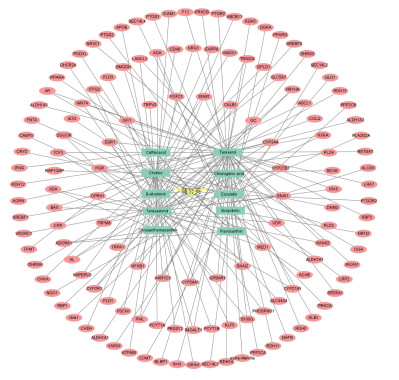
|
| 图 1 “有效成分-作用靶点”网络图 Fig. 1 Network diagram of"active ingredient-target of action" |
利用GeneCards、OMIM、TTD、DisGeNET、Pharmgkb、Malacards数据库筛选得到1 856个乳腺癌疾病靶点;最终通过韦恩数据库2.1.1得到蒲公英抗乳腺癌的41个可能作用靶点,详细信息见图 2,靶点蛋白信息见OSID。
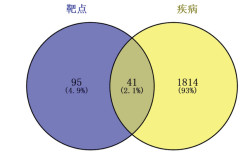
|
| 图 2 蒲公英活性成分靶点与乳腺癌相关靶点的韦恩图 Fig. 2 Wayne diagram of dandelion active ingredient target and breast cancer related target |
将获得的交集靶点基因导入String数据库,通过Cytoscape3.8.0软件对得到的数据进行可视化,绘制蛋白相互作用网络及核心靶点网络,见图 3和图 4。PPI网络中包含40个节点和161条边,颜色由深到浅表示节点的度值由大到小,节点由大到小表示节点的度值由大到小。经筛选得到重要的基因有ESR1、PPARG、PTGS2等。
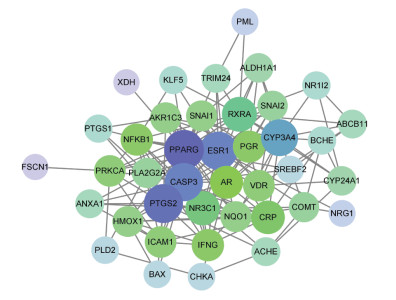
|
| 图 3 PPI网络 Fig. 3 PPI network |
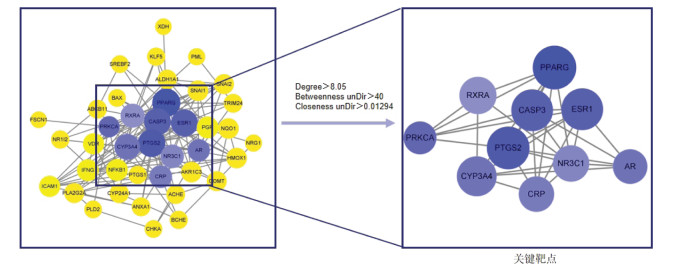
|
| 图 4 核心靶点网络 Fig. 4 Core target network |
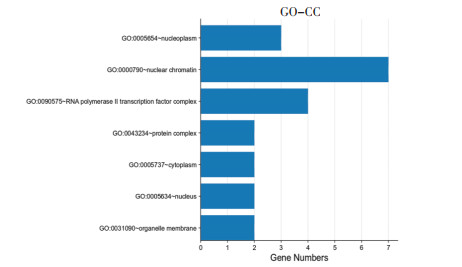
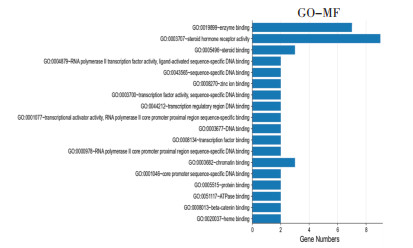
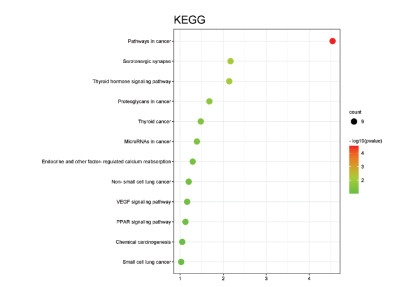
利用DAVID6.8数据库对2.4中得到的10个关键靶点进行GO功能富集分析和KEGG通路分析,从BP、CC、MF 3个方面进行GO分析,共得到53条GO分析结果,按照P值大小进行GO分析柱状图的绘制,见图 5、图 6和图 7,柱越高代表涉及此过程的基因数目越多。其中P<0.05的有47条GO分析结果,与BP有关的有RNA聚合酶Ⅱ启动子的转录起始过程、类固醇激素介导的信号通路、应对雌二醇RNA聚合酶Ⅱ启动子的转录正调控、过氧化物酶体增殖物激活受体信号通路、前列腺形态发生中分支的调节等;与CC相关的有核染色质、核浆、RNA聚合酶Ⅱ转录因子复合物、蛋白质复合体、细胞器膜等;与MF相关的有DNA结合、转录调控区DNA结合、序列特异性DNA结合、酶结合、类固醇激素受体活性等。KEGG分析共得到12条KEGG通路,按照P值大小进行KEGG通路分析气泡图的绘制,气泡颜色越深代表涉及此通路与疾病的相关性程度越高,见图 7。其中P<0.05的有6条KEGG通路,即癌症通路、含血清素的神经突触、甲状腺激素信号通路、癌症中的蛋白多糖、癌症中的微小RNA、甲状腺癌,主要涉及的靶点有AR、RXRA、CASP3、PRKCA、PPARG、PTGS2、CASP3、RXRA和ESR1。
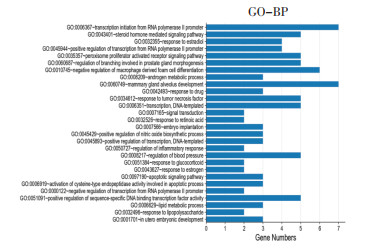
|
| 图 5 GO-BP柱状图 Fig. 5 GO-BP histogram |
|
| 图 6 GO-CC柱状图 Fig. 6 GO-CC histogram |
|
| 图 7 GO-MF柱状图 Fig. 7 GO-MF histogram |
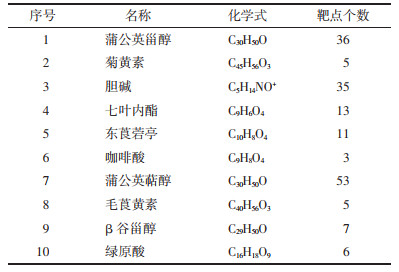
本研究将PPI网络中度值排名靠前的靶点PTGS2、PPARG、ESR1与“有效成分-靶点”网络图中度值排名靠前的蒲公英萜醇、蒲公英甾醇、七叶内酯进行结合能力预测,靶点蛋白作为受体,活性成分作为配体。一般认为,当受体与配体结合构象越稳定时,其能量越低,产生的相互作用型越大[7]。根据对接结果可知,除了Taraxerol和PTGS2的结合能大于零以外,其余成分和靶点的结合能都小于零,说明大部分成分和靶点都具有良好的结合活性。其中Taraxerol和ESR1的结合能最低,结合能力最好;Taraxasterol和PTGS2、PPARG、ESR1的结合能都较低,结合能力较好;Esculetin和PTGS2、PPARG、ESR1的结合能都较低,结合能力较好。上述成分与关键抗乳腺癌靶点最佳对接结构见图 8,全部对接结合能结果见表 2。
|
| 图 8 KEGG气泡图 Fig. 8 KEGG bubble diagram |
本研究通过网络药理学方法,构建蒲公英“成分-靶点”网络,通过多个数据库筛选到10种活性成分和137个作用靶点,其中与乳腺癌相关的靶点有41个,涉及ESR1、PPARG、PTGS2等10个关键靶点,揭示了蒲公英抗乳腺癌的物质基础及分子机制。分子对接结果显示,蒲公英与抗乳腺癌靶点结合能较低,说明其有良好的抗癌活性。
蒲公英发挥抗乳腺癌作用的有效成分可能是蒲公英萜醇、蒲公英甾醇和七叶内酯。研究表明,蒲公英萜醇通过诱导MCF-7细胞发生自噬,从而抑制细胞增殖,其机制可能与抑制mTOR信号通路有关[8];蒲公英甾醇在肿瘤发展的多个阶段均发挥了作用,包括抑制肿瘤发生、促进和诱导细胞分化,可以有效地抑制肿瘤细胞的侵袭和转移[9];七叶内酯诱导涉及细胞凋亡的细胞毒性,其机制可能与降低线粒体膜电位、促进细胞色素c的释放以及水解激活胱天蛋白酶-9/胱天蛋白酶-3的蛋白有关[10]。
为阐明蒲公英抗乳腺癌的机制,将PPI蛋白互作网络中筛选得到的10个关键靶点通过GO功能富集分析,发现蒲公英抗乳腺癌的BP涉及激素代谢过程、炎症反应的调节、转录过程和信号转导等;CC主要涉及对核浆、核染色质、蛋白质复合体和RNA聚合酶Ⅱ转录因子复合物的调控;MF主要涉及DNA结合、酶结合、类固醇结合和转录因子活性等。GO富集分析发现蒲公英抗乳腺癌的主要靶点有AR、RXRA、PPARG和ESR1。AR作为介导雄激素生物学效应的细胞内受体,可以通过丝裂原活化蛋白激酶信号通路参与乳腺的发育,同时能调节乳腺癌细胞的增殖[11];RXRA是配体依赖的核受体家族的重要成员,在炎症反应和代谢障碍中发挥重要作用,而乳腺癌特别是三阴型乳腺癌的发生发展始终伴随着炎症反应[12];PPARG可调节糖脂代谢、细胞分化、肿瘤细胞凋亡、炎症、肥胖等[13],研究发现PPARG激活可减弱肿瘤细胞的迁移和侵袭,诱导肿瘤细胞凋亡[14],PPARG作为抑癌基因在乳腺癌的肿瘤发生上起着关键作用,并且与乳腺癌患者总生存时间相关,研究表明PPARG可通过介导FABP4抑制乳腺癌的细胞生长、转移及侵犯[15];ESR1参与乳腺癌、子宫内膜癌和骨质疏松症在内的病理过程,它参与调控基因转录信号通路及乳腺癌等妇科肿瘤细胞的增殖。
通过KEGG通路富集分析,发现蒲公英抗乳腺癌的通路主要是癌症通路、癌症中的微小RNA通路和甲状腺激素信号通路等,涉及的主要靶点有CASP3、PRKCA和PTGS2。癌症中的微小RNA可以在各类肿瘤和肿瘤组织异常表达,参与肿瘤细胞增殖、迁移、侵袭、凋亡等[16];甲状腺激素可促进血管生成、抗细胞凋亡、抑制肿瘤细胞的生长和转移[17]。CASP3编码的蛋白质是半胱氨酸-天冬氨酸蛋白酶,在肿瘤细胞凋亡的执行阶段起着关键作用,通常被视作癌症治疗效果的标志物,研究发现肿瘤细胞利用凋亡过程产生有效的生长刺激信号,而活化的CASP3是细胞凋亡中的关键执行者,参与生长刺激[18]。PRKCA属于丝氨酸和苏氨酸特异性蛋白激酶家族,可能与肿瘤细胞过度增殖相关,它参与多种细胞信号传导途径,在许多不同的细胞过程中发挥作用,如细胞黏附、细胞转化、细胞周期检查点和细胞体积控制等;PTGS2是环氧合酶-2(COX-2)的编码基因,而COX-2是诱导型酶,可参与炎症反应、肿瘤细胞增殖和凋亡等多种病理过程[19],PTGS2通过在乳腺癌中的过表达促进血管再生、肿瘤细胞的增殖和侵袭,从而促进肿瘤的发生、发展和转移,Esculetin和PTGS2对接活性好,有效抑制了PTGS2的表达,可以预测为蒲公英治疗乳腺癌的可能作用靶点。
综上所述,本研究基于网络药理学和分子对接法初步阐述了蒲公英抗乳腺癌的作用机制,通过对具有多成分、多靶点特点的蒲公英与乳腺癌复杂网络关系的研究,阐述了蒲公英抗乳腺癌的有效成分、关键靶点、涉及的生物过程和通路,使“药物-靶点”网络可视化,为后续研究蒲公英抗乳腺癌提供了理论依据。
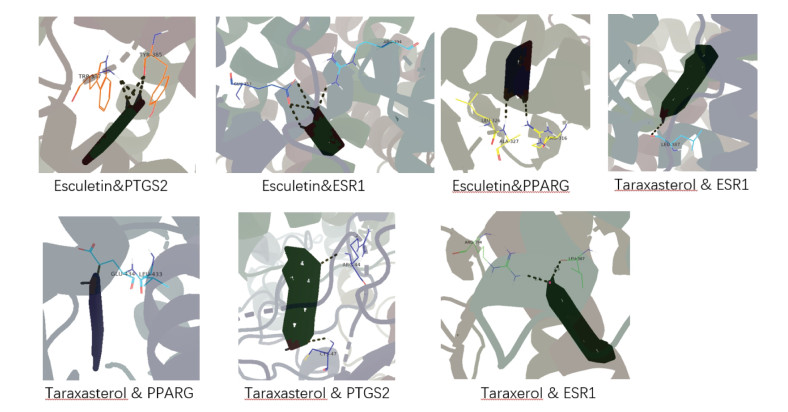
|
| 图 9 关键抗乳腺癌靶点和活性成分最佳对接图 Fig. 9 Optimal docking diagram of key anti breast cancer targets and active ingredients |
| [1] |
郑荣寿, 孙可欣, 张思维, 等. 2015年中国恶性肿瘤流行情况分析[J]. 中华肿瘤杂志, 2019(1): 19-28. ZHENG R S, SUN K X, ZHANG S W, et al. Report of cancer epidemiology in China, 2015[J]. Chinese Journal of Oncology, 2019(1): 19-28. |
| [2] |
王冬, 谈谣, 于海洋, 等. 中药多靶点抗乳腺癌的研究进展[J]. 中南药学, 2019, 17(10): 1600-1607. WANG D, TAN Y, YU H Y, et al. Research progress in traditional Chinese medicine multi-target treatment for breast cancer[J]. Central South Pharmacy, 2019, 17(10): 1600-1607. |
| [3] |
任汉书, 朱文卿, 郑媛媛, 等. 蒲公英的功能性成分及生物活性研究进展[J]. 食品与药品, 2022, 24(2): 193-201. REN H S, ZHU W Q, ZHENG Y Y, et al. Research progress on functional components and biological activities of taraxaci herba[J]. Food and Drug, 2022, 24(2): 193-201. |
| [4] |
史易暖. 蒲公英黄酮对乳腺癌MCF-7细胞迁移和侵袭能力的影响及相关的机制研究[D]. 西宁: 青海大学, 2021. SHI Y N. Effect of dandelion flavonoids on migration and invasion of MCF-7 cells and related mechanism[D]. Xining: Qinghai University, 2021. |
| [5] |
牛虎. 蒲公英多糖对乳腺癌细胞增殖和凋亡的影响[D]. 济南: 山东大学, 2017. NIU H. Effects of polysaccharide from T. mongolicum on proliferation and apoptosis of breast cancer cells[D]. Jinan: Shandong University, 2017. |
| [6] |
田苗苗, 刘扬, 修海楠, 等. 蒲公英提取物对SK-BR-3、T47D乳腺癌细胞增殖的影响[J]. 吉林中医药, 2020, 40(10): 1343-1347. TIAN M M, LIU Y, XIU H N, et al. Effect of dandelion extract on proliferation of SK-BR-3 and T47D breast cancer cells[J]. Jilin Journal of Chinese Medicine, 2020, 40(10): 1343-1347. |
| [7] |
赵志恒, 毕经会, 叶诗洁, 等. 基于网络药理学和分子对接探究黄芪-女贞子治疗免疫缺陷病的作用机制[J]. 食品工业科技, 2022, 43(3): 374-383. ZHAO Z H, BI J H, YE S J, et al. Mechanism of astragalus-ligustrum lucidum in the treatment of immunodeficiency diseases based on network pharmacology and molecular docking[J]. Science and Technology of Food Industry, 2022, 43(3): 374-383. |
| [8] |
朱坤, 丁米娜, 李月, 等. 蒲公英萜醇通过mTOR信号通路诱导乳腺癌细胞自噬[J]. 中国实验方剂学杂志, 2019, 25(21): 32-37. ZHU K, DING M N, LI Y, et al. Effect of taraxerol in inducing autophagy in breast cancer cells via mTOR signaling pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(21): 32-37. |
| [9] |
OVESNÁ Z, VACHÁLKOVÁ A, HORVÁTHOVÁ K. Taraxasterol and beta-sitosterol: new naturally compounds with chemoprotective/chemopreventive effects[J]. Neoplasma, 2004, 51(6): 407-414. |
| [10] |
CHANG H T, CHOU C T, LIN Y S, et al. Esculetin, a natural coumarin compound, evokes Ca2+ movement and activation of Ca2+-associated mitochondrial apoptotic pathways that involved cell cycle arrest in ZR-75-1 human breast cancer cells[J]. Tumour Biology: the Journal of the International Society for Oncodevelopmental Biology and Medicine, 2016, 37(4): 4665-4678. |
| [11] |
秦文华, 杨宝军, 张芳, 等. Twist1、PGM5、AR与乳腺癌病理分期及预后的关系[J]. 实用癌症杂志, 2021, 36(12): 2019-2022. QIN W H, YANG B J, ZHANG F, et al. Relationship of Twist1, PGM5 and AR with pathological stage and prognosis of breast cancer patients[J]. The Practical Journal of Cancer, 2021, 36(12): 2019-2022. |
| [12] |
尚策. 以核受体RXRα和ERα为靶点的硝基苯乙烯和占吨酮类化合物的合成与研究[D]. 厦门: 厦门大学, 2018: 1-135. SHANG C. Synthesis and research of nitrostyrene and xanthone compounds targeting nuclear receptors RXRα and ERα[D]. Xiamen: Xiamen University, 2018: 1-135. |
| [13] |
王静, 陈红, 孙晓, 等. 过氧化物酶体增殖物激活受体γ与相关疾病的研究进展[J]. 中国当代医药, 2019, 26(12): 30-32, 36. WANG J, CHEN H, SUN X, et al. Research advances in peroxisome proliferator-activated receptor γ and related diseases[J]. China Modern Medicine, 2019, 26(12): 30-32, 36. |
| [14] |
吴亚飞. PPARG通过负调控Six2影响肾透明细胞癌的增殖和凋亡[D]. 重庆: 重庆医科大学, 2019: 1-49. WU Y F. PPARG negatively modulates Six2 in tumor formation of clear cell renal cell carcinoma[D]. Chongqing: Chongqing Medical University, 2019: 1-49. |
| [15] |
杨宇钦. PPARG/FABP4信号通路介导乳腺癌增殖侵袭能力的体外研究[D]. 广州: 南方医科大学, 2020. YANG Y Q. In vitro study on proliferation and invasion of breast cancer mediated by PPARG/FABP4 signal pathway[D]. Guangzhou: Southern Medical University, 2020. |
| [16] |
马海忠, 王光学, 向振东, 等. 转化医学研究新热点: 微小RNA调控癌症[J]. 转化医学杂志, 2014, 3(5): 265-268, 305. MA H Z, WANG G X, XIANG Z D, et al. A new hotspot for translational medicine research: microRNA controlling tumorigenesis[J]. Translational Medicine Journal, 2014, 3(5): 265-268, 305. |
| [17] |
王浩华, 向光大. 甲状腺激素非经典核受体作用途径的研究进展[J]. 医学综述, 2012, 18(18): 2961-2964. WANG H H, XIANG G D. Progress in the study of non-classical nuclear receptor mediated mechanism of thyroid hormone[J]. Medical Recapitulate, 2012, 18(18): 2961-2964. |
| [18] |
CHENG J, TIAN L, MA J J, et al. Dying tumor cells stimulate proliferation of living tumor cells via caspase-dependent protein kinase Cδ activation in pancreatic ductal adenocarcinoma[J]. Molecular Oncology, 2015, 9(1): 105-114. |
| [19] |
AMBATI G G, JACHAK S M. Natural product inhibitors of cyclooxygenase (COX) enzyme: a review on current status and future perspectives[J]. Current Medicinal Chemistry, 2021, 28(10): 1877-1905. |
 2023, Vol. 40
2023, Vol. 40