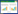文章信息
- 姜恒丽, 钟鑫, 王双双, 马向慧, 刘烨, 康亚娟, 黄馥, 张永和, 曹丽娟
- JIANG Hengli, ZHONG Xin, WANG Shuangshuang, MA Xianghui, LIU Ye, KANG Yajuan, HUANG Fu, ZHANG Yonghe, CAO Lijuan
- 经典名方泽泻汤基准样品HPLC特征指纹图谱分析研究
- HPLC characteristic fingerprint analysis and research of benchmark samples of famous classical prescription Zexie Decoction
- 天津中医药, 2023, 40(1): 117-125
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(1): 117-125
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.01.21
-
文章历史
- 收稿日期: 2022-10-28
2. 天津津村制药有限公司, 天津 300301
2008年国家食品药品监督管理局发布“关于印发中药注册管理补充规定的通知”,明确了“经典名方”的概念,是指目前仍广泛应用、疗效确切、具有明显特色与优势的清代及清代以前医籍所记载的方剂[1]。2018年国家中医药管理局官网公布包含泽泻汤在内的第一批100首古代经典名方目录[2]。泽泻汤始载于汉代张仲景的《金匮要略·痰饮咳嗽病脉证并治第十二》,原文载“心下有支引,其人苦冒眩,泽泻汤主之” [3],处方由泽泻、白术组成,方中泽泻气平,味甘、淡,利水渗湿,化浊降脂,引水湿从小便排出而治其标,为君药,白术苦、甘,健脾益气、利水消肿,助脾运化水湿,则痰饮不得生,而治其本,为臣药,两者相须为用,祛湿又健脾,具有利水除饮、健脾制水的功效[4],后代因袭不衰。据文献研究报道,从泽泻中分离出的化合物达200多个,三萜和倍半萜类化合物是泽泻的主要化学成分,其他还包括二萜类、含氮化合物、黄酮、糖类、脂肪烃及其衍生物、苯丙素等化合物。原萜烷型四环三萜类是泽泻中研究最多的特征性成分,根据生物途径,泽泻醇A、泽泻醇B、泽泻醇C等单体及其衍生物等均可通过23-乙酰泽泻醇B衍生获得[4-6]。相关药理研究显示,泽泻醇类成分如泽泻醇A、泽泻醇B、24-乙酰泽泻醇A、23-乙酰泽泻醇B等是泽泻发挥降血压、降血脂、利尿及抗炎等作用的主要成分[7]。白术的化学成分主要包括挥发油、多糖、内酯类、多种氨基酸和维生素等,其中重要的活性成分为白术内酯类,主要有白术内酯Ⅰ、Ⅱ、Ⅲ和双白术内酯等。现代研究显示,白术中的多种活性成分具有抗肿瘤、抗炎、改善胃肠功能、调节免疫等众多药理作用[8]。泽泻汤组方虽简,但临床疗效颇佳,中医临床主要用来医治水停心下,清阳不升,浊阴上犯,头目昏眩证,现代临床多用于治疗高血压、高血脂症、梅尼埃病、内耳性眩晕病等,经多年临床实践具有较好的临床效果[9-10]。
经典名方主要为复方制剂,由多种化学成分复杂的中药组成,在疾病治疗方面不同于以单一化合物为主的化学制剂,通过“多靶点、多成分”进行协同作用。有研究表明,泽泻汤包含多种药效成分,仅用单一的化学成分对其进行质量控制研究,不能准确地反映其有效性和安全性[11-12]。随着中药质控体系的不断完善,可以利用HPLC特征指纹图谱,该方法技术十分成熟、稳定、科学和可靠,是一种可以表征中药产品内在质量整体变化的评价手段,对全面控制中药产品质量具有十分关键的意义,现在经常被用于中药材、中药饮片及中药制剂的质量分析[13-15]。经典名方基准样品研发是制剂研发的关键组成部分,为研发制剂提供了基准参照,保证古今工艺制剂的质量一致性[16-18]。本研究采用高效液相色谱法建立18批泽泻汤基准样品的特征指纹图谱,以期为泽泻汤基准样品及复方制剂的质量评价提供科学依据和参考。
1 仪器与试药 1.1 仪器Agilent 1260 Series高效液相色谱仪、Agilent ZORBAX SB-Aq(250 mm×4.6 mm)色谱柱(美国安捷伦科技有限公司);LQ-C30002电子天平(上海瑶新电子科技有限公司);SKG便携式电陶炉(广东艾诗凯奇智能有限公司);全自动陶瓷壶(2 L,夏新科技有限责任公司);FDU1110型冷冻干燥机、PFR-100预备冻结槽(东京理化器械株式会社);1-14离心机(Sigma仪器有限公司);VORTEX 3000涡旋混合器(WIGGENS有限责任公司);XP205电子天平、PL403电子天平[梅特勒-托利多仪器(上海)有限公司];AS30600BDT超声波清洗器(AUTO SCIENCE有限责任公司)。
1.2 试剂与试药试剂:乙腈(色谱纯,德国默克股份有限公司);超纯水(制水机型号为Milli-Q Reference)。对照品:白术内酯Ⅰ(批号:111975-201501,纯度为99.9%),23-乙酰泽泻醇B(批号:111846-201705,纯度为99.7%)均购买于中国食品药品检定研究院;泽泻醇A(批号:B21638,纯度≥98%),泽泻醇B(批号:B21640,纯度≥98%)均购买于上海源叶生物科技有限责任公司。样品:18批次泽泻药材分别购于四川眉山、四川五通桥、湖北宜昌、湖北枝江4个产地,经盛实百草药业有限公司曹丽娟研究员鉴定为泽泻科植物泽泻Alisma plantago-aquatica Linn.的干燥块茎。18批次白术药材分别购于浙江磐安、安徽亳州、安徽谯城3个产地,经盛实百草药业有限公司曹丽娟研究员鉴定为菊科植物白术Astractylodes macrorephala Koide. 的干燥根茎。泽泻、白术对应饮片均按照2020年版《中国药典》(一部)各药材项下饮片的炮制要求加工。经检验均合格。18批泽泻汤基准样品原料泽泻和白术的批号和产地明细如表 1所示。

|
称取泽泻15 g,白术6 g,加水400 mL,加盖,浸泡30 min,以武火煮沸后,调节火力,保持微沸煎煮45 min,趁热用150目滤网过滤,滤液冷冻干燥,即得。
2.2 色谱条件色谱柱:Agilent ZORBAX SB-Aq C18(4.6 mm × 250 mm,5 μm);流动相:乙腈(A)和超纯水(B);梯度洗脱程序:0~5 min,35%~35%B;5~15 min,35%~55% B;15~30 min,55%~65% B;30~40 min,65%~75%B;40~47 min,75%~85%B。流速:1.0 mL/min;波长:208 nm;进样量:10 μL;柱温:30 ℃。理论塔板数按23-乙酰泽泻醇B峰计算不低于10 000。
2.3 溶液的制备 2.3.1 混合对照品溶液的制备精密称取泽泻醇A、白术内酯Ⅰ、泽泻醇B、23-乙酰泽泻醇B对照品适量,加甲醇配制成每1 mL含泽泻醇A、白术内酯Ⅰ、泽泻醇B、23-乙酰泽泻醇B分别为20、30、100和500 μg的混合对照品溶液。
2.3.2 供试品溶液的制备称取约1 g的泽泻汤基准样品粉末,进行精密称定,加10 mL水,称得质量,超声30 min,冷却至室温,称质量,用溶剂补足减失的质量,精密吸取5 mL,置于10 mL的容量瓶内,加乙腈定容至刻度,摇匀,离心(12 000 rpm,5 min,离心半径20 cm),取上清液,用0.22 μm微孔滤膜过滤,即得。
2.3.3 单味药材及饮片煎煮液的制备按组方用量分别称取泽泻和白术药材和饮片,按泽泻汤基准样品制法制备冻干粉末,按照“2.3.2”项下方法制备,所得供试品溶液即为单味药材和饮片溶液。
2.3.4 单味饮片阴性供试品溶液的制备按处方量称取缺泽泻、缺白术阴性处方,并按“2.1”项下泽泻汤基准样品制法制得相应的阴性冻干粉末,再按“2.3.2”项下方法制备,所得相应的单味饮片阴性供试品溶液。
2.4 方法学考察 2.4.1 精密度考察取同一份泽泻汤(S1号)供试品试液,按照“2.2”项下色谱方法连续进样6次,记录图谱数据。选取23-乙酰泽泻醇B(9号峰)作为参照,计算11个共有峰的相对保留时间和相对峰面积。各共有峰的相对保留时间的RSD值为0.08%,相对峰面积的RSD值为1.08%,结果显示仪器精密度符合要求。
2.4.2 稳定性考察取同一份泽泻汤(S1号)供试品试液,分别在0、2、4、6、8、12、24、32 h,按照“2.2”项下色谱条件进样1次检测,记录特征指纹图谱数据。选取23-乙酰泽泻醇B(9号峰)作为参照,计算11个共有峰的相对保留时间和相对峰面积。各共有峰的相对保留时间的RSD值为0.09%,相对峰面积的RSD值为1.77%,结果显示该样品在32 h内稳定性符合要求。
2.4.3 重复性考察称取6份泽泻汤基准样品(S1号),制备供试品试液,分别按照”2.2”项下色谱方法进样1次检测,记录特征指纹图谱数据。选取23-乙酰泽泻醇B(9号峰)作为参照,计算11个共有峰的相对保留时间和相对峰面积。各共有峰的相对保留时间的RSD值为0.03%,相对峰面积的RSD值为1.59%,结果显示该方法重复性符合要求。
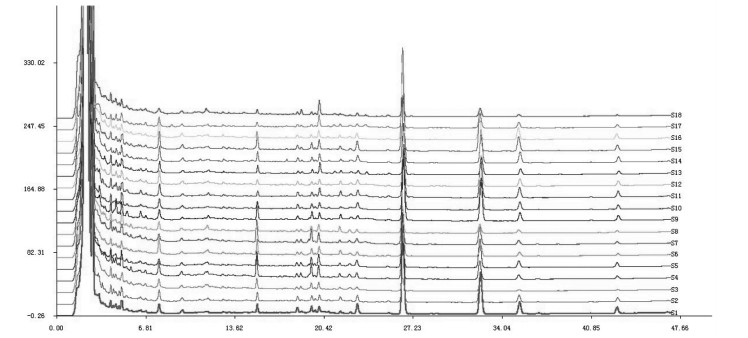
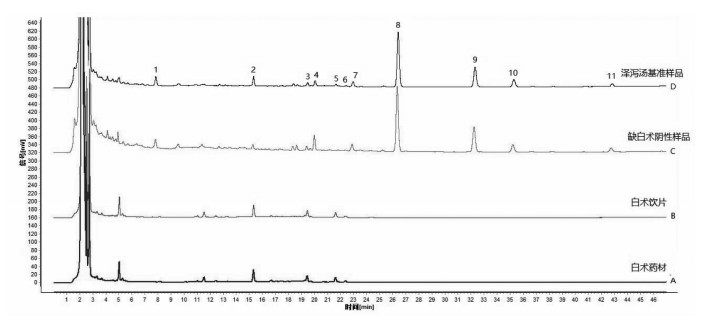
2.5 泽泻汤基准样品特征指纹图谱测定 2.5.1 特征指纹图谱建立取按“2.1”项下泽泻汤基准样品制备方法所得的18批样品,配置供试品试液,按“2.2”项下色谱条件进样分析,记录图谱数据。将数据导入国家药典委员会的《中药色谱指纹图谱相似度评价系统软件》(2012版),对18批泽泻汤基准样品图谱进行数据匹配,图谱见图 1。从图谱中可见其中11个峰为18批基准样品所共有,因此确定这11个色谱峰为各基准样品的共有峰,以平均值法确定共有模式,结果如图 2所示。
|
| 图 1 18批泽泻汤基准样品特征指纹图谱 Fig. 1 Characteristic fingerprint of 18 batches of Zexie Decoction benchmark samples |
|
| 图 2 泽泻汤基准样品特征图谱(共有模式图谱) Fig. 2 HPLC characteristic of benchmark samples of Zexie Decoction (mutual mode) |
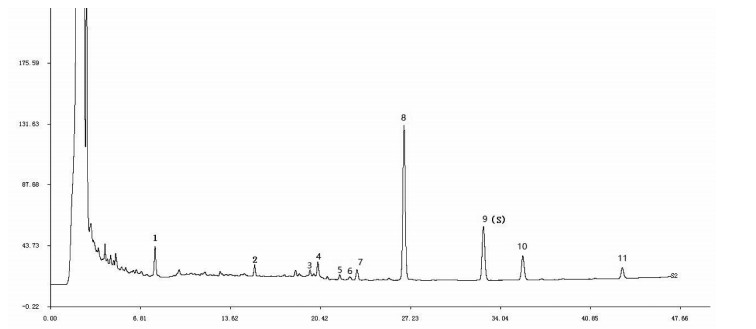
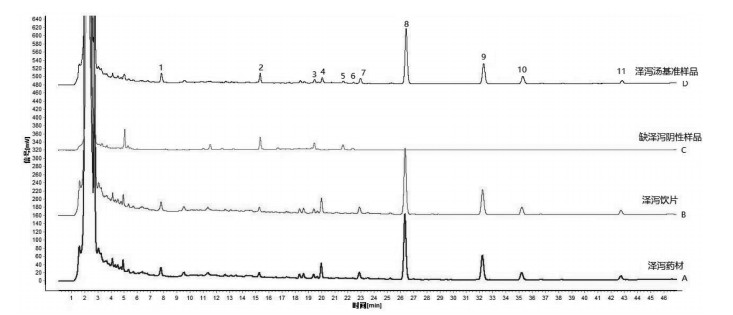
取“2.3”项下泽泻汤基准样品供试品试液、泽泻和白术单味药材及饮片溶液、单味饮片阴性溶液,按“2.2”项下色谱方法检测,获得各HPLC图谱,结果如图 3和图 4所示。通过对比相对保留时间,对泽泻汤基准样品进行色谱峰追溯,确定了峰1、峰4、峰7、峰8、峰9、峰10和峰11来自泽泻,峰5和峰6来自白术,峰2和峰3为泽泻和白术共有。
|
| 图 3 泽泻色谱峰归属比较图谱 Fig. 3 Chromatographic peak attribution comparison of alismatis rhizoma |
|
| 图 4 白术色谱峰归属比较图谱 Fig. 4 Chromatographic peak attribution comparison of atractylodis macrocephalae rhizoma |
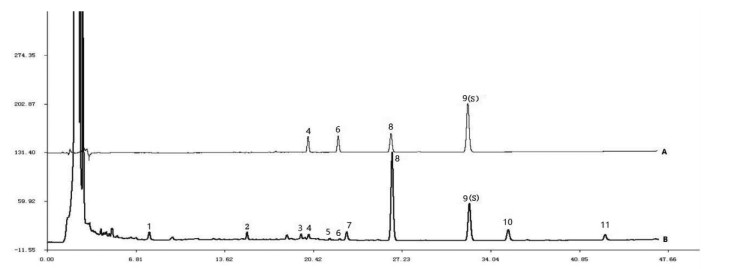
通过与混合对照品比较进行特征峰指认,分别精密吸取配置的混合对照品溶液和供试品溶液,按“2.2”项下色谱方法检测,记录图谱数据。见图 5。
|
| 注:4.泽泻醇A;6.白术内酯I;8.泽泻醇B;9. 23-乙酰泽泻醇B。 图 5 混合对照品(A)和基准样品(B)对比图谱 Fig. 5 Chromatographic peak comparison of mixed reference substance (A) and substance benchmarks sample (B) |
由图 5可见,确定4号峰为泽泻醇A,6号峰为白术内酯I,8号峰为泽泻醇B,9号峰为23-乙酰泽泻醇B。其中9号峰的23-乙酰泽泻醇B是君药泽泻的重要活性成分,根据供试品溶液的特征图谱可知,23-乙酰泽泻醇B为已知化学成分,化学性质稳定,并且其在各色谱峰中,具有较好的分离度且较大的峰面积,因此选取9号峰(23-乙酰泽泻醇B)作为基准样品特征图谱的参照峰。
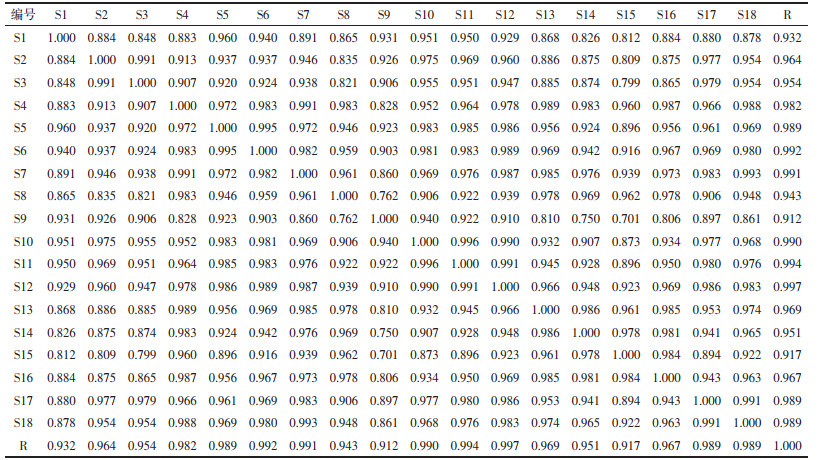
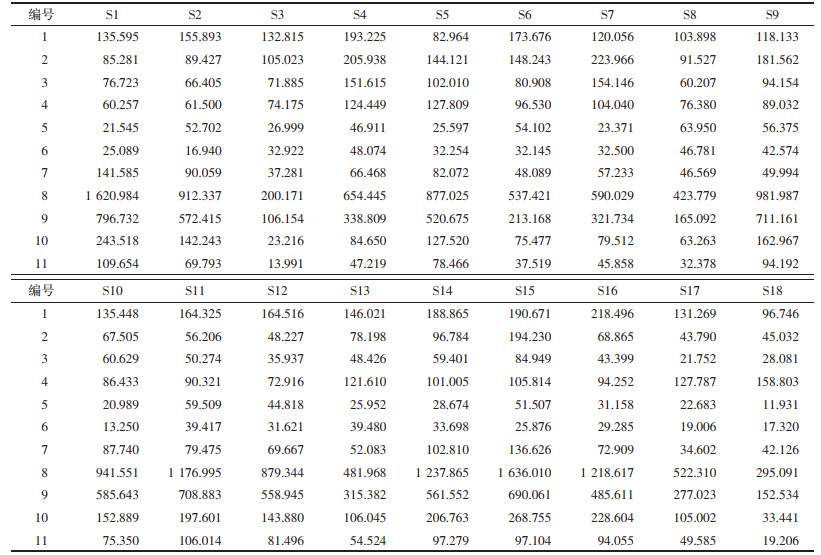
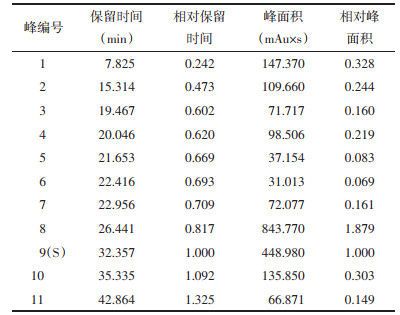
2.5.4 相似度评价和共有峰计算对“2.5.1”项下制得的18批泽泻汤基准样品的特征指纹图谱数据,导入国家药典委员会的《中药色谱指纹图谱相似度评价系统软件》(2012版)进行分析,将对照特征指纹图谱上标示的色谱峰作为匹配点,进行校正,并计算18批泽泻汤基准样品指纹图谱相似度及共有峰的峰面积,选取23-乙酰泽泻醇B峰(9号峰)的保留时间和峰面积为参照,计算11个特征峰的相对保留时间与相对峰面积,结果如表 2、表 3、表 4所示。
|
|
|
根据表 2相似度结果可知,18批泽泻汤基准样品的指纹图谱相似度在0.912~0.997,选取23-乙酰泽泻醇B对应峰(峰9)为S峰,计算各特征峰的相对保留时间,各相对保留时间应在要求值的±5%。具体要求值为:0.242(峰1)、0.473(峰2)、0.602(峰3)、0.620(峰4)、0.669(峰5)、0.693(峰6)、0.709(峰7)、0.817(峰8)、1.000(峰9)、1.092(峰10)、1.325(峰11)。
3 讨论 3.1 剂量考证泽泻汤原方记载“泽泻五两,白术二两。以水二升,煮取一升,分温再服”。《中国科学技术史·度量衡卷》记载,并通过实测汉代出土器具,得到西汉1斤厘定为250 g,新莽权1斤厘定为245 g,东汉1斤厘定为222 g,故东汉:1两=13.8 g[19]。但明代李时珍在《本草纲目》中就提出:“今古异制,古之一两,今用一钱可也。”清代汪昂《汤头歌诀》也遵李时珍之说,认为“大约古用一两,今用一钱足矣。”由于李时珍在中国医药界地位崇高,对古方剂量的主张对后世影响甚大,“古一两折今一钱”成了通例,为多数医家所沿用。现代医家李培生编著的《伤寒论讲义》,其在书中的古今剂量折算表中也提到东汉时代的1两折合为3 g。众多学者对张仲景用药的古今剂量折算关系进行了大量考证和核实[20-23],通过对古籍文献和历代度量衡演变考证,综合分析后,本研究按照汉代1两=3 g对处方剂量进行折算。
3.2 基准样品制备工艺 3.2.1 浸泡工艺古籍中对是否浸泡及时间并未明确说明,以泽泻汤出膏率为考察指标,发现浸泡30 min后泽泻汤样品出膏率为26.73%,高于未浸泡样品的出膏率23.96%。此外,浸泡30 min时药材饮片吸水达到饱和,且吸水量与煎煮后的药渣吸水量接近,所以确定浸泡时间为30 min。
3.2.2 煎煮工艺关于加热设备,对比了全自动陶瓷壶加热盘和可调功率电陶炉,后者煎煮时间适中,制备的泽泻汤的出膏率为18.93%,高于前者16.42%,且电陶炉受热均匀,控温准确,火候易掌控,所以确定可调功率电陶炉为制备物质基准的加热设备。目前市面上的煎煮容器多数为陶瓷材质的煎药壶,选择2 L陶瓷壶作为泽泻汤物质基准的制备容器,壶身壁的平均厚度为5 mm,其加水量为400 mL,液面高度为2.2 cm,符合《医疗机构中药煎药室管理规范》中规定的2~5 cm液面高度。
现代由于加热方式的改变,根据加水量和煎煮时间的长短,通过调节加热功率以达到同古代文武火基本一致的煎药效果。以出膏率为指标,对泽泻汤进行不同功率的煎煮考察发现,400 W煎煮的出膏率最高为26.21%,且煎煮时间适中,所以选择400 W作为泽泻汤物质基准的制备功率。此外,不加盖煎煮时水量蒸发快,煎煮时间短,但对应出膏率较低,故确定煎煮时进行加盖煎煮。
3.2.3 过滤工艺通过对滤过方式、滤过材质、滤过目数对泽泻汤出膏率的影响进行考察,发现常压滤过出膏率较高,同时结合仪器可操作性及设备利用度,选择滤网常压滤过作为制备泽泻汤物质基准的滤过方式。在采用4层纱布、100目滤布和100目滤网滤过的结果中,100目滤网出膏率相对较高,所以选择滤网作为制备泽泻汤物质基准滤过材质。同时考察100、150和200目滤网对出膏率的影响,150目滤网出膏率相对较高,所以最终选择150目作为制备泽泻汤物质基准的滤过目数。
3.2.4 干燥工艺中药提取液的成分和性质复杂,常用的干燥方式为减压浓缩真空干燥和冷冻干燥。传统的干燥会引起材料皱缩,破坏细胞,而冷冻干燥过程中样品的结构不会被破坏,可以保持物料原化学组成和物理性质,除长期保存的稳定性以外,还保留了其固有的生物活性与结构,故选择冷冻干燥。
通过对泽泻汤制备过程中的一系列影响因素进行考察筛选,并制备3批泽泻汤对该工艺进行验证,结果表明该方法制备的泽泻汤基准样品质量稳定,因此确定泽泻汤基准样品的制备工艺,通过对18批泽泻和白术饮片进行随机组合,制备了18批泽泻汤基准样品冻干粉。
3.3 色谱条件筛选泽泻汤中成分主要有君药泽泻中的倍半萜类、三萜类,白术中的挥发油、内酯类成分,本研究采用DAD检测器对样品进行全波长扫描,同时对200、208、220 nm波长下的色谱图进行比较发现,当波长在208 nm时,色谱图中呈现的色谱峰数量最多,各指标成分色谱峰的吸收强度很平均,且分离度较好,因此,最终选用208 nm波长为检测波长。
分别比较Agilent ZORBAX SB-Aq(250 mm× 4.6 mm,5 μm),ZORBAX Eclipse Plus(250 mm×4.6 mm,5 μm),COSMOSIL C18-MS-II I(250 mm×4.6 mm,5 μm)3个型号的色谱柱,结果显示,使用Agilent ZORBAX SB-Aq色谱柱时,各色谱峰呈现了较好的分离度,且特征峰很明显,各峰形良好,因此选择Agilent ZORBAX SB-Aq色谱柱作为HPLC特征指纹图谱的色谱柱。
选用Agilent ZORBAX SB-Aq色谱柱,对不同柱温条件(20、30和40 ℃)进行比较和筛选,结果显示,在柱温30 ℃条件下,各色谱峰具有较好的分离度,不易受干扰因素影响。所以,最终选择柱温30 ℃作为HPLC特征指纹图谱的最佳柱温条件。
以乙腈-水为流动相,考察了4个不同梯度洗脱条件下的色谱峰数目和各色谱峰分离情况,选出最佳梯度洗脱条件。考察了不同提取溶剂对泽泻汤样品的影响,筛选了纯化水溶解、乙腈提取和50%乙腈提取法,结果发现,50%乙腈提取法样品在色谱条件下色谱峰数目较多,且各色谱峰紫外吸收和分离度良好,因此最终选择50%乙腈提取法为最佳前处理法。
3.4 测定结果分析本研究采用HPLC法建立了18批泽泻汤基准样品的特征指纹图谱,相似度在0.912~0.997,共标定11个共有色谱峰,确定了峰1、峰4、峰7、峰8、峰9、峰10和峰11来自君药泽泻,峰5和峰6来自臣药白术,峰2和峰3为泽泻和白术共有。指认了4个特征峰,其中4号峰为泽泻醇A,6号峰为白术内酯I,8号峰为泽泻醇B,9号峰为23-乙酰泽泻醇B。选取23-乙酰泽泻醇B对应峰(峰9)为S峰,计算各特征峰的相对保留时间,各相对保留时间应在要求值的±5%。具体要求值为:0.242(峰1)、0.473(峰2)、0.602(峰3)、0.620(峰4)、0.669(峰5)、0.693(峰6)、0.709(峰7)、0.817(峰8)、1.000(峰9)、1.092(峰10)、1.325(峰11)。
本研究通过建立泽泻汤基准样品的HPLC特征指纹图谱,为泽泻汤基准样品关键化学属性的质量评价奠定了良好的基础,同时对泽泻汤复方制剂的质量评价和标准建立提供基准参照和控制依据。
| [1] |
国家药品监督管理局. 关于印发中药注册管理补充规定的通知[EB/OL]. (2008-01-07)[2022-03-05]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20080107120001991.html. National Medical Products Administration. Notice on the issuance of supplementary provisions on the registration administration of traditional Chinese medicine[EB/OL]. (2008-01-07)[2022-03-05]. https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjyp/20080107120001991.html. |
| [2] |
国家中医药管理局. 关于发布《古代经典名方目录(第一批)》的通知[EB/OL]. (2018-04-16)[2022-05-08]. http://www.satcm.gov.cn/kejisi/zhengcewenjian/2018-04-16/7107.html. National Administration of Traditional Chinese Medicine. Notice on the publication of the catalogue of famous ancient classics (the First Batch)[EB/OL]. (2018-04-16)[2022-05-08]. http://www.satcm.gov.cn/kejisi/zhengcewenjian/2018-04-16/7107.html. |
| [3] |
张仲景. 金匮要略[M]. 北京: 人民卫生出版社, 1963. ZHANG Z J. Synopsis of golden chamber[M]. Beijing: People's Medical Publishing House, 1963. |
| [4] |
严林, 李新健, 张冰冰, 等. 泽泻汤的研究现状[J]. 中国实验方剂学杂志, 2021, 27(16): 191-197. YAN L, LI X J, ZHANG B B, et al. Research status of Zexie Decoction[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(16): 191-197. |
| [5] |
刘珊珊, 郭杰, 李宗艾, 等. 泽泻化学成分及药理作用研究进展[J]. 中国中药杂志, 2020, 45(7): 1578-1595. LIU S S, GUO J, LI Z A, et al. Advances in studies on chemical compositions of alismatis rhizoma and their biological activities[J]. China Journal of Chinese Materia Medica, 2020, 45(7): 1578-1595. |
| [6] |
张维君, 韩东卫, 李冀. 泽泻的化学成分及药理作用研究进展[J]. 中医药学报, 2021, 49(12): 98-102. ZHANG W J, HAN D W, LI J. Advances in chemical compositions and pharmacological effects of alismatis rhizoma[J]. Acta Chinese Medicine and Pharmacology, 2021, 49(12): 98-102. |
| [7] |
程志红, 萧伟, 王振中, 等. 泽泻调血脂活性成分及其药理和临床应用研究进展[J]. 中草药, 2015, 46(22): 3420-3426. CHENG Z H, XIAO W, WANG Z Z, et al. Research progress on hypolipidemic constituents in alismatis rhizoma and their pharmacology and clinical application[J]. Chinese Traditional and Herbal Drugs, 2015, 46(22): 3420-3426. |
| [8] |
谭丽盈, 胡国辉. UPLC-MS/MS同时测定经典名方泽泻汤中6个成分的含量[J]. 中国现代中药, 2022(4): 696-700. TAN L Y, HU G H. Simultaneous determination of six components in classical herbal prescription Zexie Decoction by UPLC-MS/MS[J]. Modern Chinese Medicine, 2022(4): 696-700. |
| [9] |
陈与丰, 陈建新, 王雅蕾, 等. 泽泻汤治疗梅尼埃病作用机制的网络药理学探讨[J]. 世界中医药, 2021, 16(7): 1060-1066, 1073. CHEN Y F, CHEN J X, WANG Y L, et al. Network pharmacological study on the mechanism of Zexie Decoction in the treatment of meniere disease[J]. World Chinese Medicine, 2021, 16(7): 1060-1066, 1073. |
| [10] |
谢小晓. 泽泻汤联合手法复位治疗良性阵发性位置性眩晕137例[J]. 医学理论与实践, 2016, 29(7): 885-886. XIE X X. Treatment of 137 cases of benign paroxysmal positional vertigo with Zexie Decoction combined with manual reduction[J]. The Journal of Medical Theory and Practice, 2016, 29(7): 885-886. |
| [11] |
唐文强, 高艳蓉, 杨长花, 等. 经典名方泽泻汤UPLC指纹图谱的建立[J]. 中国现代应用药学, 2021, 38(6): 680-687. TANG W Q, GAO Y R, YANG C H, et al. Establishment of UPLC fingerprint of Zexie Decoction which is a classical herbal formula[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(6): 680-687. |
| [12] |
管咏梅, 万鑫浩, 吴文婷, 等. 经典名方桂枝加葛根汤标准汤剂HPLC指纹图谱研究[J]. 中草药, 2021, 52(18): 5535-5542. GUAN Y M, WAN X H, WU W T, et al. HPLC fingerprint of classic prescription Guizhi Jia Gegen Decoction[J]. Chinese Traditional and Herbal Drugs, 2021, 52(18): 5535-5542. |
| [13] |
刘东方, 赵丽娜, 李银峰, 等. 中药指纹图谱技术的研究进展及应用[J]. 中草药, 2016, 47(22): 4085-4094. LIU D F, ZHAO L N, LI Y F, et al. Research progress and application in fingerprint technology on Chinese materia medica[J]. Chinese Traditional and Herbal Drugs, 2016, 47(22): 4085-4094. |
| [14] |
施崇精, 李希, 冯建安, 等. 古代经典名方济川煎物质基准HPLC特征指纹图谱研究[J]. 中草药, 2020, 51(15): 3930-3936. SHI C J, LI X, FENG J A, et al. Study on HPLC characteristic fingerprint of substance benchmark of classical famous prescription of Jichuan Decoction[J]. Chinese Traditional and Herbal Drugs, 2020, 51(15): 3930-3936. |
| [15] |
孟岩, 李焐仪, 单家明, 等. 经典名方小承气汤物质基准的HPLC指纹图谱分析[J]. 中国实验方剂学杂志, 2021, 27(4): 130-136. MENG Y, LI W Y, SHAN J M, et al. HPLC fingerprint analysis of substance benchmark of Xiaochengqi Decoction[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(4): 130-136. |
| [16] |
刘艳, 章军, 陈士林, 等. 经典名方复方制剂研发策略[J]. 中国实验方剂学杂志, 2019, 25(24): 166-172. LIU Y, ZHANG J, CHEN S L, et al. Research and development strategy of classical formula compound preparation[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(24): 166-172. |
| [17] |
代云桃, 靳如娜, 吴治丽, 等. 基于标准汤剂(物质基准)的经典名方制备工艺和质量标准研究[J]. 中国实验方剂学杂志, 2020, 26(2): 164-174. DAI Y T, JIN R N, WU Z L, et al. Research strategies for quality standards of famous classical formula based on standard decoction (material reference)[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(2): 164-174. |
| [18] |
刘艳, 章军, 杨林勇, 等. 经典名方物质基准研制策略及关键问题分析[J]. 中国实验方剂学杂志, 2020, 26(1): 1-9. LIU Y, ZHANG J, YANG L Y, et al. Research strategies and key problems analysis over substance benchmark of famous classical formulas[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(1): 1-9. |
| [19] |
卢嘉锡, 丘光明, 邱隆, 等. 中国科学技术史: 度量衡卷[M]. 北京: 科学出版社, 2001. LU J X, QIU G M, QIU L, et al. Science and civilization in China: weights and measures volume[M]. Beijing: Science Press, 2001. |
| [20] |
郭明章. 仲景方用药剂量古今折算及配伍比例的研究[D]. 北京: 北京中医药大学, 2009. GUO M Z. Study on ancient and modern conversion of dosage and compatibility ratio of Zhongjing Formula[D]. Beijing: Beijing University of Chinese Medicine, 2009. |
| [21] |
程先宽. 《伤寒杂病论》方剂剂量折算标准研究[D]. 北京: 北京中医药大学, 2006. CHENG X K. Comparative study on criterion of dosage convert of prescriptions of treatise on febrile and miscellaneous diseases[D]. Beijing: Beijing University of Chinese Medicine, 2006. |
| [22] |
杜茂波. 《伤寒论》药物剂量问题探讨[J]. 中国中药杂志, 2019, 44(22): 5012-5016. DU M B. Discussion on drug dosage in treatise on febrile diseases[J]. China Journal of Chinese Materia Medica, 2019, 44(22): 5012-5016. |
| [23] |
刘乐环, 周跃华. 源自汉代经典名方的已上市中成药及日本汉方药与古代医籍剂量对比分析[J]. 中国现代中药, 2021, 23(1): 5-11. LIU L H, ZHOU Y H. Comparative analysis on drug dosage of listed Chinese patent medicines, Japanese kampo medicines and ancient medical records derived from classical prescriptions of Han dynasty[J]. Modern Chinese Medicine, 2021, 23(1): 5-11. |
2. Tianjin Tsumura Pharmaceuticals Co., Ltd., Tianjin 300301, China
 2023, Vol. 40
2023, Vol. 40