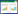文章信息
- 李贺, 姬寒蕊, 杜雅薇, 等.
- LI He, JI Hanrui, DU Yawei, et al.
- 化痰散结法对ApoE-/-小鼠血脂及动脉粥样硬化的影响
- Effect of the method of resolving phlegm and dispersing stasis on blood lipids and atherosclerosis in ApoE-/- mice
- 天津中医药, 2023, 40(10): 1313-1319
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(10): 1313-1319
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.10.15
-
文章历史
- 收稿日期: 2023-05-28
2. 北京中医药大学东直门医院, 北京 100700
动脉粥样硬化(AS)是一种慢性多因素血管性疾病,是心脑血管疾病的重要病理基础[1]。颈动脉粥样硬化与冠状动脉粥样硬化分别是AS在颈动脉和冠状动脉的体现,与缺血性脑卒中、急性冠脉综合征的风险和严重程度直接相关[1-3],大幅增加了居民病死率,已成为影响居民身体健康的主要因素,消退AS斑块对维护居民的健康和减轻社会医疗负担具有重要意义。高脂血症是AS的主要危险因素,降低低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)是改善AS,预防心脑血管疾病并发症的关键手段[4-5]。中药有着多靶点、副作用小的优势,或能成为改善AS的重要替代或补充方案。内消软脉汤2号是在课题组“脉生痰核”理论[6-7]指导下,以化痰散结为主要治法,选用大量的化痰散结药化裁而来的自拟方剂,内消软脉汤2号在临床上治疗颈动脉粥样硬化及高脂血症获得了良好疗效。前期实用性随机对照试验发现,该方可使颈动脉横切斑块厚度平均下降11.48%[8],但其内在机制尚不明确。故研究以内消软脉汤2号为基础治疗方案,通过建立ApoE-/-小鼠的AS模型,探究内消软脉汤2号对AS、高脂血症的改善效果,并初步探究其作用机制。
1 材料及方法 1.1 动物6周龄雄性ApoE-/-小鼠30只,基因背景为C57BL/6J,由北京华阜康生物科技股份有限公司提供,动物许可证号:SCXK(京)2020-0004。实验动物饲养于北京中医药大学东直门医院SPF级标准化实验动物室,环境温度为22 ℃,相对湿度45%~55%,12 h光照与12 h黑夜循环,动物自由进食水。
1.2 药剂与试剂内消软脉汤2号颗粒剂组成:灵芝30 g、玄参15 g、丹参15 g、黄连9 g、浙贝母9 g、生牡蛎9 g、当归9 g、制乳香9 g、制没药9 g,本次实验所需颗粒剂由东直门医院颗粒剂药房全成分提取制作。磷酸盐缓冲液粉末(pH 7.3,中杉金桥公司);4%多聚甲醛溶液(东都凯源有限公司);中性快干胶;油红O染液;蛋白酶抑制剂;二奎啉甲酸(BCA)蛋白定量试剂盒;丙烯酰胺;三羟基氨基甲烷Tris碱;甘氨酸;1 mol/L Tris-HCl(pH 7.4)缓冲液;1.5 mol/L Tris- HCl(pH 8.8)缓冲液;1 mol/L Tris-HCl(pH 6.8)缓冲液;吐温-20;SDS;过硫酸铵(普利莱公司);TEMED(Sigma公司);预染蛋白Maker(普利莱公司);丽春红染色液(普利莱公司);硝酸纤维素膜(NC膜)(普利莱公司);封闭专用脱脂奶粉(普利莱公司);蛋白免疫印迹法(Western Blot)专用杂交袋(普利莱公司);发光液(碧云天公司);EASYBIO易杰膜(易杰公司);GADPH抗体(Abcam公司);解偶联蛋白1(UCP1)抗体(Abcam公司);LDLR抗体(Abcam公司);戊巴比妥钠(北京东都凯源生物科技有限公司)。
1.3 实验仪器动物恒温饲养箱(北京福意联公司);制冰机(型号:MV600,Scotsman公司);多功能酶标仪(BIO-RAD公司);光学显微镜(Olympus BX60,Olympus公司);-20 ℃冰箱(德国Siemens公司);精密电子称(JA1003N,上海精密科学仪器有限公司);电泳槽及电泳仪(北京六一仪器厂);塑料薄膜封口机(SF-200/250型,温州市兴业机械设备有限公司);低温离心机[5424/5424R(FA-45-24-11,Eppendorf公司]。
1.4 模型制备、分组和干预30只ApoE-/-小鼠常温适应性饲养1周后,随机将小鼠平均分为3组,每组10只,分别为对照组、内消软脉汤2号低剂量组、高剂量组。每组均给予高脂饮食(配方:21%脂肪+0.15%胆固醇,购买于北京华阜康生物科技股份有限公司)喂养16周,以建立AS模型[9]。各组在造模之初分别给予蒸馏水灌胃、内消软脉汤2号低剂量[2.1 g/(kg·d)]灌胃、内消软脉汤2号高剂量[4.2 g/(kg·d)]灌胃,以蒸馏水灌胃组作为对照,干预16周后取材,取材前禁食水12 h。干预期间各组小鼠继续接受高脂饮食(HFD)喂养。鉴于环境温度对脂解作用有明显影响,本研究将采用环境动物饲养箱,全程控制并恒定饲养温度。
实验中所有动物饲养条件以及动物实验操作均严格遵守北京中医药大学东直门医院重点学科实验室动物实验伦理委员会制定的制度规定。
1.5 观察指标及方法 1.5.1 主动脉AS斑块采用油红O染色及改良Movat五色套染的方法进行观察。小鼠在处死前保持空腹8 h。使用生理盐水配制好6.7 mg/mL的戊巴比妥钠,以0.01 mL/g小鼠体重的剂量进行腹腔注射,待麻醉成功后进行手术处理,自心脏开始,小心地将主动脉于脊柱进行剥离,将小鼠主动脉与心脏一起取下,放于4%的多聚甲醛固定液中加以固定。根据油红O染液试剂盒说明书步骤进行整根动脉染色。在主动脉根部切下大约5 mm的长度并将其与心脏组织分离并置于石蜡组织的包埋盒中,通过自动脱水石蜡组织制作仪、石蜡切片器进行血管的石蜡切片制备,后按照改良Movat五色套染的试剂盒说明书进行染色。
1.5.2 血脂4项采用摘眼球取血法采集小鼠血液,室温静置1 h,4 ℃、3 000 r/min离心10 min,离心半径8.4 cm,收集上层血清。每只小鼠取200~300 μL血清,采用生化法检测TG、LDL-C、HDL-C及总胆固醇(TC)。
1.5.3 肝脏脂肪变性程度采用油红O染色的方法进行观察。取小鼠新鲜肝脏置于软塑瓶盖中,并添加适当的OCT包埋剂,之后再把小盒慢慢地放入液态氮里,当组织结冰成小块状,将已结冰的组织置入恒冷箱切片机中进行冷冻切片制备。按照油红O染液试剂盒说明书步骤进行染色。
1.5.4 肩胛脂肪组织活化情况采用苏木素-伊红(HE)染色的方法进行观察。将小鼠肩胛脂肪组织取出,置于石蜡组织的包埋盒中,通过自动脱水石蜡组织制作仪、石蜡切片器进行血管的石蜡切片制备,进行HE染色。
1.5.5 组织病理学图片采集通过对各样品的病理染色,得到了血管斑块区域的切片、肝脏切片、脂肪组织切片等。采用高倍显微镜对切片进行拍照,在每张切片上观察到多个区域后,确定最接近平均水平的区域进行拍照并保存图像,各个图像的全部参数都经过均一化处理。
1.5.6 肩胛脂肪组织UCP1及肝脏低密度脂蛋白受体(LDLR)的表达采用Western Blot法检测小鼠肩胛脂肪组织UCP1及LDLR的表达。将组织蛋白裂解液加入各组小鼠的肝脏及肩胛脂肪组织中,快速研磨,置冰上20 min,然后置于4 ℃低温离心机中、12 000 r/min离心10 min,离心半径8.4 cm,取上清,采用BCA法测定组织蛋白含量后加上样缓冲液,置于沸水中煮5 min;分别取40 μg蛋白量的组织总蛋白样品上样,80 V浓缩胶电泳,100 V分离胶电泳;采用半干电转移仪进行蛋白质的电转移,恒流30 mA,90 min,5%TBS-T脱脂奶粉封闭1 h,用UCP1和LDLR一抗稀释后孵育过夜(UCP1抗体稀释倍数:1∶500;LDLR抗体稀释倍数:1∶500),二抗稀释后孵育1 h(稀释倍数:1∶5 000),洗膜后加入ECL混合液中5 min温育,置于X光片盒中;将已曝光的胶片放入显影液中显影,直至出现清晰影像,再将胶片放入定影液中定影,清水冲洗,晾干保存,扫描。采用Image-Pro Plus 6. 0软件对扫描图像的目的条带进行灰度分析。
1.6 统计学方法应用SPSS 24.0统计学软件系统对相关数据进行录入并进行分析。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
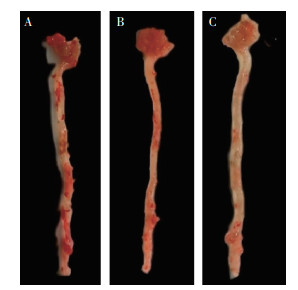
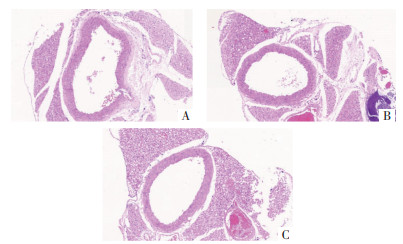
2 结果 2.1 内消软脉汤2号对ApoE-/-小鼠AS的影响为探究内消软脉汤2号是否可以改善ApoE-/-小鼠的AS,本研究通过油红O染色的方法对小鼠整个主动脉进行观察,同时通过改良Movat五色套染的方法对小鼠主动脉根部进行观察。结果表明,与高脂饮食+蒸馏水对照组(HFD组)比较,内消软脉汤2号低剂量组及高剂量组小鼠整个主动脉斑块改善,见图 1、图 2、图 3。
|
| 注:油红O染色可使脂质成分呈现为红色,图中红色即为动脉斑块。A.HFD组,B.内消软脉汤2号低剂量组,C.内消软脉汤2号高剂量组。 图 1 各组小鼠主动脉的油红O染色结果 Fig. 1 Oil Red O staining results of mouse aorta in each group |
|
| 注:A.HFD组;B.内消软脉汤2号低剂量组;C.内消软脉汤2号高剂量组。 图 2 各组小鼠的主动脉HE染色(×50) Fig. 2 HE staining of the aorta in each group of mice(×50) |
|
| 注:A.HFD组;B.内消软脉汤2号低剂量组;C.内消软脉汤2号高剂 图 3 各组小鼠的主动脉改良Movat五色套染(×50) Fig. 3 Modified Movat five color staining of the aorta in each group of mice(×50) |
为探究内消软脉汤2号是否可以改善ApoE-/-小鼠的高脂血症,研究通过生化法对小鼠血中LDL-C、TC、TG、HDL-C的水平进行检测。与HFD组相比,内消软脉汤2号低剂量组的血清LDL下降31.61%(P < 0.05)、TC下降23.9%(P < 0.05),差异均有统计学意义,见图 4。综合来看,内消软脉汤2号具有降低LDL-C及TC的功效。
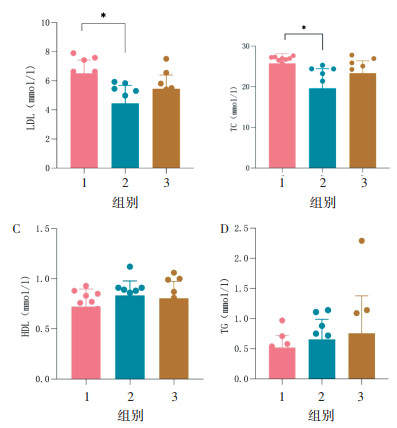
|
| 注:1. HFD组;2. HFD+内消软脉汤2号低剂量组;3. HFD+内消软脉汤2号高剂量组。与HFD组比较,*P<0.05。 图 4 各组小鼠的血脂4项水平(x±s,n=10) Fig. 4 Four levels of blood lipids in each group of mice(x±s, n=10) |
为探究内消软脉汤2号是否可以改善ApoE-/-小鼠的肝脂肪变性,研究通过油红O染色观察小鼠肝脏。结果表明,与对照组比较,内消软脉汤2号低剂量组及高剂量组小鼠肝脏脂滴明显减少,提示内消软脉汤2号具有改善小鼠肝脂肪变性的功效,见图 5。
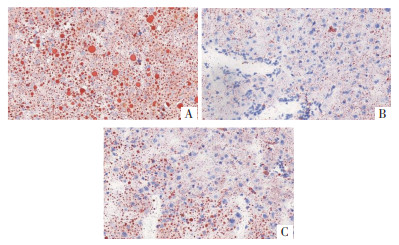
|
| 注:A.HFD组;B.内消软脉汤2号低剂量组;C.内消软脉汤2号高剂量组。 图 5 各组小鼠的肝脏油红O染色(×200) Fig. 5 Liver oil red O staining of mice in each group(×200) |
为探究内消软脉汤2号是否可以激活ApoE-/-小鼠的肩胛脂肪组织,研究通过HE染色观察小鼠肩胛处的脂肪组织。结果表明,HFD组小鼠的脂肪细胞表现较为饱满、体积较大、单房结构脂滴染色较浅。与之形成对比的是,低剂量组及高剂量组脂肪细胞体积较小、多房室结构脂泡分隔增多,HE染色变深,细胞核着色增多,其中以低剂量组改变最为明显。提示服用内消软脉汤2号后,小鼠肩胛脂肪组织可被活化,见图 6。
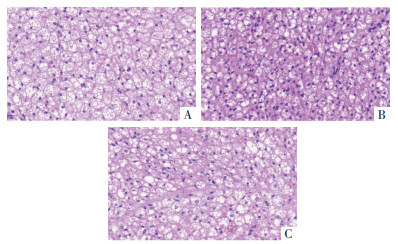
|
| 注:A.HFD组;B.内消软脉汤2号低剂量组;C.内消软脉汤2号高剂量组。 图 6 各组小鼠的肩胛脂肪组织HE染色(×200) Fig. 6 HE staining of scapular adipose tissue in each group of mice(×200) |
由于脂肪组织活化是脂肪分解的重要途径,UCP1表达的升高是体内棕色脂肪组织活化的重要标志,研究通过Western blot的方法探究内消软脉汤2号对肩胛棕色脂肪组织表达的影响。结果表明,与HFD组比较,内消软脉汤2号低剂量及高剂量组肩胛脂肪组织UCP1的表达水平显升高(P < 0.05),其中高剂量组升高(P < 0.01)最为显著,差异均具有统计学意义,见图 7。
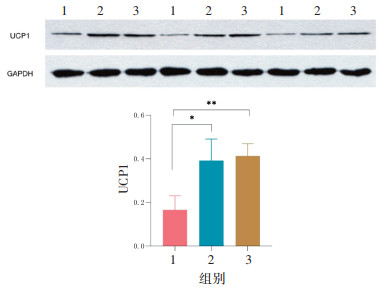
|
| 注:1. HFD组;2. HFD+内消软脉汤2号低剂量组;3. HFD+内消软脉汤2号高剂量组。与HFD组比较,*P<0.05,**P<0.01。 图 7 内消软脉汤2号对肩胛脂肪组织UCP1表达的影响(x±s,n=3) Fig. 7 Effect of Neixiao Ruanmai Decoction No.2 on the expression of UCP1 in scapular adipose tissue(x±s, n=3) |
内消软脉汤2号具有降低LDL-C的效果,由于肝脏中LDLR是促进体内LDL-C代谢的关键蛋白,是LDL-C内源性清除的关键途径,故本研究通过Western Blot的方法探究内消软脉汤2号对肝脏LDLR表达的影响。结果表明,与HFD组比较,内消软脉汤2号低剂量及高剂量组肝脏LDLR的表达水平均升高(P < 0.05),其中低剂量组升高显著(P < 0.01),差异均具有统计学意义,见图 8。
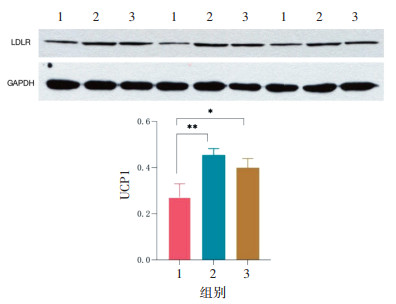
|
| 注:. HFD组;2. HFD+内消软脉汤2号低剂量组;3. HFD+内消软脉汤2号高剂量组。与HFD组比较,*P<0.05,**P<0.01。 图 8 内消软脉汤2号对肝脏LDLR表达的影响(x±s,n=3) Fig. 8 Effect of Neixiao Ruanmai Decoction No.2 on the expression of LDLR in the liver(x±s, n=3) |
AS是一种由慢性炎症引发的动脉壁脂肪病变,已成为老年人的关键死亡原因之一[10]。脂质代谢紊乱与AS的发生发展密切相关,是AS主要的独立危险因素。当血脂水平过高时,可导致动脉内皮损伤及脂质分子大量沉积,这些脂质分子会受到多种炎症细胞的浸润和吞噬,进而转化为泡沫细胞并引发一系列炎症和氧化反应,导致AS的发生[11]。大量研究表明[12],血浆胆固醇水平的升高与AS的发生率及病死率呈正相关。目前他汀类等降脂药物虽已广泛应用,但中国高脂血症发病率仍然较高。《中国居民营养与慢性病状况报告(2020年)》[13]显示,中国18岁及以上居民高脂血症总体患病率高达35.6%,造成了严重的疾病负担。中医药是一个伟大的宝库,进一步挖掘治疗高脂血症及AS的中医方剂从而改善高脂血症、减少心脑血管疾病的发生,既是深入贯彻《“健康中国2030”规划纲要》的重要一环,也是高脂血症领域的重点研究方向,对维护人类健康具有重要意义。
在中医中,AS为“痰核”结于血脉所致。津液与血液皆由水谷所化,运行于脉中,津液壅滞则血运亦不通畅,痰为津液壅滞,故“痰核”一旦形成,易影响血液运行而又夹杂瘀血等病理产物,最终形成斑块[4-5]。高脂血症作为AS的基础,属于“痰湿”“脂膏”的范畴,为本虚标实之证,肝、脾、肾三脏功能失调是导致血脂异常的内因。饮食不节、嗜食肥甘厚味、情志失调、过逸少劳、先天不足等原因可造成脏腑功能失调,肝、脾、肾三脏功能失常,导致水谷不能正常运化、津液代谢失常,进而形成湿浊、痰湿等病理产物,即血脂代谢紊乱[14]。故在AS及高脂血症的治疗上,总以化痰为主,兼顾扶正。
内消软脉汤2号以“脉生痰核”理论为指导,以化痰散结为主要治法,在临床上运用其治疗颈动脉斑块获得了良好疗效,显示出逆转颈动脉斑块的潜力。全方以灵芝为君药,可健脾化痰,助脾胃运化,以绝生痰之源,是本方中改善AS和脂代谢紊乱的关键药物。大量研究证明,灵芝可安全有效地改善脂代谢紊乱、肥胖、胰岛素抵抗等代谢紊乱性疾病,进而达到抑制AS发展的作用[15-21]。痰浊之邪日久易化热生毒,故辅黄连、玄参以清热解毒。此外,方中牡蛎、贝母化痰散结,乳香、没药、丹参、当归活血化瘀,起到消退病理产物以调节气机、改善AS的作用。整体来看,内消软脉汤2号配伍有序、寒温并用、加减灵活,用于治疗AS与高脂血症,确有其效。前期临床试验与本次实验结果均表明,内消软脉汤2号可以减轻AS斑块的发展,实验组小鼠的LDL-C和TC水平降低。由此可见,内消软脉汤2号降低血脂水平是其改善AS的重要原因。由于内消软脉汤2号可改善AS并降低血脂,故可为他汀类药物不耐受及他汀抵抗的AS斑块患者提供较好的备选方案,也为配合他汀类药物产生更好的临床疗效提供了可能。
根据实验结果,内消软脉汤2号灌胃后,小鼠肩胛区脂肪组织的活化程度及UCP1的表达均增加,同时肝脏LDLR的表达增加。研究表明,UCP1是介导棕色脂肪组织活化产热的关键蛋白[22-23]。当脂肪组织活化时,细胞质中脂滴包被蛋白1的磷酸化得到激活,在脂肪组织内三酰甘油脂肪酶(ATGL)等酶的介导下使TG分解为甘油及脂肪酸[23-24],UCP1被激活[24-25]后可介导线粒体内膜形成质子通道,使得氧化与磷酸化解偶联,最终不产生ATP而由热能直接释放[26],同时还可增加胆固醇逆向转运的效率及机体对胆固醇的利用等,以减少TC、TG等脂类物质的储存。由于脂肪组织活化产热严格依赖于UCP1的激活[22],是控制肥胖的重要靶点,故推测内消软脉汤2号使脂肪组织活化与UCP1密切相关。激活UCP1依赖性脂肪组织活化可能是药物改善AS及脂代谢紊乱的潜在机制。LDLR是体内LDL-C代谢调控的关键调节因子,可通过内吞作用将LDL清除,在胆固醇从血浆到细胞质的转运和清除中起到重要作用。LDLR的功能不全或LDLR基因突变将导致高胆固醇血症的发生,并明显加速AS的发展[27]。故增加LDLR的表达及功能是抑制高胆固醇血症及AS的重要手段。根据实验结果,内消软脉汤2号可使小鼠肝脏中LDLR表达显著增加,提示内消软脉汤2号改善小鼠AS、降低LDL-C与LDLR相关,鉴于LDLR对LDL-C代谢的重要作用,我们推测内消软脉汤2号通过增加LDLR的表达,进而促进其对LDL的代谢,以达到降低胆固醇并改善动脉粥样硬化的作用。故LDLR表达升高亦是内消软脉汤2号改善高脂血症并抑制AS的潜在机制之一。
综上所述,AS与高脂血症皆因痰邪而起,内消软脉汤2号可通过化痰散结来清除痰邪这一宿根,其内在机制可能与激活UCP1及LDLR有关,若能深入挖掘方中的有效成分,进一步提高其疗效,对未来高脂血症及AS的防治、开拓中医药治疗心脑血管疾病的新思路具有重要意义。
| [1] |
任正肖, 朱庆均, 王彦芳, 等. 中药调控细胞凋亡抗动脉粥样硬化研究进展[J]. 中国实验方剂学杂志, 2022, 28(22): 214-223. REN Z X, ZHU Q J, WANG Y F, et al. Chinese medicine regulates apoptosis to treat atherosclerosis: a review[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(22): 214-223. |
| [2] |
王意丹, 彭格红, 张松松. 三维能量多普勒超声评估颈动脉斑块与缺血性卒中发生的相关性[J]. 中国医学影像学杂志, 2021, 29(3): 277-280. WANG Y D, PENG G H, ZHANG S S. Correlation between carotid plaque and ischemic stroke evaluated by three-dimensional power Doppler imaging[J]. Chinese Journal of Medical Imaging, 2021, 29(3): 277-280. DOI:10.3969/j.issn.1005-5185.2021.03.024 |
| [3] |
TZOLOS E, WILLIAMS M C, MCELHINNEY P, et al. Pericoronary adipose tissue attenuation, low-attenuation plaque burden, and 5-year risk of myocardial infarction[J]. JACC: Cardiovascular Imaging, 2022, 15(6): 1078-1088. DOI:10.1016/j.jcmg.2022.02.004 |
| [4] |
ARNOLD N, KOENIG W. Atherosklerose als inflammatorische erkrankung-pathophysiologie, klinische relevanz und therapeutische implikationen[J]. DMW-Deutsche Medizinische Wochenschrift, 2019, 144(5): 315-321. DOI:10.1055/a-0657-1595 |
| [5] |
金璨, 邓颖, 曹楠, 等. 茶多酚对高脂饮食诱导的非酒精性脂肪性肝病预防作用的研究进展[J]. 食品科学, 2023, 44(7): 295-302. JIN C, DENG Y, CAO N, et al. Progress in research on the preventive effect of tea polyphenols on non-alcoholic fatty liver disease induced by high-fat diet[J]. Food Science, 2023, 44(7): 295-302. |
| [6] |
吴圣贤, 何芳, 武荣荣. 以"脉生痰核"理论指导动脉粥样硬化研究[J]. 中医杂志, 2017, 58(3): 262-264. WU S X, HE F, WU R R. Guiding the study of atherosclerosis with the theory of "pulse generating phlegm nucleus"[J]. Journal of Traditional Chinese Medicine, 2017, 58(3): 262-264. |
| [7] |
苏文全, 吴圣贤, 杜雅薇. 从"脉生痰核"论治动脉粥样硬化[J]. 中医学报, 2019, 34(8): 1617-1620. SU W Q, WU S X, DU Y W. Treating atherosclerosis from perspective of "meridian phlegm node"[J]. Acta Chinese Medicine, 2019, 34(8): 1617-1620. |
| [8] |
李贺, 吴圣贤, 姬寒蕊, 等. 内消软脉汤2号治疗颈动脉粥样硬化斑块痰瘀互结证的实用性随机对照研究[J]. 中医杂志, 2022, 63(19): 1853-1858. LI H, WU S X, JI H R, et al. Neixiao Ruanmai Decoction Ⅱ in the treatment of carotid atherosclerosis plaque with binding of phlegm and stasis syndrome: a pragmatic randomized controlled trial[J]. Journal of Traditional Chinese Medicine, 2022, 63(19): 1853-1858. |
| [9] |
林丰夏, 李亮, 曾志聪, 等. 动脉粥样硬化动物模型研究进展与中医病证结合的造模思路探析[J]. 中西医结合心脑血管病杂志, 2019, 17(21): 3338-3342. LIN F X, LI L, ZENG Z C, et al. Research progress of animal model of atherosclerosis and thinking of modeling by combining disease and syndrome of traditional Chinese medicine[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2019, 17(21): 3338-3342. |
| [10] |
PUNCH E, KLEIN J, DIABA-NUHOHO P, et al. Effects of PCSK9 targeting: alleviating oxidation, inflammation, and atherosclerosis[J]. Journal of the American Heart Association, 2022, 11(3): e023328. DOI:10.1161/JAHA.121.023328 |
| [11] |
OWENS A P, BYRNES J R, MACKMAN N. Hyperlipidemia, tissue factor, coagulation, and simvastatin[J]. Trends in Cardiovascular Medicine, 2014, 24(3): 95-98. DOI:10.1016/j.tcm.2013.07.003 |
| [12] |
宋江波, 杨志明, 梁斌, 等. 血管紧张素1-7对大鼠血脂及胆固醇逆转运相关因子表达的影响[J]. 中国动脉硬化杂志, 2013, 21(8): 685-689. SONG J B, YANG Z M, LIANG B, et al. Effects of angiotensin(1-7) on the expression of lipids and reverse cholesterol transport related factors in rats[J]. Chinese Journal of Arteriosclerosis, 2013, 21(8): 685-689. |
| [13] |
中国居民营养与慢性病状况报告(2020年)[J]. 营养学报, 2020, 42(6): 521. Report on nutrition and chronic diseases of residents in China(2020)[J]. Acta Nutrimenta Sinica, 2020, 42(6): 521. |
| [14] |
柏帆, 唐露霖, 尚文斌. 高脂血症的中医分类治疗探讨[J]. 中医药学报, 2022, 50(2): 10-13. BAI F, TANG L L, SHANG W B. Discussion on traditional Chinese medicine classification and treatment of hyperlipemia[J]. Acta Chinese Medicine and Pharmacology, 2022, 50(2): 10-13. |
| [15] |
袁江南. 灌胃灵芝三萜白蛋白与运动结合对肥胖小鼠的影响评价[J]. 中国食用菌, 2020, 39(8): 53-55. YUAN J N. Evaluation of the effect of ganoderma lucidum triterpene albumin combined with exercise on obese mice[J]. Edible Fungi of China, 2020, 39(8): 53-55. |
| [16] |
陈嘉骏, 王颖, 桑婷婷, 等. 灵芝多糖在糖尿病及其并发症防治中的研究进展[J]. 中草药, 2022, 53(3): 937-947. CHEN J J, WANG Y, SANG T T, et al. Research progress on ganoderma polysaccharide in prevention and treatment of diabetes and its complications[J]. Chinese Traditional and Herbal Drugs, 2022, 53(3): 937-947. |
| [17] |
蒙田秀, 龚志强, 黄振园, 等. 白鹤灵芝不同提取部位抗鹌鹑高血脂症及动脉粥样硬化的影响[J]. 中国实验方剂学杂志, 2014, 20(8): 166-169. MENG T X, GONG Z Q, HUANG Z Y, et al. Effects of different extracts of rhinacanthus nasutus on lipid metabolism of quails[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(8): 166-169. |
| [18] |
杨丹阳, 姜涛, 周径, 等. 富硒灵芝粗提物对2型糖尿病模型大鼠脂代谢、肝功能及炎症反应的改善作用研究[J]. 中国药房, 2019, 30(3): 364-370. YANG D Y, JIANG T, ZHOU J, et al. Study on improvement effect of selenium-enriched ganoderma lucidum crude extract on lipid metabolism, liver function and inflammatory response in type 2 diabetic model rats and its mechanism[J]. China Pharmacy, 2019, 30(3): 364-370. |
| [19] |
KHAN M S, PARVEEN R, MISHRA K, et al. Determination of nucleosides in cordyceps sinensis and ganoderma lucidum by high performance liquid chromatography method[J]. Journal of Pharmacy & Bioallied Sciences, 2015, 7(4): 264-266. |
| [20] |
SANODIYA B S, THAKUR G S, BAGHEL R K, et al. Ganoderma lucidum: a potent pharmacological macrofungus[J]. Current Pharmaceutical Biotechnology, 2009, 10(8): 717-742. |
| [21] |
YANG Z, WU F, HE Y M, et al. A novel PTP1B inhibitor extracted from ganoderma lucidum ameliorates insulin resistance by regulating IRS1-GLUT4 cascades in the insulin signaling pathway[J]. Food & Function, 2018, 9(1): 397-406. |
| [22] |
HARMS M, SEALE P. Brown and beige fat: development, function and therapeutic potential[J]. Nature Medicine, 2013, 19(10): 1252-1263. |
| [23] |
BEAN C, AUDANO M, VARANITA T, et al. The mitochondrial protein opa1 promotes adipocyte browning that is dependent on urea cycle metabolites[J]. Nature Metabolism, 2021, 3(12): 1633-1647. |
| [24] |
LAFONTAN M, LANGIN D. Lipolysis and lipid mobilization in human adipose tissue[J]. Progress in Lipid Research, 2009, 48(5): 275-297. |
| [25] |
VERGNES L, CHIN R, YOUNG S G, et al. Heart-type fatty acid-binding protein is essential for efficient brown adipose tissue fatty acid oxidation and cold tolerance[J]. The Journal of Biological Chemistry, 2011, 286(1): 380-390. |
| [26] |
ROSEN E D, SPIEGELMAN B M. What we talk about when we talk about fat[J]. Cell, 2014, 156(1/2): 20-44. |
| [27] |
BLANCO-RUIZ M, AMAYA-PASCASIO L, DE TORRES CHACÓN R, et al. Effectiveness and safety of PCSK9 inhibitors in real-world clinical practice: an observational multicentre study. The IRIS-PCSK9I study[J]. Atherosclerosis Plus, 2021, 45: 32-38. |
2. Dongzhimen Hospital, Beijing University of Chinese Medicine, Beijing 100700, China
 2023, Vol. 40
2023, Vol. 40