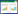文章信息
- 孟曦, 丁伟, 王建美, 等.
- MENG Xi, DING Wei, WANG Jianmei, et al.
- 膜肾1号方对大鼠肾脏病理及PI3K/Akt/mTOR信号通路表达的影响
- The effect of membranous kidney No.1 formula on renal pathology and PI3K/Akt/mTOR signaling pathway expression in rats
- 天津中医药, 2023, 40(10): 1320-1326
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(10): 1320-1326
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.10.16
-
文章历史
- 收稿日期: 2023-05-28
2. 天津市河东中医院, 天津 300162;
3. 天津市北辰医院, 天津 300400;
4. 天津市中医药大学第一附属医院, 天津 300193
膜性肾病是一组以肾小球基底膜上皮细胞下免疫复合物沉积伴基底膜弥漫增厚为特征的疾病[1]。根据病因的不同,分为特发性膜性肾病(IMN)和继发性膜性肾病。IMN是构成原发性肾病综合征的常见疾病,发病高峰年龄多为40~50岁,男女比例约为2∶1,本病起病隐匿,以高度水肿、大量蛋白尿为主要临床表现[2]。长期大量蛋白尿会导致患者肾功能进行性减退,甚至逐渐发展为终末期肾病。蛋白尿的形成与足细胞损伤密切相关,生理状态下足细胞具有较高的自噬活性。研究发现自噬信号通路磷脂肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)对足细胞的损伤具有调控作用,肾小球足细胞存在较强的自噬活性[3],足细胞的分化、损伤、修复过程中往往伴随着自噬[4],激活自噬可以减少肾小管上皮细胞凋亡,防止细胞损伤[5-6]。王耀光教授多年临床经验总结治疗膜性肾病基础方膜肾1号方(生黄芪、炒白术、防风、防己、地龙、僵蚕、诃子、芡实、泽兰、丹参),临床疗效显著。膜肾1号方化裁自《金匮要略》名方防己黄芪汤,具有益气祛风,健脾利水之功效,主治表虚不固之风水或风湿证,王耀光教授根据临床多年经验在经方基础上加入活血祛瘀及收敛固涩之药,临床收效显著。经前期临床研究表明膜肾1号方能显著改善膜性肾病患者临床症状、体征,可明显降低患者蛋白尿、胆固醇及三酰甘油(TG),实验基于此,研究膜肾1号方对肾脏的保护作用,通过动物实验研究明确作用机制。
1 研究材料与方法 1.1 实验材料 1.1.1 实验动物无特定病原体(SPF)级SD大鼠40只,6周龄雄性,体质量150~170 g(北京维通利华实验动物技术有限公司),普通饲料喂养,自由进食及饮水,室温20 ℃,相对湿度45%±5%。实验遵循《实验动物护理和使用指南》(动物实验伦理批号GENINK-20220002),自然光照12 h,在同等标准环境内适应性饲养1周后进行实验。
1.1.2 主要仪器与材料脱水机[武汉俊杰公司(JT-12J)];包埋机[武汉俊杰公司(JB-L8)];电子天秤(永康市艾瑞贸易有限公司);血生化仪(日本日立公司);阳离子化牛血清白蛋白(C-BSA,美国Sigma-Aldrich公司,货号:H2519-100UN);柠檬酸抗原修复液(北京索莱宝科技有限公司,货号:C1034-100 mL);PI3K一抗(兔源,英国Abcam公司,货号:ab302958);磷酸化磷酸肌醇3激酶(p-PI3K)一抗(兔源,中国Bioss公司,货号:bs-5570R);蛋白激酶B(AKT)一抗(兔源,美国CST公司,货号:#9272);磷酸化AKT蛋白(p-Akt)一抗(兔源,美国CST公司,货号:#4060);雷帕霉素靶蛋白(mTOR)一抗(兔源,美国CST公司,货号:#2972);磷酸化雷帕霉素靶蛋白(p-mTOR)一抗(英国Abcam公司兔源,美国CST公司,货号:#5536);蛋白轻链3(LC3)一抗(兔源,美国CST公司,货号:#4108英国Abcam公司);磷酸甘油脱氢酶(GAPDH)一抗(小鼠源,中国优抗,货号:UM4002);免疫球蛋白G(IgG,Alexa Fluor?誖488)抗体(兔源,英国Abcam公司,货号:ab133470);羊抗兔抗体和酶标二抗(IgG-HRP,羊源,中国Bioss公司,货号:bs-0295G-HRP);羊抗小鼠IgG-HRP二抗(羊源,中国Bioss公司,货号:bs-0296G-HRP);冷冻包埋剂(OCT,德国莱卡公司)。
1.2 实验方法 1.2.1 动物模型制备SD大鼠40只,适应性喂养1周后,用尿蛋白试纸测定每只大鼠的尿蛋白为阴性后,按照随机原则,选取7只大鼠做为对照组,33只进行造模,大鼠模型方法参照Border法[7]。制备阳离子化牛血清白蛋白(C-BSA)溶液及C-BSA冻干粉剂。将2 g/L C-BSA与等量弗氏不完全佐剂混匀,在腋下、腹股沟选取多点皮下注射0.1 mL进行预免疫,隔日1次,共计3次。正式免疫将2 g/L C-BSA与等体积的磷酸盐缓冲液(PBS)混匀后于大鼠尾静脉注射,每次0.5 mL,每周3次,连续4周。测定大鼠的尿苷三磷酸(UTP)水平,以UTP≥20 mg作为模型制备成功标准[8]。
1.2.2 实验动物分组及干预造模成功后,将造模组分为模型组5只,膜肾1号方高剂量组(简称高剂量组)7只、膜肾1号方中剂量组(简称中剂量组)7只、膜肾1号方低剂量组(简称低剂量组)7只,盐酸贝那普利组7只。将膜肾1号方汤剂(生黄芪30 g,丹参30 g,炒白术15 g,防风15 g,防己20 g,地龙15 g,僵蚕15 g,诃子15 g,芡实30 g,泽兰30 g,购自天津市中医药研究院附属医院中药房)旋转蒸发仪浓缩。按高、中、低浓度稀释。使用生理盐水将盐酸贝那普利片制备含生药浓度的药液。根据“人和动物间体表面积折算的等效剂量比率”换算,将3个浓度的中药以及盐酸贝那普利灌胃,每日2次,对照组灌服同体积生理盐水,灌胃14 d。留取大鼠24 h尿液,4 ℃冰箱保存。大鼠禁食水12 h后取血,以离心半径200 px,离心速度维持在3 500~4 000 r/min,将大鼠全血样本离心10 min,离心分离出血清,4 ℃冰箱保存备用;分离大鼠肾脏,快速转移到-80 ℃冰箱保存备用。
1.2.3 血液生化指标检测及尿蛋白定量检测测定血液生化指标24 h尿蛋白(PRO),白蛋白(ALB),白球比(A/G),TG,总胆固醇(CHO),高密度脂蛋白(HDL)和低密度脂蛋白(LDL),实验步骤按照试剂盒说明书进行。
1.2.4 组织病理学观察大鼠肾脏药物干预后,将大鼠禁食12 h,按0.3 mL/100 g剂量予腹腔注射10%水合氯醛以麻醉,确认麻醉起效后将大鼠固定于鼠板,剃除腹部皮毛,迅速剖开腹腔,寻找到肾脏,并分离出肾脏,置于生理盐水中洗去血液。标记各组肾脏组织,部分置于10%多聚甲醛中固定。剩余部分剪成若干等分,装入2 mL冻存管中于-80 ℃冻存,以备后续实验。肾脏组织进行苏木精-伊红(HE)染色、免疫荧光染色。
1.2.5 蛋白免疫印迹法(Western Blot)实验提取总蛋白,将蛋白提取物从-80 ℃冰箱取出,置于冰上解冻,采用二奎啉甲酸(BCA)蛋白质定量试剂盒,测定蛋白质浓度,离心后准备上样,进行电泳、转膜。按照增强型化学发光试剂(ECL)显色试剂盒说明书要求,配制适量ECL工作液,沥干PVDF膜上的洗膜液,将配制好的ECL工作液,均匀滴在膜上,室温孵育5 min,然后吸去多余显色液,采用全自动化学发光图像分析系统成像,使用灰度值软件分析结果。
1.3 统计学方法运用SPSS 24.0软件对数据进行统计分析,计量资料进行正态性检验,用均数±标准差(x±s)表示,多组计量资料组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 膜肾1号方对大鼠PRO、ALB等生化指标的影响各组大鼠PRO,ALB,A/G组间比较:与对照组相比,模型组大鼠的PRO等生化指标出现异常。药物干预后,盐酸贝那普利组和膜肾1号方低、中、高剂量组PRO开始下降且低于模型组,差异具有统计学意义(P<0.05)。同时与对照组相比,模型组中大鼠PRO、ALB、A/G表达显著下降,差异具有统计学意义(P<0.05)。与模型组相比,盐酸贝那普利组和高剂量组的PRO定量表达下降明显,差异具有统计学意义(P<0.01)。见表 1。
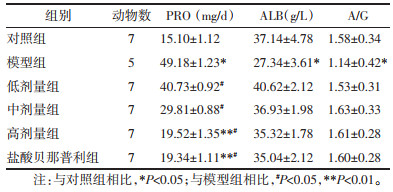
与对照组相比,模型组大鼠出现血脂代谢异常,TG、CHO和LDL表达升高,差异具有统计学意义(P<0.05)。药物干预后,盐酸贝那普利组和高剂量组的TG、CHO、LDL表达下降且低于模型组,差异具有统计学意义(P<0.05)。见表 2。
|
对照组:肾组织整体结构及基底膜未见异常,可见肾小球及肾小管,组织内未见明显的炎症细胞浸润,未见嗜复红蛋白及IgG沉积;模型组:肾小球毛细血管丛充血,系膜增生,基底膜出现增厚,部分肾小管细胞明显空泡化、部分管腔扩张内含淡然无结构物形成透明管型,组织内可见炎症细胞浸润,可见嗜复红蛋白及IgG沉积,足细胞融合。经膜肾1号方和盐酸贝那普利干预后,大鼠肾脏病理学改变均有所减轻。见图 1。

|
| 注:A.对照组;B.模型组;C.阳性药组;D.低剂量组;E.中剂量组;F.高剂量组。 图 1 光镜下肾脏组织HE染色(×100) Fig. 1 HE staining of renal tissue under light microscope (×100) |
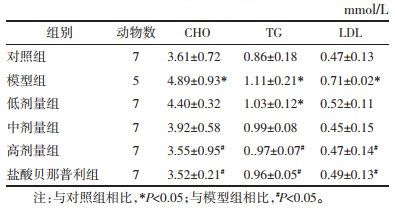
各组大鼠的IgG沉积比较:与对照组相比,模型组大鼠出现IgG沉积明显,IgG荧光表达升高,差异具有统计学意义(P<0.05)。药物干预后盐酸贝那普利组和膜肾1号方大鼠组IgG荧光表达下降且低于模型组,差异具有统计学意义(P<0.05)。见图 2。
|
| 图 2 荧光显微镜下肾脏组织IgG免疫荧光染色(×200) Fig. 2 IgG immunofluorescence staining of renal tissue under fluorescence microscope (×200) |
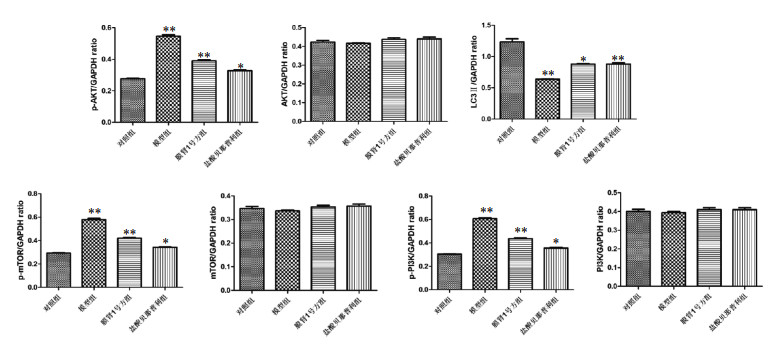
各组大鼠肾脏组织中自噬及PI3K-AKT信号通路相关蛋白表达:与对照组相比,模型组大鼠PI3K-AKT信号通路相关蛋白p-PI3K,p-Akt,p-mTOR蛋白表达显著增加,自噬相关蛋白LC3表达降低;药物干预后,盐酸贝那普利组和膜肾1号方组PI3K-AKT信号通路相关蛋白p-PI3K,p-Akt,p-mTOR蛋白表达降低,自噬相关蛋白LC3表达升高,差异具有统计学意义(P<0.05)。见图 3和4。

|
| 图 3 Western blotting检测大鼠肾脏组织中自噬信号通路及PI3K-AKT信号通路重要蛋白 Fig. 3 Western blotting detection of important proteins in autophagy signaling pathway and PI3K-AKT signaling pathway in rat kidney tissue |
|
| 注:与对照组相比,*P<0.05,**P<0.01。 图 4 大鼠肾脏组织中自噬信号通路及PI3K-AKT蛋白的相对表达量 Fig. 4 Autophagy signaling pathway and relative expression of PI3K-AKT protein in rat kidney tissue |
IMN是原发性肾小球疾病中常见的病理类型之一,在各种肾脏病的病理类型中位于第2或第3的位置,日本有研究显示膜性肾病占原发性肾病综合征的36.8%,IMN在膜性肾病中所占比例约为77.9%[9]。本病发病机制比较复杂,一般由于免疫复合物的沉积激活补体系统,形成膜攻击复合物C5b-9进而刺激足细胞释放炎症介质,导致足细胞损伤,引起一系列病理生理改变[10]。膜性肾病的主要治疗原则为控制疾病发展,减少蛋白尿,延缓肾功能减退,控制并发症。除一般治疗外,主要采取激素联合免疫抑制剂、细胞毒类药物为主,但容易出现白细胞降低、增加感染风险等免疫功能抑制和体重增加等激素相关不良反应,近年中医药对膜性肾病蛋白尿的治疗优势日益凸显。
膜性肾病的主要症状之一蛋白尿的形成与足细胞损伤密切相关,生理状态下足细胞具有较高的自噬活性。研究发现自噬信号通路PI3K/Akt/mTOR对足细胞的损伤具有调控作用,自噬是一种高度保守的降解机制,广泛存在于真核细胞生物,可清除、降解和回收利用受损细胞器,对维持细胞内环境稳定发挥重要的作用[11-12]。自噬可由多种信号通路调节,主要包括PI3K/Akt/mTOR、单磷酸腺苷活化蛋白激酶(AMPK)、核转录因子-κB(NF-KB)、c-jun N-terminal kinase氨基末端激酶(JNK)通路等[13-14]。酪氨酸激酶受体被细胞外和胞内因子活化进而激活PI3K,与酪氨酸激酶偶联并结合配体,催化磷酸肌醇二磷酸(PIP2)生成磷酸肌醇三磷酸(PIP3),PIP3与磷脂酰肌醇依赖性激酶1(PDK-1)共同激活蛋白丝/苏氨酸激酶(Akt),活化后的p-Akt激活mTOR,活化后的mTOR可通过激活其下游相关因子,进而促进细胞蛋白质的合成、增殖以及生长,加速细胞的代谢,抑制细胞的自噬,雷帕霉素靶蛋白1(mTOR1)在自噬的负调控中发挥重要的作用[6, 15-16]。LC3是自噬路径中的中心蛋白[17],分为Ⅰ型和Ⅱ型,LC3-Ⅱ位于自噬体膜表面,参与自噬体形成,其表达的强度与自噬泡数量的多少成正相关,通常作为自噬的分子标志[18]。LC3的表达强度体现自噬泡的数量,LC3表达升高提示自噬增强,PI3K/Akt/mTOR信号通路相关蛋白P-PI3K,P-Akt表达减低可减低对自噬的抑制,自噬对神经细胞、足细胞等细胞的生长发育具有重要作用,足细胞的分化、损伤、修复过程中往往伴随着自噬,激活自噬可以减少肾小管上皮细胞凋亡,防止细胞损伤[5-6]。膜性肾病的发生发展与足细胞的损伤密切相关,足细胞的损伤可造成蛋白尿增加,蛋白尿是膜性肾病的主要临床表现之一,近些年mTOR及相关信号通路在肿瘤相关疾病的机制研究较为明确,随着研究不断深入,除肿瘤外的其他疾病如代谢性疾病糖尿病、心脑血管疾病、自身免疫性疾病等疾病的发生发展也与mTOR及相关信号通路的参与相关[19]。有体外研究发现[20]mTOR抑制剂可通过激活足细胞自噬,发挥对特发性膜性肾病的治疗作用。故本研究从自噬的角度进一步研究膜肾1号方的作用机制,研究显示,与对照组相比,模型组大鼠PI3K-Akt信号通路相关蛋白P-PI3K,P-Akt,P-mTOR蛋白表达显著增加,自噬相关蛋白LC3表达降低;药物干预后,盐酸贝那普利组和膜肾1号方组PI3K-Akt信号通路相关蛋白P-PI3K,P-Akt,P-mTOR蛋白表达降低,自噬相关蛋白LC3表达升高,提示膜肾1号方可以降低PI3K-Akt信号通路的激活,提高自噬相关蛋白水平,自噬的激活可减少足细胞的损伤,发挥足细胞保护作用,从而起到减少蛋白尿、保护肾脏的作用。
自噬可通过清除、降解和回收受损的细胞器来发挥维持细胞内环境稳定状态的作用,此过程可以认为是中医阴阳消长、正邪相搏以达到阴阳动态平衡,正如《黄帝内经》所云:“阴平阳秘,精神乃至。”膜性肾病归属于中医“水肿”“尿浊”“腰痛”等范畴。蛋白在中医被认为是人体的精微物质,《素问·六节藏象论》曰:“肾者主蜇,封藏之本,精之处也。”可见精微物质主要依赖肾脏固摄与封藏,若肾脏封藏固摄功能异常,则发生精微物质下泄,出现蛋白尿。本病病机为本虚标实,以脾肾亏虚为本,以痰湿、浊毒、瘀血等为标实之证,随着中医药对膜性肾病治疗的深入研究,中医药可通过保护足细胞、减轻肾纤维化、保护基底膜等多种途径保护肾脏。王耀光教授总结膜性肾病的基本病机为本虚标实,脾虚不能运化水液,肾脏亏损,不能固摄,肾失封藏,精关不固,则精微物质下泄,出现蛋白尿,针对本病的病因病机提出以补脾益肾,固本培元为主要治法,佐以活血祛瘀以治标,选用《金匮要略》防己黄芪汤加减化裁为膜肾1号方(生黄芪、炒白术、防风、防己、地龙、僵蚕、诃子、芡实、泽兰、丹参)为王耀光教授多年临床经验总结治疗膜性肾病基础方,临床疗效显著,方中生黄芪性甘温为君药,益气健脾、补气活血、利水消肿,炒白术健脾燥湿,助黄芪利水消肿,防风、防己祛风胜湿,地龙活血通经,祛瘀通络,丹参、泽兰加强活血祛瘀、利水消肿,诃子、芡实收敛固涩,增强培本固原。现代药理学研究显示黄芪甲苷可改善肾小球基底膜增厚、系膜基质增殖等病理损伤,减少大鼠蛋白尿[21]。
综上所述,结果表明膜肾1号方治疗膜性肾病与调控自噬信号通路PI3K/Akt/mTOR的表达有关,可通过调节自噬信号通路发挥足细胞的保护作用,本研究为膜肾1号方在临床上治疗蛋白尿,延缓膜性肾病发展提供可靠的实验依据。
| [1] |
王海燕. 肾脏病学[M]. 3版. 北京: 人民卫生出版社, 2008. WANG H Y. Nephrology[M]. 3rd ed.. Beijing: People's Medical Publishing House, 2008. |
| [2] |
MURTAS C, RAVANI P, GHIGGERI G M. New insights into mem-branous glomerulonephritis: from bench to bedside[J]. Nephrology Dialysis Transplantation, 2011, 26(8): 2428-2430. DOI:10.1093/ndt/gfr336 |
| [3] |
OH S H, CHOI Y B, KIM J H, et al. Quantification of autophagy flux using LC3 ELISA[J]. Analytical Biochemistry, 2017, 530: 57-67. DOI:10.1016/j.ab.2017.05.003 |
| [4] |
ZENG C H, FAN Y, WU J N, et al. Podocyte autophagic activity plays a protective role in renal injury and delays the progression of podocytopathies[J]. The Journal of Pathology, 2014, 234(2): 203-213. DOI:10.1002/path.4382 |
| [5] |
GUAN X J, QIAN Y Y, SHEN Y, et al. Autophagy protects renal tubular cells against ischemia/reperfusion injury in a time-depen-dent manner[J]. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2015, 36(1): 285-298. DOI:10.1159/000374071 |
| [6] |
LAHIRI V, HAWKINS W D, KLIONSKY D J. Watch what You (self-) eat: autophagic mechanisms that modulate metabolism[J]. Cell Metabolism, 2019, 29(4): 803-826. DOI:10.1016/j.cmet.2019.03.003 |
| [7] |
BORDER W A, WARD H J, KAMIL E S, et al. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen[J]. The Journal of Clinical Investigation, 1982, 69(2): 451-461. DOI:10.1172/JCI110469 |
| [8] |
刘欣. 加味升降散对膜性肾病大鼠的肾保护作用及对肾组织CXCL16、FcRn表达的影响[D]. 石家庄: 河北医科大学, 2017. LIU X. The renal protective effect of the modified Shengjiang Power on rats with membranous nephropathy and impact on the expression of CXCL16 and FcRn in kidney tissues[D]. Shijiazhuang: Hebei Medical University, 2017. |
| [9] |
YOKOYAMA H, TAGUCHI T, SUGIYAMA H, et al. Membranous nephropathy in Japan: analysis of the Japan renal biopsy registry (J-RBR)[J]. Clinical and Experimental Nephrology, 2012, 16(4): 557-563. DOI:10.1007/s10157-012-0593-7 |
| [10] |
钟珍, 李俊佳, 胡海滢, 等. 补体攻膜复合物C5b-9在特发性膜性肾病发病中作用研究进展[J]. 中华实用诊断与治疗杂志, 2015, 29(7): 631-633. ZHONG Z, LI J J, HU H Y, et al. Role of membrane attack complex C5b-9 in the development of idiopathic membranous nephropathy[J]. Journal of Chinese Practical Diagnosis and Therapy, 2015, 29(7): 631-633. |
| [11] |
NETEA-MAIER R T, PLANTINGA T S, VANDE VEERDONK F L, et al. Modulation of inflammation by autophagy: consequences for human disease[J]. Autophagy, 2016, 12(2): 245-260. DOI:10.1080/15548627.2015.1071759 |
| [12] |
ASHFORD T P, PORTER K R. Cytoplasmic components in hepatic cell lysosomes[J]. The Journal of Cell Biology, 1962, 12(1): 198-202. DOI:10.1083/jcb.12.1.198 |
| [13] |
GALLUZZI L, BRAVO-SAN PEDRO J M, LEVINE B, et al. Pharmacological modulation of autophagy: therapeutic potential and persisting obstacles[J]. Nature Reviews Drug Discovery, 2017, 16(7): 487-511. DOI:10.1038/nrd.2017.22 |
| [14] |
ONORATI A V, DYCZYNSKI M, OJHA R, et al. Targeting autophagy in cancer[J]. Cancer, 2018, 124(16): 3307-3318. DOI:10.1002/cncr.31335 |
| [15] |
HALES E C, TAUB J W, MATHERLY L H. New insights into Notch1 regulation of the PI3K-AKT-mTOR1 signaling axis: targeted therapy of γ-secretase inhibitor resistant T-cell acute lymphoblastic leukemia[J]. Cellular Signalling, 2014, 26(1): 149-161. DOI:10.1016/j.cellsig.2013.09.021 |
| [16] |
TARANTINO G, CAPONE D. Inhibition of the mTOR pathway: a possible protective role in coronary artery disease[J]. Annals of Medicine, 2013, 45(4): 348-356. DOI:10.3109/07853890.2013.770333 |
| [17] |
TANG J, ZHU J, YE Y G, et al. Inhibition LC3B can increase chemosensitivity of ovarian cancer cells[J]. Cancer Cell International, 2019, 19: 199. DOI:10.1186/s12935-019-0921-z |
| [18] |
RAMKUMAR A, MURTHY D, RAJA D A, et al. Classical autophagy proteins LC3B and ATG4B facilitate melanosome movement on cytoskeletal tracks[J]. Autophagy, 2017, 13(8): 1331-1347. DOI:10.1080/15548627.2017.1327509 |
| [19] |
SAXTON R A, SABATINI D M. mTOR signaling in growth, metabolism, and disease[J]. Cell, 2017, 169(2): 361-371. |
| [20] |
胡康. mTOR抑制剂激活足细胞自噬治疗特发性膜性肾病的体外研究[A]. 中国中西医结合学会肾脏疾病专业委员会2018年学术年会论文摘要汇编[C]. 重庆, 2018: 166. HU K. In vitro study of mTOR inhibitor activated podocyte autophagy in the treatment of idiopathic membranous nephropathy[A]. Compilation of abstracts from the 2018 Academic Annual Meeting of the Kidney Disease Professional Committee of the Chinese Association of Integrated Traditional and Western Medicine[C]. Chongqing, 2018: 166. |
| [21] |
刘红, 王增四, 高文, 等. 黄芪甲苷对STZ诱导的糖尿病大鼠肾组织内质网应激及CHOP信号通道的影响[J]. 中国医院药学杂志, 2021, 41(13): 1318-1322. LIU H, WANG Z S, GAO W, et al. Influence of astragalosideⅣ on endoplasmic reticulum stress and CHOP signaling pathways in diabetic nephropathy rats induced with STZ[J]. Chinese Journal of Hospital Pharmacy, 2021, 41(13): 1318-1322. |
2. Tianjin Hedong Traditional Chinese Medicine Hospital, Tianjin 300162, China;
3. Tianjin Beichen Hospital, Tianjin 300400, China;
4. The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2023, Vol. 40
2023, Vol. 40