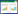文章信息
- 巨虎, 翟婷, 达哇卓玛, 等.
- JU Hu, ZHAI Ting, DAWA Zhuoma, et al.
- 过表达JAK1对岩藻多糖保护神经元免受糖氧剥夺/复氧损伤的影响
- Effect of overexpression of JAK1 on protection of fucoidan-exposed neurons from glucose-oxygen deprivation/reoxygenation injury
- 天津中医药, 2023, 40(10): 1337-1346
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(10): 1337-1346
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.10.18
-
文章历史
- 收稿日期: 2023-07-10
2. 青海大学高原医学研究中心, 西宁 810000
脑缺血性疾病是造成患者死亡及残疾的重要疾病之一,是指血管阻塞后不能及时将营养物质及氧气运送至头部,待血流再次汇通导致神经细胞坏死,造成脑缺血再灌注损伤(CIRI)[1-2]。研究表明,CIRI是由多种因素联合作用下而导致的,其中氧化应激、神经元凋亡、自噬等因素是近年来的研究热点[3]。活性氧(ROS)是给机体造成氧化应激损伤的主要物质,当其含量过高时会损伤机体的蛋白质、DNA及RNA,从而导致基因表达失活沉默[4]。细胞凋亡是细胞在基因控制下出现自主有序的死亡情况,在CIRI中主要表现为神经细胞凋亡[5]。而自噬与细胞凋亡关系密不可分,自噬可通过抑制含半胱氨酸的天冬氨酸蛋白水解酶表达从而降解蛋白质及受损细胞器,以起到维持细胞平衡的效用[6]。
研究表明,中国缺血性心脑血管疾病占心脑血管疾病的70%~80%,给人们的生活及健康带来严重威胁[7]。目前常以药物溶栓进行治疗为主,但治疗后易出现神经细胞坏死或凋亡而难以达到较好的治疗目的。近年来中成药已经广泛应用于脑缺血性疾病中的治疗,并取得较好的成果[8]。岩藻多糖是从海洋无脊椎动物、海带等动植物中提取出的活性成分,具有抗衰老、抗肿瘤、抗病毒及增强免疫力等功能[9]。且前期研究表明,岩藻多糖在认知功能障碍、神经前体细胞衰老、帕金森病、神经性疼痛等神级系统疾病中均有报道,在脑部具有缓解氧化损伤、炎症及神经元细胞凋亡的作用,对CIRI具有良好的治疗作用,但其具体的致病机制还尚不清楚[10]。故本研究通过建立细胞缺氧缺糖/再灌注模型,对岩藻多糖是否通过抑制JAK/STAT信号通路促进线粒体自噬,从而保护神经元免受糖氧剥夺/复氧损伤(OGD/RP)进行研究。
1 材料与方法 1.1 药物、试剂与仪器岩藻多糖(上海源叶生物科技有限公司,货号:S11142);大鼠PC12细胞(武汉Procell公司);胎牛血清、DMEM培养(美国Gibco公司,货号分别为10100147、11885084);Bax、Bcl-2、cleaved-Caspase-3、Caspase-3、LC3B、PINK1、Parkin、JAK1、p-JAK1、STAT3、p-STAT3抗体(武汉Abclonal公司,货号分别为:A0207、A0208、A2156、A19665、A7131、A19665、A18323、AP0530、A1192、AP0070);生物素化山羊抗兔IgG(H+L)(affinity公司,货号:S0001);超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)ELISA KIT(上海茁彩生物科技有限公司,货号:ZC-S0350、ZC-S0860);BCA蛋白浓度测定试剂盒、JC-1试剂盒、ROS检测试剂盒、CCK8试剂盒(上海beyotime公司,货号依次为:P0012、C2006、S0033S、C0037);流式分析仪(美国Beckman公司);酶标仪(上海美谷分子仪器有限公司);透射电镜(日本Hitachi公司);二氧化碳(CO2)培养箱(美国Thermo Fisher公司)。
1.2 细胞培养及分组将大鼠PC12细胞复苏,在细胞中加入10%血清的DMEM培养基后,将其置于37 ℃、5% CO2培养箱中,待细胞长至单层后用于后续实验。将细胞分为Control组、OGD/RP组、100 mg/kg岩藻多糖组、200 mg/kg岩藻多糖组、400 mg/kg岩藻多糖组、OGD/RP+岩藻多糖+pcDNA-NC组及OGD/RP+岩藻多糖+ pcDNA3.1-JAK1组共7组。
1.3 OGD/RP损伤模型建立及用药除Control组细胞常规培养外,其余各组建立OGD/RP损伤模型。待细胞生长至对数期时,将各组细胞培养液换为无糖培养基,并置于95%N2、1% O2厌氧条件下培养3 h,后置于正常培养箱中培养24 h,建立OGD/RP损伤模型。将不同浓度岩藻多糖组、OGD/RP+岩藻多糖+pcDNA-NC组和OGD/RP+岩藻多糖+ pcDNA3.1-JAK1组细胞用岩藻多糖处理12 h。OGD/RP损伤+岩藻多糖组+ pcDNA-NC组和OGD/RP+岩藻多糖+pcDNA3.1-JAK1组分别转染pcDNA3.1空载质粒及转染pcDNA3.1-JAK1质粒到PC12细胞中,并置于37 ℃、5% CO2培养箱中培养,培养24 h后收取细胞进行检测。
1.4 岩藻多糖浓度筛查将100、200、400 mg/kg的岩藻多糖作用于PC12细胞OGD/RP模型中,用CCK-8法筛选出抑制OGD/RP模型细胞损伤的最大浓度用于后续实验研究。在96孔板中加入100 μL细胞悬液,贴壁后弃上清加入100 μL各组的试剂,孵育24 h;加入10 μL的CCK-8混匀并孵育4 h;用酶标仪测定450 nm波长下的吸光度。
1.5 细胞凋亡检测收集细胞离心后弃上清,加入磷酸盐缓冲溶液(PBS)重悬后进行细胞计数;取5万重悬细胞,离心后弃上清,加入195 μLAnnexin V-FITC结合液后孵育15 min;加入5 μL碘化丙啶染色液后孵育5 min;用流式细胞仪检测各组细胞凋亡程度。
1.6 细胞ROS活性测定收集各组细胞,离心并弃去上清,每管加入用DMEM培养基按1∶1 000稀释的DCFH-DA混匀,孵育20 min;后用DMEM洗涤3次,后用PBS重悬;用流式细胞仪测定各组细胞的ROS活性,采用CytExpert软件分析流式ROS结果。
1.7 线粒体膜电位(MMP)测定收集各组细胞,经PBS洗涤后,按照JC-1试剂盒说明书进行操作,依次加入1 mL的DMEM培养基及JC-1染色液,37 ℃、5% CO2孵育30 min,后用JC-1染色缓冲液洗涤3次,弃上清后加入2 mL的DMEM,用流式细胞仪观察结果,用CytExpert软件分析流式JC-1结果。
1.8 抗氧化酶SOD和GSH-Px水平收集每组培养的细胞,每组重复3次,后按照ELISA试剂盒的操作方式对抗氧化酶SOD、GSH-Px进行检测。
1.9 透射电镜观察线粒体自噬将各组细胞收集后离心后弃上清,细胞经过戊二醛固定、乙醇及丙酮脱水、环氧树脂浸透、包埋、超薄切片机切片、醋酸铀-柠檬酸铅染色后,用透射电镜观察并进行图片采集。
1.10 蛋白相对表达收集细胞后用蛋白试剂盒提取总蛋白,用BCA蛋白定量试剂盒进行蛋白定量,后通过SDS-凝胶电泳、转膜、封闭,后加入稀释后的一抗(兔抗Bax、Bcl- 2、cleaved-Caspase-3、Caspase-3、LC3B、PINK1、Parkin、JAK1、p-JAK1、STAT3、p-STAT3),4 ℃孵育过夜,加入二抗(羊抗兔),室温孵育2~3 h,ECL显色试剂盒显色后用凝胶成像仪拍照,分析其灰度值。以β-actin作为内参,计算目的蛋白的相对表达量。
1.11 统计学方法实验数据采用Graphpad8.4.3软件分析,计量资料用表示均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 岩藻多糖作用浓度筛选各组细胞经过处理后显微镜下观察到(见图 1A),与Control组相比,OGD/RP组细胞数量及增殖能力降低;与OGD/RP组相比,不同浓度的岩藻多糖组细胞数量增加,其中400 mg/kg岩藻多糖组细胞数目增加最为显著。岩藻多糖对OGD/RP模型细胞活性的影响结果显示(见图 1B),OGD/RP组细胞活性较Control组降低,差异具有统计学意义(P < 0.01);不同浓度的岩藻多糖组细胞活性均有不同程度的增加,其中400 mg/kg岩藻多糖组细胞活性升高(P < 0.01)。综上所述,选取400 mg/kg的岩藻多糖剂量用于后续实验研究。
|
| 注:A.细胞增殖情况;B.细胞活力统计情况;与Control组相比,**P<0.01;与OGD/RP组相比,#P<0.05,##P<0.01。 图 1 岩藻多糖对OGD/RP模型细胞活性的影响 Fig. 1 Effect of fucoidan on activity of OGD/RP model cells |
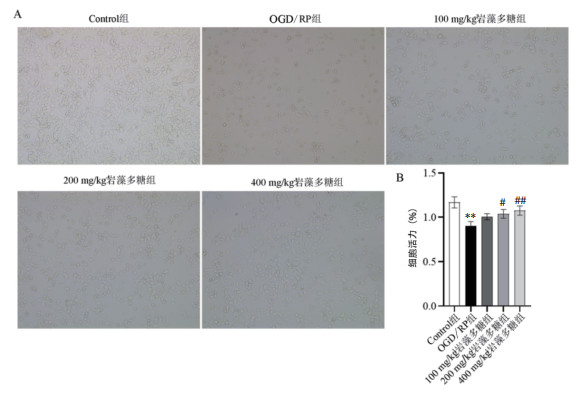
流式结果显示(见图 2A),OGD/RP组与Control组相比细胞凋亡率增加,差异具有统计学意义(P < 0.01);OGD/RP+岩藻多糖组与OGD/RP组相比细胞凋亡率降低,差异具有统计学意义(P < 0.01)。Western Bolt检测结果显示(见图 2B),OGD/RP组与Control组相比Bax/Bcl-2、cleaved-Caspase-3/Caspase-3的表达量增加,差异具有统计学意义(P < 0.01);OGD/RP+岩藻多糖组与OGD-RP组比较发现Bax/Bcl-2、cleaved-Caspase-3/Caspase-3的表达量降低,差异具有统计学意义(P < 0.01)。
|
| 注:A.流式细胞仪检测细胞凋亡;B. Western Blot检测凋亡相关蛋白的表达;与Control组相比,**P<0.01;与OGD/RP组相比,##P<0.01。 图 2 岩藻多糖具有降低OGD/RP模型细胞凋亡的作用 Fig. 2 Fucoidan can reduce apoptosis in OGD/RP model cells |
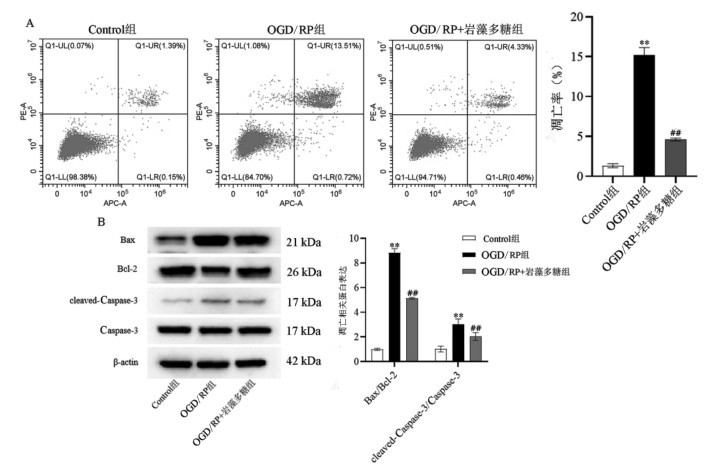
根据JC-1法检测PC12细胞线粒体膜电位(MMP)结果显示(见图 3),OGD/RP组的MMP值较Control组降低(P < 0.01);OGD/RP+岩藻多糖组的MMP值较OGD/RP组升高(P < 0.01),差异均具有统计学意义。
|
| 注:与Control组相比,**P<0.01;与OGD/RP组相比,##P<0.01。 图 3 岩藻多糖促进PC12细胞OGD/RP损伤线粒体膜电位的表达 Fig. 3 Fucoidan promotes mitochondrial membrane potential expression in PC12 cells injured by OGD/RP |
细胞中ROS检测结果显示(见图 4A-B),与Control组相比,OGD/RP组ROS含量增加(P < 0.01);OGD/RP+岩藻多糖组与OGD/RP组相比,细胞内ROS含量降低(P < 0.01),差异均具有统计学意义。通过ELISA检测各组细胞中抗氧化酶SOD、GSH-Px含量结果显示(见图 4C-D),OGD/RP组较Control组相比,细胞中SOD、GSH-Px的含量降低(P < 0.01);OGD/RP+岩藻多糖组较OGD/RP组相比SOD、GSH-Px的含量升高(P < 0.01),差异均具有统计学意义。

|
| 注:A. ROS流式细胞;B. ROS的FITC平均荧光强度统计;C. SOD含量统计;D. GSH-Px含量统计;与Control组相比,**P<0.01;与OGD/RP组相比,##P<0.01。 图 4 岩藻多糖对PC12细胞OGD/RP损伤中ROS、SOD和GSH-Px含量的影响 Fig. 4 Effect of fucoidan on ROS, SOD and GSH-Px contents in OGD/RP injury of PC12 cells |
透射电镜观察线粒体自噬结果可知(见图 5A),与Control组相比,OGD/RP组和OGD/RP+岩藻多糖组均出现了不同程度线粒体肿胀,可见部分细胞存在自噬,且存在溶酶体与自噬体融合的现象。OGD/RP+岩藻多糖组与OGD/RP组相比,线粒体自噬数量增多。对线粒体自噬相关蛋白的检测结果表明(见图 5B),OGD/RP组较Control组相比PINK1、Parkin蛋白的表达降低,差异具有统计学意义(P < 0.05),Lc3B无统计学差异;OGD/RP+岩藻多糖组较OGD/RP组相比PINK1、Parkin及Lc3B蛋白的相对表达量增加,差异具有统计学意义(P < 0.05或P < 0.01)。
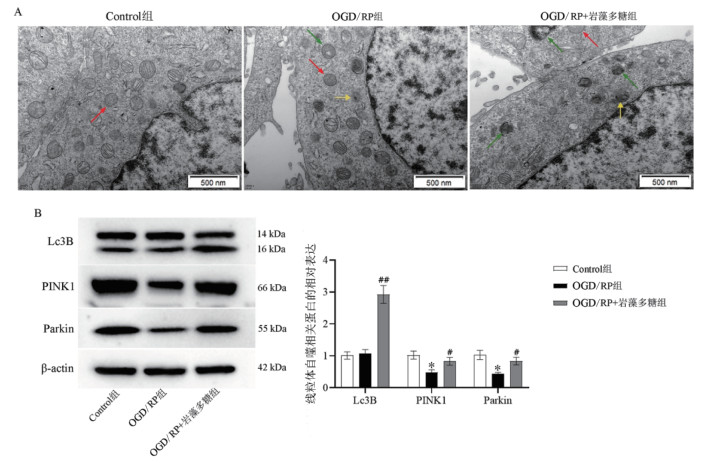
|
| 注:A. 电镜下线粒体形态结构(×20 000);B. 线粒体自噬相关蛋白的表达;红色箭头表示线粒体,绿色箭头表示自噬体,黄色箭头表示溶酶体;与Control组相比,*P<0.05;与OGD/RP组相比,#P<0.05,##P<0.01。 图 5 岩藻多糖对OGD/RP损伤细胞线粒体自噬的影响 Fig. 5 Effect of fucoidan on mitophagy in OGD/RP injured cells |
根据结果可知(见图 6),OGD/RP组与Control组相比,细胞中p-JAK1/JAK1、p-STAT/STAT3蛋白的相对表达量增加,差异具有统计学意义(P < 0.01);OGD/RP+岩藻多糖组较OGD/RP组相比,细胞中p-JAK1/JAK1、p-STAT/STAT3蛋白的相对表达量降低,差异具有统计学意义(P < 0.05或P < 0.01)。

|
| 注:与Control组相比,**P<0.01;与OGD/RP组相比,#P<0.05,##P<0.01。 图 6 Western blot对JAK1/STAT3通路相关蛋白的检测 Fig. 6 Detection of JAK1/STAT3 pathway-related proteins by Western blot |
根据Western Blot结果可知(见图 7),与pcDNA-NC组相比,pcDNA3.1-JAK1组细胞中p-JAK1/JAK1蛋白的相对表达增加,差异具有统计学意义(P < 0.05)。
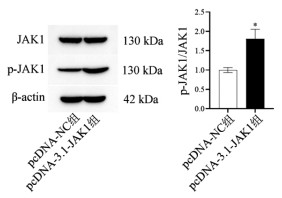
|
| 注:与pcDNA-NC组相比,*P<0.05。 图 7 过表达JAK1后细胞中JAK1的表达水平及磷酸化水平 Fig. 7 Expression and phosphorylation levels of JAK1 in cells after overexpression of JAK1 |
根据流式细胞仪检测PC12细胞线粒体膜电位结果显示(见图 8),OGD/RP组的MMP值较Control组降低,差异具有统计学意义(P < 0.01);OGD/RP损伤+岩藻多糖+pcDNA3.1-JAK1组与OGD/RP损伤+岩藻多糖+pcDNA-NC组相比,细胞中MMP值降低,差异具有统计学意义(P < 0.01)。
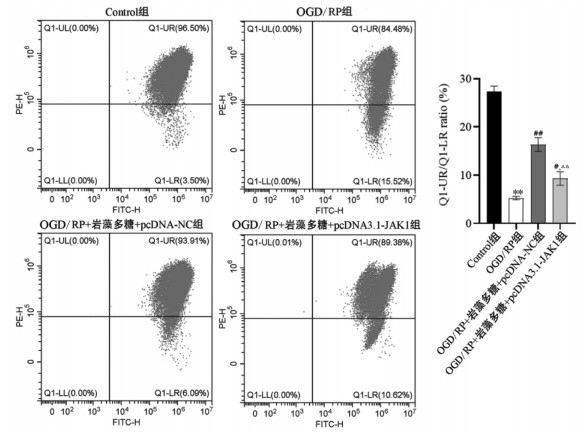
|
| 注:与Control组相比,**P<0.01;与OGD/RP组相比,#P<0.05,##P<0.01;与OGD/RP+岩藻多糖+ pcDNA-NC组相比,△△P<0.01。 图 8 过表达JAK1对岩藻多糖作用细胞OGD/RP损伤线粒体膜电位的影响 Fig. 8 Effect of fucoidan on mitochondrial membrane potential by regulating JAK/STAT pathway |
细胞中ROS检测结果表明(见图 9A-B),与Control组相比,OGD/RP组ROS含量增加,差异具有统计学意义(P < 0.01);OGD/RP+岩藻多糖组与OGD/RP组相比细胞内ROS含量降低,差异具有统计学意义(P < 0.01);OGD/RP损伤+岩藻多糖+pcDNA3.1-JAK1组与OGD/RP损伤+岩藻多糖+pcDNA-NC组相比细胞内ROS含量增高,差异具有统计学意义(P < 0.05)。通过ELISA检测各组细胞中抗氧化酶SOD、GSH-Px含量结果显示(见图 9C-D),OGD/RP组较Control组相比,细胞中SOD、GSH-Px的含量降低,差异具有统计学意义(P < 0.01);OGD/RP+岩藻多糖+pcDNA-NC组组较OGD/RP组相比,细胞中SOD、GSH-Px的含量升高,差异具有统计学意义(P < 0.01);OGD/RP损伤+岩藻多糖+pcDNA3.1-JAK1组与OGD/RP损伤+岩藻多糖+ pcDNA-NC组相比,细胞中SOD、GSH-Px的含量降低,差异具有统计学意义(P < 0.05)。
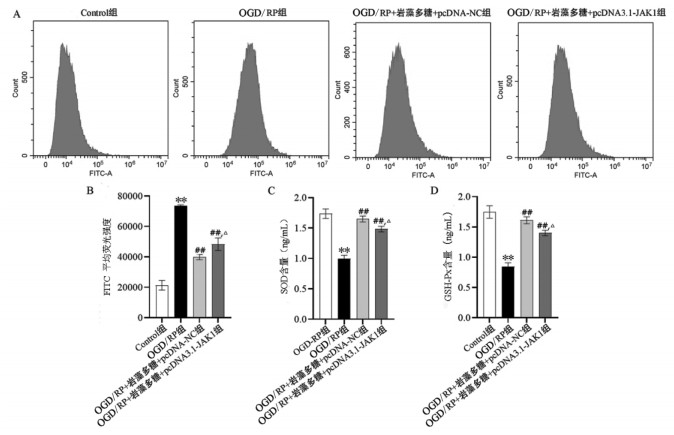
|
| 注:A. ROS流式细胞图;B. ROS的FITC平均荧光强度统计图;C. SOD含量统计图;D. GSH-Px含量统计图;与Control组相比,**P<0.01;与OGD/RP组相比,##P<0.01;与OGD/RP+岩藻多糖+pcDNA-NC组相比,△P<0.05。 图 9 过表达JAK1对岩藻多糖介导OGD/RP损伤细胞的氧化应激标志物的影响 Fig. 9 Effect of overexpression of JAK1 on oxidative stress markers in OGD/RP-injured cells exposed to fucoidan |
根据透射电镜结果可知(见图 10A),与Control组相比,OGD/RP组、OGD/RP+岩藻多糖组及OGD/RP+岩藻多糖组+pcDNA3.1-JAK1均出现了不同程度线粒体肿胀,可见部分细胞存在自噬,且存在溶酶体与自噬体融合的现象;OGD/RP损伤+岩藻多糖+ pcDNA3.1-JAK1组与OGD/RP损伤+岩藻多糖+pcDNA-NC组相比,细胞中线粒体自噬数目降低。Western Blot对线粒体自噬相关蛋白的检测结果表明(见图 10B),OGD/RP组较Control组相比,细胞中PINK1、Parkin蛋白的表达降低,差异具有统计学意义(P < 0.05),Lc3B无统计学差异;OGD/RP+岩藻多糖组及OGD/RP+岩藻多糖+pcDNA3.1-JAK1组与OGD/RP组相比,细胞中PINK1、Parkin及Lc3B蛋白的相对表达量增加,OGD/RP+岩藻多糖组增加更显著,差异具有统计学意义(P < 0.05);OGD/RP损伤+岩藻多糖+pcDNA3.1-JAK1组与OGD/RP损伤+岩藻多糖+ pcDNA-NC组相比,细胞中PINK1、Parkin及Lc3B蛋白表达降低,差异具有统计学意义(P < 0.05)。
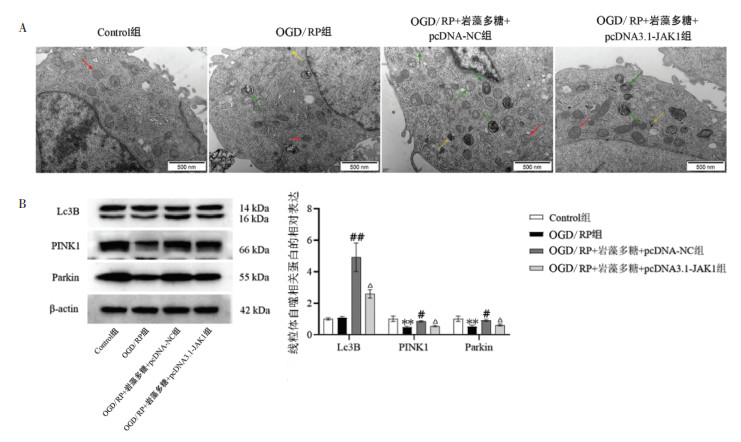
|
| 注:A. 电镜下线粒体形态结构(×20 000);B. 线粒体自噬相关蛋白的表达;红色箭头表示线粒体;绿色箭头表示自噬体;黄色箭头表示初级溶酶体;与Control组相比,**P<0.01;与OGD/RP组相比,#P<0.05,##P<0.01;与OGD/RP+岩藻多糖+ pcDNA-NC组相比,△P<0.05。 图 10 过表达JAK1对岩藻多糖介导OGD/RP损伤细胞自噬的影响 Fig. 10 Effct of overexpression of JAK1 on fucoidan-mediated autophagy in OGD/RP-injured cells |
缺血性脑卒中(IS)由于患者大脑缺氧缺血引起的脑组织损伤的一种疾病,主要以失语、偏瘫、痴呆等为主要临床症状[11]。患者经药物溶栓或血管内介入手术治疗后引起血液复流易加重神经元细胞损伤,造成CIRI[12]。目前还尚未有有效药物用于治疗,故寻找抗神经元损伤的药物尤为重要。前期研究表明,岩藻多糖对神经系统疾病具有较好的治疗作用,如可通过抑制活化的胶质细胞,减少细胞凋亡及氧化应激而有效地保护神经元免受短暂性脑缺血的损伤[13];而JAK/STAT信号通路作为脑缺血再灌注损伤的重要机制通路之一,不仅参与神经细胞的凋亡、增殖与分化,而且还是参与机体缺血、缺氧和氧化应激等过程[14-15]。故推测岩藻多糖能够通过抑制JAK/STAT信号通路而促进线粒体自噬来改善CIRI。
氧化应激是指抗氧化剂与ROS之间存在的一种不平衡的状态[16]。ROS产生于线粒体,在机体氧化应激损伤及维持机体正常生理活动起到重要作用[17-18]。当机体处于呼吸抑制或抗氧化能力衰退等不良条件下,线粒体膜电位的下降会导致机体中ROS大量产生,对机体造成损害[19]。研究证明,ROS的大量产生是缺血再灌注损伤的标志性指标之一,可能是导致神经细胞损伤的重要原因[20]。SOD和GSH-Px分别为抗氧化剂及抗氧化应激酶,是机体内抗氧化能力的重要指标[21]。研究结果表明,岩藻多糖不仅能够有效降低ROS含量,增加机体中SOD和GSH-Px含量,降低机体氧化应激的能力,而且还能通过降低线粒体膜电位,降低凋亡相关蛋白的表达,对CIRI的治疗起积极作用。
自噬是对受损或衰老的细胞器进行自主吞噬降解的过程,在CIRI的过程中起着重要作用。Lc3B是自噬的标志性蛋白,能够反应机体中自噬水平的高低。Pink1和Parkin作为帕金森病的主要致病蛋白,能够通过介导线粒体自噬以维护线粒体稳定[22]。而Pink1和Parkin在机体内含量减少会降低受损线粒体的降解能力,导致细胞出现死亡。研究证实,自噬对CIRI是一把双刃剑,维持自噬在神经细胞中的稳态十分关键,通常认为在CIRI的过程中神经细胞的自噬是处于上调状态,但也不能排除是由于机体中自噬体清除率降低而导致的该现象。研究证实,再灌注期间能够通过线粒体自噬清除损伤线粒体从而减轻CIRI;而在神经细胞中线粒体过度的自噬会造成有用的蛋白质和细胞器降解,从而加剧CIRI。研究表明缺血缺氧条件下造成的自噬会导致神经元细胞凋亡及损伤,且抑制自噬则会有降低CIRI海马区的细胞凋亡的作用[23]。研究表明,调控自噬相关蛋白可作为治疗CIRI的重要途径之一。JAK/STAT信号通路作为中枢神经系统的重要通路之一,不仅能够调节机体的氧化应激,而且还对机体自噬具有一定的影响。Liu等[24]表明能通过抑制JAK-STAT可通过激活自噬对肠道缺血再灌注起保护作用;通过调节JAK2-STAT3通路可改善CIRI后炎症反应、氧化应激及对神经元凋亡发挥保护作用[25]。因此在本研究中鉴定岩藻多糖是否能通过JAK1/STAT3相关蛋白来参与线粒体自噬的调控过程。研究结果表明,在OGD/RP模型细胞过表达JAK1会促进p-JAK1/JAK1、p-STAT/STAT3蛋白的表达,从而抑制线粒体自噬相关蛋白的表达。而岩藻多糖能够降低OGD/RP模型细胞中p-JAK1/JAK1、p-STAT/STAT3蛋白的表达,促进线粒体自噬数量及自噬相关蛋白的表达,表明岩藻多糖能够通过抑制JAK1/STAT3通路的激活,促进线粒体自噬,减轻细胞的OGD/RP损伤。
综上所述,岩藻多糖对PC12细胞的OGD/RP损伤具有较好的治疗作用,其机制可能是通过抑制JAK1/STAT3信号通路促进线粒体自噬而保护神经元免受糖氧剥夺/复氧损伤。
| [1] |
杨文亮. 黄芪甲苷对PC12细胞OGD/R损伤的保护作用及其作用机制研究[D]. 开封: 河南大学, 2016. YANG W L. Protective effect of astragaloside Ⅳ on PC12 cells injured by OGD/R and its mechanism of action research[D]. Kaifeng: Henan University, 2016. |
| [2] |
ZHANG S H, YE J L, DONG G X. Neuroprotective effect of baicalein on hydrogen peroxide-mediated oxidative stress and mitochondrial dysfunction in PC12 cells[J]. Journal of Molecular Neuroscience, 2010, 40(3): 311-320. DOI:10.1007/s12031-009-9285-5 |
| [3] |
顾超, 谭晓丹, 向葡, 等. ZNRF2抑制自噬保护氧糖剥夺/复糖复氧致PC12细胞损伤[J]. 中国药理学通报, 2021, 37(6): 768-774. GU C, TAN X D, XIANG P, et al. ZNRF2 attenuates PC12 cell injury caused by oxygen-glucose deprivation and reoxygenation through inhibiting autophagy[J]. Chinese Pharmacological Bulletin, 2021, 37(6): 768-774. DOI:10.3969/j.issn.1001-1978.2021.06.007 |
| [4] |
ZHU J R, LU H D, GUO C, et al. Berberine attenuates ischemia-reperfusion injury through inhibiting HMGB1 release and NF-κB nuclear translocation[J]. Acta Pharmacologica Sinica, 2018, 39(11): 1706-1715. DOI:10.1038/s41401-018-0160-1 |
| [5] |
FAN Y, LI Y K, YANG Y K, et al. Chlorogenic acid promotes angiogenesis and attenuates apoptosis following cerebral ischaemia-reperfusion injury by regulating the PI3K-Akt signalling[J]. Pharmaceutical Biology, 2022, 60(1): 1646-1655. DOI:10.1080/13880209.2022.2110599 |
| [6] |
MOON H G, CHO S C, JEONG S W, et al. Early versus late thrombolysis in acute arterial occlusion of lower extremity[J]. International Journal of Cardiology, 2017, 228(2): 86-89. |
| [7] |
于文霞, 刘跃, 王佳乐, 等. 蒺藜皂苷在心脑血管缺血再灌注损伤中的研究进展[J]. 中国现代医药杂志, 2022, 24(8): 93-95. YU W X, LIU Y, WANG J L, et al. Research progress of Tribulus terrestris saponins in cardiovascular and cerebrovascular ischemia-reperfusion injury[J]. Modern Medicine Journal of China, 2022, 24(8): 93-95. |
| [8] |
CHEN C, YU L T, CHENG B R, et al. Promising therapeutic candidate for myocardial ischemia/reperfusion injury: what are the possible mechanisms and roles of phytochemicals?[J]. Frontiers in Cardiovascular Medicine, 2021, 8(2): 792592. |
| [9] |
蒯云逸, 蒋和浩, 红雷, 等. 岩藻多糖对大鼠肾脏氧化应激、炎症和细胞凋亡的缓解作用[J]. 动物营养学报, 2022, 34(8): 5393-5403. KUAI Y Y, JIANG H H, HONG L, et al. Alleviating effects of fucoidan on oxidative stress, inflammation and apoptosis in kidney of rats[J]. Chinese Journal of Animal Nutrition, 2022, 34(8): 5393-5403. |
| [10] |
巨虎, 刘川川, 王虎, 等. 岩藻多糖调节JAK2/STAT3信号通路保护神经元免受缺氧缺糖/再灌注损伤[J]. 中国高原医学与生物学杂志, 2022, 43(1): 7-17. JU H, LIU C C, WANG H, et al. Fucoidan protecting neurons from OGD/RP injury by regulating JAK2/STAT3 signal channel[J]. Chinese High Altitude Medicine and Biology, 2022, 43(1): 7-17. |
| [11] |
CAMPBELL B C V, DE SILVA D A, MACLEOD M R, et al. Ischaemic stroke[J]. Nature Reviews Disease Primers, 2019, 5(1): 70. DOI:10.1038/s41572-019-0118-8 |
| [12] |
WEI X, LIU J Y, ZHANG W L, et al. Research advances in prevention and treatment of cerebral ischemia-reperfusion injury by targeting mitochondrial quality control[J]. China Journal of Chinese Materia Medica, 2022, 47(16): 4305-4313. |
| [13] |
KIM H, AHN J H, SONG M, et al. Pretreated fucoidan confers neuroprotection against transient global cerebral ischemic injury in the gerbil hippocampal CA1 area via reducing of glial cell activation and oxidative stress[J]. Biomedecine & Pharmacotherapie, 2019, 109(1): 1718-1727. |
| [14] |
KIM H C, KIM E, BAE J I, et al. Sevoflurane postconditioning reduces apoptosis by activating the JAK-STAT pathway after transient global cerebral ischemia in rats[J]. Journal of Neurosurgical Anesthesiology, 2017, 29(1): 37-45. DOI:10.1097/ANA.0000000000000331 |
| [15] |
KUMAR S, MEHAN S, NARULA A S. Therapeutic modulation of JAK-STAT, mTOR, and PPAR-γ signaling in neurological dysfunctions[J]. Journal of Molecular Medicine, 2023, 101(1/2): 9-49. |
| [16] |
ZENG J, ZHU L, LIU J, et al. Metformin protects against oxidative stress injury induced by ischemia/reperfusion via regulation of the lncRNA-H19/miR-148a-3p/Rock2 axis[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019(12): 8768327. |
| [17] |
DANDEKAR A, MENDEZ R, ZHANG K Z. Cross talk between ER stress, oxidative stress, and inflammation in health and disease[J]. Methods in Molecular Biology, 2015, 1292: 205-214. |
| [18] |
杨静, 贾圣琪, 汪煜, 等. 羟考酮与吗啡对大鼠心肌缺血再灌注损伤时氧化应激的影响[J]. 中国医院药学杂志, 2022, 42(15): 1528-1532. YANG J, JIA S Q, WANG Y, et al. Effect of oxycodone and morphine on reducing oxidative stress in rat myocardial ischemia reperfusion injury model[J]. Chinese Journal of Hospital Pharmacy, 2022, 42(15): 1528-1532. |
| [19] |
BISHT S, FAIQ M, TOLAHUNASE M, et al. Oxidative stress and male infertility[J]. Nature Reviews Urology, 2017, 14(8): 470-485. |
| [20] |
ZULUAGA M, GUEGUEN V, LETOURNEUR D, et al. Astaxanthin-antioxidant impact on excessive Reactive Oxygen Species generation induced by ischemia and reperfusion injury[J]. Chemico-Biological Interactions, 2018, 279(11): 145-158. |
| [21] |
IGHODARO O M, AKINLOYE O A. First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX): their fundamental role in the entire antioxidant defence grid[J]. Alexandria Journal of Medicine, 2018, 54(4): 287-293. |
| [22] |
WAUER T, SIMICEK M, SCHUBERT A, et al. Erratum: mechanism of phospho-ubiquitin-induced PARKIN activation[J]. Nature, 2015, 526(7575): 728. |
| [23] |
RAVANAN P, SRIKUMAR I F, TALWAR P. Autophagy: the spotlight for cellular stress responses[J]. Life Sciences, 2017, 188: 53-67. |
| [24] |
LIU Z, HU K, CHEN Y S, et al. JAK2/STAT3 inhibition attenuates intestinal ischemia-reperfusion injury via promoting autophagy: in vitro and in vivo study[J]. Molecular Biology Reports, 2022, 49(4): 2857-2867. |
| [25] |
DONG Y F, HU C Y, HUANG C X, et al. Interleukin-22 plays a protective role by regulating the JAK2-STAT3 pathway to improve inflammation, oxidative stress, and neuronal apoptosis following cerebral ischemia-reperfusion injury[J]. Mediators of Inflammation, 2021, 2021: 6621296. |
2. High Altitude Medicine Research Center of Qinghai University, Xining 810000, China
 2023, Vol. 40
2023, Vol. 40