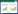文章信息
- 崔方强, 王悦芬, 蔡朕, 等.
- CUI Fangqiang, WANG Yuefen, CAI Zhen, et al.
- 保肾通络方抑制DN小鼠肾小球炎症和系膜基质增生减轻肾脏损伤机制研究
- Mechanism research of Baoshen Tongluo Formula inhibition on inflammation and extracellular matrix accumulation of glomeruli to reduce kidney demage in DN mice
- 天津中医药, 2023, 40(11): 1445-1450
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(11): 1445-1450
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.11.16
-
文章历史
- 收稿日期: 2023-07-15
糖尿病肾病(DN)已经成为中国终末期肾病(ESRD)及透析患者的主要原发肾脏疾病[1],但目前针对DN发病的关键病理机制缺少相对应的治疗措施。研究表明,肾小球炎症介导的系膜基质增生是DN发生及进展的重要病理机制[2]。而抑制炎症减轻系膜基质增生可能成为DN治疗的潜在靶点[3]。中医药在防治DN方面具有独特的优势,保肾通络方为首都医科大学附属北京中医医院肾病科临床经验方,被广泛应用于临床防治DN。保肾通络方治疗DN临床疗效确切,但其防治DN的分子机制目前尚不清楚。因此本研究观察了保肾通络方对于DN小鼠肾脏病理损伤、肾小球细胞外基质蛋白Ⅳ型胶原蛋白(Collagen Ⅳ)及纤连蛋白(FN)、肾小球炎症因子肿瘤坏死因子-α(TNF-α)及白细胞介素-6(IL-6)水平的影响,进而探讨其防治DN的分子机制。
1 材料和方法 1.1 实验动物本研究应用的KK-Ay小鼠及C57BL/6J小鼠均购自北京华阜康生物科技股份有限公司,其中KK-Ay小鼠30只,C57BL/6J小鼠10只,所有小鼠均为8周龄SPF级雄性,体质量为(25±5)g,实验动物生产许可证号:SCXK(京)2014-0004。小鼠在12 h光照/黑暗循环,温度(24±1)℃,湿度50%~70% 条件下饲养,并可自由进食进水。本研究已通过实验动物伦理委员会批准,动物造模及实验过程严格遵守动物福利伦理原则。
1.2 试剂和药物Collagen Ⅳ抗体(ab6586,abcam,英国)、FN抗体(ab2413,abcam,英国)、糖原(PAS)染色试剂盒(碧云天生物技术有限公司,C0142M)、苏木素-伊红(HE)染色试剂盒(碧云天生物技术有限公司,C0105S)、Masson染色试剂盒(武汉谷歌生物科技有限公司,G1006)、IL-6酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司,ml023130)、TNF-α、酶联免疫吸附测定(ELISA)试剂盒(上海酶联生物科技有限公司,ml077385)、尿蛋白定量检测试剂盒(南京建成,C035-2)、肌酐测定试剂盒(ROCHE,瑞士,657881)、尿素氮测定试剂盒(ROCHE,瑞士,658513)、缬沙坦胶囊(北京诺华制药有限公司,批号:X1440);保肾通络方颗粒剂,由首都医科大学附属北京中医医院药剂科制备。
1.3 主要仪器酶标仪(北京市新风机电技术公司,ZS-3)、离心机(美国Sigma,3K18)、全自动生化分析仪(上海科华生物工程股份有限公司,ZY1280)、倒置显微镜(德国Leica公司,DMIL-PH1)、凝胶化学发光成像分析系统(法国Vilber公司,FUSION FX6 XT)、高电流电泳电源(美国伯乐公司,1645052)。
1.4 实验方法 1.4.1 动物模型建立及分组给药首先建立DN小鼠模型,8周龄雄性KK-Ay小鼠予高脂饲料喂养,C57BL/6J小鼠予普通饲料饲养。4周后检测各组小鼠血糖及24 h尿蛋白定量。当KK-Ay小鼠血糖≥16.7 mmol/L,并且24 h尿蛋白明显高于C57BL/6J小鼠时,DN小鼠模型造模成功。DN小鼠以血糖、24 h尿蛋白定量并结合体质量进行分层,随机分为模型组、保肾通络方组及缬沙坦组,另外将C57BL/6J小鼠作为正常对照组,每组10只。保肾通络方予保肾通络方颗粒剂灌胃,灌胃剂量为20 g/(kg·d)(生药剂量),缬沙坦组予10 mg/(kg·d)缬沙坦灌胃,其余两组予等剂量蒸馏水灌胃,连续灌胃12周。
1.4.2 标本采集与处理于灌胃0、4、8和12周收集小鼠24 h尿液,检测尿蛋白水平。灌胃结束后,小鼠予戊巴比妥麻醉,心尖取血,静置20 min左右,离心半径8 cm,2 000 r/min离心20 min,分离血清,后检测血肌酐及尿素氮水平。摘取肾脏组织,一部分肾组织放入4%多聚甲醛固定,然后石蜡包埋切片,用于免疫组化及肾脏病理检测,另外部分放入-80 ℃冰箱,用于逆转录-聚合酶链反应(RT-PCR)检测及ELISA检测。
1.4.3 HE、PAS染色将石蜡切片进行脱蜡处理,然后将切片放入伊红或无色盐基性品红溶液对切片进行染色,染色结束后流水冲洗,后用苏木精对细胞核进行染色,程序性脱水透明后,封片,光镜下观察肾脏病理改变。
1.4.4 Masson染色将石蜡切片进行脱蜡处理,Weigert铁苏木素染色液染核5~10 min,1%盐酸酒精分化5~15 s,充分水洗,丽春红酸性品红液染5~10 min,用苯胺蓝液复染5 min,程序性脱水透明后,封片,光镜下观察肾脏病理改变。
1.4.5 酶联免疫法检测将各组小鼠肾组织用磷酸缓冲盐溶液(PBS)清洗,放置在冰上匀浆,应用离心机4 ℃、12 000×g、离心10 min,取离心后的上清液,应用BCA蛋白定量试剂盒测定上清液总蛋白浓度,根据ELISA试剂盒说明书操作步骤对肾组织中的IL-6、TNF-α水平进行检测。
1.4.6 免疫组化首先将石蜡切片脱蜡,然后将一抗稀释成特定浓度(Collagen Ⅳ 1∶1 000;FN 1∶1 000),一抗稀释液滴加到不同组别切片上,4 ℃孵育过夜,后流水冲洗,加入二抗37 ℃孵育1 h,用苏木精进行染核,封片。光镜下观察蛋白表达水平。
1.4.7 RT-PCR首先对肾脏总RNA进行提取,然后将mRNA反转录成为cDNA,对cDNA进行扩增和荧光定量分析。采用2-ΔΔCT法进行数据的相对定量分析,所有操作均按照产品说明书进行。利用Primer 5.0软件设计引物序列,见表 1。
采用SPSS20.0进行统计处理,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析(one-way ANOVA),多重比较采用LSD检验,P < 0.05表示有统计学差异。
2 结果 2.1 各组小鼠一般状态比较正常对照组小鼠毛发光泽,对外界刺激反应灵敏,精神状态良好;而模型组小鼠毛色晦暗,反应迟钝,精神萎靡,并出现多饮和形体消瘦;而保肾通络方组和缬沙坦组小鼠一般状态均较模型组有不同程度的改善。
2.2 保肾通络方对DN小鼠24 h尿蛋白水平的影响正常对照组小鼠24 h尿蛋白水平在整个实验期间均维持在低水平。与正常对照组相比,模型组小鼠在不同时间节点其24 h尿蛋白水平均有不同程度升高(P < 0.05),并且随着时间延长,其尿蛋白水平呈现逐渐升高的趋势。与模型组相比,保肾通络方及缬沙坦组小鼠在灌胃4、8和12周其24 h尿蛋白水平均有明显下降(P < 0.05)。见图 1。
|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。 图 1 各组小鼠不同时间点24 h尿蛋白的比较(n=10) Fig. 1 Comparison of 24 h proteinuria from mice in different groups(n=10) |
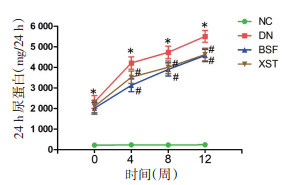
模型组小鼠血肌酐及尿素氮水平较正常对照组明显升高(P < 0.05);与模型组相比,保肾通络方组及缬沙坦组小鼠血肌酐、尿素氮水平均有明显下降(P < 0.05)。见图 2。
|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。 图 2 各组小鼠血肌酐(A)及血尿素氮(B)水平比较(x±s,n=10) Fig. 2 Comparison of Scr (A) and BUN (B) from mice in different groups(x±s, n=10) |
正常对照组小鼠肾小球系膜细胞较少,细胞外基质正常;与正常对照组相比,模型组小鼠肾小球系膜细胞明显增多,细胞外基质增生明显。与模型组相比,保肾通络方组及缬沙坦组小鼠肾小球系膜细胞减少,细胞外基质增生减轻。见图 3。

|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。 图 3 各组小鼠肾小球肾脏病理改变比较(×200) Fig. 3 Comparison of renal pathology from mice in different groups (×200) |
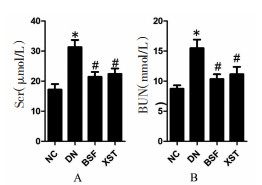
与正常对照组相比,模型组小鼠肾小球细胞外基质FN蛋白及mRNA表达明显上调(P < 0.05);与模型组相比,保肾通络方组及缬沙坦组小鼠肾小球细胞外基质FN蛋白及mRNA表达明显下调(P < 0.05)。见图 4。
|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。图A的放大倍数为200倍。图B、图C与正常对照组比较,*P<0.05;与模型组比较,#P<0.05(x±s,n=10)。 图 4 各组小鼠足细胞FN蛋白(A-B)及mRNA(C)表达水平的比较 Fig. 4 Comparison of FN protein (A-B) and mRNA (C) expression levels in mice podiocytes in each group |
与正常对照组相比,模型组小鼠肾小球细胞外基质Collagen Ⅳ蛋白及mRNA表达明显上调(P < 0.05);与模型组相比,保肾通络方组及缬沙坦组小鼠肾小球细胞外基质Collagen Ⅳ蛋白及mRNA表达明显下调(P<0.05)。见图 5。
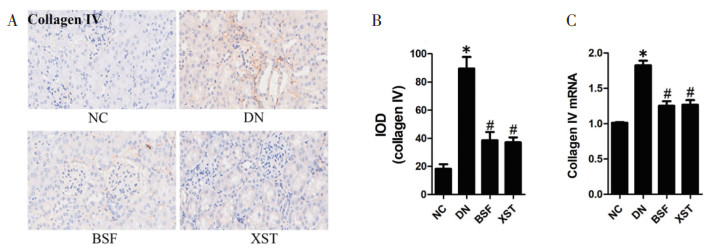
|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。图A的放大倍数为200倍。图B、图C与正常对照组比较,*P<0.05;与模型组比较,#P<0.05(x±s,n=10)。 图 5 各组小鼠足细胞FSP-1蛋白(A-B)及mRNA(C)表达水平的比较 Fig. 5 Comparison of expression levels of FSP-1 protein (A-B) and mRNA (C) in micee podiocytes in each group |
与正常对照组相比,模型组小鼠肾组织TNF-α及IL-6水平明显升高(P < 0.05);与模型组相比,保肾通络方组及缬沙坦组小鼠肾组织TNF-α及IL-6水平明显降低(P < 0.05)。见图 6。
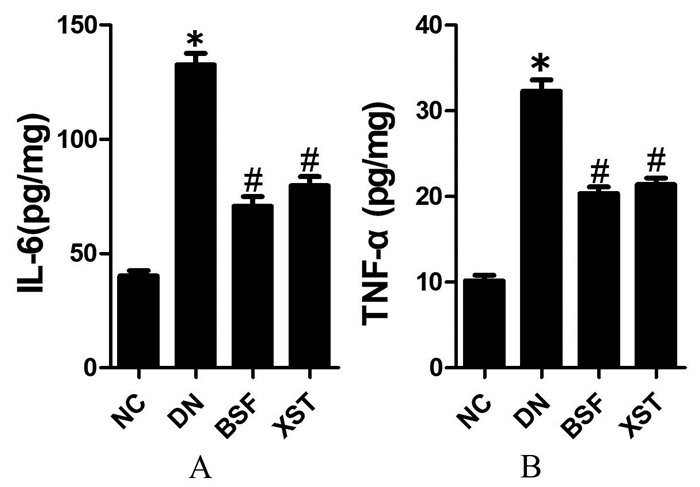
|
| 注:NC.正常对照组;DN.模型组;BSF.保肾通络方组;XST.缬沙坦组。与正常对照组比较,*P<0.05;与模型组比较,#P<0.05。 图 6 各组小鼠肾组织IL-6(A)及TNF-α(B)水平比较(x±s,n=10) Fig. 6 Comparison of IL-6 (A) and TNF-α (B) expression from mice in different groups(x±s, n=10) |
DN发病率逐年升高,已经成为导致终末期肾病(ESRD)主要的原发肾脏疾病[4]。目前关于DN的治疗取得了一些进展,包括应用钠-葡萄糖协同转运蛋白2(SGLT-2)抑制剂和胰高血糖素样肽-1(GLP-1)受体激动剂,但这些药物在中重度肾功能受损患者仍需减量或者停药[5]。此外尽管采取了以上积极早期的临床干预措施,仍有很多患者快速进入ESRD。因此积极探讨DN的发病机制,进而寻求其潜在治疗靶点及新的治疗策略显得尤为重要。
肾小球系膜细胞增多及细胞外基质增生是DN特征性的病理改变[6]。其中细胞外基质增生是导致DN肾小球纤维化及疾病进展的重要病理机制[7]。肾小球细胞外基质主要包括Collagen Ⅳ和FN,其中FN是一种大分子糖蛋白,广泛存在于细胞外基质、基膜及体液中,并在细胞外基质中相互交叉,形成网络,为其他细胞外基质成分沉积提供支架[8]。Collagen Ⅳ是一种基膜胶原,存在于上皮细胞、血管内皮细胞基膜中。Collagen Ⅳ同时也是肾小球系膜基质及基底膜的主要成分,其在系膜细胞间相互交叉呈网状结构[9]。生理情况下,肾小球细胞外基质生成和降解处于动态平衡。在DN中,肾小球系膜细胞外基质生成增多,降解减少,进而引起细胞外基质累积。而抑制肾小球细胞外基质蛋白FN及Collagen Ⅳ生成,减轻细胞外基质增生可以有效的延缓DN疾病进展[10]。
炎症介导肾小球系膜基质增生是DN发生及进展的重要病理机制。DN患者肾小球处于一种局部的、非显性的慢性低度炎症,并非由病原微生物引起,而是与多种致炎因子相关的免疫性炎症[11]。研究发现,高糖等病理因素会引起巨噬细胞、中性粒细胞等炎性细胞在肾小球浸润,并释放相关炎性因子[12]。而炎性因子可作用于肾脏固有细胞,引起系膜细胞增殖及细胞外基质增生,进而引起肾小球纤维化,最终导致蛋白尿的产生及肾功能的进展[13]。其中IL-6及TNF-α是介导DN肾小球炎症及系膜基质增生的重要炎性因子。研究发现,DN患者IL-6水平较无肾脏损伤人群明显升高,且随着IL-6水平的升高,其肾小球系膜细胞基质增生呈现逐渐加重趋势[14]。TNF-α不仅可以直接介导系膜细胞损伤,同时可以刺激成纤维细胞生长和局部胶原的增加,在肾纤维化中发挥作用[15]。
中医药在防治DN方面具有独特的优势,并显示出较好的减轻炎症抑制系膜基质增生作用[16-17]。全国名老中医张炳厚教授长期从事中医药防治DN的临床研究工作,提出“肾气精两虚,肾失封藏,肾络闭阻”是DN发病的核心病机,并主张治疗糖尿病肾病应采用补肾活血通络的治疗原则。保肾通络方是在补肾活血通络的治则指导下组方而成,由黄芪、熟地黄、菟丝子、刘寄奴、鬼箭羽、水蛭、丹参组成,本研究在补肾药物基础上加入虫蚁通络药和辛润通络药。方中熟地黄滋阴补肾,重用为君药,黄芪健脾益气,菟丝子补肾涩精,三者配伍,共奏益气养阴、补益脾肾之效,加用丹参、刘寄奴、鬼箭羽活血化瘀通络,但糖尿病肾病肾络闭阻日久,单凭草木之力难以起效,加用水蛭加强通络之力。临床试验已经证实,保肾通络方对于DN患者具有较好的降低尿蛋白、改善肾功能的作用[18]。此外基础实验证实,保肾通络方能够减轻DN小鼠足细胞损伤,延缓疾病进展[19]。但是保肾通络方对DN肾小球炎症及系膜基质增生的作用目前并不清楚。
因此,课题组进行了前期动物实验研究,设立了保肾通络方低、中、高剂量组,实验结果证实,中剂量组[20 g/(kg·d)]小鼠肾功能改善明显优于其他两个剂量组,因此本实验中保肾通络方的给药剂量为20 g/(kg·d)。研究结果显示保肾通络方能够显著降低DN小鼠蛋白尿,降低DN小鼠血肌酐、血尿素氮水平。此外保肾通络方可以降低DN小鼠肾小球系膜细胞数目,减轻肾小球细胞外基质增生,改善肾脏病理。基于FN及Collagen Ⅳ在DN肾小球细胞外基质增生中的重要作用,本课题观察了不同组别小鼠肾小球FN及Collagen Ⅳ的表达情况。结果显示,保肾通络方能够明显下调DN小鼠肾小球FN及Collagen Ⅳ蛋白及mRNA表达。与此同时,保肾通络方可以降低DN小鼠肾组织炎性因子IL-6及TNF-α水平。本实验研究结果表明,保肾通络方能够降低DN蛋白尿,保护肾功能。同时保肾通络方能够下调FN和Collagen Ⅳ表达,降低炎性因子IL-6和TNF-α水平,减轻肾小球炎症及系膜基质增生。至于其减轻DN肾小球炎症和系膜基质增生的详细的分子机制有待进一步研究。
| [1] |
LIN Y C, CHANG Y H, YANG S Y, et al. Update of pathophysiology and management of diabetic kidney disease[J]. Journal of the Formosan Medical Association, 2018, 117(8): 662-675. DOI:10.1016/j.jfma.2018.02.007 |
| [2] |
XIANG E, HAN B, ZHANG Q, et al. Human umbilical cord-derived mesenchymal stem cells prevent the progression of early diabetic nephropathy through inhibiting inflammation and fibrosis[J]. Stem Cell Research & Therapy, 2020, 11(1): 336. |
| [3] |
WU M, HAN W X, SONG S, et al. NLRP3 deficiency ameliorates renal inflammation and fibrosis in diabetic mice[J]. Molecular and Cellular Endocrinology, 2018, 478: 115-125. DOI:10.1016/j.mce.2018.08.002 |
| [4] |
FU H Y, LIU S, BASTACKY S I, et al. Diabetic kidney diseases revisited: a new perspective for a new era[J]. Molecular Metabolism, 2019, 30: 250-263. DOI:10.1016/j.molmet.2019.10.005 |
| [5] |
SAWAF H, THOMAS G, TALIERCIO J J, et al. Therapeutic advances in diabetic nephropathy[J]. Journal of Clinical Medicine, 2022, 11(2): 378. DOI:10.3390/jcm11020378 |
| [6] |
QI C Y, MAO X, ZHANG Z G, et al. Classification and differential diagnosis of diabetic nephropathy[J]. Journal of Diabetes Research, 2017, 2017: 8637138. |
| [7] |
WANG J Y, YANG Q Q, NIE Y X, et al. Tetrahydrobiopterin contributes to the proliferation of mesangial cells and accumulation of extracellular matrix in early-stage diabetic nephropathy[J]. The Journal of Pharmacy and Pharmacology, 2017, 69(2): 182-190. DOI:10.1111/jphp.12677 |
| [8] |
GONG W Y, LI J, CHEN Z Q, et al. Polydatin promotes Nrf2-ARE anti-oxidative pathway through activating CKIP-1 to resist HG-induced up-regulation of FN and ICAM-1 in GMCs and diabetic mice kidneys[J]. Free Radical Biology and Medicine, 2017, 106: 393-405. DOI:10.1016/j.freeradbiomed.2017.03.003 |
| [9] |
ZHANG B, SHI Y Q, ZOU J J, et al. High glucose stimulates cell proliferation and Collagen Ⅳ production in rat mesangial cells through inhibiting AMPK-KATP signaling[J]. International Urology and Nephrology, 2017, 49(11): 2079-2086. DOI:10.1007/s11255-017-1654-3 |
| [10] |
WANG S Y, ZHAO X X, YANG S X, et al. Salidroside alleviates high glucose-induced oxidative stress and extracellular matrix accumulation in rat glomerular mesangial cells by the TXNIP-NLRP3 inflammasome pathway[J]. Chemico-Biological Interactions, 2017, 278: 48-53. DOI:10.1016/j.cbi.2017.10.012 |
| [11] |
李响. 糖尿病肾病微炎症状态与"瘀"的关系探讨[J]. 新中医, 2021, 53(1): 198-201. LI X. Study on the relationship between micro-inflammation state of diabetic nephropathy and blood stasis[J]. Journal of New Chinese Medicine, 2021, 53(1): 198-201. |
| [12] |
TANIGUCHI K, XIA L, GOLDBERG H J, et al. Inhibition of Src kinase blocks high glucose-induced EGFR transactivation and collagen synthesis in mesangial cells and prevents diabetic nephropathy in mice[J]. Diabetes, 2013, 62(11): 3874-3886. DOI:10.2337/db12-1010 |
| [13] |
LIU Y H. Cellular and molecular mechanisms of renal fibrosis[J]. Nature Reviews Nephrology, 2011, 7(12): 684-696. DOI:10.1038/nrneph.2011.149 |
| [14] |
SUZUKI D, MIYAZAKI M, NAKA R, et al. In situ hybridization of interleukin 6 in diabetic nephropathy[J]. Diabetes, 1995, 44(10): 1233-1238. DOI:10.2337/diab.44.10.1233 |
| [15] |
CHEN Y L, QIAO Y C, XU Y, et al. Serum TNF-α concentrations in type 2 diabetes mellitus patients and diabetic nephropathy patients: a systematic review and Meta-analysis[J]. Immunology Letters, 2017, 186: 52-58. DOI:10.1016/j.imlet.2017.04.003 |
| [16] |
王军媛, 赵建红, 刘颖, 等. 芪明颗粒对早期糖尿病肾病炎症因子及尿微量白蛋白的影响[J]. 天津中医药大学学报, 2017, 36(2): 113-116. WANG J Y, ZHAO J H, LIU Y, et al. Effect of Qiming Granule on inflammatory factors and urinary micro albumin in early diabetic nephropathy[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2): 113-116. |
| [17] |
程丽颖, 张翥, 马继伟, 等. 加味升降散辅助治疗Ⅳ期糖尿病肾病患者的临床疗效观察[J]. 天津中医药大学学报, 2022, 41(2): 182-187. CHENG L Y, ZHANG Z, MA J W, et al. Clinical effect of modified Shengjiang Powder in patients with Ⅳ-stage diabetic nephropathy[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(2): 182-187. |
| [18] |
孟元, 赵文景, 陈东, 等. 保肾通络方治疗糖尿病肾脏病(G3期)的前瞻性非随机对照研究[J]. 世界科学技术-中医药现代化, 2020, 22(6): 1807-1814. MENG Y, ZHAO W J, CHEN D, et al. Prospective, clinical, non-randomized controlled trial of Baoshen Tongluo Recipe in the treatment of diabetic kidney disease(G3 stage)[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2020, 22(6): 1807-1814. |
| [19] |
崔方强, 赵文景, 高彦彬, 等. 保肾通络方对DN模型小鼠肾脏病理改变及足细胞损伤的影响研究[J]. 江苏中医药, 2019, 51(8): 82-85. CUI F Q, ZHAO W J, GAO Y B, et al. An impact study of Baoshen Tongluo Fang to pathological changes of kidney and podocyte lesion of mouse models with DN[J]. Jiangsu Journal of Traditional Chinese Medicine, 2019, 51(8): 82-85. |
 2023, Vol. 40
2023, Vol. 40