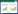文章信息
- 乔晓莉, 曹宁宁, 王清果, 等.
- QIAO Xiaoli, CAO Ningning, WANG Qingguo, et al.
- 清热利胆片HPLC指纹图谱建立及多成分含量测定研究
- Establishment of HPLC fingerprint and determination of multi-componentsof Qingre Lidan Tablet
- 天津中医药, 2023, 40(11): 1457-1465
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(11): 1457-1465
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.11.18
-
文章历史
- 收稿日期: 2023-07-12
2. 天津中医药大学第二附属医院,天津 300250;
3. 天津中医药大学中药学院,天津 301617;
4. 天津中医药大学研究生院,天津 301617
清热利胆片是天津市南开医院研制的院内中药制剂,由茵陈、金钱草、夏枯草、大黄、黄芩、厚朴6味药组成。方中茵陈清利湿热、利胆退黄,且为黄疸要药,为君药;金钱草利湿退黄、利尿通淋,夏枯草清肝泻火、散结消肿,两者合用增强组方利胆之功效,共为臣药;大黄清热泻火、泻下攻积,黄芩清热燥湿、泻火解毒,厚朴燥湿消痰、下气除满,三者共为佐药,泄化湿热。6味药共奏清热利胆之效,临床用于治疗急性单纯性和轻度化脓性胆囊炎、胆管炎,急性胆囊胰腺炎,胆道术后综合征等,疗效显著[1]。清热利胆片的化学成分复杂,现院内制定的制剂质量控制标准仅测定大黄素和大黄酚的含量,难以对清热利胆片进行较为全面的评价,且目前关于清热利胆片的报道较少,仅1篇文献测定了清热利胆片中10个成分的含量[2]。为较全面地反映清热利胆片的内在质量,提高质量评价水平,需建立一套灵敏、稳定的清热利胆片质量评价方法。
中药指纹图谱作为中药质量评价的重要方法,可反映化学成分的整体组成和特征[3],但无法在“量”上为制剂提供质量保证,而这正是多成分定量分析的优势[4]。中药指纹图谱与多成分含量测定相结合,可更好地反映中药制剂的内在质量,且近年来中药指纹图谱结合多成分含量测定的方法已逐渐应用于中药制剂的质量评价[5]。因此,本研究建立了15批清热利胆片的高效液相色谱(HPLC)指纹图谱,同时对其中14个成分进行多成分含量测定,以期提高清热利胆片质量评价水平。
1 仪器与试剂 1.1 仪器Agilent 1260高效液相色谱仪(美国Agilent公司);Eclipse XDB-C18色谱柱(美国Agilent公司);SHIMADZU AUW120D分析天平(日本岛津公司);SHB-Ⅲ循环水式真空泵(河南省予华仪器有限公司);DK-98-Ⅱ电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 试剂与药品绿原酸(批号:110753-202119,纯度为96.3%),芦丁(批号:100080-201811,纯度为92.4%),金丝桃苷(批号:111521-201809,纯度为94.9%),迷迭香酸(批号:111871-202007,纯度为98.1%),黄芩苷(批号:110715-202223,纯度为97.2%),槲皮素(批号:100081-201610,纯度为99.80%),芦荟大黄素(批号:110795-201710,纯度为98.3%),大黄酸(批号:110757-201607,纯度为99.30%),大黄素(批号:110756-201512,纯度为98.7%),和厚朴酚(批号:110730-201915,纯度为99.8%),厚朴酚(批号:110729-202015,纯度为99.0%),大黄酚(批号:110796-201922,纯度为99.4%),大黄素甲醚(批号:110758-201817,纯度为99.2%)均购自中国食品药品检定研究院;山奈酚(批号:520-18-3,纯度为98.0%)购自上海源叶生物科技有限公司;乙腈(色谱纯,DIKMA公司);甲醇(色谱纯,天津市康科德科技有限公司);磷酸(分析纯,天津市化学试剂供销公司);实验用水为娃哈哈饮用纯净水,其他试剂均为分析纯。15批清热利胆片均为天津市南开医院研制的院内中药制剂,编号分别为S1~S15,具体信息见表 1。
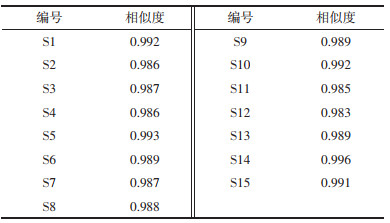
精密称取绿原酸、芦丁、金丝桃苷、迷迭香酸、黄芩苷、槲皮素、山奈酚、芦荟大黄素、大黄酸、大黄素、和厚朴酚、厚朴酚、大黄酚、大黄素甲醚对照品适量,加甲醇配制成质量浓度为500.33、200.79、101.49、500.52、3005.21、500.62、399.01、350.97、380.28、415.74、898.26、2002.13、967.25、246.92 μg/mL的混合对照品溶液。测定前用甲醇稀释0、5、10、20、40和80倍,得到系列质量浓度的混合对照品溶液。
2.1.2 清热利胆片供试品溶液的制备取清热利胆片10片,研细,取约1 g,精密称定,置于塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声(360 W,40 kHz)30 min,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,0.22 μm滤膜滤过,取续滤液,即得。
2.1.3 阴性供试品及单味药材溶液的制备按照清热利胆片处方制备工艺,制备茵陈、金钱草、夏枯草、大黄、黄芩、厚朴的阴性样品,再按“2.1.2”项下方法制得各阴性供试品溶液。取各单味药材,按“2.1.2”项下方法制备单味药材溶液。
2.2 指纹图谱研究 2.2.1 色谱条件色谱柱:Eclipse XDB-C18(5 μm,4.6 mm×250 mm);流动相:0.1%磷酸水(A)-乙腈(B);梯度洗脱:0~22 min,5%~20% B;22~61 min,20%~41% B;61~67 min,41%~60% B;67~74 min,60%~66% B;74~83 min,66%~85% B;83~83.1 min,85%~5% B;83.1~86 min,5% B;流速:1.0 mL/min;柱温:35 ℃;进样量:10 μL;检测波长:294 nm。
2.2.2 方法学考察1)精密度实验。取同一份清热利胆片(S7)按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件连续进样6次,记录图谱数据。选取黄芩苷(28号峰)作为参照,各共有峰相对保留时间的RSD值为0.11%~0.25%,相对峰面积的RSD值为0.20%~0.79%,表明仪器精密度良好。
2)重复性实验。取6份清热利胆片(S7)按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样,记录图谱数据。选取黄芩苷(28号峰)作为参照,各共有峰相对保留时间的RSD值为0.29%~0.56%,相对峰面积的RSD值为1.41%~2.93%,表明该方法重复性良好。
3)稳定性实验。取同一份清热利胆片(S7)按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件分别于0、2、4、6、8、10、24 h进样,记录图谱数据。选取黄芩苷(28号峰)作为参照,各共有峰相对保留时间的RSD值为0.09%~0.23%,相对峰面积的RSD值为0.96%~1.27%,表明供试品溶液24 h内稳定性良好。
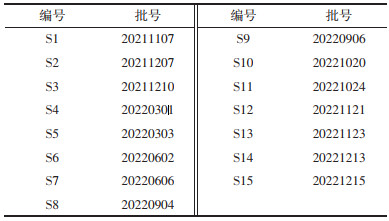
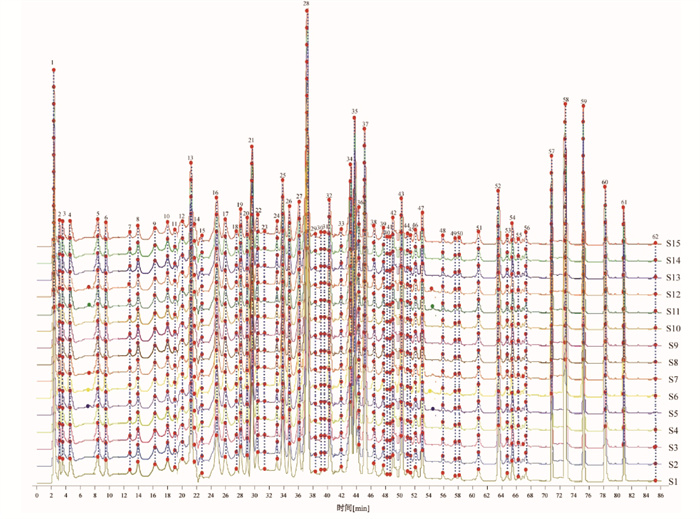
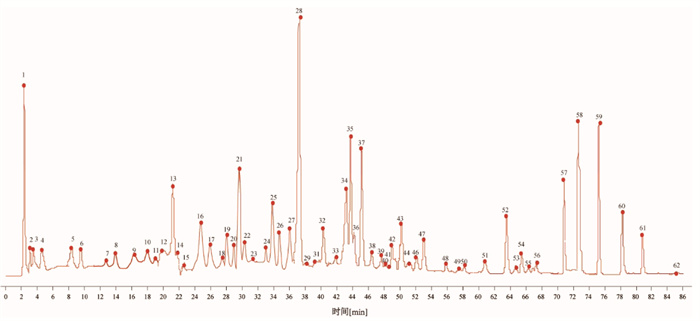
2.2.3 指纹图谱的建立及相似度分析取15批清热利胆片按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样,将图谱数据导入国家药典委员会开发的中药色谱指纹图谱相似度评价系统(2012版)进行数据匹配,以S7为参照色谱图,采用中位数法,时间窗宽度设为0.1 min,进行多点校正和色谱峰匹配,得到15批样品的指纹图谱和对照指纹图谱,分别见图 1和图 2,共标定出62个共有峰,计算15批样品的相似度在0.983~0.996,结果见表 2。15批清热利胆片的指纹图谱相似度均大于0.983,表明清热利胆片批次间一致性良好,整体质量稳定。
|
|
|
|
|
|
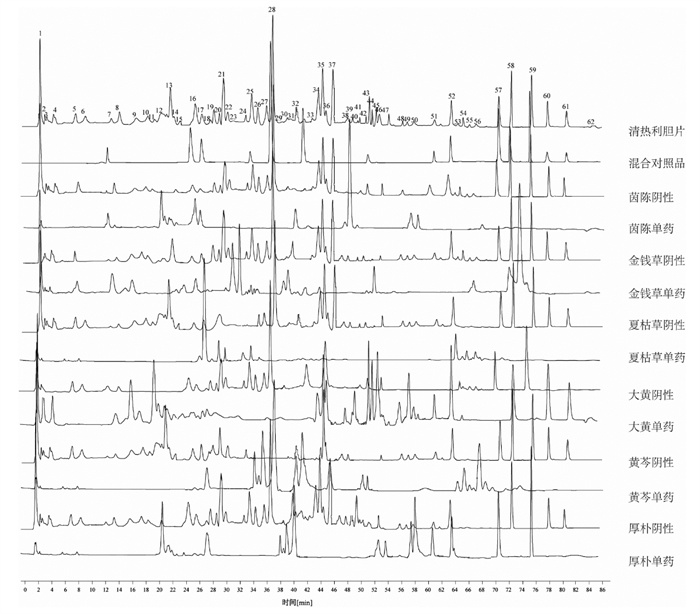
取清热利胆片供试品溶液、混合对照品溶液、各阴性供试品及单味药材溶液,按“2.2.1”项下色谱条件进样,记录图谱数据,并对共有峰进行归属,其中7、12~14、16、17、32、38~40、49、50号峰归属于茵陈,2、5、7、15、16、22、23、29、30、33、43号峰归属于金钱草,18、20、21、24、25、53~56号峰归属于夏枯草,1、3、4、8~14、34~36、38~41、44~52、58、60~62号峰归属于大黄,19、26~28、32、33、37、42、43、53~56号峰归属于黄芩,13~15、31、32、46、47、49~52、57、59号峰归属于厚朴。经对照品比对指认14个色谱峰,分别为7号峰绿原酸、16号峰芦丁、17号峰金丝桃苷、25号峰迷迭香酸、28号峰黄芩苷、33号峰槲皮素、43号峰山奈酚、51号峰芦荟大黄素、52号峰大黄酸、57号峰厚朴酚、58号峰大黄素、59号峰厚朴酚、60号峰大黄酚、61号峰大黄素甲醚。
2.3 多成分含量测定 2.3.1 色谱条件色谱条件同“2.2.1”。
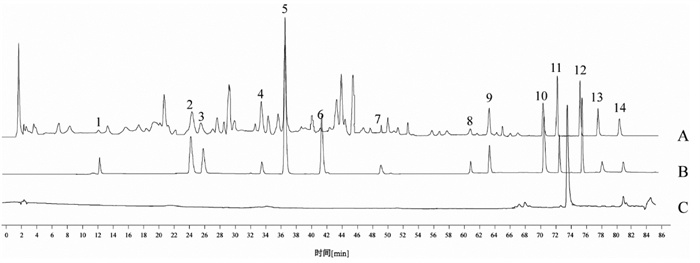
2.3.2 方法学考察1)专属性考察。取空白溶剂、混合对照品溶液、清热利胆片样品溶液,按“2.2.1”项下色谱条件进样,色谱图如图 4。结果表明,混合对照品溶液与供试品溶液在相同保留时间处均有相应的色谱峰出现,且空白溶剂指标性成分出峰处无干扰,说明方法专属性良好。
|
| 注:A. 清热利胆片样品,B. 混合对照品,C. 空白溶剂。1.绿原酸,2.芦丁,3.金丝桃苷,4.迷迭香酸,5.黄芩苷,6.槲皮素,7.山奈酚,8.芦荟大黄素,9.大黄酸,10.和厚朴酚,11.大黄素,12.厚朴酚,13.大黄酚,14.大黄素甲醚。 图 4 专属性考察色谱图 Fig. 4 Chromatograms for investigation of specificity |
|
|
注:7.绿原酸,16.芦丁,17.金丝桃苷,25.迷迭香酸,28.黄芩苷,33.槲皮素,43.山奈酚,51.芦荟大黄素,52.大黄酸,57.和厚朴酚,58.大黄素,59.厚朴
酚,60.大黄酚,61.大黄素甲醚。
|
2)线性关系考察。取“2.1.1”项下稀释后的系列质量浓度的混合对照品溶液,按“2.2.1”项下色谱条件进样,记录各对照品的色谱峰面积,以色谱峰面积为纵坐标(y),各对照品浓度为横坐标(x),绘制标准曲线,计算回归方程,结果见表 3,各对照品线性关系良好。
3)精密度实验。取同一份清热利胆片(S7)按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件连续进样6次。14个成分峰面积的 RSD 值为 0.12%~0.85%,表明仪器精密度良好,符合含量测定的要求。
4)重复性实验。取同一批清热利胆片(S7)6份,按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样。14个成分峰面积的 RSD 值为 1.34%~2.10%,表明该方法重复性良好,符合含量测定的要求。
5)稳定性实验。取同一份清热利胆片(S7)按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件分别于0、2、4、6、8、10、24 h进样。14个成分峰面积的 RSD 值为 0.49%~1.26%,表明供试品在24 h内稳定,符合含量测定的要求。
6)加样回收率实验。取同一批已知含量的清热利胆片(S7)6份,每份约 0.05 g,分别按样品:对照品(1∶1)的比例加入各对照品,按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样。14个成分的加样回收率为 98.97%~100.89%,RSD 值为 0.37%~2.81%。
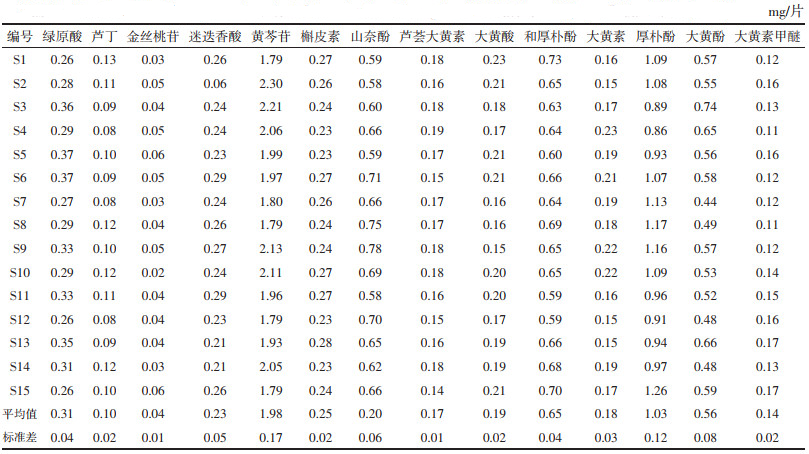
2.3.3 样品含量测定取15批清热利胆片按“2.1.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件进样,记录14个成分峰面积,计算其在15批样品中的含量,结果见表 4。
|
清热利胆片中化学成分复杂,主要含有酚酸类[6-7]、蒽醌类[8]、黄酮类[9-10]、酚类[11]等成分。《中国药典》(2020年)中,茵陈、金钱草、夏枯草、大黄、黄芩、厚朴含量测定的检测波长分别为327、360、330、254、280、294 nm[12],为实现多个成分的同时测定,本研究对检测波长进行考察,结果发现在 294 nm波长下,色谱峰数量较多,且峰强度较为适中,基线相对稳定,故选择 294 nm作为检测波长。另外,本研究考察了流动相(水-乙腈、水-甲醇、0.1%甲酸水溶液-乙腈、0.1%磷酸水溶液-乙腈、0.2%磷酸水溶液-乙腈)、柱温(30、35、40 ℃)、流动相流速(0.3、0.5、1.0 mL/min),最终确定色谱条件为乙腈-0.1%的磷酸溶液梯度洗脱,柱温35 ℃,流速1.0 mL/min时,色谱峰峰数较多,紫外吸收较强,峰形对称,分离度较好,且基线较为平稳。
3.2 指纹图谱结果分析15批清热利胆片的HPLC指纹图谱共确定62个共有峰,并指认出其中14个成分。以峰形、分离度较好的黄芩苷为参照峰,15批清热利胆片样品相似度较高,各成分保留时间稳定,表明所建立的指纹图谱方法稳定可靠。相似度评价结果显示,15批清热利胆片的指纹图谱相似度均大于 0.983,表明清热利胆片批次间一致性良好,化学成分基本一致,整体质量稳定。
3.3 指标成分的选择清热利胆片由茵陈、金钱草、夏枯草、大黄、黄芩、厚朴6味药组成,绿原酸、槲皮素、山奈酚、迷迭香酸、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、黄芩苷、厚朴酚和厚朴酚分别为《中国药典》(2020年版)规定的6味中药含量测定指标成分[12]。且现代研究表明,以上成分具有保肝、抑制肝纤维化、促进胆汁分泌等药理作用,如绿原酸、厚朴酚和和厚朴酚对四氯化碳(CCl4)所致肝损伤小鼠具有肝保护作用[13-14],其中绿原酸还可通过抑制TLR4(Toll样受体4)/NF-κB(核因子-κB)信号通路来预防刀豆蛋白(Con A)诱导的小鼠肝炎[15];金丝桃苷可减轻急性酒精性肝损伤小鼠的肝纤维化和损伤[16];山奈酚可下调脂多糖诱导的Kupffer细胞活化及HIF-1α/HK2表达,抑制糖酵解和乳酸生成,显著减少炎性反应和氧化应激,进而发挥肝细胞保护作用[17];槲皮素可降低肝脏中总胆汁酸水平,同时升高血清中总胆汁酸水平[18];芦丁为槲皮素的一种糖苷,能够有效改善经前烦躁障碍肝气逆证的情绪和躯体症状[19];迷迭香酸和黄芩苷可以抑制肝星状细胞中典型Wnt信号介导的过氧化物酶体增殖物激活受体γ(PPARγ)表达,从而抑制胆汁淤积性肝纤维化[20]。研究发现大黄总蒽醌能够减轻肝损伤,有效改善肝纤维化[21-22],其中大黄素可通过调节氧化应激、减轻肝细胞凋亡从而减轻脂多糖诱导的急性肝损伤[23];大黄酚和大黄素甲醚可减轻非酒精性肝损伤和酒精性肝损伤的肝脂肪变性[24-25];芦荟大黄素可减轻内质网应激引起的肝细胞脂质代谢紊乱[26];大黄酸抑制肝星形细胞激活,来降低胆汁淤积性肝纤维化程度[27]。因此,以上成分为清热利胆片的保肝利胆药效相关成分。
本研究共选择14个成分作为质量控制的成分,其中绿原酸为君药茵陈的指标成分,迷迭香酸为臣药夏枯草的指标成分,黄芩苷为黄芩的指标成分,芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚均为佐药大黄的指标成分,厚朴酚和厚朴酚为佐药厚朴的指标成分;槲皮素、山奈酚和芦丁为茵陈、金钱草和夏枯草的共有成分,金丝桃苷为茵陈和夏枯草的共有成分。这14个成分的选择,既考虑到君臣佐的配伍意义,又兼顾保肝利胆药效作用,提高了清热利胆片质量评价的水平。
3.4 含量测定结果分析本研究通过混合对照品比对指认了14个共有峰,分别为绿原酸、金丝桃苷、槲皮素、山奈酚、芦丁、迷迭香酸、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚、黄芩苷、厚朴酚、和厚朴酚。在此基础上,对指认出的成分进行含量测定,测得其平均含量分别为(0.31±0.04)(0.04±0.01)(0.25±0.02)(0.20±0.06)(0.10±0.02)(0.23±0.05)(0.17±0.01)(0.19±0.02)(0.18±0.03)(0.56±0.08)(0.14±0.02)(1.98±0.17)(1.03±0.12)(0.65±0.04)mg/片。
本研究建立的清热利胆片HPLC指纹图谱及14个成分含量测定方法稳定可靠、操作简便,可为清热利胆片的质量评价提供参考。
| [1] |
天津市药品监督管理局. 天津市医疗机构制剂规范[EB/OL]. (2022-08-09)[2023-05-30]. https://scjg.tj.gov.cn/tjsscjdglwyh_52651/tjyj/XWDT149660/GZDT149685/202208/t20220809_5953943.html. Tianjin Municipal Drug Administration. Specification for preparations of medical institutions in Tianjin[EB/OL]. (2022-08-09)[2023-05-30]. https://scjg.tj.gov.cn/tjsscjdglwyh_52651/tjyj/XWDT149660/GZDT149685/202208/t20220809_5953943.html. |
| [2] |
兰贺燕, 阎姝, 汤湧. HPLC方法同时测定清热利胆片中10个成分含量[J]. 药物分析杂志, 2019, 39(4): 644-651. LAN H Y, YAN S, TANG Y. Simultaneous determination of ten components in Qingre Lidan Tablet by HPLC[J]. Chinese Journal of Pharmaceutical Analysis, 2019, 39(4): 644-651. |
| [3] |
柴士伟, 戈明蕾, 吴梦暄, 等. 疏血通注射液UPLC指纹图谱及5种核苷类成分含量测定研究[J]. 天津中医药, 2023, 40(3): 364-370. CHAI S W, GE M L, WU M X, et al. Study on UPLC fingerprint and content determination of 5 nucleosides in Shuxuetong Injection[J]. Tianjin Journal of Traditional Chinese Medicine, 2023, 40(3): 364-370. |
| [4] |
李宝辉, 李冬晖, 薛党党, 等. 中药益母草的化学指纹图谱及多组分定量分析方法的建立及应用研究[J]. 天津中医药大学学报, 2020, 39(3): 336-340. LI B H, LI D H, XUE D D, et al. The establishment and application of chemical fingerprint and multi-component quantitative analysis for leonuri herba[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2020, 39(3): 336-340. |
| [5] |
张佳, 杨怀瑾, 马丽霞, 等. 中药品质传递过程评价技术与方法研究进展[J]. 中草药, 2021, 52(15): 4711-4721. ZHANG J, YANG H J, MA L X, et al. Research progress on evaluation technology and method of quality delivery process of traditional Chinese medicine[J]. Chinese Traditional and Herbal Drugs, 2021, 52(15): 4711-4721. |
| [6] |
罗弘杉, 谭知浩, 徐春芳, 等. 夏枯草茎叶总酚酸提取工艺优化及其化学成分研究[J]. 中药新药与临床药理, 2022, 33(5): 700-706. LUO H S, TAN Z H, XU C F, et al. Optimization of extraction technology and composition analysis of total phenolic acids from stems and leaves of prunella vulgarisl[J]. Traditional Chinese Drug Research and Clinical Pharmacology, 2022, 33(5): 700-706. |
| [7] |
位翠杰, 刘晓霞, 冯涌微, 等. 基于UPLC特征图谱和多成分定量的不同产地绵茵陈药材质量评价[J]. 中国现代中药, 2023, 25(5): 1026-1033. WEI C J, LIU X X, FENG Y W, et al. Quality evaluation of artemisia scoparia from different producing areas based on UPLC characteristic chromatogram and multi-component determination[J]. Modern Chinese Medicine, 2023, 25(5): 1026-1033. |
| [8] |
王敏, 韩婷, 李春帅, 等. 大黄炮制前后的化学成分变化及其减毒研究[J]. 世界中医药, 2022, 17(22): 3131-3138. WANG M, HAN T, LI C S, et al. Chemical components and toxicity of radix et rhizoma rhei before and after processing[J]. World Chinese Medicine, 2022, 17(22): 3131-3138. |
| [9] |
黄盼, 周改莲, 周文良, 等. 广金钱草的化学成分、药理作用及质量控制研究进展[J]. 中华中医药学刊, 2021, 39(7): 135-139. HUANG P, ZHOU G L, ZHOU W L, et al. Advances in research on chemical composition, pharmacological action and quality control of desmodiumstyracifolium[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(7): 135-139. |
| [10] |
高文雅, 李涛, 周严严, 等. 黄芩水煎液中化学成分的定性及定量研究[J]. 中草药, 2022, 53(23): 7339-7352. GAO W Y, LI T, ZHOU Y Y, et al. Qualitative and quantitative study on chemical constituents in scutellariae radix decoction[J]. Chinese Traditional and Herbal Drugs, 2022, 53(23): 7339-7352. |
| [11] |
张晓娟, 左冬冬, 胡妮娜, 等. 厚朴的化学成分及药理作用研究进展[J]. 中医药信息, 2023, 40(2): 85-89. ZHANG X J, ZUO D D, HU N N, et al. Advances in chemical constituents and pharmacological actions of magnolia officinalis[J]. Information on Traditional Chinese Medicine, 2023, 40(2): 85-89. |
| [12] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020. State Pharmacopoeia Commission. Pharmacopoeia of the people' s republic of China[S]. Beijing: China Medical Science Press, 2020. |
| [13] |
史秀玲, 高银辉. 绿原酸对小鼠急性肝损伤的保护作用[J]. 中国实验方剂学杂志, 2011, 17(19): 199-202. SHI X L, GAO Y H. Protective effects of chlorogenic acid on liver injury in mice[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(19): 199-202. |
| [14] |
符健, 高艺, 林锋, 等. 和厚朴酚对大鼠肝纤维化及P38MAPK/Nrf2信号通路的影响[J]. 中西医结合肝病杂志, 2021, 31(3): 246-249. FU J, GAO Y, LIN F, et al. Protective effect of honokiol on carbon tetrachloride induced liver fibrosis and its effect on P38MAPK/Nrf2 pathway in rats[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2021, 31(3): 246-249. |
| [15] |
SU H Z, WANG Q, LI Y, et al. Effect of different ratios of Yinchen and Gancao Decoction on ANIT-treated cholestatic liver injury in mice and its potential underlying mechanism[J]. Frontiers in Pharmacology, 2021, 12: 611610. |
| [16] |
乔靖怡, 汪保英, 栗俞程, 等. 金丝桃苷对小鼠急性酒精性肝损伤的保护作用[J]. 中药药理与临床, 2017, 33(3): 30-33. QIAO J Y, WANG B Y, LI Y C, et al. Protective effects of hyperoside on acute alcohol-inducing liver injury in mice[J]. Pharmacology and Clinics of Chinese Materia Medica, 2017, 33(3): 30-33. |
| [17] |
高进, 殷娟, 沈文娟, 等. 山奈酚对脓毒症大鼠肝损伤的影响及其与HIF-1α/HK2通路的关系[J]. 中国急救医学, 2023, 43(4): 279-284. GAO J, YIN J, SHEN W J, et al. The effect of kaempferol on liver function injury in septic rats and its relationship with HIF-1α/HK2 signaling pathway[J]. Chinese Journal of Critical Care Medicine, 2023, 43(4): 279-284. |
| [18] |
YANG H, YANG T T, HENG C, et al. Quercetin improves nonalcoholic fatty liver by ameliorating inflammation, oxidative stress, and lipid metabolism in db/db mice[J]. Phytotherapy Research: PTR, 2019, 33(12): 3140-3152. |
| [19] |
张长龙, 马明钰, 李阳, 等. 丹皮酚和芦丁对经前烦躁障碍症肝气逆证大鼠行为、卵巢激素和神经递质的影响[J]. 山东中医药大学学报, 2022, 46(4): 508-515. ZHANG C L, MA M Y, LI Y, et al. Effects of paeonol and rutin on behavior, ovarian hormones and neurotransmitters in premenstrual dysphoric disorder rats with liver qi ascending counterflow syndrome[J]. Journal of Shandong University of Traditional Chinese Medicine, 2022, 46(4): 508-515. |
| [20] |
YANG M D, CHIANG Y M, HIGASHIYAMA R, et al. Rosmarinic acid and baicalin epigenetically derepress peroxisomal proliferatoractivated receptor γ in hepatic stellate cells for their antifibrotic effect[J]. Hepatology, 2012, 55(4): 1271-1281. |
| [21] |
ZHUANG T X, GU X Y, ZHOU N, et al. Hepatoprotection and hepatotoxicity of Chinese herb Rhubarb(Dahuang): how to properly control the General(Jiang Jun) in Chinese medical herb[J]. Biomedicine & Pharmacotherapy=Biomedecine & Pharmacotherapie, 2020, 127: 110224. |
| [22] |
宋献美, 王雪银, 李宁宁, 等. 大黄总蒽醌对免疫性肝纤维化大鼠的保护作用及机制探讨[J]. 现代预防医学, 2018, 45(15): 2818-2822. SONG X M, WANG X Y, LI N N, et al. Protective effect and mechanism of rhubarb total anthraquinones on immune hepatic fibrosis in rats[J]. Modern Preventive Medicine, 2018, 45(15): 2818-2822. |
| [23] |
潘广涛, 刘宇寒, 周方园, 等. 大黄素通过减轻氧化应激和肝细胞凋亡对脂多糖诱导急性肝损伤的保护机制研究[J]. 世界科学技术-中医药现代化, 2021, 23(7): 2294-2301. PAN G T, LIU Y H, ZHOU F Y, et al. Protective mechanism of emodin on lipopolysaccharide-induced acute liver injury by reducing oxidative stress and hepatocyte apoptosis[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2021, 23(7): 2294-2301. |
| [24] |
胡云芝, 李军民, 鲁之中, 等. 大黄酚对高脂饮食诱导的幼龄大鼠非酒精性脂肪肝的调节作用[J]. 免疫学杂志, 2018, 34(10): 869-874. HU Y Z, LI J M, LU Z Z, et al. The effect of chrysophanol on high fat diet-induced non-alcoholic fatty liver disease in neonatal rats[J]. Immunological Journal, 2018, 34(10): 869-874. |
| [25] |
王瑞婕, 杨勇, 白婷. 大黄素甲醚对酒精性肝损伤中SIRT1-AMPK通路的影响[J]. 中国药理学通报, 2020, 36(11): 1557-1562. WANG R J, YANG Y, BAI T. Effect of physcion on SIRT1-AMPK pathway in alcoholic liver injury[J]. Chinese Pharmacological Bulletin, 2020, 36(11): 1557-1562. |
| [26] |
周培, 李莎莎, 王炳芳. 芦荟大黄素对非酒精性脂肪性肝病细胞模型内质网应激的影响[J]. 中国临床药理学与治疗学, 2015, 20(10): 1092-1097. ZHOU P, LI S S, WANG B F. Effects of aloe emodin on fat emulsion-induced endoplasmic reticulum stress of fatty liver cells[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2015, 20(10): 1092-1097. |
| [27] |
孔艺璇, 刘章心怡, 张荣花, 等. 赖氨大黄酸与大黄酸对大鼠胆汁淤积性肝纤维化的疗效比较[J]. 中国医药指南, 2019, 17(15): 44-46. KONG Y X, LIU Z X Y, ZHANG R H, et al. Comparison of therapeutic effects of rhein and rhein on cholestatic liver fibrosis in rats[J]. Guide of China Medicine, 2019, 17(15): 44-46. |
2. Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300250, China;
3. School of Chinese Materia Medica, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
4. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40