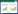文章信息
- 贾晓旭, 张怡博, 袁庆, 等.
- JIA Xiaoxu, ZHANG Yibo, YUAN Qing, et al.
- 羟基红花黄色素A抗缺氧/复氧所致神经元损伤的作用及机制研究
- Effect of hydroxysafflor yellow A(HSYA) on neuron against hypoxia/reoxygenation injury and its mechanism
- 天津中医药, 2023, 40(11): 1478-1483
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(11): 1478-1483
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.11.20
-
文章历史
- 收稿日期: 2023-08-25
2. 天津中医药大学, 天津 301617;
3. 天津中医药大学中医药研究院, 组分中药国家重点实验室, 天津 301617
缺血性脑血管疾病严重危害着人类的生命健康,及时恢复血流以实现再灌注是目前最常用的治疗策略,但该策略在挽救患者生命的同时又会产生新损伤,即脑缺血再灌注损伤(CIRI)[1]。CIRI是一种复杂的级联反应性病理生理过程,涉及多种发病机制。研究表明,CIRI可损伤神经元轴突及突触结构,进一步导致海马、大脑皮层等部位神经元死亡[2-3]。因此,神经元突触重塑在减轻CIRI以及神经组织修复方面发挥重要作用。
具有多环节、多靶点、多途径等作用特点的中药在防治CIRI方面具有独特的作用[4]。中药红花(Carthamus tinctorius L.)具有通络活血、祛瘀止痛的功效,常用于心脑血管疾病(如高血压病、冠心病、脑血栓)的辅助治疗,其主要活性成分为水溶性成分红花黄色素(SY),其中羟基红花黄色素A(HSYA)为红花黄色素中含量较高的成分[5]。药理研究表明,HSYA能抗兴奋性毒性、抗氧化应激、抗凋亡、抗炎、保护血脑屏障和调节自噬,还能促进突触可塑性,从而发挥抗CIRI的作用[6-7]。Yu等[8]研究发现HSYA可增强大脑中动脉闭塞(MCAO)大鼠基底兴奋性突触传递,并诱导海马长时程增强(LTP),增加脑源性神经生长因子(BDNF)和GluN2B的表达,增强突触可塑性,但是对CIRI后神经元突触重塑的作用机制尚未研究。
本研究体外原代培养皮层神经元,建立缺氧/复氧(H/R)损伤模型模拟CIRI,通过考察HSYA对H/R损伤后神经元活力及乳酸脱氢酶(LDH)的影响,明确其神经保护作用;并考察HSYA对H/R损伤的神经元中BDNF、生长相关蛋白43(GAP-43)以及NogoA mRNA和蛋白表达的影响,初步探讨HSYA抗H/R所致神经元损伤的作用机制。
1 材料与方法 1.1 实验动物Wistar大鼠16 d孕鼠,清洁级,由天津中医药大学实验动物中心提供。
1.2 药物与主要试剂HSYA(天津一方科技有限责任公司,中国),DMEM/F12培养基、B-27(GIBCO公司,美国),胰酶1∶250(Ameresco公司,美国),胎牛血清(FBS,HYCLONE公司,美国),LDH检测试剂盒(北京中生生物工程高技术公司,中国),四甲基偶氮唑盐(MTT),二甲基亚砜(DMSO)、多聚赖氨酸(SIGMA公司,美国),青霉素、链霉素(市售分析纯)、Trizol(上海生工生物技术有限公司)、逆转录试剂盒、聚合酶链反应(PCR)试剂盒(宝生物工程有限公司);BDNF、GAP-43及Nogo-A酶联免疫试剂盒(R&D公司),丙三醇、氯仿、无水乙醇(分析纯,天津市化学试剂厂),BDNF、GAP-43及Nogo-A mRNA的上、下游引物(上海生工生物技术有限公司)。
CO2恒温培养箱(THERMO,FORMA3111型,美国),倒置相差显微镜(LEIClA DMIL,德国),三气培养箱(MODEL 3131,THERMO,美国),酶标仪(Multiskan Ascent,THERMO LABSYSTEMS,美国),微量多功能读板机(NanoQuant,infinite M200,瑞士),ABI®7300型实时荧光定量PCR系统(Applied Biosystems,美国)。
1.4 方法 1.4.1 神经元原代培养参照本课题组前期实验方法[9],取怀孕16 d的Wistar大鼠,颈椎脱臼处死,用75%医用酒精浸泡3~5 min,于无菌条件下取出胚胎大脑皮层,剔除脑膜及大血管。将皮质剪碎约1 mm3大小,加入适量0.25%胰蛋白酶,37 ℃消化5 min。立即加入含10%胎牛血清(FBS)的DMEM/F12培养液终止消化,并将组织完全吹散。经75 μm筛网过滤,收集滤液;800 r/min离心10 min(本研究所用离心机半径均为13 cm),弃上清,收集沉淀。用含体积分数10% FBS的DMEM/F12培养液将细胞重悬。调整细胞密度至1×106/mL,接种于预先涂有0.01%多聚赖氨酸的培养板中,置于培养箱培养4 h后,置换为无血清DMEM/F12培养液(含体积分数2% B-27,100 U/mL青霉素,100 U/mL链霉素)。以后,每2 d半量换液1次,细胞生长至第7天时可用于实验。
1.4.2 实验分组及给药取接种于6孔或者96孔细胞培养板中的神经元,每组设平行6孔,随机分为正常对照组、H/R组、羟基红花黄色素A低(5 μg/mL)、中(20 μg/mL)、高(80 μg/mL)剂量组,具体处理方法如下。正常对照组:置换无血清培养液继续培养48 h,不做H/R处理;H/R组:置换无血清培养液,将培养板放入体积分数分别为0.94 N2、0.05 CO2、0.01 O2的三气培养箱中缺氧孵育24 h,再于体积分数分别为0.95空气、0.05 CO2条件下复氧孵育24 h;HSYA低、中、高剂量组:分别置换为含5、20、80 μg/mL HSYA的无血清培养液,H/R处理同H/R组。
1.4.3 指标检测 1.4.3.1 噻唑蓝(MTT)法检测细胞活力取接种于96孔板的神经元,收集培养上清液(用于LDH检测),将MTT液按0.5 mg/mL的浓度加入100 μL/孔,继续孵育4 h后,倒置显微镜下可见活细胞处有大量紫蓝色针状结晶,弃上清,加DMSO 100 μL/孔溶解后,酶标仪上读取OD值,波长为570 nm。
1.4.3.2 LDH试剂盒检测细胞上清液中LDH活性取细胞上清液,按照试剂盒说明书方法操作,以全自动生化分析仪测定LDH活性。
1.4.3.3 RT-PCR检测BDNF、GAP-43及Nogo-A mRNA表达水平取接种于6孔板的神经元,弃培养液,用冷磷酸缓冲盐溶液(PBS)洗2次,每孔加入1 mL裂解液TRIzol,反复吹打,室温放置5 min,使得核酸蛋白复合物完全分离。加0.2 mL氯仿,剧烈振荡,室温放置15~30 min后,于4 ℃ 12 000 r/min离心15 min,将水相转移到新的无RNase的离心管中,缓慢加入1倍体积-20 ℃保存的丙三醇,混匀,置-20 ℃ 2 h以上,充分沉淀RNA。4 ℃ 10 000×g离心10 min,弃上清。沉淀加入75%乙醇1 mL,重新悬浮,4℃ 8 000×g离心10 min,弃上清。在超净台内室温挥发5 min,加入适量无RNnase水轻轻吹打沉淀,使之溶解,用紫外分光光度法检测RNA样品的浓度及纯度。反转录,应用ABI®7300实时定量PCR仪分析软件进行分析,获得每个样品每次反应的CT值,计算得到其△CT,进行数据统计[10]。
1.4.3.4 ELISA检测BDNF、GAP-43及Nogo-A蛋白表达水平收集各组上清液,1 000 r/min离心10 min。将50 μL标准品、50 μL样品加入相应反应孔,立即加入50 μL的生物素标记的抗体,混匀,37 ℃温育1 h,洗板3次,每孔加入60 μL的亲和链霉素-HRP,37 ℃温育30 min,洗板3次,每孔加入底物A、B各50 μL,混匀30 s,封板,37 ℃避光温育10 min,每孔加入终止液50 μL,立即于450 nm波长处检测,根据标准曲线方程计算浓度。
1.5 统计学方法运用SPSS 20.0软件包进行数据处理,所有数据采用均值±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05表示差异具有统计学意义。
2 结果 2.1 HSYA对缺氧/复氧损伤神经元活力的影响与正常对照组比较,H/R组神经元活力显著降低(P<0.01);与H/R组比较,HSYA低、中、高剂量组神经元活力均显著增强(P<0.01)。见图 1。
|
| 注:Control.正常对照组。与正常对照组比较,**P<0.01;与H/R组比较,##P<0.01。 图 1 不同浓度HSYA对缺氧/复氧损伤神经元活力的影响(x±s,n=6) Fig. 1 Effect of different concentrations of HSYA on neuronal viability after hypoxia/reoxygenation injury(x±s, n=6) |
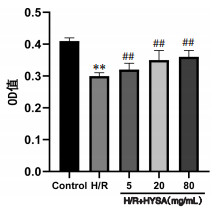
与正常对照组比较,H/R组神经元LDH释放明显增加(P<0.05)。与H/R组比较,HSYA低、中、高剂量组神经元LDH释放均显著减少(P<0.01)。见图 2。
|
|
注:Control.正常对照组。与正常对照组比较,*P<0.05;与H/R组比较,##P<0.01。
图 2 不同浓度HSYA对缺氧/复氧损伤神经元LDH释放的影响(x±s,n=6)
Fig. 2
Effect of different concentrations of HSYA on LDH release in neurons with hypoxia/reoxygenation injury ( |
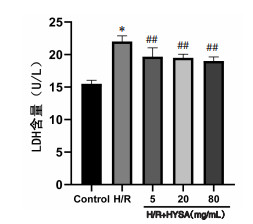
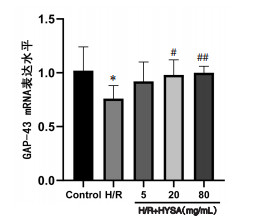
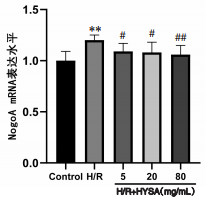
与正常对照组比较,H/R组BDNF及GAP-43 mRNA表达均显著降低(P<0.05),Nogo-A mRNA表达显著增加(P<0.01);与H/R组比较,HSYA低、中、高剂量均可显著促进BDNF mRNA表达(P<0.05或P<0.01),且抑制Nogo-A mRNA表达(P<0.05或P<0.01);HSYA中、高剂量可显著促进GAP-43 mRNA表达(P<0.05或P<0.01)。见图 3、4、5。
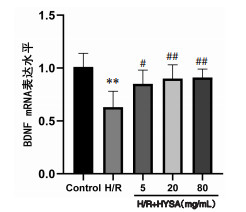
|
| 注:Control.正常对照组。与正常对照组比较,**P<0.01;与H/R组比较,#P<0.05,##P<0.01。 图 3 HSYA对H/R损伤神经元的BDNF mRNA表达的影响(x±s,n=6) Fig. 3 Effect of HSYA on BDNF mRNA expression in H/R injured neurons(x±s, n=6) |
|
| 注:Control.正常对照组。与正常对照组比较,*P<0.05;与H/R组比较,#P<0.05,#P<0.01。 图 4 HSYA对H/R损伤神经元的GAP-43 mRNA表达的影响(x±s,n=6) Fig. 4 Effect of HSYA on GAP-43 mRNA expression in H/R injured neurons(x±s, n=6) |
|
| 注:Control.正常对照组。与正常对照组比较,**P<0.01;与H/R组比较,#P<0.05,#P<0.01。 图 5 HSYA对H/R损伤神经元的Nogo-A mRNA表达的影响(x±s,n=6) Fig. 5 Effect of HSYA on Nogo-A mRNA expression in H/R injured neurons(x±s, n=6) |
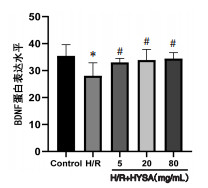
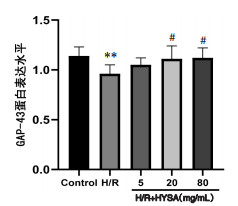
与正常对照组比较,H/R组BDNF、GAP-43蛋白表达均显著降低(P<0.05),NogoA蛋白表达水平显著提高(P<0.01);与H/R组比较,HSYA低、中、高剂量均可显著降低BDNF蛋白表达水平(P<0.05),且抑制Nogo-A蛋白表达(P<0.05或P<0.01);HSYA中、高剂量可显著促进GAP-43 mRNA表达(P<0.05)。见图 6、7、8。
|
| 注:Control.正常对照组。与正常对照组比较,*P<0.05;与H/R组比较,#P<0.05。 图 6 HYSA对H/R损伤神经元BDNF蛋白表达的影响(x±s,n=6) Fig. 6 Effect of HYSA on BDNF protein expression in H/R injured neurons(x±s, n=6) |
|
| 注:Control.正常对照组。与正常对照组比较,**P<0.01;与H/R组比较,#P<0.05。 图 7 HYSA对H/R损伤神经元GAP-43蛋白表达的影响(x±s,n=6) Fig. 7 Effect of HYSA on the expression of GAP-43 protein in H/R injured neurons(x±s, n=6) |
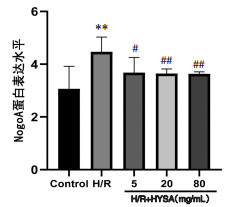
|
| 注:Control.正常对照组。与正常对照组比较,**P<0.01;与H/R组比较,#P<0.05,#P<0.01。 图 8 HYSA对H/R损伤神经元Nogo-A蛋白表达的影响(x±s,n=6) Fig. 8 Effect of HYSA on the expression of Nogo-A protein in H/R injured neurons(x±s, n=6) |
CIRI最核心的问题是神经元损害引起的神经功能障碍,因此,保护和恢复受损神经元的功能成为治疗CIRI最重要的任务[11]。近年来,诸多学者认为其治疗靶点不应仅仅局限于抵抗损伤的因素,而更应该着眼于内源性的神经保护机制和长期的恢复过程[12]。
神经营养因子可诱导、调节和控制神经元的生存、生长、迁移以及与其他细胞建立功能性联系,并在神经再生过程中促进轴突的再生长。神经营养因子(NTFs)是一类对神经元的发育、存活和凋亡起重要作用的蛋白质,主要分为:1)神经营养素(NT)家族,包括神经生长因子(NGF)、BDNF、神经营养因子-3(NT-3)、神经营养因子-4/5(NT-4/5)等。2)胶质细胞源性神经营养因子(GDNF)。3)睫状神经营养因子(CNTF)。这些蛋白质已经成为治疗神经损伤等疾病的潜在药物标靶。其中BDNF是体内含量最多的神经营养因子。BDNF是从猪脑脊液中发现的一种具有神经营养作用的碱性蛋白质,BDNF及其受体在神经系统广泛表达,但主要是在中枢神经系统内表达,其中海马和皮质的含量最高。它通过与酪氨酸激酶受体B(TrkB)的结合而发挥作用,对神经元的生存、分化、生长和神经元正常生理功能具有维持和促进作用,而且还有增加突触可塑性及神经再生等作用[13]。本研究结果显示,HSYA可有效抑制H/R引起的LDH释放,明显增加神经元细胞活力,表明HSYA能有效减轻H/R引起的神经元损伤。为了探究其作用机制,本研究进一步考察了HSYA对神经元表达及分泌BDNF的影响,结果表明HSYA可有效促进神经元释放BDNF。
此外,BDNF还可以促进突触成熟,增加突触可塑性[14-15]。因此,本研究进一步考察HSYA是否可以通过促进BDNF表达而增加神经元突触可塑性。GAP-43是存在于神经元轴突生长锥中的一种特异性胞膜磷酸蛋白,广泛分布于大脑、小脑、脊髓、背根节以及自主神经系统的神经元内。在发育中的神经元内,沿整个轴突表达,在生长锥表达尤其丰富;而在成熟神经系统,主要分布于某些特定区域的神经终末中,在促进神经细胞生长、轴突再生和突触重构等方面发挥重要作用,已成为研究神经生长发育和损伤修复等神经可塑性的首选分子探针[16-17]。Nogo-A是一种氨基酸的膜蛋白,是有效的轴突生长抑制因子,不仅表达于少突胶质细胞,还广泛表达于神经元,是反映神经损伤后是否可再生的指标之一[18-19]。在生理状态下,Nogo-A对生长较迟的神经纤维起到约束的作用,神经纤维只能进入特定的区域层内。在成年哺乳动物中枢神经系统中,Nogo-A的主要作用是保持中枢神经系统微环境的稳定,防止不必要的出芽,有助于保持神经联系的特异性,防止形成不必要的、错误的投射,通过微管动力学调节参与轴突生长和树突塑形的进程。Nogo-A与其他生长抑制因子和神经生长促进因子呈平衡状态,当出现外界刺激后,其内部平衡被破坏,Nogo-A呈现抑制作用[20-21]。以上两种蛋白均可一定程度地分泌到细胞外。本研究考察了HSYA对神经元内GAP-43和Nogo-A mRNA以及细胞上清液中二者蛋白含量的影响,结果显示,HSYA可促进GAP-43 mRNA及蛋白表达,同时抑制Nogo-A mRNA及蛋白表达,表明HSYA能有效增加神经元突触可塑性。
本研究初步表明HSYA抗H/R损伤神经元的作用机制可能是通过促进BDNF表达而改善神经元生存状态,并增加神经元突触可塑性。但该作用还有待从神经元突触微观形态学角度来进一步验证,其作用机制亦有待围绕BDNF/酪氨酸激酶B(TrkB)、Nogo-A/Nogo-A受体(NgR)等信号通路进行深入探讨。
2. Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. State Key Laboratory of Component-Based Chinese Medicine, Institute of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40