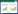文章信息
- 罗帅, 陈勇.
- LUO Shuai, CHEN Yong.
- 冬凌草甲素联合免疫因子TRAF4对非小细胞肺癌细胞自噬和凋亡的影响及机制研究
- Study on the effect of oridonin combined with immune factor TRAF4 on autophagy and apoptosis of non-small cell lung cancer cells and its mechanism
- 天津中医药, 2023, 40(11): 1484-1489
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(11): 1484-1489
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.11.21
-
文章历史
- 收稿日期: 2023-08-10
根据病理表现可以将肺癌分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占肺癌全部的80%~85%[1]。虽然医学上已经取得了进步,但是非小细胞肺癌的复发转移仍是当前其治疗的难点[2-3]。冬凌草又称为冰凌草,性微寒,甘微苦,常用于治疗咽喉肿痛、蛇虫咬伤和扁桃体炎等疾病[4],具有多种化学活性,如冬凌草甲素具有明显的抗肿瘤效果[5]。有研究结果显示,冬凌草甲素抑制肺癌细胞A549的增殖[6],促进肺癌细胞的自噬小体的产生,并诱导细胞凋亡[7]。肿瘤坏死因子受体相关因子4(TRAF4)位于染色体17q11-12上,与肿瘤坏死受体家族信号转导密切相关[8]。有研究发现,miR-370通过靶向负调控TRAF4抑制肺癌细胞的增殖和促进细胞的凋亡[9]。但是关于冬凌草甲素是否能够联合TRAF4影响非小细胞肺癌的研究尚不明确,因此,本研究通过体外培养A549细胞,探讨冬凌草甲素联合TRAF4对细胞自噬和凋亡的影响。
1 材料与方法 1.1 细胞和主要试剂A549细胞购自美国ATCC公司;冬凌草甲素购于成都普菲德公司;DMEM培养基和胎牛血清购于Hyclone公司;噻唑蓝(MTT)试剂盒购于北京索莱宝公司;Lipofectamine 2000试剂盒购于赛默飞世尔公司;si-NC、si-TRAF4、pcDNA、TRAF4购于广州锐博生物公司;凋亡试剂盒购于江苏凯基生物公司;B细胞淋巴瘤2(Bcl-2)相关X蛋白(Bax)抗体、Bcl-2抗体、微管相关蛋白1的轻链3(LC3)Ⅱ抗体、LC3Ⅰ抗体、Beclin 1抗体、ATG7抗体、TRAF4抗体、GAPDH抗体购于美国Abcam公司;荧光定量试剂盒、逆转录试剂盒、Trizol试剂购于Promega公司;引物购于上海吉玛公司。
1.2 细胞培养在37 ℃、5% CO2培养箱中,A549细胞培养于含有10%胎牛血清的DMEM培养基。细胞汇合率为80%时,采用胰蛋白酶进行消化传代。
1.3 噻唑蓝(MTT)检测细胞活力取对数生长期A549细胞并接种在96孔板中。过夜培养后,细胞与0、1、5、10、20、50 μmol/L的冬凌草甲素孵育48 h。随后,细胞与MTT试剂孵育4 h,然后用二甲基亚砜(DMSO)试剂溶解结晶。利用酶标仪检测吸光度值,评估细胞活力。
1.4 细胞分组A549细胞接种6孔板内(1×105个/mL),细胞贴壁生长后加入0、20 μmol/L的冬凌草甲素,记为对照组、冬凌草甲素组。按照Lipofectamine 2000说明书进行细胞转染。A549细胞转染si-TRAF4和si-NC,记为si-TRAF4组、si-NC组;将pcDNA和TRAF4转染至A549细胞后,采用20 μmol/L的冬凌草甲素处理,记为冬凌草甲素+pcDNA组、冬凌草甲素+TRAF4组。
1.5 流式细胞术检测细胞凋亡取1.4各组A549细胞,取1 mL细胞液添加至500 μL结合缓冲液内,用于制备细胞悬液。细胞与Annexin V-FITC和PI试剂孵育,利用流式细胞仪分析细胞凋亡率。
1.6 蛋白免疫印迹法(Western Blot)检测蛋白表达取1.4中各组A549细胞4 ℃裂解30 min,然后经过12 000 r/min(离心半径为15 cm)离心10 min,收集细胞上清液,根据BCA法定量蛋白浓度,在95 ℃变性7 min。取蛋白样品经过凝胶电泳处理,转膜,转膜结束后封闭培养1.5 h,洗膜3次,加入Bax、Bcl-2、LC3Ⅱ、LC3Ⅰ、Beclin 1、ATG7和TRAF4抗体于4 ℃过夜培养,洗膜3次,加入二抗,室温培养1.5 h,滴加提前配置的显影液,显色、曝光。用Image J软件分析蛋白条带。
1.7 实时荧光定量聚合酶链反应(qRT-PCR)检测mRNA表达利用Trizol试剂提取总RNA,分光光度计检测RNA样品的浓度和纯度。逆转录法合成cDNA,然后根据荧光定量试剂盒说明书进行PCR扩增反应。以GAPDH为内参,分析采用2-ΔΔCt公式计算TRAF4 mRNA表达量。TRAF4上游引物为:5’-CATCCACAGTGAGGAGGGCT-3’,下游引物为:5’-TTCATGGGGCAGCGATTAG-3’;GAPDH上游引物为:5’-TGCACCACCAACTGCTTAGC-3’,下游引物为:5’-GGCATGGACTGTGGTCATGAG-3’。
1.8 统计学方法采用SPSS 21.0软件分析实验数据。计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果 2.1 不同浓度冬凌草甲素对A549细胞活力的影响评估浓度为0、1、5、10、20、50 μmol/L的冬凌草甲素对A549细胞活力的影响。结果显示,A549细胞活力随着冬凌草甲素浓度的上升而逐渐下降(P<0.05)。A549细胞半数抑制率(IC50)为22.4 μmol/L,因此本研究选择20 μmol/L进行后续实验。见表 1。
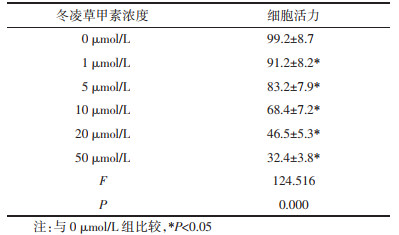
|
与对照组相比,冬凌草甲素组的细胞凋亡率、Bax水平显著升高(P<0.05),Bcl-2水平显著下降(P<0.05)。见图 1、表 2。
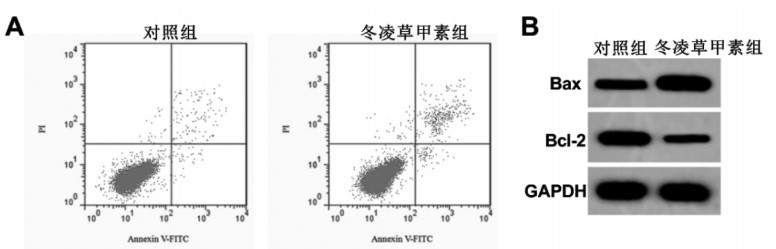
|
| 图 1 冬凌草甲素对A549细胞凋亡的影响 Fig. 1 Effect of oridonin on apoptosis of A549 cells |
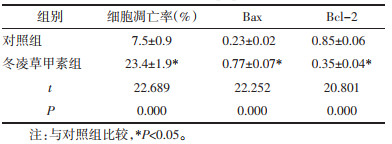
与对照组相比,冬凌草甲素组的Beclin 1、LC3Ⅱ/LC3Ⅰ和ATG7蛋白表达显著增加(P<0.05)。见图 2、表 3。
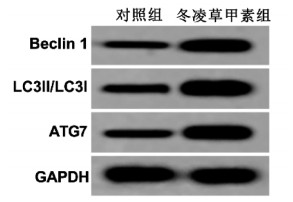
|
| 图 2 冬凌草甲素对A549细胞自噬的影响 Fig. 2 Effect of oridonin on autophagy in A549 cells |
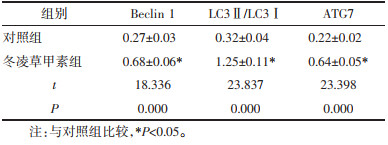
qRT-PCR和Western Blot检测结果显示,与对照组相比,冬凌草甲素组的TRAF4 mRNA和蛋白表达显著降低(P<0.05)。见图 3、表 4。

|
| 图 3 冬凌草甲素对TRAF4蛋白水平的影响 Fig. 3 Effect of oridonin on TRAF4 protein level |
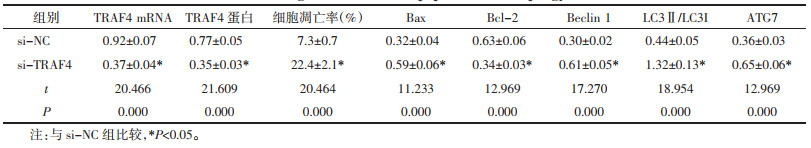
与si-NC组相比,si-TRAF4组的TRAF4 mRNA和蛋白表达显著降低(P<0.05),细胞凋亡率、Bax、Beclin 1、LC3Ⅱ/LC3Ⅰ和ATG7水平显著上升(P<0.05),Bcl-2水平显示下降(P<0.05)。见图 4、表 5。
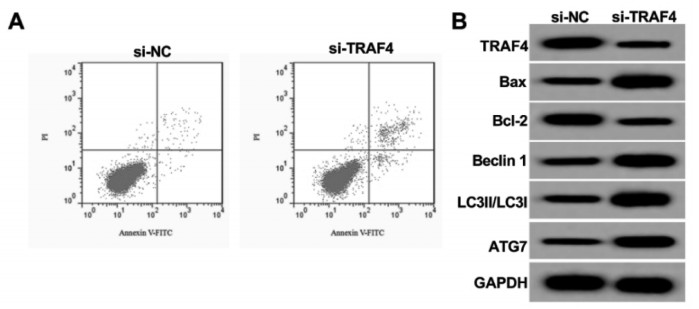
|
| 图 4 干扰TRAF4对A549细胞凋亡和自噬的影响 Fig. 4 Effect of interference TRAF4 on apoptosis and autophagy in A549 cells |
|
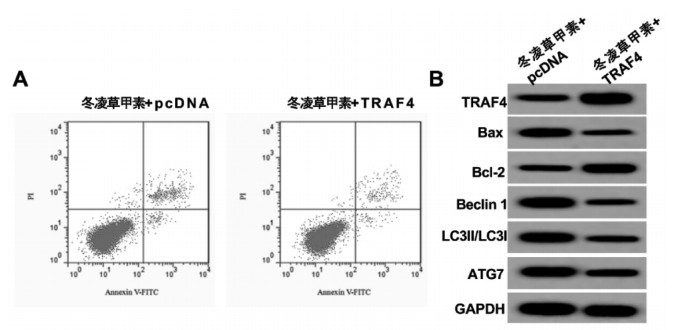
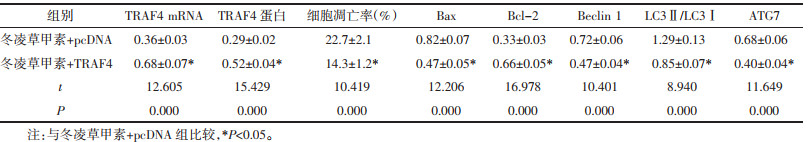
与冬凌草甲素+pcDNA组相比,冬凌草甲素+TRAF4组的TRAF4 mRNA和蛋白表达显著增加(P<0.05),细胞凋亡率、Bax、Beclin 1、LC3Ⅱ/LC3Ⅰ和ATG7水平显著下降(P<0.05),Bcl-2水平显示上升(P<0.05)。见图 5、表 6。
|
| 图 5 冬凌草甲素联合免疫因子TRAF4对A549细胞凋亡和自噬的影响 Fig. 5 Effect of oridonin combined with immunizing factor TRAF4 on apoptosis and autophagy in A549 cells |
|
冬凌草甲素是从冬凌草二萜类化合物内提取分离而来的,具有明显的抗肿瘤作用,如抑制细胞增殖和转移、促进细胞凋亡等[10]。吴楠等[11]研究结果显示,冬凌草甲素通过抑制TPX2促进前列腺癌细胞的凋亡,阻滞细胞周期,抑制细胞的增殖。研究发现,冬凌草甲素在宫颈癌研究中可以抑制宫颈癌细胞的增殖,促进线粒体凋亡[12]。黄陈翼等[13]在研究骨髓瘤中发现,冬凌草甲素通过抑制磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)通路促进骨髓瘤细胞的凋亡和抑制细胞增殖。本研究采用不同浓度(0、1、5、10、20、50 μmol/L)冬凌草甲素作用A549细胞,MTT实验检测细胞的活力,结果显示,冬凌草甲素呈剂量效应降低,因此本研究采用20 μmol/L(接近IC50浓度)进行后续实验,检测冬凌草甲素作用A549细胞后的机制研究。
凋亡在癌症的发展中具有重要的作用,Bax和Bcl-2是Bcl-2家族的成员,Bax在细胞发生凋亡时起到促进作用,其过度表达可与Bcl-2拮抗促使细胞发生凋亡[14]。自噬在细胞代谢和生长发育中至关重要,是一个进化保守的饥饿应答过程,Beclin 1是一种转运蛋白,可将LC3自噬蛋白转移至自噬体膜内间接促进细胞的自噬[15-16]。LC3是自噬标志的相关蛋白,主要两种亚型LC3Ⅱ、LC3Ⅰ,LC3Ⅰ没有活性,LC3Ⅱ可与线粒体受体蛋白结合促进细胞的自噬;LC3Ⅱ与LC3Ⅰ比值可以反映自噬体情况[17-18]。此外,LC3-I被Atg7活化,然后在膜内与磷脂酰乙醇胺(PE)偶联生成被加工的LC3-Ⅱ。本研究结果显示,冬凌草甲素能促进细胞的凋亡率,上调Bax、LC3Ⅱ/LC3Ⅰ、Beclin 1、ATG7蛋白表达,下调Bcl-2蛋白表达,提示冬凌草甲素可以诱导A549细胞的凋亡和自噬。
TRAF4在多种细胞高表达,是一种致癌基因,最早在乳腺癌内发现,可以广泛参与癌细胞的发展,通过抑制TRAF4抑制肿瘤细胞增殖,促进细胞凋亡等[19-20]。陈刚等[21]研究结果显示,TRAF4在非小细胞肺癌细胞内表达上调,生物信息学网站预测显示TRAF4是miR-615-5p的靶标,miR-615-5p通过靶向负调控TRAF4发挥在非小细胞肺癌中的作用。有研究发现,利用干扰沉默技术,干扰TRAF4通过抑制Notch1通路促进肺癌细胞的凋亡和抑制细胞增殖[22]。本研究结果显示,冬凌草甲素作用A549细胞后,TRAF4 mRNA和蛋白表达下调,抑制TRAF4明显增加细胞凋亡率,下调TRAF4 mRNA和蛋白表达,上调Bax、LC3Ⅱ/LC3Ⅰ、Beclin 1、ATG7蛋白表达,下调Bcl-2蛋白表达,说明抑制TRAF4可以促进A549细胞的凋亡和自噬。深一步研究结果显示,过表达TRAF4可以逆转冬凌草甲素对A549细胞的凋亡和自噬的影响,提示冬凌草甲素通过联合TRAF4发挥在非小细胞肺癌中的作用。
综上所述,冬凌草甲素能够促进非小细胞肺癌细胞的凋亡和自噬,其作用机制可能与下调TRAF4有关。本研究探究了冬凌草甲素靶向治疗非小细胞肺癌的分子理论基础,然而,其是否还有其他途径参与冬凌草甲素的抗癌作用仍需要深入探索。
 2023, Vol. 40
2023, Vol. 40