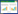文章信息
- 冯玲玲, 陈树杰, 车炜.
- FENG Lingling, CHEN Shujie, CHE Wei.
- 刺五加注射液对急性心肌梗死后心力衰竭大鼠心肌保护作用的研究
- Protective effect of Ciwujia Injection on heart failure after acute myocardial infarction in rats
- 天津中医药, 2023, 40(12): 1587-1594
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(12): 1587-1594
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.12.15
-
文章历史
- 收稿日期: 2023-06-23
心力衰竭(HF)是ST抬高型急性心肌梗死(AMI)患者最常见并发症。据统计,AMI后1年内HF发病率超过45%,而AMI后HF(HF-AMI)患者5年生存率不足40%,HF-AMI是影响AMI患者中远期预后的重要因素[1-2]。HF-AMI病理机制复杂,其中氧化应激和心肌组织纤维化在HF-AMI发生发展过程中扮演着重要角色,由核因子E2相关因子2(Nrf2)及其下游蛋白血红素加氧酶1(HO-1)组成的信号通路对氧化应激具有重要调控作用。有文献报道通过干预Nrf2/HO-1信号通路可有效减轻HF-AMI大鼠心肌组织氧化应激和纤维化,改善心功能[3]。
刺五加(又名五加参)为《中国药典(一部)》收录中药品种,以五加科植物刺五加的干燥根和根茎入药,性温、味辛,归脾、肾、心经,具有益气健脾、补肾安神等功效。刺五加注射液(CWJI)是以刺五加水醇提取物为有效成分制成的中成药,目前主要用于缺血性脑病以及冠心病、心绞痛的治疗。有研究报道CWJI可通过激活Nrf2/HO-1信号通路减轻氧化应激对大鼠肾缺血再灌注损伤起到保护作用[4],并且CWJI对化疗药物等所致大鼠心肌损伤具有保护作用[5-6],但CWJI对HF-AMI大鼠的影响及相关机制尚未见文献报道。本研究通过复制HF-AMI大鼠模型,探讨CWJI对HF-AMI大鼠心肌组织的影响及相关机制,以期为HF-AMI临床治疗提供参考。
1 材料与方法 1.1 实验动物清洁级Wistar大鼠(雄性、7周龄、210~240 g)105只购自北京科宇动物养殖中心[许可证号:SCXK(京)2018-0010]。在(23±1)℃、相对湿度(55±10)%、光照12 h黑暗12 h的控制环境中饲养,进食饮水不限。本实验获得医院伦理委员会批准。实验动物相关操作遵循减少、替代、优化原则。
1.2 药物与试剂CWJI(黑龙江乌苏里江制药有限公司,国药准字Z23023215,批号21A0917005);卡托普利注射液(CPT,常州制药厂有限公司,国药准字H10970293,批号220113);心肌肌钙蛋白T(cTnT)、血管紧张素Ⅱ(Ang Ⅱ)酶联免疫吸附法(ELISA)试剂盒和苏木精-伊红(HE)、原位末端转移酶标记(TUNEL)、马松(Masson)染色试剂盒(北京索莱宝生物科技公司,货号SEKR-0047、SEKR-0049、G1120、T2190、G1340);醛固酮(ALD)ELISA法试剂盒(泉州市睿信生物科技有限公司,货号RXJ302392R);总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)检测试剂盒和RIPA裂解液、2,2’-联喹啉-4,4’-二甲酸二钠(BCA)法蛋白定量试剂盒(上海碧云天生物科技有限公司,货号S0109、S0056、S0131S、W063-1-1、A045-4-1);活性氧(ROS)检测试剂盒、TRIzol总RNA提取试剂、一步法RT-PCR试剂盒(南京建成生物工程研究所,货号E004-1-1、N065、N116);Nrf2、HO-1、β-肌动蛋白(β-actin)抗体和免疫球蛋白G抗体(IgG二抗)、增强化学发光液(ECL)(北京博奥森生物技术公司,货号bs-1074R、bs-2075R、bs-0061R、bs-0295G、C05-07004)。
1.3 主要仪器小动物呼吸机(DW-3000型,安徽正华生物仪器公司);多普勒超声仪(770TM-120型,加拿大Visual Sonics公司);生理信号采集系统(MP150型,美国BSI公司);酶标仪(DTX880型,美国贝克曼公司);紫外-可见分光光度计(ND2000C型,美国Thermo公司);930F型荧光分光光度计(上海仪电分析仪器有限公司);石蜡切片机(RM2016型,上海徕卡仪器公司);超薄切片机(EMUC7型,德国Leica公司);透射电子显微镜(HT7700型,日本日立公司);蛋白电泳转膜系统(PowerPac型,美国Bio-Rad公司);QuantStudio 5型PCR仪(美国ABI公司)。
1.4 实验方法 1.4.1 HF-AMI大鼠模型制备与给药适应性饲养1周后,随机取105只大鼠中的16只作为假手术(Sham)组,剩余89只通过结扎左冠状动脉前降支复制HF-AMI大鼠模型,结扎后心尖部位颜色变苍白、心电图ST段明显抬高或T波高耸则说明心肌梗死制备成功,2周后通过多普勒超声检测左室射血分数(LVEF),LVEF < 50%即可判定HF-AMI大鼠模型制备成功[7]。共造模成功82只,随机取80只HF-AMI成模大鼠随机分为模型(Model)组、CPT组和CWJI低(CWJI-L)、中(CWJI-M)、高剂量(CWJI-H)组,每组16只。Sham组大鼠除了不结扎左冠状动脉前降支外,其余操作同Model组。CPT组腹腔注射给药10 mg/kg[8],CWJI-L、CWJI-M、CWJI-H组分别腹腔注射给药15、30、60 mg/kg(参照人临床应用剂量,根据人与大鼠剂量换算公式计算所得,分别相当于人临床剂量的1/2、1、2倍),Sham组和Model组分别腹腔注射给予生理盐水,给药频次均为1次/日,疗程4周。
1.4.2 大鼠心功能指标检测治疗完成后,随机取每组8只大鼠,腹腔注射水合氯醛溶液(0.35 mg/kg)进行麻醉后,通过多普勒超声仪,取左室短轴解剖位M模式图像,检测大鼠心功能指标[LVEF和左室短轴缩短率(LVFS)];通过生理信号采集系统检测心功能指标[左室内压最大上升速率和最大下降速率(+dp/dtmax、-dp/dtmax)]。
1.4.3 ELISA法检测血清cTnI、Ang Ⅱ、ALD水平经腹主动脉采血5 mL并离心(1 500 r/min,离心半径10 cm,5 min)取血清,遵照试剂盒操作说明,采用ELISA法检测血清cTnI、Ang Ⅱ、ALD水平。
1.4.4 计算左室心肌肥厚指数(LVHI)称量大鼠体质量(M1),开胸取心脏,剪取左心室心肌用生理盐水冲洗干净后称质量(M2),LVHI(%)=(M2/M1)×100%。
1.4.5 HE、TUNEL、Masson染色法观察心肌组织病理学改变、细胞凋亡和组织纤维化状况取左心室缺血区心肌组织,经4%多聚甲醛溶液固定、石蜡包埋、切片、展片、烤片等处理后,按照各试剂盒操作说明:1)行HE染色后显微镜下观察心肌组织病理学改变。2)行TUNEL染色后观察心肌细胞凋亡状况(细胞核黄褐色为阳性着色),400倍光学显微镜下取每张切片5个互不重叠的视野,计数视野内凋亡细胞数和细胞总数,凋亡指数(AI)=(凋亡细胞数/细胞总数)×100%。3)行Masson染色后观察心肌组织纤维化状况(蓝色为胶原着色),400倍光学显微镜下拍取5个互不重叠的视野,通过Image J软件分析视野内蓝色胶原纤维面积和视野总面积,胶原容积分数(CVF)=(蓝色胶原纤维面积/视野总面积)×100%。
1.4.6 透射电子显微镜观察心肌细胞线粒体超微结构变化取每组剩余的8只大鼠,颈椎脱臼处死后开胸取心脏,剪取少量左心室心肌修饰成1 mm3小块后行2.5%戊二醛3 h和1%锇酸1 h双固定,脱水和丙酮置换后环氧树脂包埋,50 nm超薄切片后行醋酸双氧铀和柠檬酸铅双染色,通过透射电子显微镜观察心肌细胞线粒体超微结构。
1.4.7 分光光度法检测心肌组织T-SOD、GSH-Px活性和MDA、ROS含量取部分左心室缺血区心肌组织加入适量4 ℃生理盐水研磨匀浆,离心(3 500 r/min,离心半径10 cm,5 min)取上清液,遵照试剂盒操作说明,通过紫外-可见分光光度计检测心肌组织T-SOD活性(检测波长560 nm)、GSH-Px活性(检测波长340 nm)、MDA含量(检测波长535 nm);通过荧光分光光度计检测心肌组织ROS含量(激发波长502 nm,发射波长530 nm)。
1.4.8 RT-PCR法检测心肌组织Nrf2、HO-1 mRNA表达取适量左心室缺血区心肌组织,TRIzol法提取总RNA,按试剂盒说明将RNA逆转录成cDNA后行PCR扩增,引物序列:Nrf2上游引物5’-TGACAATGAGGTTTCTTCGGCTACG-3’,下游引物5’-TGCCCCTGAGATGGTGACAA -3’,扩增长度112 bp;HO-1上游引物5’-GGCCTCCCTGTACCACATCT-3’,下游引物5’-CTGCA TGGCTGGTGTGTAGG-3’,扩增长度173 bp;β-actin上游引物5’-CTGTGTTG TCCCTGTATGCC TCTG’,下游引物5’- GGAACCG CTCATTGCCGATAGTG -3’,扩增长度116 bp。扩增程序:95 ℃ 5 min;95 ℃ 30 s、60 ℃ 30 s,重复40个循环。以β-actin为内参,运用公式2-ΔΔCt计算Nrf2、HO-1 mRNA相对表达量。
1.4.9 Western Blot法检测心肌组织Nrf2、HO-1蛋白表达取100 mg左心室缺血区心肌组织加入1 mL RIPA裂解液提取总蛋白,BCA法进行蛋白定量后,30 μg总蛋白量上样、凝胶电泳分离蛋白、转PVDF膜、5%蛋白封闭液室温封闭2 h后,加目标蛋白一抗稀释液Nrf2(1∶1 000)、HO-1(1∶1 000)和内参蛋白稀释液β-actin(1∶2 000)4 ℃孵育过夜,洗膜后加二抗稀释液IgG(1∶2 000)室温孵育1 h,洗膜后加ECL显影,通过蛋白条带灰度值半定量目标蛋白相对表达量。
1.5 统计学处理采用SPSS 20.0软件行统计分析。计量资料符合正态分布以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 各组大鼠心功能指标比较与Sham组比较,Model组大鼠LVEF、LVFS、+dp/dtmax、-dp/dtmax显著降低(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组LVEF、LVFS、+dp/dtmax、-dp/dtmax(CWJI-L组除外)显著升高(P < 0.05),CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组LVEF、+dp/dtmax、-dp/dtmax显著升高(P < 0.05),两组间LVFS差异无统计学意义(P > 0.05)。见表 1。
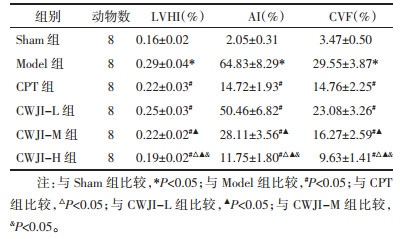
与Sham组比较,Model组大鼠血清cTnI、Ang Ⅱ、ALD水平显著升高(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组血清cTnI、Ang Ⅱ、ALD水平显著降低(P < 0.05),CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组cTnI、Ang Ⅱ、ALD水平显著降低(P < 0.05)。见表 2。
|
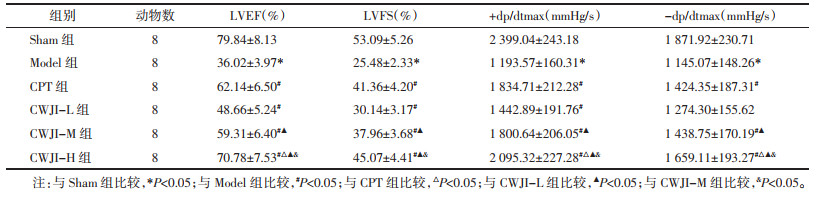
与Sham组比较,Model组大鼠LVHI显著升高(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组LVHI显著降低(P < 0.05),CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组LVHI显著降低(P < 0.05)。见表 3。
Sham组大鼠心肌组织形态和细胞结构均未见异常。Model组心肌组织可见明显的病理学改变,如心肌纤维断裂,细胞排列紊乱、空泡变性、坏死、消失,结缔组织增生,间质区水肿、巨噬细胞及中性粒细胞浸润等炎性细胞浸润。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组心肌组织病理学改变均明显改善,CWJI各剂量组改善效果呈剂量依赖性,且CWJI-H组效果优于CPT组。见图 1。
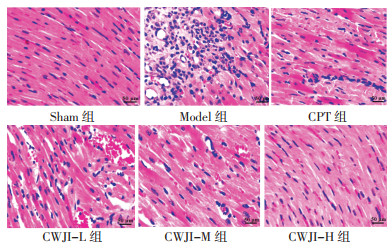
|
| 图 1 各组大鼠心肌组织病理学改变比较(HE染色,×400) Fig. 1 Comparison of myocardial histopathological changes of rats in each group (HE staining, ×400) |
Sham组心肌组织可见少量散在分布的凋亡细胞。Model组心肌细胞凋亡数量较Sham组明显增多。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组心肌细胞凋亡数量明显减少,CWJI各剂量组上述效应呈剂量依赖性,且CWJI-H组优于CPT组。与Sham组比较,Model组AI显著升高(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组AI显著降低(P < 0.05),CWJI各剂量组对AI的作用呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组AI显著降低(P < 0.05)。见图 2、表 3。
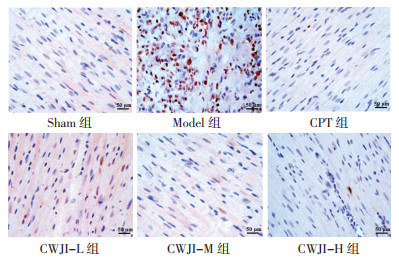
|
| 图 2 各组大鼠心肌细胞凋亡状况比较(TUNEL染色,×400) Fig. 2 Comparison of cardiomyocyte apoptosis of rats in each group (TUNEL staining, ×400) |
Sham组心肌组织可见生理状态下极少量丝状的胶原纤维分布。Model组心肌组织间质区和血管壁周围可见大量条索状胶原纤维沉积,部分融合成片状。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组胶原纤维沉积状况明显减轻,CWJI各剂量组效应呈剂量依赖性,且CWJI-H组优于CPT组。与Sham组比较,Model组CVF显著升高(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组CVF显著降低(P < 0.05),CWJI各剂量组对CVF的作用呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组CVF显著降低(P < 0.05)。见图 3、表 3。
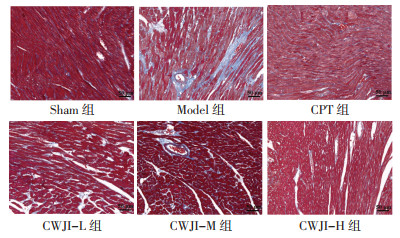
|
| 图 3 各组大鼠心肌组织纤维化状况比较(Masson染色,×400) Fig. 3 Comparison of myocardial fibrosis of rats in each group (Masson staining, ×400) |
Sham组大鼠左心室心肌细胞线粒体形态结构均未见异常。与Sham组比较,Model组可见肌原纤维紊乱,线粒体空泡化、肿胀、破裂,嵴断裂或者减少,可见线粒体自噬体。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组心肌细胞线粒体上述病变明显改善,CWJI各剂量组效果呈剂量依赖性,且CWJI-H组效果优于CPT组。见图 4。

|
| 图 4 各组大鼠心肌细胞线粒体超微结构变化比较(透射电子显微镜,×20 000) Fig. 4 Comparison of mitochondrial ultrastructural changes of cardiomyocyte of rats in each group (Transmission electron microscope, ×20 000) |
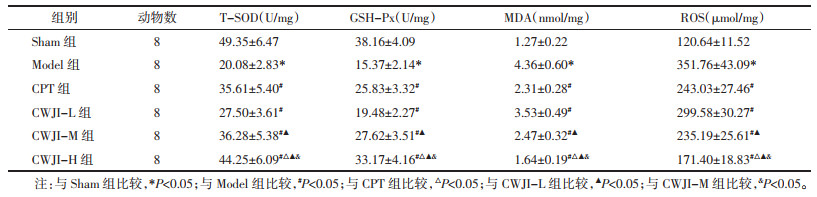
与Sham组比较,Model组大鼠心肌组织T-SOD、GSH-Px活性显著降低,MDA、ROS含量显著升高(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组T-SOD、GSH-Px活性显著升高,MDA、ROS含量显著降低(P < 0.05);CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组T-SOD、GSH-Px活性显著升高,MDA、ROS含量显著降低(P < 0.05)。见表 4。
|
与Sham组比较,Model组大鼠心肌组织Nrf2、HO-1 mRNA表达量显著降低(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组Nrf2、HO-1表达量显著升高(P < 0.05);CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组Nrf2、HO-1表达量显著升高(P < 0.05)。见表 5。
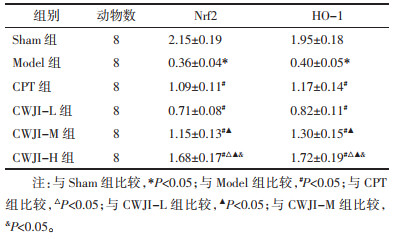
|
与Sham组比较,Model组大鼠心肌组织Nrf2、HO-1蛋白表达量显著降低(P < 0.05)。与Model组比较,CPT组和CWJI-L、CWJI-M、CWJI-H组Nrf2(CWJI-L组除外)、HO-1蛋白表达量显著升高(P < 0.05);CWJI各剂量组间上述效应呈剂量依赖性(P < 0.05)。与CPT组比较,CWJI-H组Nrf2、HO-1蛋白表达量显著升高(P < 0.05)。见图 5、表 6。

|
| 图 5 各组大鼠心肌组织Nrf2、HO-1蛋白表达比较 Fig. 5 Comparison of the expression of Nrf2, HO-1 in myocardial tissue of rats in each group |
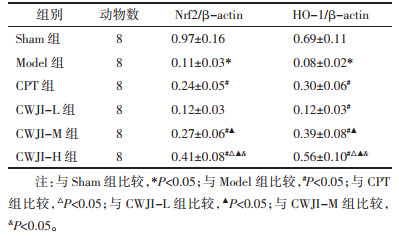
|
CWJI是由刺五加水醇提取物制成的一种中药注射剂,主要成分包括刺五加苷D、刺五加苷E、异嗪皮啶、咖啡酸、绿原酸等,具有较好的抗氧化、抗凋亡等药理学作用[9-10]。本研究探讨了CWJI对HF-AMI大鼠心肌组织的影响及相关机制,结果显示,CWJI可剂量依赖性提高HF-AMI大鼠LVEF、LVFS、+dp/dtmax、-dp/dtmax,提示CWJI具有改善HF-AMI大鼠心功能的作用,与李影雄等[11]报道相似。HE、TUNEL染色结果显示,HF-AMI模型大鼠心肌组织可见心肌纤维断裂,细胞空泡变性、数量减少,结缔组织增生,间质区水肿、炎性细胞浸润等病理学改变,以及大量心肌细胞凋亡,与顾峥等[12]研究结果一致;线粒体是细胞能量代谢的场所,对维持细胞生理状态及新陈代谢具有重要作用,本研究发现HF-AMI模型大鼠心肌线粒体呈现空泡化、肿胀、破裂,嵴断裂或者减少,自噬体形成等超微结构改变,与Cheng等[13]研究结果一致。CWJI可剂量依赖性改善HF-AMI大鼠心肌组织病理学改变、细胞凋亡和线粒体结构改变,并且CWJI-H组效果优于CPT组,提示CWJI具有减轻HF-AMI大鼠心肌组织损伤的作用。
氧化应激和心肌组织纤维化是HF-AMI发生和进行性加重的重要原因,并且心肌组织纤维化与氧化应激密切相关。AMI发生后线粒体结构和功能受损导致氧化呼吸链电子传递受阻,致使大量活性氧簇(ROS)生成,过度消耗内源性ROS还原性清除酶T-SOD、GSH-Px等,导致ROS蓄积而引发氧化应激,损伤线粒体脊结构、线粒体膜等,并破坏细胞膜、核酸、结构蛋白等引发细胞凋亡[14-15]。心室重构是HF-AMI的病理基础,而心肌纤维化是导致心室重构的关键,血清cTnT水平能够敏感地反映心肌损伤程度,而Ang Ⅱ、ALD水平能够反映心肌纤维化及心室重构状况[16]。ROS可刺激心肌成纤维细胞向肌成纤维细胞分化,分泌大量细胞外基质(ECM)而促进心肌组织纤维化病变[17]。Nrf2是哺乳动物细胞内广泛存在的一种核转录因子,可诱导T-SOD、GSH-Px等抗氧化酶和下游靶蛋白HO-1转录表达,HO-1具有催化血红素降解的生理学作用,降解产物中Fe2+、胆绿素等均具有较好的抗氧化作用,从而提高机体抗氧化能力[18-19]。本研究发现,CWJI可剂量依赖性降低HF-AMI大鼠血清cTnI、Ang Ⅱ、ALD水平,改善心肌组织纤维化状况,提高T-SOD、GSH-Px活性并降低MDA、ROS含量,提高Nrf2、HO-1 mRNA和蛋白表达量,并且CWJI-H组效果优于CPT组,提示CWJI具有抑制HF-AMI大鼠心肌组织纤维化和氧化应激的作用,激活Nrf2/HO-1信号通路可能是其重要的作用机制。与纪新博等[20]报道相似。
综上,CWJI可减轻HF-AMI大鼠心肌组织病变、细胞凋亡、组织纤维化和线粒体超微结构病变,改善心功能,其机制可能与激活Nrf2/HO-1信号通路,抑制氧化应激有关。本研究结果为CWJI作为HF-AMI治疗备选药物提供了理论依据,但其作用机制尚需深入研究。
| [1] |
CORDERO A, RODRÍGUEZ-MAÑERO M, BERTOMEU-GONZÁLEZ V, et al. New-onset heart failure after acute coronary syndrome in patients without heart failure or left ventricular dysfunction[J]. Revista Espanola De Cardiologia, 2021, 74(6): 494-501. DOI:10.1016/j.recesp.2020.03.020 |
| [2] |
NAIR A, SAJEEV C G, MUNEER K. A case of recent myocardial infarction with cardiac failure[J]. Heart, 2017, 103(7): 508-516. |
| [3] |
CHEN X H, WAN W G, GUO Y, et al. Pinocembrin ameliorates post-infarct heart failure through activation of Nrf2/HO-1 signaling pathway[J]. Molecular Medicine, 2021, 27(1): 100. DOI:10.1186/s10020-021-00363-7 |
| [4] |
李强, 靳书滨, 霍韶军. 刺五加注射液调控Nrf2/HO-1通路减轻大鼠肾缺血再灌注损伤作用[J]. 现代药物与临床, 2022, 37(4): 681-686. LI Q, JIN S B, HUO S J. Effect of Ciwujia Injection reduces renal ischemia-reperfusion injury in rats by regulating Nrf2/HO-1 pathway[J]. Drugs & Clinic, 2022, 37(4): 681-686. |
| [5] |
葛一蒙, 郝春华, 韩冰, 等. 刺五加注射液对化疗药物心脏损伤保护及辅助治疗的实验研究[J]. 药物评价研究, 2018, 41(11): 1963-1969. GE Y M, HAO C H, HAN B, et al. Effect of Acanthopanax Injection on myocardial protection induced by doxorubicin in rat and sleeping, antidepressant effect in mice[J]. Drug Evaluation Research, 2018, 41(11): 1963-1969. |
| [6] |
张珊, 郝春华, 葛一蒙, 等. 刺五加注射液改善阿霉素诱导大鼠心脏收缩功能下降的作用研究[J]. 中草药, 2018, 49(17): 4071-4077. ZHANG S, HAO C H, GE Y M, et al. Effect of Ciwujia Injection on decrease of cardiac contractile function induced by doxorubicin hydrochloride[J]. Chinese Traditional and Herbal Drugs, 2018, 49(17): 4071-4077. DOI:10.7501/j.issn.0253-2670.2018.17.016 |
| [7] |
曹亚选, 郑荣菲, 王贺, 等. 参附益心颗粒对急性心肌梗死后心力衰竭大鼠心肌细胞线粒体自噬的影响[J]. 中国药房, 2022, 33(10): 1183-1188. CAO Y X, ZHENG R F, WANG H, et al. Effects of Shenfu Yixin Granule on mitochondrial autophagy of cardiomyocytes in rats with heart failure after acute myocardial infarction[J]. China Pharmacy, 2022, 33(10): 1183-1188. DOI:10.6039/j.issn.1001-0408.2022.10.06 |
| [8] |
黄慧, 熊雁, 唐艺加, 等. 大黄素对心肌梗死后心力衰竭大鼠心肌保护机制研究[J]. 中国临床解剖学杂志, 2023, 41(1): 64-71. HUANG H, XIONG Y, TANG Y J, et al. The protective effects of emodin on myocardial energy metabolism in rats with heart failure after myocardial infarction[J]. Chinese Journal of Clinical Anatomy, 2023, 41(1): 64-71. |
| [9] |
李强, 靳书滨, 陈晶, 等. 刺五加注射液预处理在大鼠肾缺血再灌注损伤中的抗氧化作用及其对肿瘤坏死因子-α的影响[J]. 海南医学, 2015, 26(7): 941-943. LI Q, JIN S B, CHEN J, et al. Effect of aeanthopanax senticosus on antioxidants and serum TNF-α during acute renal ischemia-reperfusion injury in rats[J]. Hainan Medical Journal, 2015, 26(7): 941-943. DOI:10.3969/j.issn.1003-6350.2015.07.0338 |
| [10] |
冯丹, 黄万宇, 偰光华. 刺五加注射液对大鼠肝缺血再灌注损伤的保护机制[J]. 中国卫生工程学, 2013, 12(6): 449-451, 454. FENG D, HUANG W Y, XIE G H. Protective effects of Acanthopanax Senticosus Injection on hepatic ischemia- reperfusion injury in rats[J]. Chinese Journal of Public Health Engineering, 2013, 12(6): 449-451, 454. |
| [11] |
李影雄, 蔡海荣, 蔡惠铃, 等. 加味人参四逆汤对急性心肌梗死后心力衰竭大鼠心功能的保护机制研究[J]. 广州中医药大学学报, 2021, 38(6): 1236-1241. LI Y X, CAI H R, CAI H L, et al. Protective mechanisms of modifided Renshen Sini Decoction for heart function in rats with heart failure after acute myocardial infarction[J]. Journal of Guangzhou University of Chinese Medicine, 2021, 38(6): 1236-1241. |
| [12] |
顾峥, 王顾浩, 刘恋. 皮质抑素通过p38 MAPK信号通路抑制急性心肌梗死后心力衰竭大鼠氧化应激及心肌细胞凋亡[J]. 中西医结合心脑血管病杂志, 2022, 20(18): 3312-3317. GU Z, WANG G H, LIU L. Cortistatin inhibits oxidative stress and cardiomyocyte apoptosis in rats with post-acuate myocardial infarction heart failure through p38 MAPK signaling pathway[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease, 2022, 20(18): 3312-3317. DOI:10.12102/j.issn.1672-1349.2022.18.008 |
| [13] |
CHENG S Y, YU P, YANG L, et al. Astragaloside Ⅳ enhances cardioprotection of remote ischemic conditioning after acute myocardial infarction in rats[J]. American Journal of Translational Research, 2016, 8(11): 4657-4669. |
| [14] |
AMRUTA N, BIX G. ATN-161 ameliorates ischemia/reperfusion-induced oxidative stress, fibro-inflammation, mitochondrial damage, and apoptosis-mediated tight junction disruption in bEnd.3 cells[J]. Inflammation, 2021, 44(6): 2377-2394. |
| [15] |
DONG W X, CHEN W H, ZOU H B, et al. Ginsenoside Rb1 prevents oxidative stress-induced apoptosis and mitochondrial dysfunction in muscle stem cells via NF-κB pathway[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 9159101. |
| [16] |
ZAMPIERI M, BERTEOTTI M, FERRANTINI C, et al. Pathophysiology and treatment of hypertrophic cardiomyopathy: new perspectives[J]. Current Heart Failure Reports, 2021, 18(4): 169-179. |
| [17] |
卢迎宏, 王丹, 井海云, 等. 胰激肽原酶缓解心肌缺血再灌注损伤大鼠氧化应激和纤维化[J]. 中国比较医学杂志, 2022, 32(3): 23-30. LU Y H, WANG D, JING H Y, et al. Pancreatic kininogenase relieves oxidative stress and fibrosis in rats with myocardial ischemia-reperfusion injury[J]. Chinese Journal of Comparative Medicine, 2022, 32(3): 23-30. |
| [18] |
LIU C X, ZHOU J, WANG B Y, et al. Bortezomib alleviates myocardial ischemia reperfusion injury via enhancing of Nrf2/HO-1 signaling pathway[J]. Biochemical and Biophysical Research Communications, 2021, 556: 207-214. |
| [19] |
YAO D S, SHI B, WANG S C, et al. Isoliquiritigenin ameliorates ischemia-induced myocardial injury via modulating the Nrf2/HO-1 pathway in mice[J]. Drug Design, Development and Therapy, 2022, 16: 1273-1287. |
| [20] |
纪新博, 顾申红, 麦华德, 等. Prdx1过表达通过Nrf2/HO-1信号通路抑制氧化应激减轻自发性高血压大鼠心肌肥厚和纤维化[J]. 安徽医科大学学报, 2023, 58(2): 196-201. JI X B, GU S H, MAI H D, et al. Prdx1 overexpression inhibits oxidative stress through Nrf2/HO-1 signaling pathway and reduces myocardial hypertrophy and fibrosis in spontaneously hypertensive rats[J]. Acta Universitatis Medicinalis Anhui, 2023, 58(2): 196-201. |
 2023, Vol. 40
2023, Vol. 40