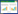文章信息
- 董丽君, 周波, 杨翠玲, 等.
- DONG Lijun, ZHOU Bo, YANG Cuiling, et al.
- 基于MAPK/NF-κB通路探究藏红花素对幼年小鼠肺炎模型的治疗作用及分子机制
- Exploring the therapeutic effect and molecular mechanism of crocin on a young mouse pneumonia model based on the MAPK/NF-κB pathway
- 天津中医药, 2023, 40(12): 1609-1614
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(12): 1609-1614
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.12.17
-
文章历史
- 收稿日期: 2023-08-10
2. 安丘市人民医院影像科, 安丘 262199;
3. 安丘市人民医院儿科, 安丘 262199;
4. 山东中医药大学中医学院, 济南 250355;
5. 潍坊医学院附属医院儿科, 潍坊 261035
肺炎是一种常见的下呼吸道疾病,主要由病毒感染、细菌或真菌病原体引起,在世界范围内具有较高的发病率和病死率[1]。肺炎广泛发病于儿童中,主要是由于儿童免疫力低下和呼吸道解剖结构的缺陷,其高发病率和复发率可引起各种严重并发症和预后不良,严重影响儿童发育和生命健康[2]。因此,确定儿童肺炎的潜在发病机制,开发新的治疗策略来抑制肺炎的进展非常重要。革兰氏阴性菌中的脂多糖(LPS)是一种有效的炎症内毒素,可导致各种器官如肺部炎症性疾病的发生,LPS通过激活丝裂原活化蛋白激酶(MAPK)/核因子-κB(NF-κB)通路来促进和扩增炎症介质的表达,而过度的炎症浸润导致肺炎进一步加重[3]。研究发现,通过下调NF-κB/MAPK通路可减弱急性肺炎体外模型的炎症反应[4]。藏红花素(CRO)具有抗氧化、抗炎、抗肿瘤、抗细胞凋亡和心脏保护等多种生物活性,CRO对肺纤维化大鼠模型中的肺部炎症和肺血管功能障碍有减轻作用[5]。CRO还能通过抑制p38 MAPK/NF-κB信号通路发挥对脓毒症诱导的肝、肾和肺损伤的保护作用[6]。而CRO能否通过调节MAPK/NF-κB信号通路发挥幼年肺炎小鼠的保护作用,尚不清楚。本研究通过构建幼年小鼠肺炎模型,探究CRO的治疗作用及其分子机制。
1 材料与方法 1.1 实验材料SPF级C57BL/6小鼠80只,购自武汉贝赛模式生物科技有限公司,生产许可证号:SCXK(鄂)2022-0029,3~4周龄,适应性喂养1周,饲养环境温度22 ℃左右,湿度55 %,12 h光暗循环,不禁水食。本研究通过动物伦理委员会批准。
1.2 主要试剂与仪器CRO(纯度≥98 %)、白细胞介素(IL)-1β酶联免疫吸附(ELISA)试剂盒(上海源叶生物科技有限公司);LPS、髓过氧化物酶(MPO)(北京索莱宝公司);地塞米松(DEX,福州海王福药制药有限公司);MAPK激活剂(Anisomycin,美国MedChemExpress公司);ELISA试剂盒:肿瘤坏死因子-α(TNF-α)、IL-6(上海酶联生物公司);苏木精-伊红(HE)染色试剂盒(上海翌圣生物公司);丙二醛(MDA)、超氧化物歧化酶(SOD)、吉姆萨染色试剂盒(北京百奥莱博科技有限公司);二抗辣根酶标记山羊抗兔(美国Abcam公司);一抗p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、p-IκBα、核因子κB抑制蛋白α(IκBα)和β-actin抗体(赛默飞世尔科技公司)。全自动酶标仪(奥地利TECAN公司);显微镜(日本尼康公司)。
1.3 实验方法 1.3.1 小鼠分组、建模和药物干预将小鼠随机分为对照组、模型组、DEX(阳性对照)组、CRO低剂量组、CRO中剂量组、CRO高剂量组、Anisomycin组(CRO高剂量+MAPK激活剂Anisomycin),每组10只。其中DEX组小鼠以2 mg/kg灌胃[7],CRO低、中、高剂量组分别以25、50、100 mg/kg灌胃[8]、Anisomycin组在CRO 100 mg/kg基础上加Anisomycin 2 mg/kg灌胃[9],对照组和模型组灌胃相同剂量生理盐水,每天1次,连续给药1周。除对照组外,其余小鼠最后1次药物干预1 h后,参照文献[10]采用腹腔注射LPS(5 mg/kg)构建肺炎模型,对照组注射相同剂量生理盐水。24 h后小鼠出现呼吸频率增快、精神萎靡、活动减少等症状表明模型构建成功,对造模不成功或出现死亡的各组小鼠共10只及时补充。
1.3.2 样本采集各组小鼠造模72 h后,眼球取血,离心取上清液-80 ℃保存;麻醉处死小鼠,取5只小鼠手术暴露气管并插管,用磷酸缓冲盐溶液冲洗3次,获得肺泡灌洗液(BALF),离心取上清液-80 ℃保存;剩余5只小鼠分离肺组织,取小鼠左肺测量湿/干(W/D)比,右肺上叶进行HE染色,其余肺组织-80 ℃保存进行蛋白免疫印迹(Western Blot)检测。
1.3.3 肺W/D比取小鼠左肺,擦净肺组织表面液体后称质量以获得湿质量,后将肺组织置于80 ℃的烘箱中48 h至质量稳定,再次称取获得干质量,W/D比由湿质量与干质量之比计算。
1.3.4 HE染色观察肺部组织病理变化及病理损伤评分取小鼠右上叶肺生理盐水洗净,4 %多聚甲醛固定、石蜡包埋,制备肺切片(4 μm),脱蜡后HE染色,脱水封片在电子显微镜下观察肺部组织病理学变化并拍照。并进行肺组织病理损伤评分,根据以下参数进行评分:1)有无出血。2)水肿程度。3)肺泡充血,中性粒细胞在空隙空间或血管壁聚集。4)肺泡壁厚度/透明膜形成。分别记为0~4分,分数越高损伤程度越重。
1.3.5 MPO活性检测取-80 ℃肺组织并准确称质量,并将组织在反应缓冲液中均质化(质量/体积比=1∶19),然后按照MPO试剂盒说明检测肺组织的MPO活性,测定450 nm处吸光度变化。
1.3.6 BALF中细胞计数取-80 ℃保存的BALF,采用血细胞计数器和吉姆萨染色进行计数总细胞、中性粒细胞和白细胞。
1.3.7 血清和BALF中炎症因子取-80 ℃保存的血清和BALF,按照ELISA试剂盒说明书,检测炎性因子IL-6、IL-1β和TNF-α的水平。
1.3.8 血清和BALF中MDA、SOD水平取-80 ℃保存的血清和BALF,按照试剂盒说明书,检测炎性因子MDA、SOD的水平。
1.3.9 Western Blot检测蛋白表达取-80 ℃保存幼年小鼠肺组织,用RIPA裂解,提取总蛋白,用BCA试剂盒进行浓度定量,按步骤将蛋白SDS-PAGE电泳、转膜,5%脱脂奶粉封闭2 h,在4 ℃下加入一抗p-p38 MAPK、p38 MAPK、p-NF-κB p65、NF-κB p65、p-IκBα、IκBα(1∶1 000)和β-actin(1∶2 000)过夜孵育,清洗,在4 ℃下加入二抗山羊抗兔IgG(1∶2 000),孵育2 h。用ECL发光显影,观察拍照,各条带灰度值用Image J软件处理分析。
1.4 统计学处理数据采用SPSS 22.0软件进行统计分析,计量资料统计描述用均数±标准差(x±s)表示,多组间比较用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
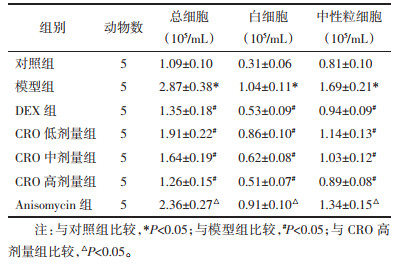
2 结果 2.1 各组小鼠W/D比和MPO活性变化与对照组比较,模型组小鼠肺W/D比、MPO活性显著升高(P < 0.05);与模型组比较,DEX组和CRO低、中、高剂量组肺W/D比、MPO活性显著下降(P < 0.05),DEX组与CRO高剂量组间差异无统计学意义(P > 0.05);与CRO高剂量组比较,Anisomycin组肺W/D比、MPO活性显著升高(P < 0.05)。见表 1。
|
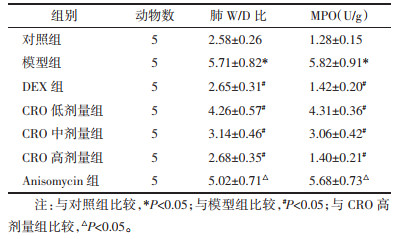
对照组小鼠肺结构完整,无炎症、水肿、出血,未见炎性细胞浸润;模型组小鼠出现肺组织损伤,肺泡壁有增厚融合,水肿破裂的肺泡充满红血球,肺间质有炎性细胞浸润,病理损伤评分显著升高(P < 0.05);DEX组和CRO低、中、高剂量组小鼠肺组织病理损伤减轻,少量炎性细胞浸润,DEX组与CRO高剂量组改善效果相似,病理损伤评分显著下降(P < 0.05);Anisomycin组相比于CRO高剂量组,肺部病理损伤加重,病理损伤评分显著升高(P < 0.05)。见图 1和表 2。
|
| 注:A.对照组;B.模型组;C. DEX组;D. CRO低剂量组;E. CRO中剂量组;F. CRO高剂量组;G. Anisomycin组。 图 1 各组幼年小鼠肺组织HE染色图(×200) Fig. 1 HE staining of lung tissue in young mice of each group (×200) |
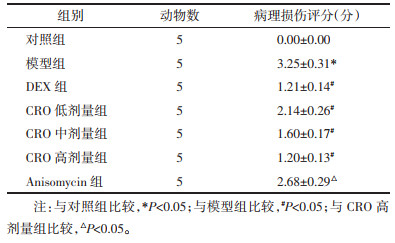
|
与对照组比较,模型组小鼠总细胞、中性粒细胞和白细胞计数显著升高(P < 0.05);与模型组比较,DEX组和CRO低、中、高剂量组总细胞、中性粒细胞和白细胞计数显著下降(P < 0.05),DEX组与CRO高剂量组间差异无统计学意义(P > 0.05);与CRO高剂量组比较,Anisomycin组总细胞、中性粒细胞和白细胞计数显著升高(P < 0.05)。见表 3。
与对照组比较,模型组小鼠血清和BALF中IL-6、IL-1β和TNF-α水平显著升高(P < 0.05);与模型组比较,DEX组和CRO低、中、高剂量组血清和BALF中IL-6、IL-1β和TNF-α水平显著下降(P < 0.05),DEX组与CRO高剂量组间差异无统计学意义(P > 0.05);与CRO高剂量组比较,Anisomycin组血清和BALF中IL-6、IL-1β和TNF-α水平显著升高(P < 0.05)。见表 4。
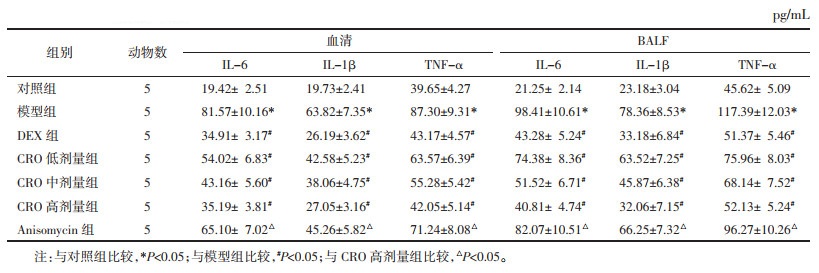
|
与对照组比较,模型组小鼠血清和BALF中MDA水平显著升高,SOD水平显著下降(P < 0.05);与模型组比较,DEX组和CRO低、中、高剂量组血清和BALF中MDA水平显著下降,SOD水平显著升高(P < 0.05),DEX组与CRO高剂量组间差异无统计学意义(P > 0.05);与CRO高剂量组比较,Anisomycin组血清和BALF中MDA水平显著升高,SOD水平显著下降(P < 0.05)。见表 5。
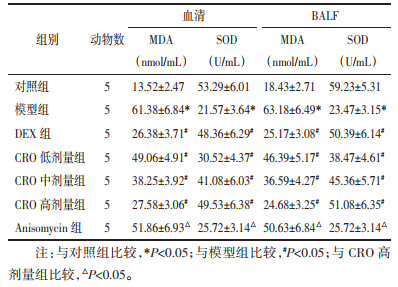
|
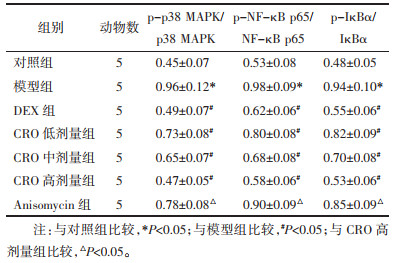
与对照组比较,模型组小鼠p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα显著升高(P < 0.05);与模型组比较,DEX组和CRO低、中、高剂量组p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα显著下降(P < 0.05),DEX组与CRO高剂量组间差异无统计学意义(P > 0.05);与CRO高剂量组比较,Anisomycin组p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα显著升高(P < 0.05)。见图 2和表 6。
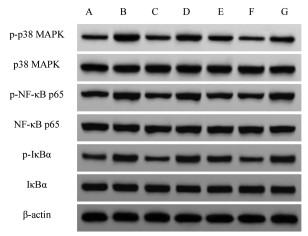
|
| 注:A.对照组;B.模型组;C.DEX组;D.CRO低剂量组;E.CRO中剂量组;F.CRO高剂量组;G.Anisomycin组。 图 2 各组小鼠肺组织蛋白表达结果 Fig. 2 Protein expression in lung tissue of mice in each group |
|
由于儿童的气道纤毛和免疫系统尚未发育完全,呼吸道经常暴露在碳颗粒、病毒和其他刺激物中,很容易引起肺炎等呼吸道疾病,严重影响患儿的生长发育,造成沉重的经济和社会负担[2]。LPS与许多肺部炎症性疾病的发展有关,可刺激呼吸系统的免疫功能,引起急、慢性炎症反应,导致肺损伤、肺气肿、气道重塑等病理改变,影响儿童肺发育[11]。以往的研究主要是针对中老年呼吸系统疾病,而关于儿科呼吸系统疾病研究相对较少。本研究通过LPS法构建幼年小鼠肺炎模型,选用3~4周龄小鼠,其免疫功能和组织修复功能弱,肺部发育与人类的童年早期相似,为探究儿童肺炎的机制及临床应用奠定基础。本研究结果显示,模型组小鼠出现肺组织损伤,肺泡水肿出血,大量炎性细胞浸润,肺W/D比和病理损伤评分显著升高,表明肺炎小鼠模型构建成功。模型组小鼠BALF中总细胞、中性粒细胞和白细胞计数显著升高,且血清和BALF中TNF-α、IL-lβ、IL-6、MDA水平显著升高,SOD水平显著降低,表明LPS诱导炎症因子和氧化应激反应,多种炎症因子又通过激活中性粒细胞和巨噬细胞活化,进一步导致肺部炎症发生。
CRO已被证实能通过发挥抗氧化、抗炎等作用对肺部炎症损伤起到保护作用,不仅可通过抑制炎症信号通路来缓解LPS诱导的急性呼吸窘迫综合征和肺损伤[12];还通过发挥对白细胞和淋巴细胞的免疫调节作用,降低卵清蛋白致敏小鼠肺部炎症[8]。本研究发现,CRO干预后小鼠肺组织病理损伤减轻,少量炎性细胞浸润,肺W/D比和病理损伤评分、BALF中总细胞、中性粒细胞和白细胞计数以及血清和BALF中炎症因子和MDA水平显著降低,SOD水平显著升高,表明CRO具有减轻小鼠肺炎的功效,主要是通过发挥抗炎、抗氧化、免疫调节作用。本研究还选用DEX作为阳性药物,其对小鼠肺炎损伤的改善效果与CRO高剂量组效果相似,说明CRO对LPS诱导的肺炎具有很好的改善效果。
MAPK作为介导基本生物学过程和细胞对外部应激的信号分子,可被各种炎症和应激刺激激活来调节免疫应答,p38 MAPK通路作为MAPK信号传导的纽带,与炎症密切相关,在TNF-α、IL-1β和IL-6的产生中起重要作用[13]。且MAPK是NF-κB的上游激活剂,p38 MAPK在NF-κB向细胞核的活化和迁移中起重要作用,可通过激活NF-κB促进促炎介质的表达。正常情况下,NF-κB以非活性状态与IκB结合的状态存在于细胞质中,LPS刺激增加MAPK的磷酸化,导致NF-κB活化并以p65活性形式易位到细胞核中,增加促炎细胞因子表达和过度炎症反应的发生[14]。Wang等[15]研究发现抑制p38 MAPK可缓解肺缺血再灌注损伤,可能是治疗急性肺损伤的有效方法。Yu等[16]也发现使用NF-κB抑制剂可改善炎症,进而预防LPS诱导的急性肾损伤和肺损伤。还有研究表明,抑制MAPK/NF-κB信号通路可以减少肺部炎症和血管重塑,并减轻LPS诱导的急性肺损伤[17]。本研究发现,模型组小鼠p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达显著升高,表明LPS刺激可能激活MAPK/NF-κB信号通路。而CRO干预后p-p38 MAPK/p38 MAPK、p-NF-κB p65/NF-κB p65、p-IκBα/IκBα表达降低,表明CRO可能具有抑制MAPK/NF-κB激活的作用。这与CRO通过抑制p38 MAPK/NF-κB信号通路发挥对脓毒症诱导的肝、肾和肺损伤的保护作用,以及抑制NF-κB信号传导来减轻心肌纤维化中的氧化应激、炎症和细胞凋亡[6, 18]结果相似,为进一步验证CRO对MAPK/NF-κB信号通路的干预作用,本研究在CRO高剂量组的基础上加上MAPK激活剂Anisomycin,CRO对LPS诱导的肺炎小鼠的改善作用受到抑制,因此猜测CRO的作用机制可能与抑制MAPK/NF-κB信号通路的激活有关。
综上,CRO可能通过抑制MAPK/NF-κB通路激活,减少炎症反应和氧化应激,对LPS诱导的肺炎小鼠肺部损伤有治疗作用。本研究为改善幼年肺炎小鼠提供了新思路,但仅初步探讨CRO对幼年肺炎小鼠的治疗作用,后续将进一步探讨CRO对成年小鼠的治疗作用以及研究药物与年龄的相关性。
| [1] |
TORRES A, CILLONIZ C, NIEDERMAN M S, et al. Pneumonia[J]. Nature Reviews Disease Primers, 2021, 7: 25. DOI:10.1038/s41572-021-00259-0 |
| [2] |
MASARWEH K, GUR M, TOUKAN Y, et al. Factors associated with complicated pneumonia in children[J]. Pediatric Pulmonology, 2021, 56(8): 2700-2706. DOI:10.1002/ppul.25468 |
| [3] |
XUAN T Q, GONG G H, DU H H, et al. Protective effect of pteryxin on LPS-induced acute lung injury via modulating MAPK/NF-κB pathway and NLRP3 inflammasome activation[J]. Journal of Ethno-pharmacology, 2022, 286: 114924. DOI:10.1016/j.jep.2021.114924 |
| [4] |
KO H M, LEE S H, JEE W, et al. Gancaonin N from Glycyrrhiza uralensis attenuates the inflammatory response by downregulating the NF-κB/MAPK pathway on an acute pneumonia in vitro model[J]. Pharmaceutics, 2021, 13(7): 1028. DOI:10.3390/pharmaceutics13071028 |
| [5] |
ZAGHLOUL M S, SAID E, SUDDEK G M, et al. Crocin attenuates lung inflammation and pulmonary vascular dysfunction in a rat model of bleomycin-induced pulmonary fibrosis[J]. Life Sciences, 2019, 235: 116794. DOI:10.1016/j.lfs.2019.116794 |
| [6] |
GAO J, ZHAO F, YI S N, et al. Protective role of crocin against sepsis-induced injury in the liver, kidney and lungs via inhibition of p38 MAPK/NF-κB and Bax/Bcl-2 signalling pathways[J]. Pharmaceutical Biology, 2022, 60(1): 543-552. DOI:10.1080/13880209.2022.2042328 |
| [7] |
武振帅, 纪鹏, 魏彦明, 等. 黄芩-连翘配伍对脂多糖诱导小鼠急性肺炎模型的保护作用[J]. 中国实验动物学报, 2022, 30(6): 800-809. WU Z S, JI P, WEI Y M, et al. Protective effect of Scutellariae Radix-Forsythiae fructus in an acute pneumonia mouse model induced by lipopolysaccharide[J]. Acta Laboratorium Animalis Scientia Sinica, 2022, 30(6): 800-809. |
| [8] |
ASLANI M R, JAFARI Z, RAHBARGHAZI R, et al. Effects of crocin on T-bet/GATA-3 ratio, and miR-146a and miR-106a expression levels in lung tissue of ovalbumin-sensitized mice[J]. Iranian Journal of Basic Medical Sciences, 2022, 25(10): 1267-1274. |
| [9] |
LI J Y, SUN Q, ZHENG C Y, et al. Lipoxin A4-mediated p38 MAPK signaling pathway protects mice against collagen-induced arthritis[J]. Biochemical Genetics, 2021, 59(1): 346-365. DOI:10.1007/s10528-020-10016-9 |
| [10] |
王兆建. miR-9-5p靶向CXCL11在幼年小鼠肺炎模型中的作用[J]. 中国免疫学杂志, 2021, 37(19): 2332-2337. WANG Z J. Role of miR-9-5p in juvenile mice pneumonia model via targeting CXCL11[J]. Chinese Journal of Immunology, 2021, 37(19): 2332-2337. |
| [11] |
BIAN X X, ZHAO X, MA C H, et al. Arbutin alleviates LPS induced sepsis pneumonia in mice[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2022, 2022: 5863952. |
| [12] |
ZHANG D, QI B Y, ZHU W W, et al. Crocin alleviates lipopolysaccharide-induced acute respiratory distress syndrome by protecting against glycocalyx damage and suppressing inflammatory signaling pathways[J]. Inflammation Research: Official Journal of the European Histamine Research Society, 2020, 69(3): 267-278. |
| [13] |
LIAO X T, ZHANG W K, DAI H J, et al. Neutrophil-derived IL-17 promotes ventilator-induced lung injury via p38 MAPK/MCP-1 pathway activation[J]. Frontiers in Immunology, 2021, 12: 768813. DOI:10.3389/fimmu.2021.768813 |
| [14] |
FANG C H, HE M L, LI D, et al. YTHDF2 mediates LPS-induced osteoclastogenesis and inflammatory response via the NF-κB and MAPK signaling pathways[J]. Cellular Signalling, 2021, 85: 110060. DOI:10.1016/j.cellsig.2021.110060 |
| [15] |
WANG T T, LIU C X, PAN L H, et al. Inhibition of p38 MAPK mitigates lung ischemia reperfusion injury by reducing blood-air barrier hyperpermeability[J]. Frontiers in Pharmacology, 2020, 11: 569251. DOI:10.3389/fphar.2020.569251 |
| [16] |
YU Y Y, LI X Q, HU W P, et al. Self-developed NF-κB inhibitor 270 protects against LPS-induced acute kidney injury and lung injury through improving inflammation[J]. Biomedecine & Pharmacotherapie, 2022, 147: 112615. |
| [17] |
HONG H W, LOU S Y, ZHENG F L, et al. Hydnocarpin D attenuates lipopolysaccharide-induced acute lung injury via MAPK/NF-κB and Keap1/Nrf2/HO-1 pathway[J]. Phytomedicine: International Journal of Phytotherapy and Phytopharmacology, 2022, 101: 154143. DOI:10.1016/j.phymed.2022.154143 |
| [18] |
JIN W Y, ZHANG Y Y, XUE Y R, et al. Crocin attenuates isoprenaline-induced myocardial fibrosis by targeting TLR4/NF-κB signaling: connecting oxidative stress, inflammation, and apoptosis[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2020, 393(1): 13-23. DOI:10.1007/s00210-019-01704-4 |
2. Department of Imaging, Anqiu People's Hospital, Anqiu 262199, China;
3. Department of Pediatrics, Anqiu People's Hospital, Anqiu 262199, China;
4. School of Traditional Chinese Medicine, Shandong University of Traditional Chinese Medicine, Jinan 250355, China;
5. Department of Pediatrics, Affiliated Hospital of Weifang Medical College, Weifang 261035, China
 2023, Vol. 40
2023, Vol. 40