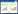文章信息
- 张梁坤, 谷文超, 吴婷婷, 李灵, 吴秀花, 张新生, 韩涛, 陈健
- ZHANG Liangkun, GU Wenchao, WU Tingting, LI Ling, WU Xiuhua, ZHANG Xinsheng, HAN Tao, CHEN Jian
- 半夏泻心汤通过抑制炎症抑制小鼠溃疡性结肠炎
- Banxia Xiexin Decoction inhibited ulcerative colitis in mice by inhibiting inflammation
- 天津中医药, 2023, 40(2): 202-213
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 202-213
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.14
-
文章历史
- 收稿日期: 2022-11-18
2. 临朐张新生中医诊所(新生堂),临朐 262600;
3. 山东中医药大学,济南 250355
溃疡性结肠炎(UC)是现阶段国内外公共卫生领域面临的重要挑战,患者常出现腹痛、泄泻、体质量减轻甚或便血、脓血便等临床表现,严重影响患者生活质量,降低幸福感[1];同时有研究证明,UC迁延不愈可导致直结肠癌的发生[2-4]。因此,积极探寻合理有效的UC防治方法迫在眉睫。半夏泻心汤出自《伤寒杂病论》,是中国古代经典名方之一。课题组前期经循证及实验研究发现,半夏泻心汤单独应用或联合应用可通过调节肠道微生态、外周及中枢5-羟色胺(5-HT)水平,促进Th1/Th2以及Th17/Treg免疫细胞平衡,改善局部炎症反应进而发挥治疗UC的作用[5-9]。
半夏泻心汤中含有有毒药物半夏,且原方中用量为半升,约为39.1 g,远超《中华人民共和国药典》(2020年版)[10](以下简称《药典》)中半夏的用量,故有关半夏的临床用量亦被历代医家深入论述。文章基于半夏的不同用药剂量组方以探究不同剂量的半夏泻心汤防治UC的疗效差异。生理状态下,机体中抗炎因子与抑炎因子之间的动态平衡是维持机体健康的基本保证,而炎症在UC的发生发展过程中发挥着举足轻重的作用[11-13],故UC患者体内必存在各类炎症因子的失衡。文章基于模型小鼠血清及局部结肠组织的炎症因子含量探究半夏泻心汤防治UC的作用机制。
本研究基于古代经典名方原意及现代用药法则,选用与原方中洗半夏最为接近的半夏现代炮制品--清半夏,且以半夏的原方用量及药典最大用量为基准,依据半夏泻心汤各药物剂量比[14]进行组方(半夏泻心汤古方量方及半夏泻心汤药典量方),干预右旋葡聚糖硫酸钠(DSS)诱导建立的UC模型小鼠(DSS-UC小鼠)以探究不同剂量的半夏泻心汤防治UC的疗效差异及其作用机制。以期为经典名方半夏泻心汤的临床合理应用及UC的防治提供实验基础。
1 材料 1.1 实验动物本研究选用的实验动物为SPF级健康C57BL/6J小鼠,雄性、6周龄(18~22 g),40只;其均购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006,质量合格证号:1100111911047707。
1.2 中药材清半夏(批号190501)、干姜(批号190101)、黄连(批号180501)、黄芩(批号190301)、人参(批号190401)、炙甘草(批号181106)和大枣(批号190506),以上药物均采自山东百味堂中药饮片有限公司,并经山东中医药大学中药鉴定学教研室主任徐凌川教授鉴定均为真品。分别精确称取清半夏39.10 g、9.00 g,干姜46.90 g、10.80 g,黄连15.60 g、3.60 g,黄芩46.90 g、10.80 g,人参46.90 g、10.80 g,炙甘草46.90 g、10.8 g和大枣31.00 g、7.2 g组成半夏泻心汤古方量方(总生药量:273.30 g)和半夏泻心汤药典量方(总生药量:63.00 g)。取上述两剂药分别加8倍量蒸馏水,冷浸120 min,大火开锅后微沸煎煮30 min后,倾出药液,趁热过滤,去滓再煎至154 mL药液;分别获取半夏泻心汤古方量方水煎液(生药浓度:1.776 5 g/mL)和半夏泻心汤药典量方水煎液(生药浓度:0.409 5 g/mL),4 ℃保存备用。
1.3 试剂右旋葡聚糖硫酸钠(美国MP公司相对分子质量36 000~50 000,批号S2839),冰醋酸(国药集团化学试剂有限公司,批号10000218),伊红(Solarbio,批号E8090),中性树脂(Solarbio,批号G8590),苏木素(Sevicebio,批号G1004),4%多聚甲醛(Biosharp,批号69111800)。
仪器:正置显微镜(徕卡显微系统有限公司,型号DM1000),恒温烘箱(上海一恒科学仪器有限公司,型号DHG-9023A),石蜡切片机(徕卡显微系统有限公司,型号RM2235),摊片烤片机(湖北康强医疗器械有限公司,型号TKD-TK),生物组织包埋机-冷冻机(泰维科技,型号TB-718L),生物组织包埋机(泰维科技,型号TB-718D),自动组织脱水机(湖北康强医疗器械有限公司,型号TKD-TSF),酶标仪(LabsystemsMultiskan,型号MS352型)。
2 方法 2.1 动物实验设计本研究采用C57BL/6J雄性小鼠,接受动物后置于观察室观察1周,期间通过体质量区间分组法将32只小鼠随机分为空白组、模型组、半夏泻心汤古方量组(以下简称古方量组)和半夏泻心汤药典量组(以下简称药典量组);实验开始后除空白组外所有小鼠自由饮用浓度为2.5%的DSS水溶液7 d;同时古方量组及药典量组按0.2 mL/10 g给予相应的中药水煎液干预,空白组及模型组给予等量的灭菌水予以对照。干预7 d后,停止DSS水溶液自由饮用,古方量组及药典量组继续中药干预1周。实验第14天晚,所有小鼠禁食禁水12 h,随后收集小鼠各类标本以供检测。具体流程如图 1。
|
| 图 1 半夏泻心汤防治溃疡性结肠炎小鼠模型的实验流程 Fig. 1 Experimental workflow of the prevention and treatment of ulcerative colitis mice model by Banxia Xiexin Decoction |
本实验过程中,所有实验小鼠均饲养于山东中医药大学实验动物中心SPF级屏障环境设施(实验动物使用许可证号为SYXK(鲁)20170022)内。实验期间采用60Co灭菌大小鼠维持饲料。环境温度(22±2)℃;相对湿度50%±5%;光照交替12/12 h。
本研究实验方案经山东中医药大学实验动物福利伦理审查委员会审查通过,所有实验操作严格遵循山东中医药大学动物伦理委员会相关规定进行。
2.2 UC动物模型复制本研究采用C57BL/6J小鼠自由饮用浓度为2.5%的DSS水溶液7 d诱导建立UC模型。在诱导建模过程中,每笼小鼠给药瓶充足且瓶中DSS溶液足量,以减少因小鼠竞争饮水而导致给药量不足所带来的偏倚。
2.3 实验动物给药在实验开始、动物造模之初同时予以中药灌胃干预。具体如下:自实验第1天起,各组小鼠每天于11:00-13:00灌胃1次,连续灌胃14 d。空白组、模型组予以生理盐水灌胃(给药量为0.2 mL/10 g);古方量组、药典量组则分别予以半夏泻心汤古方量方(生药浓度:1.776 5 g/mL)、药典量方(生药浓度:0.409 5 g/mL)水煎液灌胃(给药量为0.2 mL/10 g)。
2.4 实验动物一般状况的记录实验期间每日观察、记录实验小鼠的饮食摄水量、粪便、被毛、活动和精神状态、体质量及死亡率等一般情况,并详细记录小鼠腹泻及便血程度。同时根据文献[15]方法计算疾病指数(DAI)值:DAI=体重指数+大便黏稠度指数+出血情况指数。各指标计算标准如下:体重指数(体质量不变为0,下降1%~5%为1分,下降5%~10%为2分,下降10%~15%为3分,下降大于15%为4分);大便黏稠度指数(正常为0,松散的大便为2分,腹泻为4分)和大便出血指数(正常0分,隐血阳性为2分,显性出血为4分)。
2.5 实验动物标本的收集与检测1)通过小鼠眼眶后静脉丛收集血液,4 ℃下静置30 min后,在4 ℃、3 000 r/min条件下离心15 min,离心半径12.5 cm,取上清,-80 ℃保存,供炎症因子检测。2)打开小鼠腹腔,摘取胸腺、肝、脾、肾脏,滤纸吸干残血后称质量(g),计算脏器指数。3)分离肠管,水平拉直肠管测量肠管总长度及结肠长度(cm),称取肠管总质量及结肠质量(g)。4)截取结肠近段及远段,磷酸盐缓冲液(PBS)冲洗干净,4%甲醛溶液固定保存,经苏木精-伊红(HE)染色以观察结肠组织病理损伤情况;截取结肠中间段用PBS冲洗干净,-80 ℃保存,供炎症因子检测。
2.6 统计学方法本研究数据分析、作图采用Graphpad Prism 9统计学软件包,并使用均数±标准差(x±s)表示;多组间数据差异比较采用one-way ANOVA进行分析,组间两两比较采用LSD t-test。相关性分析则采用R version 3.5.3软件进行计算及作图。P<0.05表示具有统计学差异。
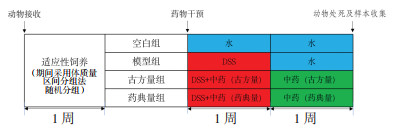
3 结果 3.1 各组小鼠HE染色比较为观察半夏泻心汤各方对DSS-UC模型小鼠局部组织的病理损伤的影响,分别对各组别小鼠结肠近段及远段组织进行HE染色,以分析其局部组织病理学改变。HE染色结果显示:空白组小鼠结肠组织近段及远段均无明显的炎症浸润,其黏膜完好、肠腺排列整齐,隐窝结构无改变,可见大量杯状细胞,见图 2A、B。DSS-UC模型小鼠则出现严重的炎性细胞浸润,同时出现肠腺排列紊乱、上皮细胞黏液分泌减少,并伴有隐窝萎缩、分支等结构改变,见图 2C、D。而药物干预组结肠组织损伤均有显著改善,上皮细胞完整性改善、黏液分泌增多,炎性细胞浸润减少,杯状细胞数量已显著增加;且古方量组的改善优于药典量组,见图 2E、F、G、H。
|
| 注:A.空白组近段;B.空白组远段;C.模型组近段;D.模型组远段;E.古方量组近段;F.古方量组远段;G.药典量组近段;H.药典量组远段。 图 2 半夏泻心汤防治溃疡性结肠炎各组小鼠结肠组织病理变化(HE染色,×200) Fig. 2 Pathological changes the prevention and treatment in colon tissue of ulcerative mice in each group of by Banxia Xiexin Decoction (HE staining, ×200) |
此结果表明,半夏泻心汤可显著改善DSS-UC模型小鼠结肠近段及远段的组织病理学损伤,且古方量组疗效优于药典量组。
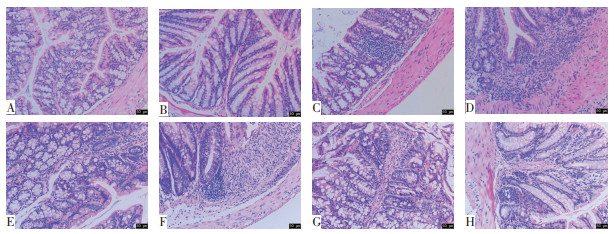
3.2 各组脏器指数比较脏器指数结果如图 3所示,与空白组相比,模型组小鼠的肝脏指数(P<0.01)、脾脏指数(P<0.01)、结肠指数(P<0.01)、结总肠质量比升高(P<0.05),均具有统计学差异。结总肠长度比有上升趋势,但无统计学差异(P > 0.05);胸腺指数降低,差异具有统计学意义(P<0.01)。与模型组相比,两给药组小鼠胸腺指数、肝脏指数、脾脏指数、结肠指数、结总肠长度比、结总肠质量比均有不同程度的恢复,其中古方量组小鼠胸腺指数恢复明显,具有统计学差异(P<0.05);药典量方对小鼠结总肠长度比、结总肠质量比的恢复明显,而古方量方则对小鼠胸腺指数、肝脏指数、脾脏指数的恢复显著。肾脏指数及结肠长度质量比在各组别小鼠间无明显差异。
|
| 注:A.胸腺指数;B.肝脏指数;C.脾脏指数;D.肾脏指数;E.结肠指数;F.结总肠长度比;G.结总肠质量比;H.结肠长度重量比。与空白组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05。 图 3 半夏泻心汤防治溃疡性结肠炎小鼠的脏器指数 Fig. 3 Organ index of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
此结果表明DSS-UC模型小鼠的肝脏指数、脾脏指数、结肠指数、结总肠长度比、结总肠质量比显著高于正常小鼠,而胸腺指数则显著低于正常小鼠,肾脏指数及结肠长度重量比则无显著变化;半夏泻心汤可不同程度的预防DSS造模所带来的脏器指数的变化,其中古方量方对胸腺指数的恢复尤为显著;不同剂量的半夏泻心汤对脏器指数的影响不尽相同,药典量方在预防UC小鼠结总肠长度比、结总肠质量比的改变方面更有优势,而古方量方则在预防UC小鼠胸腺指数、肝脏指数、脾脏指数的改变方面更有优势。
3.3 各组小鼠炎症因子水平比较炎症在UC发生发展过程中起着极为重要的作用,研究检测各组小鼠血清及结肠组织中各炎症因子含量以探究半夏泻心汤各组方在防治UC发生发展中对血清及结肠组织炎症因子含量的影响。现分述如下。
如图 4所示,与空白组相比,模型组小鼠血清及结肠组织白介素(IL)-4含量升高,差异具有统计学意义(P<0.01);而古方量组、药典量组小鼠血清及结肠组织IL-4含量低于模型组,差异具有统计学意义(P<0.01)。此结果表明半夏泻心汤可防治DSS-UC小鼠模型血清及结肠组织中IL-4的升高。
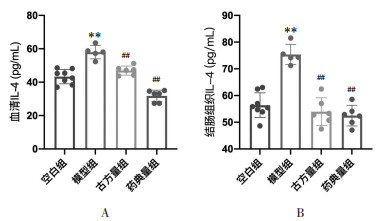
|
| 注:A.血清IL-4水平;B.结肠组织IL-4水平。与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 4 半夏泻心汤防治溃疡性结肠炎小鼠的IL-4水平 Fig. 4 Serum IL-4 level of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 5所示,与空白组相比,模型组小鼠血清及结肠组织IL-10含量降低,差异具有统计学意义(P<0.01);与模型组相比,古方量组、药典量组小鼠血清及结肠组织IL-10含量则有不同程度的恢复。古方量方及药典量方对实验小鼠结肠组织IL-10含量的恢复明显(P<0.05),其中古方量方显著(P<0.01),差异均具有统计学意义。此结果表明半夏泻心汤可防治DSS-UC小鼠模型血清及结肠组织中IL-10的降低,且以古方量方为优。
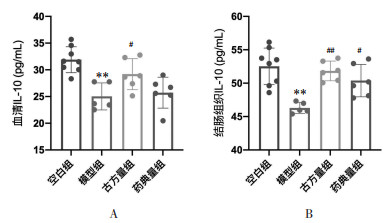
|
| 注:A.血清IL-10水平;B. 结肠组织IL-10水平。与空白组比较,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 5 半夏泻心汤防治溃疡性结肠炎小鼠的IL-10水平 Fig. 5 Serum IL-10 level of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 6所示,与空白组相比,模型组小鼠血清及结肠组织IL-17含量降低,差异具有统计学意义(P<0.01);与模型组相比,古方量组小鼠血清及结肠组织IL-17含量与模型组相近;而药典量组小鼠仅血清IL-17含量有恢复,差异具有统计学意义(P<0.01),结肠组织IL-10含量与模型组相比,无统计学差异(P > 0.05)。此结果表明半夏泻心汤药典量方可防治DSS-UC小鼠模型血清IL-10的降低。
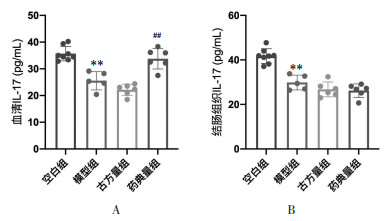
|
| 注:A.血清IL-17水平;B.结肠组织IL-17水平。与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 6 半夏泻心汤防治溃疡性结肠炎小鼠的IL-17水平 Fig. 6 Serum IL-17 level of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 7所示,与空白组相比,模型组小鼠血清及结肠组织肿瘤坏死因子(TNF)-α含量升高,差异具有统计学意义(P<0.01)。与模型组相比,古方量组、药典量组结肠组织TNF-α含量均有恢复(P<0.01),而对于血清TNF-α含量,药典量组小鼠较模型组降低(P<0.01),差异均具有统计学意义,但古方量组小鼠仅有下降的趋势。此结果表明半夏泻心汤古方量方及药典量方可防治DSS-UC小鼠模型结肠组织中TNF-α的降低,而半夏泻心汤药典量方则可防治DSS-UC小鼠模型血清TNF-α的降低。
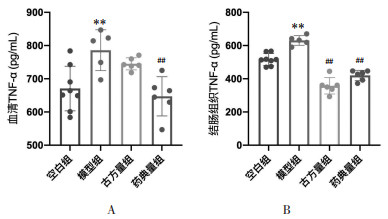
|
| 注:A.血清TNF-α水平;B. 结肠组织TNF-α水平。与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 7 半夏泻心汤防治溃疡性结肠炎小鼠的TNF-α水平 Fig. 7 Serum TNF-α level of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 8所示,与空白组相比,模型组小鼠血清及结肠组织干扰素γ(IFN-γ)含量升高,差异具有统计学意义(P<0.01)。古方量组、药典量组小鼠血清及结肠组织IFN-γ含量较模型组小鼠无变化。此结果表明半夏泻心汤各组方对DSS-UC小鼠模型血清及结肠组织IFN-γ水平无显著影响。
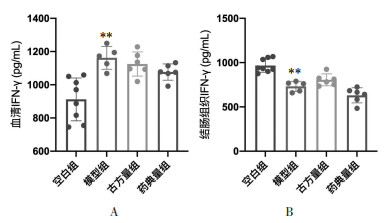
|
| 注:A.血清IFN-γ水平;B. 结肠组织IFN-γ水平。与空白组比较,**P < 0.01。 图 8 半夏泻心汤防治溃疡性结肠炎小鼠的IFN-γ水平 Fig. 8 Serum IFN-γ level the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 9所示,与空白组相比,模型组小鼠血清及结肠组织5-HT水平均下降,差异具有统计学意义(P<0.01);而与模型组相比,药物干预组小鼠血清及结肠组织5-HT水平均有恢复,差异具有统计学意义(P<0.01),其中药典量组小鼠血清及结肠组织5-HT水平均已恢复到空白组水平,与空白组比较无统计学差异(P > 0.05);但古方量组小鼠血清5-HT水平低于空白组(P<0.05),而结肠组织5-HT水平则高于空白组(P<0.01),差异均具有统计学意义。此结果表明,半夏泻心汤可预防DSS-UC模型小鼠血清及结肠组织5-HT含量的降低。
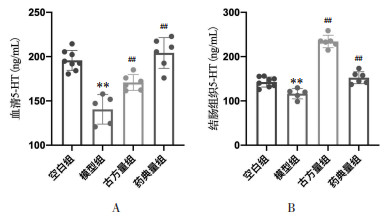
|
| 注:A.血清5-HT水平;B.结肠组织5-HT水平。与空白组比较,**P < 0.01;与模型组比较,##P < 0.01。 图 9 半夏泻心汤防治溃疡性结肠炎小鼠的5-HT水平 Fig. 9 Serum 5-HT level the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 10A、B所示,与空白组相比,模型组小鼠血清及结肠组织IL-4/IL-10水平升高,差异具有统计学意义(P<0.01);与模型组相比,古方量组、药典量组小鼠血清及结肠组织IL-4/IL-10水平则降低,差异具有统计学意义(P<0.01),与空白组小鼠水平相近。此结果表明半夏泻心汤可防治DSS-UC小鼠模型血清及结肠组织IL-4/IL-10的降低。
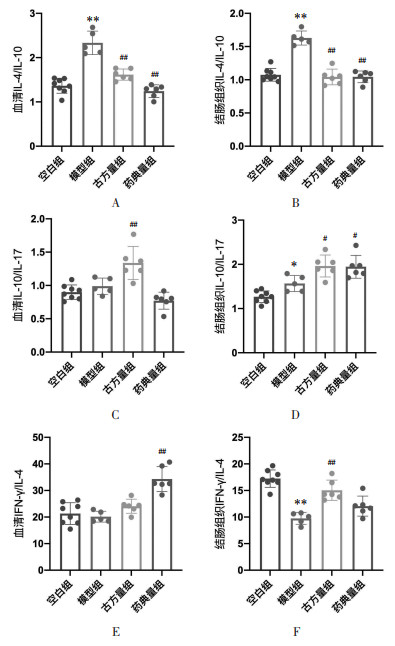
|
| 注:A.血清IL-4/IL-10水平;B.结肠组织IL-4/IL-10水平;C.血清IL-10/IL-17水平;D.结肠组织IL-10/IL-17水平;E.血清IFN-γ/IL-4水平;F.结肠组织IFN-γ/IL-4水平。与空白组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01。 图 10 半夏泻心汤防治溃疡性结肠炎小鼠的相关炎症因子比值 Fig. 10 Ratio of inflammation-related factors of experimental mice of the prevention and treatment in ulcerative colitis mice by Banxia Xiexin Decoction |
如图 10C、D所示,与空白组相比,模型组小鼠结肠组织IL-10/IL-17水平升高,差异具有统计学意义(P<0.05),而血清IL-10/IL-17水平则无变化。与模型组相比,古方量组小鼠血清及结肠组织IL-10/IL-17水平则进一步升高(P<0.05),且血清IL-10/IL-17水平升高尤为显著(P<0.01),差异均具有统计学意义。药典量组小鼠结肠组织IL-10/IL-17水平亦进一步升高,具有统计学差异(P<0.05),但血清IL-10/IL-17水平则无显著变化,与空白组、模型组小鼠相似。此结果表明半夏泻心汤古方量方可升高DSS-UC小鼠模型血清及结肠组织IL-10/IL-17的水平,而药典量方仅可升高DSS-UC小鼠模型结肠组织IL-10/IL-17的水平。
如图 10E、F所示,与空白组相比,模型组小鼠结肠组织IFN-γ/IL-4水平降低,差异具有统计学意义(P<0.01),而血清IFN-γ/IL-4水平则无显著变化。与模型组相比,古方量组小鼠结肠组织IFN-γ/IL-4水平有恢复(P<0.01),药典量组小鼠血清IFN-γ/IL-4水平有恢复(P<0.01),差异均具有统计学意义。此结果表明半夏泻心汤古方量方可防治DSS-UC小鼠模型结肠组织IFN-γ/IL-4的降低,而药典量方可防治DSS-UC小鼠模型血清IFN-γ/IL-4的降低。
3.4 各组小鼠诸指标的相关性分析本研究同时还对上述各指标进行了相关性分析,如图 11,结果发现血清5-HT水平与血清IL-4、IL-17、TNF-α水平以及结肠指数具有相关性,差异具有统计学意义(P<0.05);其中与IL-17水平(r=0.611 4,P=0.001 2)成正相关,与IL-4水平(r=-0.730 5,P=0)、TNF-α水平(r=-0.567 3,P=0.003 1)以及结肠指数(r=-0.429 5,P=0.032 2)成负相关。血清IL-10水平分别与胸腺指数、脾脏指数、结肠指数具有显著相关性(P<0.01);其中与胸腺指数(r=0.661 1,P=0.000 3)成正相关,与脾脏指数(r=-0.602 1,P=0.001 4)以及结肠指数(r=-0.643 1,P=0.000 5)成负相关。
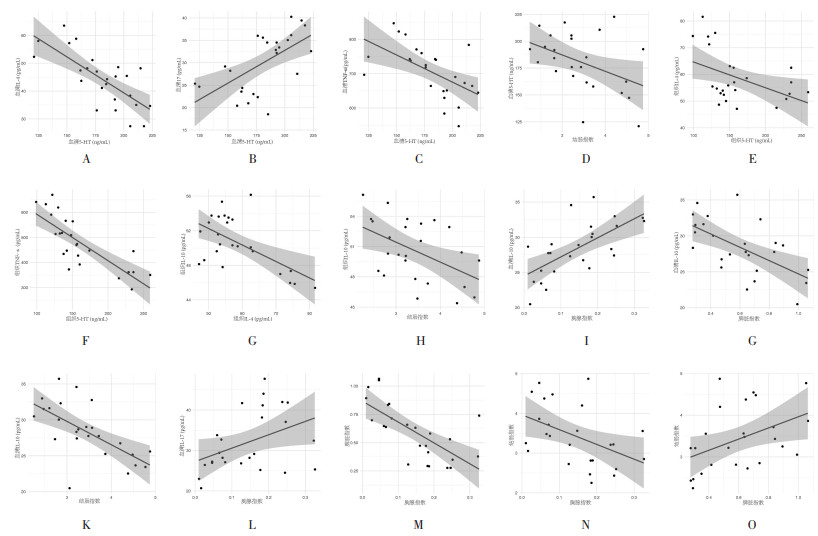
|
| 注:A.血清5-HT vs IL-4;B. 血清5-HT vs IL-17;C. 血清5-HT vs TNF-α;D. 血清5-HT vs结肠指数;E.结肠组织5-HT vs IL-4;F.结肠组织5-HT vs TNF-α;G.结肠组织IL-10 vs IL-4;H.结肠组织IL-10 vs结肠指数;I.血清IL-10 vs胸腺指数;J.血清IL-10 vs脾脏指数;K.血清IL-10 vs结肠指数;L. 结肠组织IL-17 vs胸腺指数;M.胸腺指数vs脾脏指数;N.胸腺指数vs结肠指数;O. 脾脏指数vs结肠指数。 图 11 半夏泻心汤防治溃疡性结肠炎小鼠各指标的相关性 Fig. 11 Correlation each indicator in experimental of ulcerative colitis mice by Banxia Xiexin Decoction |
结肠组织5-HT水平分别与结肠组织IL-4水平(r=-0.431 4,P=0.031 3)、TNF-α水平(r=-0.850 3,P=7.39E-08)成显著负相关。结肠组织IL-10水平分别与结肠组织IL-4水平(r=-0.420 4,P=0.036 4)、结肠指数(r=-0.489 7,P=0.01 3)成显著负相关。结肠组织IL-17水平与胸腺指数(r=0.447 8,P=0.024 8)成负相关。
胸腺指数与脾脏指数(r=-0.690 1,P=0.000 1)及结肠指数(r=-0.456 4,P=0.021 8)成负相关。脾脏指数与结肠指数(r=0.436 5,P=0.029 1)成正相关。
4 讨论半夏泻心汤原方用于治疗柴胡汤证误下之“心下痞”证及“呕而肠鸣”,其由小柴胡汤去柴胡、生姜加黄连三两、干姜一两而成,由原来治疗表里之枢病转变为治疗上下之枢病[16-17]。《黄帝内经》有云:“饮入于胃,游溢精气,上输于脾。脾气散精,上归于肺,通调水道,下输膀胱。”而UC患者脾气不升,无法将运化来的水谷精微布散全身,聚而为水湿,湿性重浊,下趋肠腑,郁久化热,血腐肉败而发病;其基本病机为脏(脾)气不升、腑(肠)气不降,实为中焦上下枢机之邪:在上为脾气虚,在下在肠蕴湿热。半夏泻心汤以“辛开苦降甘补”组方,方中甘温之参、草、枣可补脾益气,复中土之功;辛温为阳,主升主动,姜、夏助脾气升提布散;“六腑以通为用”,故芩、连之苦寒即可清热燥湿,消除肠中湿热,又可顺腑气。且方中半夏味辛性降,可辛散助开、降逆助合;开上泻下,为开上下枢机之要药。诸药相伍,补中益气,复脾升肠降,中焦上下枢机得通,病症自除。
“经方不传之秘在于量”“古方之妙,全在药量”。由此可见,历代医家对经方药物剂量的重视。经方的临床应用中,合理理解并应用各药物的剂量是平衡经方有效性及安全性的关键所在,亦是提高中医疗效的引发点。经典名方半夏泻心汤因方中含有有毒药物半夏,故其药物剂量的选用被历代医家所争论。研究在课题组前期研究的基础之上,保持全方各药物剂量比例不变,以半夏的古方用量及现代《药典》的日最大应用剂量为基准组方,分别干预DSS-UC模型小鼠,通过分析小鼠体质量、死亡率等一般状态,DAI指数、脏器指数等指标以及结肠局部病理损伤的差异以探究半夏泻心汤各组方防治UC的疗效差异。研究结果显示:DSS-UC小鼠可见精神萎靡、活动量减少、被毛蓬松等临床表现,体质量显著减轻、DAI指数、肝脏指数、脾脏指数、结肠指数、结总肠长度比、结总肠质量比显著升高,胸腺指数则显著低,结肠局部炎症反应严重,大量炎性细胞浸润。而经半夏泻心汤干预防治后上述指标出现不同程度的恢复,尤其是半夏泻心汤古方量组小鼠改善尤为明显。说明半夏泻心汤可防治因DSS诱导建模所致的小鼠局部组织及全身损伤,且古方量方疗效为佳,表明了经方原方组方的合理性。
同时本研究对半夏泻心汤治疗UC的作用机制进行初步探讨,结果表明,半夏泻心汤可以通过升高DSS-UC模型小鼠血清及结肠组织中IL-10、5-HT水平,降低血清及结肠组织中IL-4、TNF-α水平,改善IL-4/IL-10、IFN-γ/IL-4水平,进而改善DSS-UC小鼠肠道炎症反应,改善组织损伤情况,从而发挥治疗UC的治疗作用。
IL-4是由机体活化T细胞产生,具有多种生物学功能[18]。大量研究证实IL-4能抑制IL-1β和TNF-α的产生,同时降低活化单核巨噬细胞分泌氧自由基,具有显著的抑炎特征[19-20]。但亦有研究表明IL-4在UC中可发挥促炎作用,其可在UC患者体内显著升高,且其水平与UC疾病活动度成正相关[21-24],此结果与本研究结果相一致。推测原因可能是:IL-4可诱导B细胞并刺激内皮细胞,分泌黏附因子及趋化性细胞因子,且IL-4是小鼠巨噬细胞趋化因子,其可以显著促进IL-1ra的产生,并抑制单核细胞产生IL-1、TNF和IL-6;此外IL-4可诱导单核细胞及嗜酸性粒细胞并刺激肥大细胞增殖参与炎症反应[23-24]。经半夏泻心汤干预后,DSS-UC模型小鼠结肠组织及血清IL-4水平显著降低,表明半夏泻心汤可以降低UC模型中促炎因子IL-4水平以发挥治疗作用。
IL-10是由Th2细胞产生的抗炎因子,是机体维持肠道免疫平衡的关键因子[25-26]。IL-10可以通过抑制抗原提呈和产生并抑制促炎趋化因子和细胞因子的产生,进而抵抗炎症引起的组织损伤,其水平降低是UC的重要表现之一[27-30];同时有研究发现,敲除或抑制IL-10基因后,小鼠患UC的几率显著增加,对炎症性肠病表现出强敏感性[31-35]。本研究结果显示,DSS-UC模型小鼠血清及结肠组织中IL-10水平显著于正常对照组,且经半夏泻心汤干预后显著恢复;此表明IL-10在UC的免疫反应中起重要作用,且半夏泻心汤可以通过升高DSS-UC模型小鼠IL-10水平,从而抑制抗炎因子水平,改善肠道炎症,进而发挥治疗UC的作用。对各炎症因子进行相关性分析发现,抑炎因子IL-10水平与IL-4水平成负相关,此结果亦佐证了IL-4在UC中发挥促炎作用。
IL-17主要有免疫细胞Th17产生,此外巨噬细胞、树突状细胞、CD8+T细胞、嗜中性粒细胞、肥大细胞、上皮细胞和肿瘤细胞中也可产生少量IL-17;IL-17家族共有6个成员,分别为IL-17A、IL-17B、IL-17C、IL-17D、IL-17E(亦称为IL-25)和IL-17F。目前有关IL-17生物学功能的研究众多,但其具体的生物学功能尚无定论,不用研究的结果已有所差异。有研究显示IL-17可以与其他细胞因子协同,刺激中性粒细胞聚集、促进前列腺素E2表达,从而诱导并加重炎症反应,多种自身免疫病(如系统性红斑狼疮[36]、银屑病[37]、风湿性关节炎[38]等)均与其水平升高有关;同时亦有研究发现UC患者病变肠黏膜中的IL-17表达水平明显高于正常黏膜[39-43],且选择性敲除或抑制IL-17基因可减轻UC的炎症反应[44],上述研究表明IL-17在机体内为重要的促炎因子。但有研究发现在各类炎症性疾病中IL-17水平显著下降,并认为IL-17能加强上皮细胞的连接同时保护肠黏膜通透性,在UC中发挥抑炎效应[45-46]。本研究中已发现DSS-UC模型小鼠血清及组织中IL-17水平显著降低,且经半夏泻心汤干预后显著恢复,推测可能是由于IL-17在UC中发挥抑炎作用,半夏泻心汤可以升高抑炎因子IL-17的水平以发挥治疗UC的作用,但其具体机制仍需进一步的临床验证。
TNF-α、IFN-γ是经典的促炎因子。IFN-γ是可溶性二聚体细胞因子,是Ⅱ型干扰素的唯一成员,亦是常见的促炎性细胞因子[47-48]。研究表明,IFN-γ在UC患者结肠组织及血清异常高表达,可参与UC的发生发展[49-51]。TNF-α、IFN-γ等炎症因子可刺激产生更多干扰素γ诱导蛋白10(IP10),并进一步导致免疫细胞聚集,加重炎症反应;同时可直接或间接损伤肠黏膜屏障以诱发UC[52]。研究结果显示,DSS-UC模型小鼠血清IFN-γ水平显著上升,与上述研究结果相一致;但结肠组织IFN-γ水平显著下降,与上述研究结果相悖,通过查阅文献,但未查询到相关资料,因此DSS-UC模型小鼠结肠组织IFN-γ水平下降的具体原因有待于进一步的探究。TNF-α主要由巨噬细胞、T细胞、B细胞等多种细胞产生,是调节免疫细胞的关键细胞因子,属于前促炎细胞因子,最早表达于炎症反应中,与炎症的严重程度相关[53-55]。其是目前公认的能够介导UC发病的细胞因子,可以促使其他各类促炎因子的释放,扩大炎症连锁反应,参与UC的炎症反应及免疫应答[56-58]。本研究结果显示,半夏泻心汤可以显著降低DSS-UC模型小鼠结肠组织及血清TNF-α水平。众多研究结果与本研究结果相似,表明半夏泻心汤可以抑制结肠组织及血清TNF-α水平,抑制肠道炎症反应,改善局部组织损伤,进而改善UC症状[5-6, 59]。
5-HT主要由肠道中的嗜铬细胞和肠肌间神经丛合成,其可作为免疫调节因子作用于淋巴细胞、巨噬细胞和树突状细胞免疫细胞上的5-HT受体,调节免疫细胞功能,分泌IL-6、IFN-γ等细胞因子,介导炎症反应[60];同时5-HT还作为重要的脑肠肽,在“脑肠轴”中发挥重要地位[61];除此之外,5-HT还参与肝脏脂质代谢等众多生理过程[62]。研究表明,5-HT参与UC的发生与发展,但其在UC中发挥的生物学功能尚有歧义。有研究者发现UC患者结肠黏膜中5-HT生成量增加、5-HT的再摄取量减少,从而导致UC患者结肠黏膜中及血清中5-HT的有效含量升高[63-65],且UC患者结肠黏膜24 h的5-HT释放量且与UC疾病活动度(Mayo评分)呈正相关性[64]。但亦有研究发现UC患者体内5-HT水平降低[66],本研究结果与其一致,DSS-UC模型小鼠血清及组织中5-HT水平显著见底,而经半夏泻心汤干预后,其均有显著恢复。但此结果与课题组前期研究结果[6]不一致,推测其可能的原因是:5-HT水平可能随疾病的不同阶段或是不同的时期有关。但其具体机制仍需要进一步的实验探究以明确5-HT水平与UC的关系。
5 结论半夏泻心汤可以通过升高DSS-UC模型小鼠血清及结肠组织中IL-10、5-HT水平,降低血清及结肠组织中IL-4、TNF-α水平进而改善DSS-UC小鼠肠道炎症反应,改善组织损伤情况,从而发挥治疗UC的治疗作用;且以古方量效果为佳。
6 展望本研究基于免疫稳态、从炎症因子水平入手,通过检测不同剂量的半夏泻心汤对DSS-UC模型小鼠血清及结肠组织中炎症因子水平的影响,探究半夏泻心汤治疗UC的作用机制。基于实验结果,笔者对在UC疾病中生物学效应存在争议的炎症因子(如IL-4、Il-17、5-HT)进行了科学合理的阐释,但本研究仅采用了2.5%DSS诱导的小鼠为动物模型,且未从多角度对相关因子进行动态监测。故后期计划采用多种动物模型及临床研究,采用多种方法检测UC发展及转归的不同时间点各相关炎症因子的动态变化,深入探究各炎症因子在UC疾病中的变化规律,以阐释UC的发病机制。
| [1] |
FEUERSTEIN J D, MOSS A C, FARRAYE F A. Ulcerative colitis[J]. Mayo Clinic Proceedings, 2019, 94(7): 1357-1373. DOI:10.1016/j.mayocp.2019.01.018 |
| [2] |
SIGNS S A, FISHER R C, TRAN U, et al. Stromal miR-20a controls paracrine CXCL8 secretion in colitis and colon cancer[J]. Oncotarget, 2018, 9(16): 13048-13059. DOI:10.18632/oncotarget.24495 |
| [3] |
SHORT S P, PILAT J M, BARRETT C W, et al. Colonic epithelial-derived selenoprotein P is the source for antioxidant-mediated protection in colitis-associated cancer[J]. Gastroenterology, 2021, 160(5): 1694-1708.e3. DOI:10.1053/j.gastro.2020.12.059 |
| [4] |
RUBIN D C, SHAKER A, LEVIN M S. Chronic intestinal inflammation: Inflammatory bowel disease and colitis-associated colon cancer[J]. Frontiers in Immunology, 2012, 3: 107. |
| [5] |
CHEN J, ZHANG L K, GU W C, et al. Effect of Banxia Xiexin Decoction on intestinal flora of mice with ulcerative colitis induced by dextran sodium sulfate[J]. China Journal of Chinese Materia Medica, 2021, 46(11): 2871-2880. |
| [6] |
张梁坤. 基于肠道微生态探究半夏泻心汤及拆方治疗溃疡性结肠炎的作用机制[D]. 济南: 山东中医药大学, 2021. ZHANG L K, Exploring the mechanism of Banxia Xiexin Decoction and its decomposed recipes for treatment of ulcerative colitis based on gut microbiota[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2021. |
| [7] |
张艳. 半夏泻心汤及拆方对溃疡性结肠炎大鼠Th1/Th2细胞因子的影响[D]. 济南: 山东中医药大学, 2015. ZHANG Y. Influences of Banxia Xiexin Decoction and split prescriptions on Th1/Th2 cytokines of rats with ulcerative colitis[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2015. |
| [8] |
裴强伟. 半夏泻心汤干预溃疡性结肠炎免疫平衡调节的作用机制研究[D]. 济南: 山东中医药大学, 2013. PEI Q W. Study on mechanism of intervention in ulcerative colitis immune balance adjustment of Banxia Xiexin Decoction[D]. Jinan: Shandong University of Traditional Chinese Medicine, 2013. |
| [9] |
张梁坤, 陈健, 谷文超, 等. 半夏泻心汤联合中药灌肠治疗溃疡性结肠炎Meta分析[J]. 山东中医药大学学报, 2022, 46(1): 64-71. ZHANG L K, CHEN J, GU W C, et al. Meta-analysis of Banxia Xiexin Decoction combined with traditional Chinese medicinal enemas for ulcerative colitis[J]. Journal of Shandong University of Traditional Chinese Medicine, 2022, 46(1): 64-71. |
| [10] |
国家药典委员会. 中华人民共和国药典-一部: 2020年版[M]. 北京: 中国医药科技出版社, 2020. National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (volume Ⅰ): 2020 edition[M]. Beijing: China Medical Science and Technology Press, 2020. |
| [11] |
CHEN S B, LIU H B, LI Z J, et al. Epithelial PBLD attenuates intestinal inflammatory response and improves intestinal barrier function by inhibiting NF-κB signaling[J]. Cell Death & Disease, 2021, 12: 563. |
| [12] |
GEREMIA A, BIANCHERI P, ALLAN P, et al. Innate and adaptive immunity in inflammatory bowel disease[J]. Autoimmunity Reviews, 2014, 13(1): 3-10. DOI:10.1016/j.autrev.2013.06.004 |
| [13] |
FEAGAN B G, et al. Rapid response to vedolizumab therapy in biologic-naive patients with inflammatory bowel diseases[J]. Clinical Gastroenterology and Hepatology, 2019, 17(1): 130-138.e7. DOI:10.1016/j.cgh.2018.05.026 |
| [14] |
孙志其, 韩涛, 黄海量. 半夏泻心汤原方药物用量及半夏炮制方法考探[J]. 山东中医药大学学报, 2020, 44(2): 130-133, 163. SUN Z Q, HAN T, HUANG H L. Study on drug dosage and processing method of Pinellia pinellia in original prescription of Pinellia Xiexin Decoction[J]. Journal of Shandong University of Traditional Chinese Medicine, 2020, 44(2): 130-133, 163. DOI:10.16294/j.cnki.1007-659x.2020.02.004 |
| [15] |
LUKAS M, MALICKOVA K, KOLAR M, et al. Switching from originator adalimumab to the biosimilar SB5 in patients with inflammatory bowel disease: short-term experience from a single tertiary clinical centre[J]. Journal of Crohn's and Colitis, 2020, 14(7): 915-919. DOI:10.1093/ecco-jcc/jjaa001 |
| [16] |
孙志其, 韩涛. 基于气本体论的三阴三阳体系构建与应用[J]. 中华中医药杂志, 2017, 32(5): 2307-2310. SUN Z Q, HAN T. Construction and application of qi ontology based on the three yin and three yang system[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(5): 2307-2310. |
| [17] |
孙志其, 韩涛. "开合枢"的哲学内涵及"枢病"理论在中医学中的应用[J]. 中华中医药杂志, 2018, 33(5): 1699-1702. SUN Z Q, HAN T. Philosophical connotation of "opening and closing pivot" and the application of the theory of "pivot disease" in traditional Chinese medicine[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2018, 33(5): 1699-1702. |
| [18] |
RAINES L N, ZHAO H X, WANG Y Z, et al. PERK is a critical metabolic hub for immunosuppressive function in macrophages[J]. Nature Immunology, 2022, 23(3): 431-445. DOI:10.1038/s41590-022-01145-x |
| [19] |
YU D D, ZHAO Y M, WANG H D, et al. IL-1β pre-stimulation enhances the therapeutic effects of endometrial regenerative cells on experimental colitis[J]. Stem Cell Research & Therapy, 2021, 12(1): 324. |
| [20] |
金鸿锋, 李彬彬, 张微. miR-542-3p过表达对葡聚糖硫酸钠诱导的溃疡性结肠炎大鼠的作用及机制初探[J]. 国际消化病杂志, 2020, 40(6): 414-418. JIN H F, LI B B, ZHANG W. Effect and mechanism of miR-542-3p overexpression on rats with ulcerative colitis induced by dextran sodium sulfate[J]. International Journal of Digestive Diseases, 2020, 40(6): 414-418. DOI:10.3969/j.issn.1673-534X.2020.06.012 |
| [21] |
UCHIYAMA K, TAKAGI T, MIZUSHIMA K, et al. Mucosal interleukin-8 expression as a predictor of subsequent relapse in ulcerative colitis patients with Mayo endoscopic subscore 0[J]. Journal of Gastroenterology and Hepatology, 2022, 37(6): 1034-1042. DOI:10.1111/jgh.15813 |
| [22] |
WEST G A, MATSUURA T, LEVINE A D, et al. Interleukin 4 in inflammatory bowel disease and mucosal immune reactivity[J]. Gastroenterology, 1996, 110(6): 1683-1695. DOI:10.1053/gast.1996.v110.pm8964392 |
| [23] |
秦菲. 中西医结合治疗溃疡性结肠炎及调控细胞因子研究[D]. 南京: 南京中医药大学, 2015. QIN F. Research on treatment of ulcerative colitis and regulation of cytokine ulcer with combination of TCM and western medicine[D]. Nanjing: Nanjing University of Chinese Medicine, 2015. |
| [24] |
岳文杰, 刘懿, 徐薇, 等. 溃疡性结肠炎(UC)肠黏膜中IL-2、IL-4、IL-17和IL-10的表达特点及其与疾病活动度的关系[J]. 复旦学报(医学版), 2012, 39(5): 454-459, 488. YUE W J, LIU Y, XU W, et al. The expressions of IL-2, IL-4, IL-17 and IL-10 in ulcerative colitis(UC) mucosa and its relation with disease activity[J]. Fudan University Journal of Medical Sciences, 2012, 39(5): 454-459, 488. DOI:10.3969/j.issn.1672-8467.2012.05.003 |
| [25] |
SARAIVA M, O'GARRA A. The regulation of IL-10 production by immune cells[J]. Nature Reviews Immunology, 2010, 10(3): 170-181. DOI:10.1038/nri2711 |
| [26] |
SARAIVA M, VIEIRA P, O'GARRA A. Biology and therapeutic potential of interleukin-10[J]. The Journal of Experimental Medicine, 2020, 217(1): e20190418. DOI:10.1084/jem.20190418 |
| [27] |
FONSECA-CAMARILLO G, FURUZAWA-CARBALLEDA J, LLORENTE L, et al. IL-10:and IL-20:Expressing epithelial and inflammatory cells are increased in patients with ulcerative colitis[J]. Journal of Clinical Immunology, 2013, 33(3): 640-648. DOI:10.1007/s10875-012-9843-4 |
| [28] |
SCHMITT H, ULMSCHNEIDER J, BILLMEIER U, et al. The TLR9 agonist cobitolimod induces IL10-producing wound healing macrophages and regulatory T cells in ulcerative colitis[J]. Journal of Crohn's and Colitis, 2019, 14(4): 508-524. |
| [29] |
WANG G H, XU B, SHI F Y, et al. Protective effect of methane-rich saline on acetic acid-induced ulcerative colitis via blocking the TLR4/NF-κB/MAPK pathway and promoting IL-10/JAK1/STAT3-mediated anti-inflammatory response[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 7850324. |
| [30] |
XIA B T, BECKMANN N, WINER L K, et al. Amitriptyline reduces inflammation and mortality in a murine model of Sepsis[J]. Cell Physiol Biochem, 2019, 52(3): 565-579. DOI:10.33594/000000040 |
| [31] |
AMRE D K, MACK D R, MORGAN K, et al. Interleukin 10 (IL-10) gene variants and susceptibility for paediatric onset Crohn's disease[J]. Alimentary Pharmacology & Therapeutics, 2009, 29(9): 1025-1031. |
| [32] |
SUN X, GUO C Y, ZHAO F, et al. Vasoactive intestinal peptide stabilizes intestinal immune homeostasis through maintaining interleukin-10 expression in regulatory B cells[J]. Theranostics, 2019, 9(10): 2800-2811. DOI:10.7150/thno.34414 |
| [33] |
GLOCKER E O, KOTLARZ D, KLEIN C, et al. IL-10 and IL-10 receptor defects in humans[J]. Annals of the New York Academy of Sciences, 2011, 1246(1): 102-107. DOI:10.1111/j.1749-6632.2011.06339.x |
| [34] |
SOUFLI I, TOUMI R, RAFA H, et al. Overview of cytokines and nitric oxide involvement in immuno-pathogenesis of inflammatory bowel diseases[J]. World Journal of Gastrointestinal Pharmacology and Therapeutics, 2016, 7(3): 353-360. DOI:10.4292/wjgpt.v7.i3.353 |
| [35] |
WU C, et al. Matrine ameliorates spontaneously developed colitis in interleukin-10-deficient mice[J]. International Immunopharmacology, 2016, 36: 256-262. DOI:10.1016/j.intimp.2016.04.038 |
| [36] |
CLARKE J. IL-17 sustains plasma cells in SLE[J]. Nature Reviews Rheumatology, 2020, 16(12): 666. |
| [37] |
PANDIYAN P, et al. Regulation of IL-17A-producing cells in skin inflammatory disorders[J]. Journal of Investigative Dermatology, 2022, 142(3): 867-875. DOI:10.1016/j.jid.2021.06.036 |
| [38] |
MOSTAFAVI H, THARMARAJAH K, VIDER J, et al. Interleukin-17 contributes to Ross River virus-induced arthritis and myositis[J]. PLoS Pathogens, 2022, 18(2): e1010185. DOI:10.1371/journal.ppat.1010185 |
| [39] |
CHEN Y Y, CHEN Y, CAO P, et al. Fusobacterium nucleatum facilitates ulcerative colitis through activating IL-17F signaling to NF-κB via the upregulation of CARD3 expression[J]. The Journal of Pathology, 2020, 250(2): 170-182. DOI:10.1002/path.5358 |
| [40] |
CAMUESCO D, RODRGUEZ-CABEZAS M, GARRIDO-MESA N, et al. The intestinal anti-inflammatory effect of dersalazine sodium is related to a down-regulation in IL-17 production in experimental models of rodent colitis[J]. British Journal of Pharmacology, 2012, 165(3): 729-740. DOI:10.1111/j.1476-5381.2011.01598.x |
| [41] |
D'AMBROSIO A, COSSU A, AMENDOLA A, et al. Lamina propria CD4+LAP+ regulatory T cells are increased in active ulcerative colitis but show increased IL-17 expression and reduced suppressor activity[J]. Journal of Crohn's and Colitis, 2015, 10(3): 346-353. |
| [42] |
ROSEN M J, KARNS R, VALLANCE J E, et al. Mucosal expression of type 2 and type 17 immune response genes distinguishes ulcerative colitis from colon-only Crohn's disease in treatment-naive pediatric patients[J]. Gastroenterology, 2017, 152(6): 1345-1357.e7. DOI:10.1053/j.gastro.2017.01.016 |
| [43] |
MA C M, LIN W L, LIU Z Y, et al. NDR 1 protein kinase promotes IL-17- and TNF-α-mediated inflammation by competitively binding TRAF 3[J]. EMBO Reports, 2017, 18(4): 586-602. DOI:10.15252/embr.201642140 |
| [44] |
IZCUE A, HUE S, BUONOCORE S, et al. Interleukin-23 restrains regulatory T cell activity to drive T cell-dependent colitis[J]. Immunity, 2008, 28(4): 559-570. DOI:10.1016/j.immuni.2008.02.019 |
| [45] |
KINUGASA T, SAKAGUCHI T, GU X, et al. Claudins regulate the intestinal barrier in response to immune mediators[J]. Gastroenterology, 2000, 118(6): 1001-1011. DOI:10.1016/S0016-5085(00)70351-9 |
| [46] |
OGAWA A. Neutralization of interleukin-17 aggravates dextran sulfate sodium-induced colitis in mice[J]. Clinical Immunology, 2004, 110(1): 55-62. DOI:10.1016/j.clim.2003.09.013 |
| [47] |
BERNABEI P, BOSTICARDO M, LOSANA G, et al. IGF-1 down-regulates IFN-gamma R2 chain surface expression and desensitizes IFN-gamma/STAT-1 signaling in human T lymphocytes[J]. Blood, 2003, 102(8): 2933-2939. DOI:10.1182/blood-2003-01-0100 |
| [48] |
FARRAR M A, SCHREIBER R D. The molecular cell biology of interferon-gamma and its receptor[J]. Annual Review of Immunology, 1993, 11: 571-611. DOI:10.1146/annurev.iy.11.040193.003035 |
| [49] |
毛堂友, 史瑞, 谢添弘, 等. 清肠温中方对溃疡性结肠炎大鼠干扰素γ诱导蛋白10的影响[J]. 世界科学技术-中医药现代化, 2017, 19(11): 1836-1840. MAO T Y, SHI R, XIE T H, et al. Study on effect of Qing-Chang Wen-Zhong Decoction on interferon gamma induced protein 10 in ulcerative colitis rats[J]. Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2017, 19(11): 1836-1840. DOI:10.11842/wst.2017.11.012 |
| [50] |
WALLACE J W, CONSTANT D A, NICE T J. Interferon lambda in the pathogenesis of inflammatory bowel diseases[J]. Frontiers in Immunology, 2021, 12: 767505. DOI:10.3389/fimmu.2021.767505 |
| [51] |
ZHANG F, MEARS J R, SHAKIB L, et al. IFN-γ and TNF-α drive a CXCL10+ CCL2+ macrophage phenotype expanded in severe COVID-19 lungs and inflammatory diseases with tissue inflammation[J]. Genome Medicine, 2021, 13(1): 64. DOI:10.1186/s13073-021-00881-3 |
| [52] |
ØSTVIK A E, VB GRANLUND A, BUGGE M, et al. Enhanced expression of CXCL10 in inflammatory bowel disease: Potential role of mucosal toll-like receptor 3 stimulation[J]. Inflammatory Bowel Diseases, 2012, 265-274. |
| [53] |
LI A, MOUSSA A, GUS E, et al. 525 biomarkers for the early diagnosis of Sepsis in burns: Systematic review and meta-analysis[J]. Journal of Burn Care & Research, 2021, 42(Supplement_1): S109-S110. |
| [54] |
MEI Z W, HUANG X X, ZHANG H, et al. Chitin derivatives ameliorate DSS-induced ulcerative colitis by changing gut microbiota and restoring intestinal barrier function[J]. International Journal of Biological Macromolecules, 2022, 202: 375-387. DOI:10.1016/j.ijbiomac.2022.01.049 |
| [55] |
RAQIB R, AKHTAR E, SULTANA T, et al. Association of household air pollution with cellular and humoral immune responses among women in rural Bangladesh[J]. Environmental Pollution (Barking, Essex: 1987), 2022, 299: 118892. DOI:10.1016/j.envpol.2022.118892 |
| [56] |
NAKASE H, SATO N, MIZUNO N, et al. The influence of cytokines on the complex pathology of ulcerative colitis[J]. Autoimmunity Reviews, 2022, 21(3): 103017. DOI:10.1016/j.autrev.2021.103017 |
| [57] |
SINGH S, HEIEN H C, HERRIN J, et al. Comparative risk of serious infections with tumor necrosis factor α antagonists vs vedolizumab in patients with inflammatory bowel diseases[J]. Clinical Gastroenterology and Hepatology: the Official Clinical Practice Journal of the American Gastroenterological Association, 2022, 20(2): e74-e88. DOI:10.1016/j.cgh.2021.02.032 |
| [58] |
VEDAMURTHY A, GANGASANI N, ANANTHAKRISHNAN A N. Vedolizumab or tumor necrosis factor antagonist use and risk of new or recurrent cancer in patients with inflammatory bowel disease with prior malignancy: A retrospective cohort study[J]. Clinical Gastroenterology and Hepatology: the Official Clinical Practice Journal of the American Gastroenterological Association, 2022, 20(1): 88-95. DOI:10.1016/j.cgh.2020.10.007 |
| [59] |
WANG W W, XU C C, LI X Y, et al. Exploration of the potential mechanism of Banxia Xiexin Decoction for the effects on TNBS-induced ulcerative colitis rats with the assistance of network pharmacology analysis[J]. Journal of Ethnopharmacology, 2021, 277: 114197. DOI:10.1016/j.jep.2021.114197 |
| [60] |
QUINTERO-VILLEGAS A, VALDÉS-FERRER S I. Role of 5-HT7 receptors in the immune system in health and disease[J]. Molecular Medicine (Cambridge, Mass), 2019, 26(1): 2. |
| [61] |
AALDIJK E, et al. The role of serotonin within the microbiota-gut-brain axis in the development of Alzheimer's disease: A narrative review[J]. Ageing Research Reviews, 2022, 75: 101556. DOI:10.1016/j.arr.2021.101556 |
| [62] |
BERGER M, GRAY J A, ROTH B L. The expanded biology of serotonin[J]. Annual Review of Medicine, 2009, 60: 355-366. DOI:10.1146/annurev.med.60.042307.110802 |
| [63] |
田志颖, 冯丽英, 王丽华. 5-羟色胺与焦虑、抑郁的关系及其在溃疡性结肠炎发病中的作用[J]. 胃肠病学和肝病学杂志, 2011, 20(9): 827-828. TIAN Z Y, FENG L Y, WANG L H. The role of 5-HT, anxiety and depression in ulcerative colitis[J]. Chinese Journal of Gastroenterology and Hepatology, 2011, 20(9): 827-828. DOI:10.3969/j.issn.1006-5709.2011.09.014 |
| [64] |
任天华, 吕敏敏, 安晓萌, 等. 溃疡性结肠炎患者结肠黏膜5-HT信号通路的变化特点[J]. 国际消化病杂志, 2019, 39(3): 222-227. REN T H, LYU M M, AN X M, et al. Characteristics of altered 5-Hydroxytryptamine signaling in colonic mucosa of patients with ulcerative colitis[J]. International Journal of Digestive Diseases, 2019, 39(3): 222-227. DOI:10.3969/j.issn.1673-534X.2019.03.018 |
| [65] |
姜敏, 凌立平, 傅宝玉. 肠易激综合征患者结肠5-HT的分布特点[J]. 世界华人消化杂志, 2005, 13(4): 541-543. JIANG M, LING L P, FU B Y. Distribution of 5-HT in the colon of patients with irritable bowel syndrome[J]. World Chinese Journal of Digestology, 2005, 13(4): 541-543. DOI:10.3969/j.issn.1009-3079.2005.04.026 |
| [66] |
万敏婕. 5-HT通过5-HT7R调控调节性B细胞在溃疡性结肠炎中的作用研究[D]. 长春: 吉林大学, 2021. WAN M J. Mechanism of 5-HT/5-HT7R signaling in regulating regulatory B cells in patients with ulcerative colitis[D]. Changchun: Jilin University, 2021. |
2. Zhang Xinsheng Chinese Medicine Clinic (Xinsheng Hall) of Linqu, Linqu 262600, China;
3. Shandong University of Traditional Chinese Medicine, Jinan 250355, China
 2023, Vol. 40
2023, Vol. 40