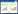文章信息
- 胡浩, 贾晓蕾
- HU Hao, JIA Xiaolei
- 痛泻要方合四逆散对糖尿病KK-Ay小鼠胰岛素抵抗及PI3K/AKT/GSK-3β通路的影响
- Effects of Tongxie Yaofang and Sini Powder on PI3K/AKT/GSK-3β signal pathway and insulin resistance in KK-Ay mice
- 天津中医药, 2023, 40(2): 214-218
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 214-218
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.15
-
文章历史
- 收稿日期: 2022-11-17
2. 北京中医药大学第三附属医院,北京 100029
胰岛素抵抗是指胰岛素作用的靶器官对胰岛素作用的敏感性下降,作为2型糖尿病的主要特征,目前多认为其是2型糖尿病的始动因素[1]。肝脏与胰岛素抵抗密切相关,肝脏是胰岛素从胰腺分泌后到达的第一器官,肝脏根据人体对胰岛素的需求调节葡萄糖的存储和处置,有多种调节肝脏胰岛素信号传导的机制[2]。而肝和全身胰岛素抵抗形成代谢综合征的核心,代谢综合征也与心血管异常,炎症和血脂异常有关[1-2]。磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(AKT)、糖原合成酶激酶-3β(GSK-3β)是胰岛素信号传导通路下游的几个关键蛋白,它们的代谢改变可以影响胰岛素抵抗的发生[3]。研究发现通过调节PI3K/AKT/GSK-3β信号通路可以明显改善糖代谢并改善糖耐量[4-5]。痛泻药方合四逆散由炒白术,白芍,陈皮,防风,柴胡等药物组成,为中医疏肝健脾治法的代表方。临床上采用疏肝健脾治法在改善糖尿病患者相关症状有较好的疗效,并具有一定降糖作用[6]。前期亦有研究发现加味四逆散可以有效改善糖尿病患者的血糖,降低低密度脂蛋白胆固醇和三酰甘油水平,改善血脂紊乱[7]。同时降低丙氨酸氨基转移酶、天冬氨酸氨基转移酶及总胆红素水平,改善肝脏功能[8]。但是痛泻药方合并四逆散对糖尿病胰岛素抵抗的影响及作用机制尚缺乏相关研究。肥胖的KK-Ay小鼠为自发性2型糖尿病模型小鼠,是研究胰岛素抵抗的理想动物模型。因此,研究旨在通过动物实验观察痛泻药方合并四逆散对KK-Ay小鼠胰岛素抵抗的影响,并阐明其通过PI3K/AKT/GSK-3β信号通路发挥作用的具体机制。
1 材料与方法 1.1 材料 1.1.1 实验动物雄性SPF级KK-Ay小鼠24只,6~8周龄,体质量(22±5)g,同龄SPF级雄性C57BL/6J小鼠6只,均购于北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0004。动物饲养于北京中医药大学动物实验室,12/12 h光照循环,自由饮食水。
1.1.2 实验药物与主要试剂痛泻要方合四逆散颗粒,组成:柴胡12 g,白芍12 g,枳壳12 g,炒白术18 g,陈皮9 g,防风6 g,甘草6 g,由北京康仁堂有限公司生产,实验前用蒸馏水配制成溶液,冰箱4 ℃保存。PI3K磷酸化(P-PI3K)抗体(货号:ab278545),AKT磷酸化(P-AKT)抗体(货号:ab38449),GSK-3β磷酸化(P-GSK-3β)抗体(货号:ab68476),PI3K抗体(货号:ab191606)、AKT抗体(货号:ab8805),GSK-3β抗体(货号:ab280376)均购自美国Abcam公司。引物由上海生工合成,序列如下:PI3K-上游引物:5’-AAA CAA AGC GGA GAA CCT ATT-3’;PI3K-下游引物:5’-TAA TGA CGC AAT GCT TGA CTT C-3’;Akt-上游引物:5’-TGC ACA AAC GAG GGG AAT ATA T-3’;AKT-下游引物:5’-CGT TCC TTG TAG CCA ATA AAG G-3’;GSK-3β-上游引物:5’-AAC GGA TAG GGA GCA GAA ACC CAA-3’;GSK-3β-下游引物:5’-GTG CAA AGG GTG AGT GAG GCA TTT-3’;β-Actin -上游引物:5’-CGT CTT CCC CTC CAT CGT-3’;β-Actin -下游引物:5’-GGA GTC CTT CTG ACC CAT ACC-3’。
1.2 实验分组与给药剂量雄性6~8周龄KK-Ay小鼠24只,适应性喂养1周后,剪尾取血,小鼠随机血糖值≥13.9 mmol/L为模型成功的标准,结果显示24只小鼠随机血糖值均符合标准。按照体质量随机分组,分为模型组6只,中药低剂量组6只、中剂量组6只、高剂量组6只。另取6只雄性C57BL/6J小鼠作为正常组。依照前期课题组预实验结果,每日小鼠灌胃剂量分别为:中药低剂量组[1.84 g/(kg·d)],中药中剂量组[3.68 g/(kg·d)],中药高剂量组[5.52 g/(kg·d)],中药剂量以痛泻要方合四逆散颗粒生药量计算。正常组和模型组均给予相同剂量的生理盐水,连续干预4周。
1.3 小鼠胰岛素耐量实验(ITT实验)在给药第4周后,小鼠禁食不禁水4 h,按0.4 U/kg剂量腹部皮下注射胰岛素,尾静脉取血,测定0、30、60、120分血糖(BG),计算曲线下面积(AUC)=0.5×(BG 0分+BG 30分)/2+0.5×(BG 30分+BG 60分)/2+1×(BG 60分+BG 120分)/2。
1.4 胰岛素抵抗指数末次给药后,对小鼠禁食不禁水处理,8 h后测定空腹血糖,并通过摘眼球取血,经静置后取上层血清,采用放射免疫法测定空腹血清胰岛素水平,然后计算胰岛素抵抗指数,计算方法如下:胰岛素抵抗指数的计算方法:空腹血糖×空腹血清胰岛素/22.5。
1.5 实时荧光定量反转录聚合酶链式反应(real time PCR)检测小鼠肝脏组织PI3K、AKT、GSK-3β基因的表达用RNA试剂盒提取小鼠肝脏组织的总RNA,在260 nm,280 nm,320 nm的不同吸光度值下进行测量,然后根据吸光度值计算总RNA的浓度,然后将RNA转录为cDNA。最后使用THUNDERBIRD SYBR qPCR Mix扩增靶基因,然后将所有配置好的反应体系放入Thermal Cycler Dice中,循环设置如下:95 ℃,30 s,1个循环;95 ℃,5 s,60 ℃,30 s,40个循环,95 ℃,15 s,60 ℃,30 s,1个循环。结果用2-ΔΔCt法分析。
1.6 蛋白免疫印迹法(Western Blot)检测小鼠肝脏组织PI3K、AKT、GSK-3β蛋白的表达小鼠的肝脏组织使用RIPA裂解液提取总蛋白,使用BCA蛋白质测定试剂盒(索莱宝公司)测定蛋白质浓度,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离不同分子量的蛋白质,然后将其转移到聚偏二氟乙烯(PVDF)膜上,完成上述步骤后,然后分别将PI3K、AKT、GSK-3β、P-PI3K、P-AKT、P-GSK-3β的一抗稀释液与PVDF封闭一起在4 ℃下孵育过夜。第二天用TTBS清洗3次,每次10 min,随后在室温下与二抗孵育1 h,将PVDF膜分别用TTBS洗涤3次,每次10 min,室温下将配置好的ECL发光液滴在PVDF膜上,然后放入凝胶成像系统,图像结果使用Image J软件分析。
1.7 统计学方法采用SPSS 26.0统计软件处理数据,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05为差异有统计学意义。
2 实验结果 2.1 痛泻药方合四逆散对KK-Ay小鼠空腹血糖的影响与正常组比较,模型组小鼠血糖水平明显升高,具有统计学差异(P < 0.05);与模型组相比,第4周中药高剂量组小鼠血糖水平有所下降,差异有统计学意义(P < 0.05);其他用药组及其他时间小鼠血糖水平有下降趋势,但无统计学差异(P>0.05)。见表 1。
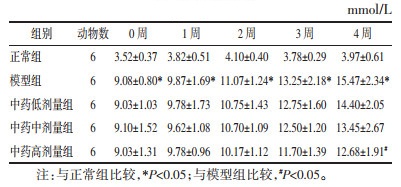
与正常组相比,模型组小鼠空腹胰岛素水平及胰岛素抵抗指数均升高,差异具有统计学意义(P < 0.05);与模型组相比,中药中剂量和高剂量组小鼠空腹胰岛素水平及胰岛素抵抗指数均有所降低,差异具有统计学意义(P < 0.05),而中药低剂量组有下降趋势,无统计学差异(P>0.05)。见表 2。
|
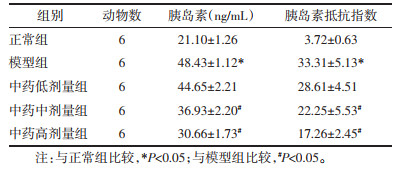
与正常组相比,模型组小鼠0分、30分、60分及120分血糖明显升高(P < 0.05),且曲线下面积(AUC)升高,差异具有统计学意义(P < 0.05);与模型组小鼠相比,中药低中高剂量组小鼠0分、30分、60分及120分血糖及AUC均有所下降,差异具有统计学意义(P < 0.05)。见表 3。
|
与正常组比较,模型组小鼠肝脏组织中PI3K、AKT、GSK-3β基因表达水平均降低,差异具有统计学意义(P < 0.05),与模型组相比,中药高剂量组小鼠肝脏组织中PI3K、AKT、GSK-3β基因表达水平均升高,差异具有统计学意义(P < 0.05)。见表 4。
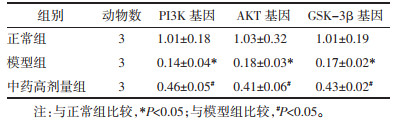
|
与正常组比较,模型组小鼠肝脏组织中PI3K、AKT、GSK-3β磷酸化蛋白表达水平均降低,差异具有统计学意义(P < 0.05);与模型组相比,中药高剂量组小鼠肝脏组织中PI3K、AKT、GSK-3β磷酸化蛋白表达水平均升高,差异具有统计学意义(P < 0.05)。见表 5和图 1。
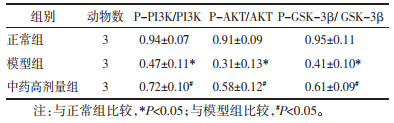
|
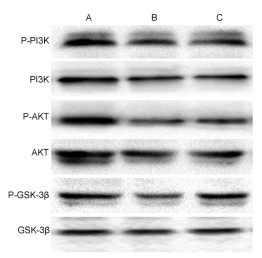
|
| 注:A.正常组;B.模型组;C.中药高剂量组。 图 1 各组小鼠PI3K、AKT、GSK-3β磷酸化蛋白相对表达水平比较 Fig. 1 Comparison of relative expression levels of phosphorylated proteins of PI3K, AKT and GSK-3β of mice among the groups |
糖尿病属中医“消渴”范畴,胰岛素抵抗作为消渴病发病的重要机制,虽无具体的中医病名,但根据其临床症状,可归属于消渴范畴。叶天士《临证指南医案》中曾言“心境愁郁,内火自燃,乃消症大病”,可见肝失疏泄与糖尿病密切相关。在益气养阴的基础上,采用疏肝、健脾等方法能改善胰岛素抵抗[9]。《伤寒论》经典方剂四逆散及《丹溪心法》中的痛泻要方是其中的代表方。痛泻要方合四逆散由陈皮、防风、白术、芍药、柴胡、枳实、甘草等药物组成。方中柴胡疏肝解郁,白芍养血敛阴,陈皮与枳实行气醒脾,条畅气机,白术燥湿健脾,防风补脾柔肝,共奏调和肝脾,柔肝理脾之效。临床研究显示采用疏肝健脾治法在改善糖尿病患者相关症状、血脂代谢紊乱及肝功能异常方面有较好的疗效[6-8]。本研究中,以肥胖的自发性2型糖尿病KK-Ay小鼠为研究对象,以不同的中药剂量干预4周,并且通过观察各组小鼠空腹血糖及胰岛素水平,胰岛素抵抗指数和胰岛功能评估药物对小鼠胰岛素抵抗的作用效果。结果显示,痛泻药方合四逆散能降低糖尿病KK-Ay小鼠的空腹血糖及胰岛素水平,改善胰岛素抵抗指数和胰岛功能,且呈现剂量依赖性。
PI3K/AKT信号通路在肝脏的葡萄糖合成,摄取和糖异生中起重要作用,并且PI3K/AKT途径还可以通过刺激胰岛素和调节脂肪的功能来促进脂肪合成[10],先前的研究表明,PI3K/AKT信号通路在肝脏中起着至关重要的作用,与肝脏胰岛素抵抗关系密切[11]。GSK-3主要有GSK-3α与GSK-3β两个亚型,起主要作用的是GSK-3β[12]。糖原合成酶可被GSK-3β抑制从而减少糖原的合成,而GSK-3β的磷酸化会使其自身失活,进而更多的肝糖原会被合成。AKT是GSK-3β上游调控的一个重要靶点[13],磷酸化的AKT可促使GSK-3β磷酸化而抑制糖异生。激活PI3K/AKT/GSK-3β信号通路可以有效改善组织中葡萄糖转运[14]。本研究发现中药高剂量组可以显著增加小鼠肝脏中PI3K、AKT、GSK-3β的磷酸化蛋白表达水平,提示痛泻药方合四逆散能激活PI3K/AKT/GSK-3β信号通路来发挥作用。
综上所述,痛泻要方合四逆散可以减轻2型糖尿病KK-Ay小鼠胰岛素抵抗,其作用机制可能是通过增加小鼠肝脏中磷酸化PI3K、AKT及GSK-3β蛋白表达水平实现的。关于胰岛素抵抗的发生机制,还涉及多种信号通路,另外痛泻药方合四逆散包含多种成份,其发挥作用可能是通过多靶点多层次实现的。因此,未来还需进一步对其进行研究,以期发现更多的作用靶点和机制,为中药防治2型糖尿病胰岛素抵抗提供科学依据。
| [1] |
SOCHOL K M, JOHNS T S, BUTTAR R S, et al. The effects of dairy intake on insulin resistance: A systematic review and meta-analysis of randomized clinical trials[J]. Nutrients, 2019, 11(9): 2237. DOI:10.3390/nu11092237 |
| [2] |
PATEL B M. Liver and insulin resistance: new wine in old bottle![J]. European Journal of Pharmacology, 2019, 862: 172657. DOI:10.1016/j.ejphar.2019.172657 |
| [3] |
PATEL T P, RAWAL K, BAGCHI A K, et al. Insulin resistance: an additional risk factor in the pathogenesis of cardiovascular disease in type 2 diabetes[J]. Heart Failure Reviews, 2016, 21(1): 11-23. DOI:10.1007/s10741-015-9515-6 |
| [4] |
WANG C J, DENG Y J, YUE Y N, et al. Glutamine enhances the hypoglycemic effect of insulin in L6 cells via phosphatidylinositol-3-kinase (PI3K)/protein kinase B (AKT)/glucose transporter 4 (GLUT4) signaling pathway[J]. Medical Science Monitor, 2018, 24: 1241-1250. DOI:10.12659/MSM.909011 |
| [5] |
SAQIER S. Effects of Agriophyllum squarrosum extracts on glucose metabolism in KKAy mice and the associated underlying mechanisms[J]. Journal of Ethnopharmacology, 2019, 241: 112009. DOI:10.1016/j.jep.2019.112009 |
| [6] |
王振静, 马素平, 张丽平. 扶脾抑肝汤治疗糖尿病性腹泻临床研究[J]. 中医学报, 2017, 32(8): 1416-1419. WANG Z J, MA S P, ZHANG L P. Clinical study on treatment of diabetic diarrhea by invigorating spleen and regulating liver decoction[J]. Acta Chinese Medicine, 2017, 32(8): 1416-1419. |
| [7] |
姜宏. 四逆散加味治疗糖尿病合并血脂异常的临床观察[J]. 中国中医药科技, 2015, 22(3): 301-302. JIANG H. Clinical observation on the treatment of diabetes with dyslipidemia with modified Sini Powder[J]. Chinese Journal of Traditional Medical Science and Technology, 2015, 22(3): 301-302. |
| [8] |
刘亚军, 王佳, 王春生. 加味四逆散治疗2型糖尿病脂肪肝肝损害临床观察[J]. 北京中医药, 2009, 28(7): 530-531. LIU Y J, WANG J, WANG C S. Clinical observation on the treatment of fatty liver damage in type 2 diabetes with Modified Sini Powder[J]. Beijing Journal of Traditional Chinese Medicine, 2009, 28(7): 530-531. |
| [9] |
吴倩, 倪青. 糖尿病肝脾失和病机与四逆散现代新用[J]. 中国中医基础医学杂志, 2022, 28(5): 701-703. WU Q, NI Q. Liver and spleen disharmony pathogenesis and modern application of Sini Powder in diabetes[J]. Journal of Basic Chinese Medicine, 2022, 28(5): 701-703. |
| [10] |
YANG H, CAO Q, XIONG X, et al. Fluoxetine regulates glucose and lipid metabolism via the PI3K-AKT signaling pathway in diabetic rats[J]. Molecular Medicine Reports, 2020, 22(4): 3073-3080. |
| [11] |
SANTOLERI D. Resolving the paradox of hepatic insulin resistance[J]. Cellular and Molecular Gastroenterology and Hepatology, 2019, 7(2): 447-456. DOI:10.1016/j.jcmgh.2018.10.016 |
| [12] |
GAO C, H?LSCHER C, LIU Y Z, et al. GSK3:a key target for the development of novel treatments for type 2 diabetes mellitus and Alzheimer disease[J]. revneuro, 2012, 23(1): 1-11. DOI:10.1515/rns.2011.061 |
| [13] |
PATEL S, DOBLE B, WOODGETT J R. Glycogen synthase kinase-3 in insulin and Wnt signalling: A double-edged sword?[J]. Biochemical Society Transactions, 2004, 32(5): 803-808. |
| [14] |
ZHONG X Z, KE C F, CAI Z X, et al. LNK deficiency decreases obesity-induced insulin resistance by regulating GLUT4 through the PI3K-Akt-AS160 pathway in adipose tissue[J]. Aging, 2020, 12(17): 17150-17166. |
2. The Third Affiliated Hospital of Beijing University of Traditional Chinese Medicine, Beijing 100029, China
 2023, Vol. 40
2023, Vol. 40