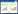文章信息
- 徐喆, 金昱彤, 赵泽宇, 王莹, 龚博炀, 周会芳, 边育红
- XU Zhe, JIN Yutong, ZHAO Zeyu, WANG Ying, GONG Boyang, ZHOU Huifang, BIAN Yuhong
- 基于国家专利数据库和网络药理学探讨中药复方治疗溃疡性结肠炎的配伍规律及作用机制研究
- Study on the compatibility rules and action mechanism of Chinese herbal compound in the treatment of ulcerative colitis based on national patent database and network pharmacology Analysis
- 天津中医药, 2023, 40(2): 219-227
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 219-227
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.16
-
文章历史
- 收稿日期: 2022-10-27
溃疡性结肠炎(UC)是一种病因复杂、难以治愈的慢性炎性肠病,以黏液脓血便、腹泻、腹痛及里急后重为主要临床表现,其复发率高、极易癌变被世界卫生组织列为难治病之一[1-3]。UC严重影响患者的代谢功能,降低患者的生活质量,并给社会带来了沉重的卫生经济负担。当前UC的发病机制尚不明确,现有研究认为其发生主要与遗传、肠道微环境、免疫反应、细胞凋亡及感染等因素有关;临床上对UC的治疗以氨基水杨酸类药物、肾上腺皮质激素类药物与免疫抑制剂3类药物为主,但是存在毒副作用大、起效慢等问题[4-5]。
中医药在UC的防治中发挥了十分重要的作用,针对UC病因、病机、分期进行辨证论治,从而改善临床症状、促进黏膜愈合、预防及治疗并发症,取得了良好的疗效[6-8]。研究表明,多种中药复方已被证实具有良好的治疗UC效果,并获得国家专利,如结肠复康颗粒、结肠炎奇效颗粒、肠清口服液等[9-10]。网络药理学是虚拟筛选潜在活性物质、作用靶点和通路,对药物作用的机制和物质基础进行预测的一种现代化研究手段[11-13]。研究通过挖掘国家专利数据库中治疗UC的中药复方数据,分析其用药规律和配伍特点,选取高频核心药物,运用网络药理学筛选治疗UC的核心作用靶点,构建作用靶点蛋白互作关系、中药-成分-治疗靶点-疾病网络,初步探索和阐述中药复方专利核心药物治疗UC的药理学机制,为临床治疗UC及中药新药研发提供理论参考,整体研究思路如图 1所示。
|
| 图 1 国家专利中药复方高频核心药物治疗UC的作用机制研究思路 Fig. 1 Research thinking of action mechanism of national patent Chinese medicinal compound high-frequency core drugs in the treatment of UC |
登录“国家知识产权局-中国专利公布公告”网站(http://epub.sipo.gov.cn/),进入“高级查询”页面,在高级查询页面中专利类型栏同时勾选“发明公布”与“发明授权”,将“溃疡性结肠炎AND中药”作为“名称”项目进行检索,对检索结果进行合并、筛选后得到最终数据。检索时间范围为建库至2021年12月10日。
1.2 复方纳入与数据标准化复方纳入:纳入国家专利数据库中治疗UC的全部中药复方专利及含中药提取物专利;中药药物组成相同但用量不同的专利可重复录入,中药药物组成及用量相同的专利仅录入1次。排除外用灌肠复方和非中医药医疗类(包括饮品、食品、保健品)专利。
数据规范及处理:依据2020年版《中国药典》《中华本草》的药物名称进行对录入的中药名称进行规范化处理;按照《中药学》规范中药复方的药物功效类别。
1.3 数据关联规则与聚类分析利用IBM SPSS Modeler 18.0软件,基于Apriori算法对已纳入的中药复方进行关联规则分析,设置同时满足支持度≥5.0、置信度≥0.5和提升度≥2的药对为治疗UC的核心药物。利用IBM SPSS Statistics 24软件中的组间联接聚类算法,对高频药物进行聚类分析。
1.4 中药复方专利高频核心药物化学成分与作用靶点挖掘通过中药系统药理学分析平台数据库[14](TCMSP,https://old.tcmsp-e.com/tcmsp.php)挖掘高频核心药物的化学成分,设置化合物生物口服利用度(OB)≥30%、类药性指数(BL)≥0.18,筛选高频核心药物的活性成分和蛋白靶点。此外,通过查阅文献整理已报道的高频核心药物的化学成分,通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、Swiss ADME数据库[15](http://www.swissadme.ch/)和Swiss Target Prediction数据库[16](http://www.swisstargetprediction.ch/)预测各主要化合物作用的靶点蛋白,收集probability>10%的靶点。使用Uniport数据库[17](https://www.uniprot.org/)对蛋白进行名称规范转化操作,去重后即得高频核心药物的对应靶点基因。
1.5 溃疡性结肠炎潜在靶点获取以“ulcerative colitis”为关键词分别在GeneCards数据库[18](https://www.Genecards.org/)、人类孟德尔遗传数据库(OMIM,http://www.omim.org/)和Drugbank数据库[19](https://go.drugbank.com/)进行检索,获取UC相关靶点。
1.6 蛋白质相互作用网络的构建及核心靶点筛选将高频核心药物作用靶点和UC潜在靶点进行比对,筛选重复靶点,得到中药复方专利高频核心药物治疗UC的作用靶点,并导入String Version 11.5平台[20](https://string-db.org/),选择物种为“Homo sapiens”,构建蛋白相互作用(PPI)网络。选取分值>0.7分的高置信度区间,并根据自由度值≥2倍中位数的靶点构建PPI网络,筛选核心靶点。
1.7 高频核心药物-成分-治疗靶点-疾病网络构建将高频核心药物、化合物成分、治疗靶点信息、疾病导入Cytoscape 3.8.0软件[21]绘制中药-成分-成分-治疗靶点-疾病网络图。
1.8 京都基因与基因组百科全书(KEGG)通路和基因本体(GO)功能富集分析为进一步研究中药复方专利高频核心药物治疗UC的作用情况,分别使用KOBAS 3.0在线基因富集网站[22](http://kobas.cbi.pku.edu.cn/)和Metascape平台[23](http://metascape.org/gp/index.html#/main/step1)对核心靶点进行KEGG信号通路和GO功能富集分析,结果以P值升序排列。
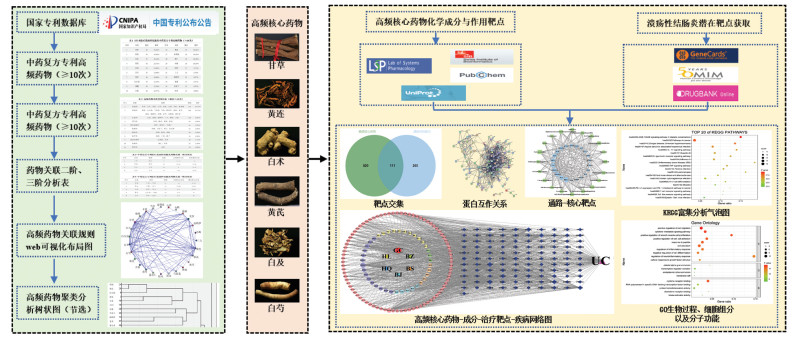
2 结果 2.1 专利检索统计与分析通过检索国家专利数据库,共获得专利项目220项,纳入符合标准的共175项。175项专利涉及药物576味,纳入中药复方中最多药味数为40,最少的药味数为3,用药频次总计2 174次。其中使用频率≥10次的药物共49味,占总使用频次的52.94%,见表 1。使用频次及频率排在前10位的药物为甘草、黄连、白术、黄芪、白及、白芍、党参、白头翁、地榆、木香。对频次≥10次的药物进行功效类别分析,发现各中药类别使用频率排名前3位的为:补虚药、清热药和止血药,见开放科学(资源服务)标识码(OSID)。疗效上多可补气健脾、清热解毒、止血、理气,该用药特点与中医理论对“久痢”的基本病机“脾气虚弱、湿热蕴肠”相符。
|
将49味高频药物导入IBM SPSS Modeler 18.0软件中,基于Apriori算法对高频药物进行关联规则分析,设定最低条件支持度百分比≥7,最小规则置信度百分比≥70,提升度>1,得出中药专利复方治疗UC在组方配伍时同时出现且频率较高的药对、药组。关联规则结果以“后项→前项”展示,按支持度由高到低排序。
1)设定最大前项数为1,进行中药专利复方治疗UC药物关联二阶分析,详见开放科学(资源服务)标识码(OSID)。结果显示二阶关联规则中支持度最高的为甘草-陈皮。2)设定最大前项数为2,进行中药专利复方治疗UC药物关联三阶分析,详见开放科学(资源服务)标识码(OSID)。结果显示三阶关联规则中支持度最高的为黄连-木香-甘草。3)根据数据挖掘结果,绘制高频药物关联规则web可视化布局图。通过线条粗细来表示药物配伍关系的强弱,线条越粗,药物之间的配伍关系越强,结果如图 2所示。4)运用IBM SPSS Statistics 24软件中的组间联接聚类算法,对上述49味高频药物进行聚类分析,结果见开放科学(资源服务)标识码(OSID)。

|
| 图 2 高频药物关联规则web可视化布局图 Fig. 2 Web visual layout diagram of high-frequency drug association rules |
根据表 1,选取频次排名前6位中药(甘草、黄连、白术、黄芪、白及、白芍)为治疗UC的高频核心药物,该核心药物与“2.2关联规则与聚类分析”中所得结果基本相同。综合文献报道以及各数据库检索筛选收集所得的结果,高频核心药物的作用化合物及对应靶点蛋白数目见开放科学(资源服务)标识码(OSID)。其中甘草89种,黄连13种,白术4种,黄芪18种,白及8种,白芍8种,去除重复后总计获得129个化合物,涉及相关作用靶点931个。
2.4 UC疾病潜在靶点经GeneCards数据库检索,得到UC相关靶点4 837个,按相关性得分≥10选取后得到186个潜在靶点。在OMIM和Drugbank数据库中分别找到UC相关靶点182和78个。三者相加即为UC潜在靶点,去除重复基因,共得到376个疾病靶点。
2.5 蛋白质相互作用网络的构建及核心靶点筛选将高频核心药物化学成分的931个靶点与UC潜在靶点取交集,查找治疗靶点共111个,见开放科学(资源服务)标识码(OSID)。将111个蛋白导入STRING平台进行蛋白互作网络可视化,见开放科学(资源服务)标识码(OSID)。根据自由度筛选得到23个核心作用靶点,见开放科学(资源服务)标识码(OSID)。
2.6 构建中药复方专利高频核心药物-成分-治疗靶点-疾病网络将中药复方专利高频核心药物6个单味中药、涉及的129个化合物成分、111个治疗靶点和1个UC疾病信息导入Cytoscape 3.8.0软件绘制中药-成分、成分-疾病靶点网络图。如图 3所示,网络图共涉及241个节点和1 400条边。网络模型中节点的面积越大代表该节点在网络中的连接度越高。其中八边形节点表示单味高频核心药物,六边形节点表示化合物成分,菱形节点表示核心靶点,三角形代表溃疡性结肠炎疾病。
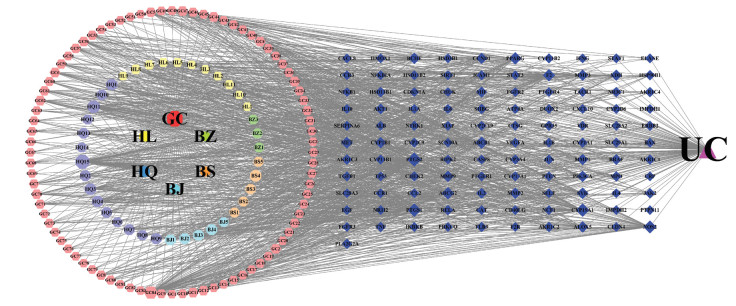
|
| 注:GC.甘草;HL.黄连;BZ.白术;HQ.黄芪;BS.白芍;BJ.白及。 图 3 高频核心药物-成分-治疗靶点-疾病网络图 Fig. 3 Network diagram of high-frequency core drugs-components-treatment targets-diseases |
将23个核心作用靶点导入KOBAS 3.0网站,通过“KEGG通路富集分析”模块,得到KEGG通路总计164条。排名靠前的通路主要有糖尿病并发症中的晚期糖基化产物(AGE)-晚期糖基化终末产物受体(RAGE)信号通路、白介素(IL)-17信号通路、炎症性肠病(IBD)信号通路、t细胞受体信号通路、辅助性T细胞17(Th17)细胞分化信号通路等,按P值对排名前20名的通路途径进行展示,绘制富集分析气泡图,见图 4。将前20条关键通路和23个核心靶点信息导入Cytoscape软件绘制关键通路-靶点信息网络图。如图 5所示,网络图共涉及42个节点和236条边。网络模型中节点的面积越大代表该节点在网络中的连接度越高。其中正方形表示关键通路,圆形表示核心靶点。
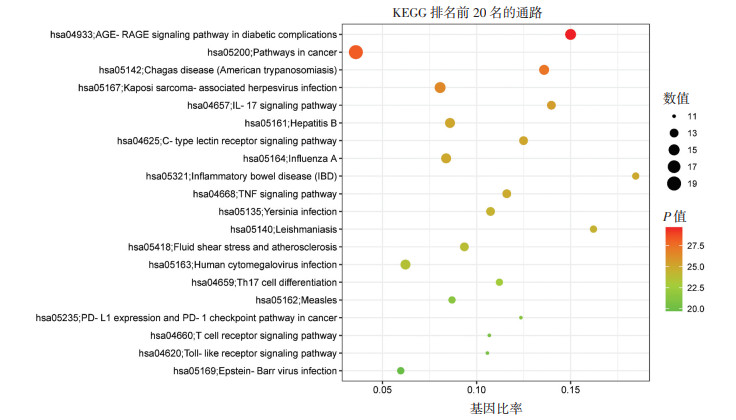
|
| 图 4 高频核心药物主要靶标基因调控的相关通路富集分析气泡图 Fig. 4 Bubble diagram for enrichment analysis of relevant pathways for regulation of main target genes of high-frequency core drugs |
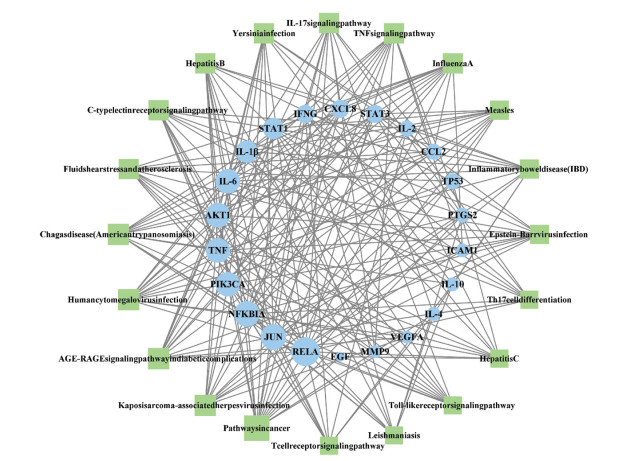
|
| 图 5 高频核心药物治疗UC关键通路-核心靶点网络图 Fig. 5 Network diagram of key pathways-core targets of high-frequency core drugs in the treatment of UC |
同时将这23个核心作用靶点蛋白导入Metascape平台进行GO生物过程、细胞组分以及分子功能富集分析,总计获得716条生物过程条目,13条细胞组分条目,31条分子功能条目。根据P值进行排序,绘制富集分析气泡图,见开放科学(资源服务)标识码(OSID)。
3 讨论根据UC的临床表现和病变特点,归属于中医“泄泻”“久痢”“滞下”等范畴,发病基础为素体脾气虚弱,感受外邪、饮食不节(洁)、情志失调为发病诱因,辨证分型为:大肠湿热、热毒炽盛、脾虚湿蕴证等,治疗总以清热化湿、健脾益气为主[3]。目前治疗UC多采用分期治疗,活动期主要以清热化湿、调气和血为主,临床多运用黄连、黄柏、白及、白芍等药物,缓解期主要以健脾益气为主,临床多运用党参、黄芪、白术、甘草等药物。
研究共纳入175项国家专利数据库中治疗UC的中药复方专利,包含576味药物,通过药物频次分析可知治疗UC的高频药物共有49味,其中使用频率排在前6位的中药分别是:甘草、黄连、白术、黄芪、白及、白芍。甘草具有补益脾气、清热解毒的功效,发挥抗菌、抗炎、抗溃疡等多种药理作用[24]。黄连具有清热燥湿、泻火解毒的功效,发挥抗菌、抗病毒、抗溃疡等多种药理作用,现代研究表明:黄连素、黄连提取物小檗碱、黄连总生物碱、黄连水煎液等对UC具有较好的保护作用[25-30]。白术具有健脾益气、燥湿利水的功效,发挥抗炎、调节消化系统等多种药理作用[31]。黄芪具有补气升阳、托毒排脓、敛疮生肌的功效,发挥抗肿瘤、免疫调节、抗纤维化等多种药理作用[32]。白及具有收敛止血、消肿生肌的功效,发挥抗菌、抗炎、促进创伤愈合等多种药理作用[33]。白芍具有养血调经、敛阴止汗的功效,发挥抗炎、抗氧化等多种药理作用[34]。6味高频核心药物与临床治疗UC药物一致,黄连、白及、白芍以清热化湿、调气和血为主,黄芪、白术、甘草以健脾益气为主。
根据高频药物类别分析,结果显示占据前3类的是补虚药、清热药和止血药,这与高频核心药物前6位分布一致。在治疗UC的专利复方中,常以补虚药为主,清热药和止血药为辅。根据高频药物聚类分析共得出7个聚类组合,聚3类:黄柏、秦皮、白头翁、黄连、木香、党参、白术、茯苓、白芍、陈皮、防风等,药物组合以清热解毒药为主,补虚药、理气药、止血药为辅。从这类药物组合来看,可视为白头翁汤、痛泻要方与参苓白术散化裁而来,其功擅清热解毒、活血止痢、健脾益气、化湿止泻,适用于UC热毒炽盛、肝郁脾虚和脾虚湿阻者。由此得出治疗UC的专利复方尤注重健脾益气、清热解毒、化湿止泻。
选取6味高频核心药物,通过在线数据库共筛选出129个化合物,涉及相关作用靶点931个,挖掘出治疗靶点111个、核心靶点23个,构建了治疗靶点蛋白互作关系网络及高频核心药物-成分-治疗靶点-疾病网络图,将核心靶点导入KOBAS 3.0网站和Metascape平台进行分析,得到KEGG通路共164条,GO生物过程716条,GO细胞组分13条,GO分子功能31条。
分析蛋白互作关系网络可知,高频核心药物治疗UC的核心靶点包括信号转导和转录激活因子3(SATA3)、肿瘤坏死因子(TNF)、IL-6、IL-1β、丝氨酸/苏氨酸激酶1(AKT1)、JUN、肿瘤蛋白P53(TP53)等。STAT3介导细胞对生长因子的反应的信号转导和转录的激活,与IL-6、JAK2共同调控免疫与炎症反应,研究表明:中药调控IL-6/JAK2/STAT3信号通路,抑制炎症介质与细胞因子的活化,防治UC具有良好疗效[35-36]。TNF-α是炎症性肠病病理进程中的关键细胞因子,可表达黏附分子、凝血因子,启动细胞毒性和凋亡等过程,中药可显著降低TNF-α水平,缓解UC的发生发展[37-38]。IL-1β与TNF-α同为促炎因子,主要由单核-巨噬细胞所产生,可促进B细胞分化和分泌抗体,进一步刺激T细胞分化IL-2和干扰素γ的产生,调节机体免疫功能,多种中药复方可显著降低IL-1β水平,促进黏膜组织修复[39-40]。TP53是与肿瘤相关的一种抑癌基因,其编码产生的p53蛋白与细胞周期的调控、细胞凋亡和衰老等相关,通过抑制细胞的生长,从而预防癌症的发生发展[41-42]。这些核心蛋白靶点主要参与了免疫调节与炎症反应等过程。
结合KEGG通路和GO功能富集分析结果表明,高频核心药物可能通过AGE-RAGE、IL-17、IBD、Th17细胞分化等信号通路发挥作用,核心靶点蛋白主要参与了细胞迁移的正向调节、细胞因子介导的信号通路、细胞间黏附的正向调节、细胞活化、炎症反应、转录调节复合物、细胞因子受体结合等过程,从而影响UC的发生发展,起到治疗UC的作用。IL-17是由Th17产生的炎症因子,可促进T细胞的激活和刺激细胞间黏附分子1(ICAM-1),进而引发炎症级联反应[43];调节性T细胞(Treg)属CD4+T细亚群,分泌IL-10,诱导和维持机体的免疫耐受,在人体自身免疫平衡中扮演重要角色,调节两者保持动态平衡,共同维持肠黏膜免疫稳态[44-45]。这与课题组的前期研究结果一致,黄连主要成分小檗碱通过调节结肠中的肠道微生物群来调节Treg/Th17平衡以治疗UC[27]。
但本研究仍存在一定局限性,基于专利数据库数据挖掘方法仅简单地统计分析出用药频次,未能充分考虑中医辨证论治的特点,且部分专利的药物用量未知,医家的用药经验不一。此外,获得了可能的关键蛋白靶点及其作用的信号通路,未能进一步采用体内外实验来验证其预测的准确性,缺乏实验研究数据支撑。因此,这些局限性仍需在今后的研究中进一步完善和补充。
4 小结本研究通过数据挖掘的方法对国家专利数据库中治疗UC专利复方的用药规律进行深入总结分析,分析其用药特点和配伍规律,选取高频核心药物,借助网络药理学筛选主要活性成分和核心作用靶点,构建PPI网络、中药-成分-靶点-疾病网络和信号通路的富集分析,初步阐明高频核心药物多组分、多靶点治疗UC特点,为临床医师遣方用药提供了一定理论依据,也为中药治疗UC的基础研究提供了预测思路。
| [1] |
ORDÁS I, ECKMANN L, TALAMINI M, et al. Ulcerative colitis[J]. Lancet, 2012, 380(9853): 1606-1619. DOI:10.1016/S0140-6736(12)60150-0 |
| [2] |
DIGNASS A, ELIAKIM R, MAGRO F, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis Part 1:Definitions and diagnosis[J]. Journal of Crohn's and Colitis, 2012, 6(10): 965-990. DOI:10.1016/j.crohns.2012.09.003 |
| [3] |
张声生, 沈洪, 郑凯, 等. 溃疡性结肠炎中医诊疗专家共识意见(2017)[J]. 中华中医药杂志, 2017, 32(8): 3585-3589. ZHANG S S, SHEN H, ZHENG K, et al. Chinese medicine diagnosis and treatment of ulcerative colitis expert consensus (2017)[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(8): 3585-3589. |
| [4] |
CAO S Y, YE S J, WANG W W, et al. Progress in active compounds effective on ulcerative colitis from Chinese medicines[J]. Chinese Journal of Natural Medicines, 2019, 17(2): 81-102. DOI:10.1016/S1875-5364(19)30012-3 |
| [5] |
DIGNASS A, LINDSAY J O, STURM A, et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 2:current management[J]. J Crohns Colitis, 2012, 6(10): 991-1030. DOI:10.1016/j.crohns.2012.09.002 |
| [6] |
李军祥, 陈誩. 溃疡性结肠炎中西医结合诊疗共识意见(2017年)[J]. 中国中西医结合消化杂志, 2018, 26(2): 105-111, 120. LI J X, CHEN J. Consensus opinion of experts on TCM diagnosis and treatment of ulcerative colitis (2017)[J]. Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2018, 26(2): 105-111, 120. |
| [7] |
凌海慧, 梁棻, 刘蓉, 等. 中医药保护肠黏膜屏障治疗炎症性肠病的研究进展[J]. 天津中医药, 2018, 35(9): 718-720. LING H H, LIANG F, LIU R, et al. Development on the protection of intestinal mucosal barrier by traditional Chinese medicine in the treatment of inflammatory bowel disease[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(9): 718-720. |
| [8] |
闫圣, 王琦, 张潞潞, 等. 溃疡性结肠炎"辨体-辨病-辨证"诊疗思路[J]. 天津中医药, 2020, 37(10): 1100-1103. YAN S, WANG Q, ZHANG L L, et al. Diagnosis and treatment of ulcerative colitis with "differentiation-constitution, differrntiation-diease, differentiation-syndrome"[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(10): 1100-1103. |
| [9] |
顾鉴秋. 肠清口服液对溃疡性结肠炎的防治作用及机制探讨[D]. 广州: 广州中医药大学, 2014. GU J Q. Preventive and therapeutic effects of Changqing oral liquid on ulcerative colitis and its mechanism[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2014. |
| [10] |
魏裕涛, 余艾锶, 张晓, 等. 治疗溃疡性结肠炎中药发明专利技术信息挖掘[J]. 中国中医药信息杂志, 2020, 27(8): 92-97. WEI Y T, YU A S, ZHANG X, et al. Data mining of technical information of TCM patents for ulcerative colitis[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2020, 27(8): 92-97. |
| [11] |
董培良, 李慧, 韩华. 中药网络药理学的应用与思考[J]. 中国实验方剂学杂志, 2020, 26(17): 204-211. DONG P L, LI H, HAN H. Application and thanking of Chinese medicine network pharmacology[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(17): 204-211. |
| [12] |
陈海彬, 周红光, 李文婷, 等. 网络药理学: 中药复方作用机制研究新视角[J]. 中华中医药杂志, 2019, 34(7): 2873-2876. CHEN H B, ZHOU H G, LI W T, et al. Network pharmacology: A new perspective of mechanism research of traditional Chinese medicine formula[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(7): 2873-2876. |
| [13] |
LU C C, BING Z T, BI Z J, et al. Top-100 most cited publications concerning network pharmacology: a bibliometric analysis[J]. Evidence-Based Complementary and Alternative Medicine, 2019, 2019: 1704816. |
| [14] |
RU J L, LI P, WANG J N, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. Journal of Cheminformatics, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [15] |
DAINA A, MICHIELIN O, ZOETE V. Swiss ADME: a free web tool to evaluate pharmacokinetics, drug-likeness and medicinal chemistry friendliness of small molecules[J]. Scientific Reports, 2017, 7: 42717. DOI:10.1038/srep42717 |
| [16] |
DAINA A, MICHIELIN O, ZOETE V. Swiss Target Prediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Research, 2019, 47(W1): W357-W364. DOI:10.1093/nar/gkz382 |
| [17] |
CONSORTIUM T U, BATEMAN A, MARTIN M J, et al. UniProt: the universal protein knowledgebase[J]. Nucleic Acids Research, 2016, 45(D1): D158-D169. |
| [18] |
REBHAN M, CHALIFA-CASPI V, PRILUSKY J, et al. GeneCards: a novel functional genomics compendium with automated data mining and query reformulation support[J]. Bioinformatics, 1998, 14(8): 656-664. DOI:10.1093/bioinformatics/14.8.656 |
| [19] |
WISHART D S, FEUNANG Y D, GUO A C, et al. DrugBank 5.0:A major update to the DrugBank database for 2018[J]. Nucleic Acids Research, 2017, 46(D1): D1074-D1082. |
| [20] |
SZKLARCZYK D, GABLE A L, LYON D, et al. STRING v11:protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Research, 2018, 47(D1): D607-D613. |
| [21] |
SHANNON P, MARKIEL A, OZIER O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Research, 2003, 13(11): 2498-2504. DOI:10.1101/gr.1239303 |
| [22] |
BU D C, LUO H T, HUO P P, et al. KOBAS-i: intelligent prioritization and exploratory visualization of biological functions for gene enrichment analysis[J]. Nucleic Acids Research, 2021, 49(W1): W317-W325. DOI:10.1093/nar/gkab447 |
| [23] |
ZHOU Y Y, ZHOU B, PACHE L, et al. Metascape provides a biologist-oriented resource for the analysis of systems-level datasets[J]. Nature Communications, 2019, 10: 1523. DOI:10.1038/s41467-019-09234-6 |
| [24] |
邓桃妹, 彭灿, 彭代银, 等. 甘草化学成分和药理作用研究进展及质量标志物的探讨[J]. 中国中药杂志, 2021, 46(11): 2660-2676. DENG T M, PENG C, PENG D Y, et al. Research progress on chemical constituents and pharmacological effects of Glycyrrhizae Radix et Rhizoma and discussion of Q-markers[J]. China Journal of Chinese Materia Medica, 2021, 46(11): 2660-2676. |
| [25] |
周瑞, 项昌培, 张晶晶, 等. 黄连化学成分及小檗碱药理作用研究进展[J]. 中国中药杂志, 2020, 45(19): 4561-4573. ZHOU R, XIANG C P, ZHANG J J, et al. Research progress on chemical compositions of Coptidis Rhizoma and pharmacological effects of berberine[J]. China Journal of Chinese Materia Medica, 2020, 45(19): 4561-4573. |
| [26] |
李阳, 郝艺照, 傅熠俊, 等. 黄连素预防葡聚糖硫酸钠诱导溃疡性结肠炎的作用机制[J]. 中华中医药杂志, 2017, 32(8): 3431-3435. LI Y, HAO Y Z, FU Y J, et al. Mechanism of berberine in preventing DSS-induced ulcerative colitis model mice[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(8): 3431-3435. |
| [27] |
CUI H T, CAI Y Z, WANG L, et al. Berberine regulates treg/Th17 balance to treat ulcerative colitis through modulating the gut microbiota in the colon[J]. Frontiers in Pharmacology, 2018, 9: 571. DOI:10.3389/fphar.2018.00571 |
| [28] |
李思, 沈雁, 钟继红, 等. 黄连提取物小檗碱对溃疡性结肠炎小鼠结肠黏膜机械屏障的影响[J]. 中华全科医学, 2018, 16(9): 1419-1423. LI S, SHEN Y, ZHONG J H, et al. Effects of Berberine extracted from Chinese Goldthread Rhizome on the intestinal mucosal mechanical barrier in mice with ulcerative colitis[J]. Chinese Journal of General Practice, 2018, 16(9): 1419-1423. |
| [29] |
蒋晓梅, 刘翀, 朱延焱. 黄连总生物碱对溃疡性结肠炎模型大鼠肠黏膜损伤及p38-PPARγ/NF-κB通路的影响[J]. 中国药师, 2019, 22(12): 2188-2193. JIANG X M, LIU C, ZHU Y Y. Effects of the total alkaloids of Coptis chinensis on intestinal mucosal injury and p38-PPARγ/NF-κB pathway in rats with ulcerative colitis[J]. China Pharmacist, 2019, 22(12): 2188-2193. |
| [30] |
武涛, 相芳, 刘静. 黄连水煎液对实验性大鼠溃疡性结肠炎治疗作用的研究[J]. 药学实践杂志, 2016, 34(1): 28-31, 61. WU T, XIANG F, LIU J. Effect of essential Coptis decoction on rats with experimental ulcerative colitis[J]. Journal of Pharmaceutical Practice, 2016, 34(1): 28-31, 61. |
| [31] |
顾思浩, 孔维崧, 张彤, 等. 白术的化学成分与药理作用及复方临床应用进展[J]. 中华中医药学刊, 2020, 38(1): 69-73. GU S H, KONG W S, ZHANG T, et al. Advances on chemical compositions, pharmacological effects and compound clinical applications of Atractylodes macrocephala koidz[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(1): 69-73. |
| [32] |
吴娇, 王聪. 黄芪的化学成分及药理作用研究进展[J]. 新乡医学院学报, 2018, 35(9): 755-760. WU J, WANG C. Research progress on chemical constituents and pharmacological effects of Astragalus membranaceus[J]. Journal of Xinxiang Medical University, 2018, 35(9): 755-760. |
| [33] |
汤逸飞, 阮川芬, 应晨, 等. 白及属植物化学成分与药理作用研究进展[J]. 中草药, 2014, 45(19): 2864-2872. TANG Y F, RUAN C F, YING C, et al. Research progress on chemical constituents and medical functions in plants of Bletilla Rchb. F[J]. Chinese Traditional and Herbal Drugs, 2014, 45(19): 2864-2872. |
| [34] |
吴玲芳, 王晓晴, 陈香茗, 等. 白芍化学成分及药理作用研究进展[J]. 国际药学研究杂志, 2020, 47(3): 175-187. WU L F, WANG X Q, CHEN X M, et al. Chemical constituents and pharmacological activities of Radix Paeoniae Alba: research advances[J]. Journal of International Pharmaceutical Research, 2020, 47(3): 175-187. |
| [35] |
张天涵, 沈洪. 基于IL-6/JAK2/STAT3信号通路中药抗溃疡性结肠炎研究进展[J]. 环球中医药, 2019, 12(10): 1600-1605. ZHANG T H, SHEN H. Research progress of Chinese medicines for ulcerative colitis based on IL-6/JAK2/STAT3 signaling pathway[J]. Global Traditional Chinese Medicine, 2019, 12(10): 1600-1605. |
| [36] |
YU T, LI Z, XU L, et al. Anti-inflammation effect of Qingchang suppository in ulcerative colitis through JAK2/STAT3 signaling pathway in vitro and in vivo[J]. J Ethnopharmacol, 2021, 266: 113442. |
| [37] |
王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义[J]. 胃肠病学和肝病学杂志, 2015, 24(1): 104-106. WANG S X, PU J, LIU C Q, et al. Expression and clinical significance of cytokine TNF-α, IL-6 and IL-4 in ulcerative colitis[J]. Chinese Journal of Gastroenterology and Hepatology, 2015, 24(1): 104-106. |
| [38] |
ZHU L, GU P, SHEN H. Protective effects of berberine hydrochloride on DSS-induced ulcerative colitis in rats[J]. Int Immunopharmacol, 2019, 68: 242-251. |
| [39] |
贾育新, 毕殿勇, 成映霞, 等. 参苓白术散对脾虚湿困型溃疡性结肠炎模型大鼠血清IL-1β、Il-4及Caspase-8基因蛋白表达的影响[J]. 时珍国医国药, 2016, 27(9): 2084-2086. JIA Y X, BI D Y, CHENG Y X, et al. Effect of Shenling Baizhu Powder on expression of serum IL-1β, Il-4 and Caspase-8 proteins in rats with ulcerative colitis of spleen deficiency and damp-retention syndrome[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(9): 2084-2086. |
| [40] |
XU L, ZHANG J Q, WANG Y F, et al. Uncovering the mechanism of Ge-gen-Qin-lian Decoction for treating ulcerative colitis based on network pharmacology and molecular docking verification[J]. Bioscience Reports, 2021, 41(2): BSR20203565. |
| [41] |
黄友, 杨莎莎, 林夏, 等. 基于网络药理-分子对接研究附子理中丸治疗溃疡性结肠炎的作用机制[J]. 药学学报, 2020, 55(8): 1812-1822. HUANG Y, YANG S S, LIN X, et al. The mechanism of action of Fuzi Lizhong Pill in treatment of ulcerative colitis based on network pharmacology-molecular docking[J]. Acta Pharmaceutica Sinica, 2020, 55(8): 1812-1822. |
| [42] |
LIU J Q, LIU J, TONG X L, et al. Network pharmacology prediction and molecular docking-based strategy to discover the potential pharmacological mechanism of Huaihua Powder against ulcerative colitis[J]. Drug Design, Development and Therapy, 2021, 15: 3255-3276. |
| [43] |
GEREMIA A, ARANCIBIA-CÁRCAMO C V. Innate lymphoid cells in intestinal inflammation[J]. Frontiers in Immunology, 2017, 8: 1296. |
| [44] |
XU T, STEWART K M, WANG X H, et al. Metabolic control of TH17 and induced Treg cell balance by an epigenetic mechanism[J]. Nature, 2017, 548(7666): 228-233. |
| [45] |
MICHALEK R D, GERRIETS V A, JACOBS S R, et al. Cutting edge: distinct glycolytic and lipid oxidative metabolic programs are essential for effector and regulatory CD4+ T cell subsets[J]. Journal of Immunology (Baltimore, Md: 1950), 2011, 186(6): 3299-3303. |
 2023, Vol. 40
2023, Vol. 40