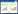文章信息
- 张蒙蒙, 魏淑婕, 沈家圆, 欧阳慧子, 常艳旭, 何俊
- ZHANG Mengmeng, WEI Shujie, SHEN Jiayuan, OUYANG Huizi, CHANG Yanxu, HE Jun
- 藜芦有效成分提取工艺优化
- Optimization of extraction process of effective ingredients in Veratrum Nigrum L.
- 天津中医药, 2023, 40(2): 228-233
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 228-233
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.17
-
文章历史
- 收稿日期: 2022-11-11
2. 天津中医药大学第一附属医院, 天津 300193
藜芦(Veratrum nigrum L.)又名山葱、葱葵、丰芦等[1],是中国传统的中草药,富含生物碱、黄酮、有机酸等天然活性成分,具有降血压、抗肿瘤、抗氧化、抗炎镇痛等作用[2-8]。甾体生物碱被认为是藜芦的活性物质基础,以芥芬胺、藜芦胺为代表成分[9-11]。芥芬胺为介藜芦型生物碱,藜芦胺为藜芦胺型生物碱,均具备C-nor-D-homo-[14(13→12)-abeo]环系,A、B、D均为六元环,C为五元环,其相似的化学结构表征两者可能具有相同的药理活性[12-18]。近年来对藜芦的提取分离、含量测定、配伍及药理作用的研究较多[19-20],提取工艺的讨论较为少见。文章对藜芦提取工艺进行优化研究,研究过程中引入了统计分析软件(JMP)实验设计模型,以验证正交实验数据的可行性与有效性。JMP软件是一种交互式可视化统计发现软件,其在医药行业中的用途有实验设计和数据的统计分析。工艺优化需考察多种因素及水平对工艺参数的影响,因此科学合理地设计实验、筛选关键影响因素对提供全面可靠的数据是十分重要的[21-23]。研究以藜芦中芥芬胺和藜芦胺的含量作为评价指标,采用单因素实验、正交实验及JMP软件实验设计模型考察乙醇体积分数、液料比、提取时间、提取次数4种因素对主要活性成分提取的影响,确定最佳提取工艺。
1 材料 1.1 仪器Agilent 1260高效液相色谱仪(美国Agilent公司);AX 205型十万分之一(瑞士Mettler Toledo公司)天平;Milli-Q超纯水制备仪(Millipore公司);3K15型高速离心机(美国sigma公司);XW-80A型涡旋混合器(上海沪西分析仪器厂)。
1.2 试药甲醇、乙腈均为色谱纯,购自美国Fisher公司;甲酸为色谱纯,购自美国ROE公司;95%乙醇为分析纯,购自天津市康科德科技有限公司;对照品芥芬胺(批号:DST190407-087,HPLC≥98%)、藜芦胺(批号:DST190108-024,HPLC≥99%)由成都德思特生物技术有限公司提供;藜芦购自安徽亳州药材市场。
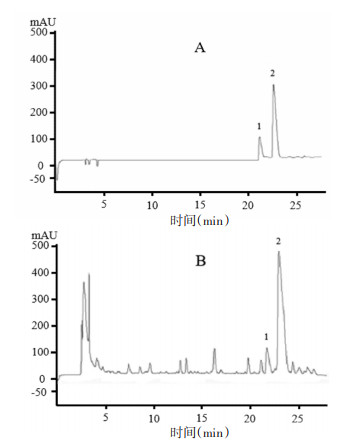
2 方法与结果 2.1 芥芬胺、藜芦胺含量测定 2.1.1 色谱条件色谱柱:Agilent ZORBAX SB-C18柱(4.6 mm×100 mm,1.6 μm);流动相:A相0.1%甲酸水,B相乙腈;梯度洗脱:0~20 min,15%~35% B;20~25 min,35%~37% B;25~28 min,37%~95% B。检测波长:0~21.8 min,254 nm;21.8~28 min,205 nm。流速:0.5 mL/min,柱温:30 ℃;进样量:5 μL。结果见图 1。
|
| 注:1. 芥芬胺;2. 藜芦胺。 图 1 对照品(A)与样品(B)色谱图 Fig. 1 Chromatograms of reference substance (A) and sample (B) |
精密称取芥芬胺和藜芦胺对照品适量至5 mL的容量瓶中,分别以甲醇溶解并定容至刻度,配制成浓度为1 mg/mL的对照品溶液,4 ℃冰箱储存备用。
2.1.3 供试品溶液的制备精密称取藜芦粗粉(过2号筛)10 g,加入80%乙醇150 mL,加热回流提取2 h,回流提取2次,两次药液合并,4 ℃冰箱储存备用。
2.1.4 线性关系考察精确量取“2.1.2”项下对照品溶液适量,以甲醇稀释至分别含有芥芬胺和藜芦胺500 μg/mL的混合对照溶液,将此溶液用甲醇依次稀释2、2.5、2、2、2.5、2、2、5倍得9个不同浓度的溶液,按“2.1.1”项下色谱条件,以待测物峰面积(Y)为纵坐标,待测物的浓度(X)为横坐标,得芥芬胺峰、藜芦胺面积与浓度的线性关系分别为Y=23.102X-15.653,r2=0.999 1,0.5~500 μg/mL;Y=70.769X+139.630,r2=0.999 2,0.5~500 μg/mL。表明各成分线性关系良好。
2.1.5 精密度实验精密吸取“2.1.4”项下混合对照品溶液适量,以甲醇稀释5倍后按“2.1.1”项下色谱条件测定连续进样测定6次,相对标准差(RSD)值分别为3.9%和2.2%,表明仪器精密度良好。
2.1.6 稳定性实验精密吸取“2.1.3”项下供试品溶液适量,按“2.1.1”项下方法于0、3、6、12、24 h测定芥芬胺和藜芦胺峰面积,24 h内RSD值分别为1.1%和1.0%,表明供试品溶液在24 h内稳定性良好。
2.1.7 重复性实验精密称取藜芦粗粉6份,每份10 g,以“2.1.3”项下方法平行制备供试品溶液,按“2.1.1”项下方法测定芥芬胺和藜芦胺的含量,RSD值分别为2.8%和1.4%,表明该方法重复性良好。
2.1.8 加样回收率精密称取藜芦粗粉6份,每份5 g,分别准确加入一定量的芥芬胺和藜芦胺对照品溶液,再加入80%乙醇至150 mL,按“2.1.3”项下方法制备并测定,计算芥芬胺和藜芦胺平均回收率分别为103.0%和98.8%,RSD为1.5%和2.7%。
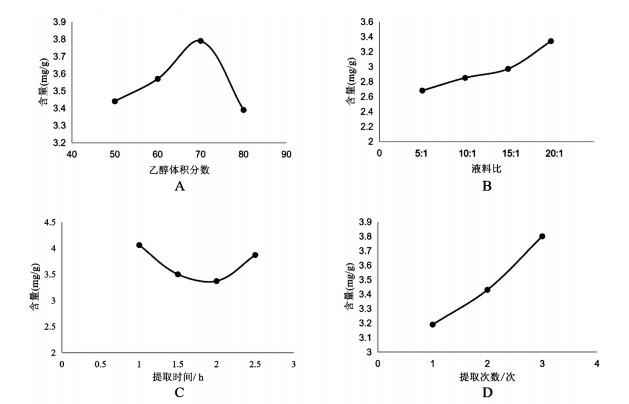
2.2 单因素实验 2.2.1 乙醇体积分数精密称取藜芦样品10 g,共4份,分别加入体积分数为50%、60%、70%、80%的乙醇,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图 2A,乙醇体积分数为60%时,芥芬胺含量最高,体积分数为70%时,藜芦胺含量最高,且芥芬胺含量未明显下降,故确定乙醇体积分数为60%、70%、80%。
|
| 图 2 乙醇体积分数(A)、液料比(B)、提取时间(C)和提取次数(D)对提取效果的影响 Fig. 2 Effects of ethanol volume fraction (A), liquid-to-solid ratio (B), extraction time (C) and extraction times (D) on extraction effect |
精密称取藜芦样品10 g,共4份,分别加入提取溶液使得液料比为5∶1、10∶1、15∶1、20∶1,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图 2B,液料比为20∶1时,藜芦胺含量最高,芥芬胺含量较高,且两者的含量总和最高,故确定液料比为10∶1、15∶1、20∶1。
2.2.3 提取时间精密称取藜芦样品10 g,共4份,提取时间分别为1 h、1.5 h、2 h、2.5 h,按“2.1.3”项下方法制备供试品溶液,以“2.1.1”项下色谱条件测定芥芬胺和藜芦胺含量。结果见图 2C,提取时间为1 h时芥芬胺与藜芦胺的提取含量总和最高,故确定提取时间为1 h、1.5 h、2 h。
2.2.4 提取次数精密称取藜芦样品10 g,共3份,提取次数分别为1、2、3次,按“2.1.3”项下方法制备供试品溶液,测定芥芬胺和藜芦胺含量。结果见图 2D,提取次数为3次时,芥芬胺和藜芦胺的提取效果最好,故确定提取次数为1、2、3次。
2.3 建立JMP实验设计模型 2.3.1 模型设计基于单因素实验结果,采用JMP软件4因素3水平的定制设计筛选藜芦芥芬胺和藜芦胺含量的影响因素,因素水平设置见表 1。
JMP软件设计出具有数据分析意义的实验列表,并对响应值进行模拟,模拟结果见表 2。结果表明,该模型预测A1B3C3D3实验条件下响应值最高,即乙醇体积分数60%,提取次数3次,提取时间2 h,液料比20∶1工艺条件下提取的芥芬胺与藜芦胺总量最高。
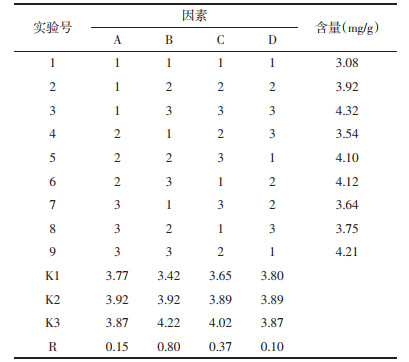
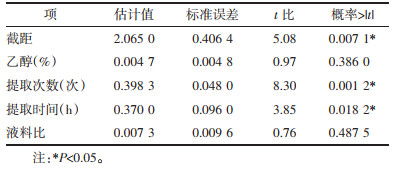
应用JMP软件对表 2中的结果进行最小二乘法拟合分析,根据P值找出影响响应值的关键因素,P<0.05为差异有统计学意义,结果见表 3。由表 3可知乙醇体积分数、提取次数、提取时间、液料比P值均大于0.05,表明4种因素均对提取工艺有影响,但并非影响提取含量的关键因素,模型预测结果需进一步验证。

|
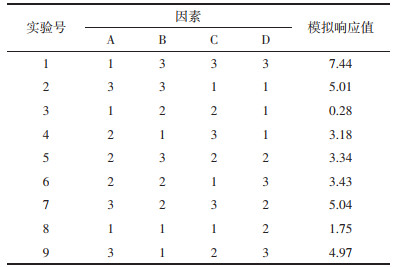
根据单因素实验结果,在乙醇体积分数、液料比、提取时间、提取次数4因素下分别设置3水平,以芥芬胺和藜芦胺含量为考察指标进行L9(34)正交实验,确定最佳提取工艺条件。因素水平设计见表 1。按照表 1进行4因素3水平正交实验,实验结果见表 4。提取工艺最优参数与JMP软件实验设计模型所得结果一致。
极差RB > RC > RA > RD,即影响藜芦提取物中芥芬胺和藜芦胺含量的主次因素为提取次数 > 提取时间 > 乙醇浓度 > 液料比,其结果与方差分析结果一致,见表 5。根据均值进行分析可得出藜芦提取的最佳工艺条件为A2B3C3D2,即乙醇体积分数70%,提取次数3次,提取时间2 h,液料比15∶1。
精密称取藜芦样品3份,每份10 g,置入250 mL圆底烧瓶中,按优化工艺进行验证实验,即加入70%乙醇150 mL,回流提取3次,每次2 h,合并滤液后放置室温,补足失重,取上清液经0.45 μm有机微孔滤膜过滤后按“2.1.1”项下色谱条件测定,结果显示芥芬胺和藜芦胺含量的平均值分别为1.60、2.98 mg/g,RSD分别为1.0%、1.1%。结果表明该工艺稳定可行。
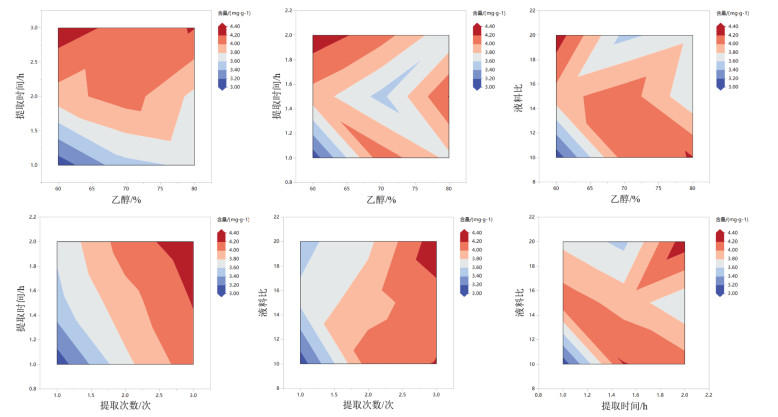
2.6 等高线图分析采用JMP软件对正交实验结果以标准最小二乘法回归分析,分析结果见表 6,参数估计值见表 7,模型与正交实验方差分析结果一致,表明正交实验结果真实有效[23]。利用JMP软件在完成回归方程模型的基础上,借助等高线图直观反映各因素变化对考察指标的影响情况。本研究4种因素两两交互作用对芥芬胺、藜芦胺提取总含量的交互影响情况如图 3所示。等高线图将变量描绘在二维图表中,横纵坐标分别代表各自变量,等高线颜色指示含量与该关系的符合程度。图 3中显示本研究中各因素两两之间的相关性较弱,当其中1项变化时,另一项并不会随之变化[24],该结论提示正交实验结果有效,所确定工艺为最优提取工艺。
|
| 图 3 各因素对芥芬胺、藜芦胺提取总含量的交互影响 Fig. 3 Interaction effects of various factors on the total content of Jervine and Veratramine extracted |
藜芦是中国传统中药,其化学成分复杂,包括生物碱类、黄酮类、二萜类、茋类等,具有多种药效[2-8]。芥芬胺与藜芦胺为藜芦中主要生物碱型化合物,具有阻断声波刺猬(Shh)信号通路[25]、信号转导抑制作用,是藜芦发挥药效作用的物质基础。
常用的生物碱提取方法有酸水提取法、亲脂性有机溶剂提取法、醇类溶剂提取法、超声提取法、酶提取法等。由于酸水提取法腐蚀性和成盐损耗大、亲脂性有机溶剂毒性高、超声或酶提取法造价高等缺陷,尚未广泛应用于大规模生产,乙醇提取法具有工艺简单、经济便捷、效率高等优点广受厂家青睐,因此本实验选用乙醇提取法。
为降低药效成分在生产过程中的损耗、优化提取效率、增强药效,实验在单因素控制条件下,共考察了影响芥芬胺和藜芦胺提取的4个因素:乙醇体积分数、提取时间、提取次数、液料比。同时分别设置了3水平,进行正交实验。根据正交实验结果得知,工艺为乙醇体积分数为70%,液料比为15∶1,提取3次,每次2 h,芥芬胺与藜芦胺含量最高,可达1.60、2.98 mg/g。同样可由表中数据得知,影响藜芦提取物中含量的主次因素为提取次数 > 提取时间 > 乙醇浓度 > 液料比。运用JMP软件定制设计实验模型,并对正交实验结果以标准最小二乘法回归分析,模型结果与正交实验结果一致,表明正交实验结果真实有效。同时在此基础上,借助等高线图直观反映各因素变化对考察指标的影响情况,全面立体地筛选最佳提取工艺。实验提取得到的芥芬胺与藜芦胺含量较高,工艺稳定,可为藜芦的进一步开发研究提供理论依据。
| [1] |
孙玉海. 早春放牧慎防藜芦中毒[J]. 吉林畜牧兽医, 2020, 41(6): 66. SUN Y H. Beware of hellebore poisoning in early spring grazing[J]. Jilin Animal Husbandry and Veterinary Medicine, 2020, 41(6): 66. |
| [2] |
贾晓华, 王维, 高梦园, 等. 基于UPLC-Q-TOF-MS/MS分析藜芦中化学成分[J]. 天津中医药大学学报, 2021, 40(1): 104-111. JIA X H, WANG W, GAO M Y, et al. Chemical component analysis of Veratrum by UPLC-Q-TOF-MS/MS[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2021, 40(1): 104-111. |
| [3] |
张蒙珍, 高丽娟, 徐世芳, 等. 藜芦属植物甾体生物碱及其药理活性研究进展[J]. 中国中药杂志, 2020, 45(21): 5129-5142. ZHANG M Z, GAO L J, XU S F, et al. Advances in studies on steroidal alkaloids and their pharmacological activities in genus Veratrum[J]. China Journal of Chinese Materia Medica, 2020, 45(21): 5129-5142. |
| [4] |
国家中医药管理局中华本草编委会. 中华本草·蒙药卷[M]. 上海: 上海科学技术出版社, 2004: 369. Chinese Materia Medica Editorial Committee of the State Administration of Traditional Chinese Medicine. Chinese materia medica: Mongolia medicine volume[M]. Shanghai: Shanghai Scientific and Technical Publishers, 2004: 369. |
| [5] |
时嘉敏, 林立五, 何翠林, 等. 毛叶藜芦的化学成分研究[J]. 华西药学杂志, 2020, 35(2): 117-121. SHI J M, LIN L W, HE C L, et al. Study on the chemical constituents of Veratrum grandiflorum[J]. West China Journal of Pharmaceutical Sciences, 2020, 35(2): 117-121. |
| [6] |
杨振楀, 文锋. 藜芦药理及作用简况[J]. 中国实用医药, 2016, 11(20): 282-283. YANG Z Y, WEN F. Pharmacology and actions of veratrum[J]. China Practical Medicine, 2016, 11(20): 282-283. |
| [7] |
SHANG Y H, DU Q D, LIU S M, et al. Antitumor activity of isosteroidal alkaloids from the plants in the genus Veratrum and Fritillaria[J]. Current Protein & Peptide Science, 2018, 19(3): 302-310. |
| [8] |
徐暾海, 徐雅红. 藜芦属植物化学成分和药理作用[J]. 国外医药(植物药分册), 2002, 17(5): 185-189. XU T H, XU Y H. Veratrum Phytochemical composition and pharmacological effects[J]. Drugs and Clinic, 2002, 17(5): 185-189. |
| [9] |
SZELIGA M, CIURA J, TYRKA M. Representational difference analysis of transcripts involved in jervine biosynthesis[J]. Life (Basel, Switzerland), 2020, 10(6): 88. |
| [10] |
FAN Y Q, ZHAO L L, HUANG X H, et al. UPLC-MS/MS method for the simultaneous quantification of eight compounds in rat plasma and its application to a pharmacokinetic study after oral administration of Veratrum (Veratrum nigrum L.) extract[J]. BioMed Research International, 2020, 2020: 8883277. |
| [11] |
CONG Y, GUO J G, TANG Z, et al. Metabolism study of veratramine associated with neurotoxicity by using HPLC-MSn[J]. Journal of Chromatographic Science, 2015, 53(7): 1092-1099. |
| [12] |
LI Q, et al. Seven new veratramine-type alkaloids with potent analgesic effect from Veratrum taliense[J]. Journal of Ethnopharmacology, 2019, 244: 112137. |
| [13] |
LIU M, LU X X, ZHANG J M, et al. Teratogenic jervine increases the activity of doxorubicin in MCF-7/ADR cells by inhibiting ABCB1[J]. Biomedecine & Pharmacotherapie, 2019, 117: 109059. |
| [14] |
ZHENG B J, WANG C H, SONG W W, et al. Pharmacokinetics and enterohepatic circulation of jervine, an antitumor steroidal alkaloid from Veratrum nigrum in rats[J]. Journal of Pharmaceutical Analysis, 2019, 9(5): 367-372. |
| [15] |
LEI W, et al. Jervine inhibits non-small cell lung cancer (NSCLC) progression by suppressing Hedgehog and AKT signaling via triggering autophagy-regulated apoptosis[J]. Biochemical and Biophysical Research Communications, 2020, 533(3): 397-403. |
| [16] |
YIN L L, XIA Y H, XU P, et al. Veratramine suppresses human HepG2 liver cancer cell growth in vitro and in vivo by inducing autophagic cell death[J]. Oncology Reports, 2020, 44(2): 477-486. |
| [17] |
BAI F, LIU K D, LI H L, et al. Veratramine modulates AP-1-dependent gene transcription by directly binding to programmable DNA[J]. Nucleic Acids Research, 2018, 46(2): 546-557. |
| [18] |
NAGATA R. Mechanisms of veratramine-induced 5-HT syndrome in mice[J]. Japanese Journal of Pharmacology, 1991, 55(1): 139-146. |
| [19] |
马莹慧, 郭淑英, 张慧锋, 等. UPLC-MS法测定藜芦丹参配伍前后吸收转运变化情况[J]. 中华中医药学刊, 2019, 37(5): 1064-1067. MA Y H, GUO S Y, ZHANG H F, et al. Study of absorption and transport of Veratrum nigrum and Salvia miltiorrhiza bunge by UPLC-MS method[J]. Chinese Archives of Traditional Chinese Medi- cine, 2019, 37(5): 1064-1067. |
| [20] |
郭丽娜, 郑茜. 基于GC/TOF-MS代谢组学方法的人参反藜芦研究[J]. 山西医科大学学报, 2019, 50(12): 1738-1744. GUO L N, ZHENG Q. GC/TOF-MS-based metabolomics study on Ginseng in combination with Veratrum nigrum[J]. Journal of Shanxi Medical University, 2019, 50(12): 1738-1744. |
| [21] |
苏颖, 白杰, 蔡正军, 等. 运用JMP软件的试验设计对甲钴胺片进行处方研究[J]. 中南药学, 2020, 18(5): 781-784. SU Y, BAI J, CAI Z J, et al. Formula of mecobalamin tablets with JMP software[J]. Central South Pharmacy, 2020, 18(5): 781-784. |
| [22] |
吴建伟, 余俊先. 头孢克肟颗粒杂质检测的均匀设计及优化[J]. 中国医院用药评价与分析, 2020, 20(10): 1216-1220. WU J W, YU J X. Uniform design and optimization for impurity detection of cefixime granule[J]. Evaluation and Analysis of Drug-Use in Hospitals of China, 2020, 20(10): 1216-1220. |
| [23] |
吴繁, 刘化勇, 丁雪梅, 等. 基于JMP软件中定制设计的纯棉和纯毛织物熨烫参数优化对比研究[J]. 毛纺科技, 2016, 44(4): 10-14. WU F, LIU H Y, DING X M, et al. Comparison study of optimizing cotton and wool fabric's ironing parameters based on custom designs methodology, a unit of JMP[J]. Wool Textile Journal, 2016, 44(4): 10-14. |
| [24] |
张大翰, 李萌, 王新悦, 等. D-最优混料设计优化肉苁蓉速溶咖啡加工工艺[J]. 食品安全质量检测学报, 2021, 12(23): 9233-9241. ZHANG D H, LI M, WANG X Y, et al. Design the formulation of instant Cistanche deserticola coffee and optimize its manufacturing process[J]. Journal of Food Safety & Quality, 2021, 12(23): 9233-9241. |
| [25] |
QIN Y T, JIANG M, TUERXUNG N, et al. Sonic hedgehog signaling pathway in Myelodysplastic Syndrome: Abnormal activation and jervine intervention[J]. Gene, 2020, 754: 144881. |
2. First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
 2023, Vol. 40
2023, Vol. 40