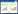文章信息
- 江正平, 张燕, 王强松
- JIANG Zhengping, ZHANG Yan, WANG Qiangsong
- 姜黄素-多巴胺纳米药物用于脑胶质瘤细胞的化疗-光热联合治疗
- Curcumin-dopamine nanomedicines for combined chemo-photothermal therapy of glioma cell
- 天津中医药, 2023, 40(2): 234-240
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 234-240
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.18
-
文章历史
- 收稿日期: 2022-10-16
脑胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,是原发性脑瘤的主要死亡原因,由于其恶性程度较高,预后差并且容易复发等特点,严重危害人类的生命健康[1]。脑胶质瘤病死率较高,胶质瘤患者的中位生存期一般小于1年,即使在有利的治疗条件下,患者的术后生存期仅延长至2年左右[2]。因此,克服目前脑胶质瘤治疗的局限性,设计和制备安全高效的治疗方式刻不容缓。
姜黄素(CUR)是从姜科植物姜黄、郁金、莪术的根茎中提取的天然多酚成分[3],已被证实有抗炎[4]、抗菌[5]、抗氧化[6]、抗细胞增殖[7]和抗血管生成[8]等治疗作用,近年来研究人员对CUR的抗肿瘤作用进行了大量的研究与探索,证明CUR能通过靶向包括生长因子、细胞因子、转录因子和调节细胞增殖和凋亡的基因在内的不同细胞信号通路来表现出抗肿瘤能力[9];同时CUR安全性较高,即使在高剂量下对人体和动物的毒性也很低[10]。然而,CUR存在水中溶解性差、化学稳定性差、口服人体生物利用度低以及半衰期和药代动力学短[5, 11]等问题,临床上大大限制了CUR的应用。
由于纳米粒子的独特特性,纳米给药系统可以提高CUR的化学稳定性、溶解性和缓释性,改善生物利用度、半衰期和细胞摄取[12]。聚多巴胺(PDA)具有良好的生物相容性和生物降解性,较高的黏附能力、负载能力和良好的光热转化性能,同时PDA也是一种具有多种刺激响应释药机制的药物递送载体材料,在pH变化和近红外光(NIR)的外源性刺激下可以达到可控释放药物的目的[13]。因此,本实验将PDA作为药物载体,制备了一种高稳定性、低毒性、可控释的CUR纳米粒,研究纳米粒的粒径、载药量、包封率、光热效率、体外药物释放等参数,并在细胞水平上模拟了纳米粒跨越血脑屏障(BBB)行为,评价了细胞摄取和治疗效果。
1 材料 1.1 细胞大鼠脑胶质瘤细胞C6-luc、人脑星形胶质母细胞瘤细胞U87-luc,购于中国医学科学院基础医学研究所细胞资源中心。培养条件:置于37 ℃、5%二氧化碳(CO2)、饱和湿度的细胞培养箱中培养。
1.2 药品及试剂CUR(纯度≥98%,美国Acros Organics公司);盐酸多巴胺(纯度≥98%,上海阿拉丁生化科技股份有限公司);DMEM培养基、磷酸盐缓冲液(PBS,美国Gibco公司);Ham’s F-12K培养基(上海源培生物科技股份有限公司);胎牛血清(FBS,以色列Biological Industries公司);单溶液细胞增殖检测试剂盒(MTS,美国Promega公司);4’-6-二脒基-2-苯基吲哚(DAPI)溶液(北京索莱宝科技有限公司)。
1.3 仪器粒径分析仪(英国MALVERN公司,型号:Nano-ZS 90);紫外-近红外分光光度计(美国Perkinelmer公司,型号:Lambda35);荧光分光光度仪,(日本HORIBA公司,型号:FluoroMax-4);多功能全波长酶标仪(美国ThermoFisher公司,型号:ThermoVarioskan Flash3001);激光扫描共聚焦倒置显微镜(德国Carl ZEISS,型号:LSM710)。
2 方法 2.1 包封CUR的PDA纳米粒(PDA@CUR NPs)的制备1 mg CUR(乙醇溶液)与10 mg多巴胺(水溶液)溶于5 mL乙醇/水(1/2,V/V)溶剂中,磁力搅拌混匀。向体系中加入1 mol/L氢氧化钠42 μL调节体系pH至弱碱性,50 ℃水浴磁力搅拌反应4 h。反应结束后将产物转移至透析袋中(截留分子量,14 000),二次水透析12 h。收集透析后的产物进行超滤浓缩,定容至1 mL,获得PDA@CUR NPs混悬液,上述实验操作过程均避光。
2.2 PDA@CUR NPs粒径和光学特征取适量PDA@CUR NPs溶液用蒸馏水稀释后,放置于马尔文粒径分析仪Nano-ZS 90中进行分析,测定纳米粒的粒径大小、多分散系数(PDI)、表面Zeta电位及粒径稳定性。
取CUR、PDA纳米粒(PDA NPs)、PDA@CUR NPs溶液稀释至CUR浓度10 μg/mL,用紫外分光光度计对其进行全波长扫描。
2.3 PDA@CUR NPs的载药量及包封率采用差量法测定CUR的包封率。纳米粒置于透析袋中,浸入30 mL蒸馏水中,磁力搅拌快速透析2 h,换水5次,收集每次透析外液。荧光分光光度计测定上述溶液中残余的CUR含量,CUR荧光激发波长426 nm,发射波长579 nm。取透析后的产物采用真空冷冻干燥方式冻干得到冻干粉,精确称质量。按照以下公式计算PDA@CUR NPs的载药量和包封率。
载药量(%)=纳米粒中CUR的质量/纳米粒的质量× 100%
包封率(%)=纳米粒中CUR的质量/CUR的投药量× 100%
2.4 PDA@CUR NPs体外光热转换取CUR、PDA NPs和PDA@CUR NPs用808 nm半导体激光器照射5 min,辐射强度为1 W/cm2,期间用红外成像仪记录温度的变化,重复实验3次。
2.5 PDA@CUR NPs体外释药行为研究设置pH5.5和pH7.4的PBS缓冲液作为释放介质来模拟人体正常生理环境和肿瘤细胞的溶酶体微环境,同时添加0.5%的吐温80为CUR增溶。将超滤浓缩后的PDA@CUR NPs加入到截留分子量7 000的透析袋中,放置于20 mL释放外液中。将释放体系37 ℃水浴中磁力搅拌,每次取样前,将pH不同的两个平行组别置于45 ℃水浴中加热15 min,以此来模拟NIR的外源性刺激。在设置好的时间点每次取样5 mL,同时加入等体积的新释放介质。取出的释放液通过荧光分光光度计测定荧光强度,计算CUR的含量,根据累积释放率公式计算并绘制累积释放曲线。
Qn=Cn×V0+(C1+C2+C3+…Cn-1)×V
累积释放百分率(%)=Qn/Q总×100%
其中Qn是第n次取样时药物的累积释放量,Cn是第n次取样时释放液中药物的浓度,V0是溶出杯中模拟液的体积,V是每次取出的释放液体积。
2.6 体外模拟PDA@CUR NPs跨越BBB和细胞摄取纳米粒的行为考察选用大鼠脑胶质瘤细胞C6-luc和人脑星形胶质母细胞瘤细胞U87-luc作为模型细胞,利用纳米粒迁移实验对纳米粒跨越BBB的行为进行模拟,选用0.4 μm的带孔小室模拟已受损的BBB,将C6-luc和U87-luc以5×104个细胞/孔接种于24孔板中,纳米粒置于带孔小室中,共孵育24 h后用DAPI染色细胞核,利用激光共聚焦显微镜观察拍照。
将两种细胞接种于共聚焦小皿中,接种密度为1×105个细胞/皿,在培养箱中培养24 h后弃去原培养基,分别加入含CUR和PDA@CUR NPs的培养基,孵育12 h后,弃去培养基,4%组织固定液固定,之后用DAPI染色细胞核,加入0.2 mL PBS封闭,将样品置于激光共聚焦显微镜下使用63倍油镜观察并拍照。
2.7 体外细胞毒性评价采用MTS实验评价纳米粒的细胞毒性,以及纳米粒协同光热联合治疗对C6-luc和U87-luc两种细胞的治疗效果。设置空白对照组、游离CUR组以及PDA@CUR NPs组,将C6-luc细胞和U87-luc细胞按1×104个细胞/孔接种于96孔板中,孵育24 h后弃去原培养基,分别加入新鲜培养基、含CUR的培养基和含PDA@CUR NPs的培养基,CUR浓度从5 μg/mL逐渐上升至80 μg/mL,12 h后,用808 nm半导体激光器照射2 min,辐射强度为1 W/cm2,之后继续孵育12 h。孵育结束后PBS洗涤细胞,加入MTS溶液孵育1 h,用酶标仪在490 nm处测量吸光度值,使用无细胞的MTS溶液的吸光度进行校正。
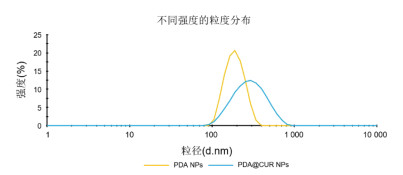
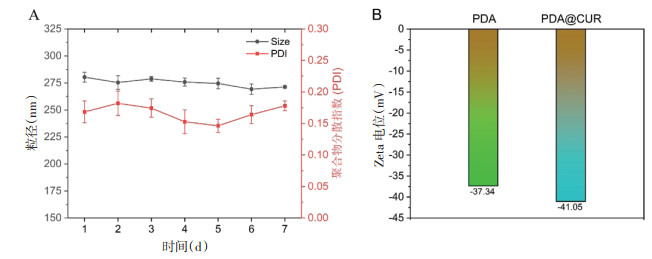
3 结果 3.1 PDA@CUR NPs粒径、粒径稳定性和光学特征通过马尔文粒径分析仪Nano-ZS 90测定的PDA@CUR NPs平均粒径为(275.1±5.6)nm,PDI为(0.167±0.020),相比于PDA NPs的粒径(180.2 nm)明显增大,见图 1。7 d内纳米粒的粒径和PDI稳定性较好,见图 2A;纳米粒的表面Zeta电位为-41.05 mV,相比于PDA NPs的Zeta电位(-37.34 mV)明显增大,见图 2B。紫外光谱表明CUR在426 nm有紫外特征吸收峰,CUR与PDA NPs混合后仍然能在426 nm观察到CUR的特征吸收峰,但是在PDA@CUR NPs紫外光谱中发现CUR的吸收峰被屏蔽,见图 3。以上实验结果说明PDA成功包载CUR形成纳米粒,且纳米粒的稳定性和分散性良好。
|
| 图 1 PDA@CUR NPs与PDA NPs粒径 Fig. 1 Particle size of PDA@CUR NPs and PDA NPs |
|
| 图 2 PDA@CUR NPs粒径稳定性、多分散系数(A)和表面Zeta电位(B) Fig. 2 PDA@CUR NPs size stability, polydispersity coefficient(A) and surface zeta potential(B) |
|
| 图 3 PDA@CUR NPs、PDA NPs和游离CUR紫外光谱 Fig. 3 UV spectra of PDA@CUR NPs, PDA NPs and free curcumin |
采用差量法测定未被PDA包载的CUR含量。通过荧光分光光度计以426 nm作为激发波长扫描游离CUR,在579 nm出现最大荧光发射波长,并且按浓度梯度测量得到CUR荧光标准曲线。根据公式计算得到纳米粒的包封率为(81.73±2.22)%,载药量为(11.41±0.27)%。
3.3 体外光热转换体外光热体外转换实验结果表明,PDA NPs和PDA@CUR NPs均表现出优秀的光热升温行为。如图 4及图 5所示,在激光1 min后,纳米粒组温度能上升约12 ℃,5 min内,纳米粒组的温度达到约45 ℃,而游离CUR 5 min内仅上升了约4 ℃。实验结果说明CUR在与PDA形成PDA@CUR NPs后受激光照射能够持续稳定产热。
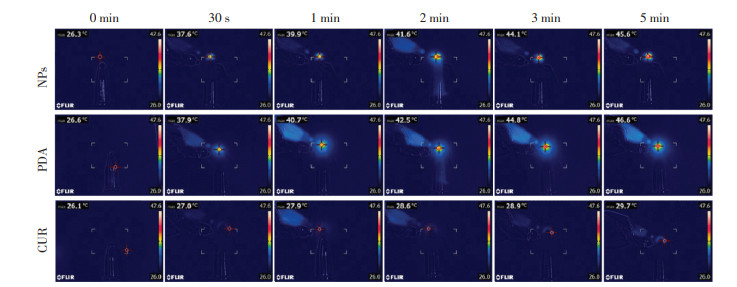
|
| 图 4 体外光热转换成像 Fig. 4 In vitro photothermal conversion imaging |
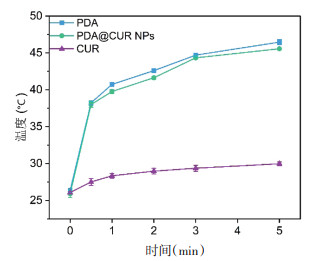
|
| 图 5 体外光热转换数据分析 Fig. 5 In vitro photothermal conversion data analysis |
实验中选用pH及温度(模拟光热升温过程)两个因素控制CUR的释放行为。从图 6可知,CUR的释放呈现出pH及温度相关性,酸性pH及光热升温可以加速CUR的释放。48 h后,在pH 7.4且无加热的释放环境中,CUR累积释放量仅为27.92%,而在pH 5.5且有加热的释放环境中高达61.31%。这些结果表明,PDA@CUR NPs的药物释放有明显的酸敏感性和NIR外源性刺激下的控释性,有助于延长药物在体内的循环时间和在肿瘤组织定点释放,降低药物全身毒性,达到药物可控制释放的目的。
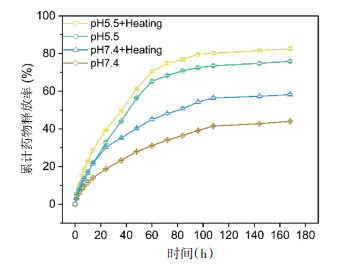
|
| 图 6 PDA@CUR NPs在不同pH及温度下的体外释放曲线 Fig. 6 In vitro release profiles of PDA@CUR NPs at different pH and temperatures |
利用激光共聚焦显微镜观察PDA@CUR NPs穿越0.4 μm的带孔小室的情况,如图 7(A)所示,绿色为CUR的荧光,蓝色为DAPI标记的细胞核的荧光,可以发现纳米粒能够穿越0.4 μm的带孔小室到达下室的胶质瘤细胞,通过体外模拟实验证明PDA@CUR NPs有跨越BBB的潜力。
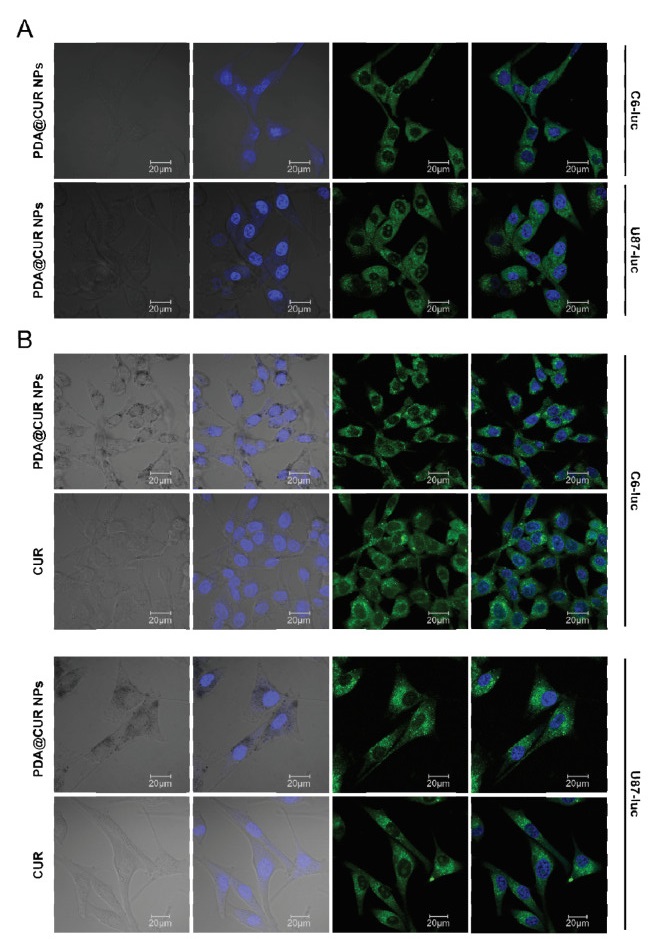
|
| 图 7 体外模拟跨越BBB实验和细胞摄取情况 Fig. 7 In vitro simulation of blood-brain barrier bypass experiments and cellular uptake |
通过激光共聚焦显微镜分析C6-luc细胞和U87-luc细胞对游离CUR和PDA@CUR NPs的摄取情况以及药物在细胞内的分布。如图 7B所示,可以看出纳米粒在与两种脑胶质瘤细胞共孵育12 h就已经被肿瘤细胞成功摄取,并且纳米粒进入细胞后主要分布在细胞质中。实验结果说明纳米粒能够携带药物进入脑胶质瘤细胞中。
3.6 体外细胞毒性实验为了研究纳米粒的细胞毒性以及CUR协同光热治疗对C6-luc细胞和U87-luc细胞的联合治疗效果,设置了不同药物浓度配合光热治疗。如图 8所示,即使在CUR浓度80 μg/mL时孵育24 h,两种脑胶质瘤细胞的细胞存活率均在80%以上,说明PDA@CUR NPs对细胞活力影响较小,与对照组相比细胞存活率下降可能是由于CUR的缓慢释放导致的。然而,在给药12 h用激光照射治疗后,纳米粒激光组随着CUR浓度升高细胞存活率明显下降,治疗效果明显优于空白激光组、游离CUR组和游离CUR激光组,说明纳米粒光热升温后对胶质瘤细胞有较强的杀伤作用;在CUR浓度在10 μg/mL以上时,联合治疗组相较游离CUR激光组的细胞存活率显著降低,当CUR浓度40 μg/mL时两种细胞存活率均降至50%以下,在CUR浓度80 μg/mL时C6-luc细胞的存活率仅为12%,见图 8A,U87-luc细胞的存活率仅为17%,见图 8B,结果表明,在NIR外源性的刺激下,CUR从纳米粒中释放出来,并且PDA在激光照射下产热,两者联合杀死脑胶质瘤细胞且治疗效果良好。
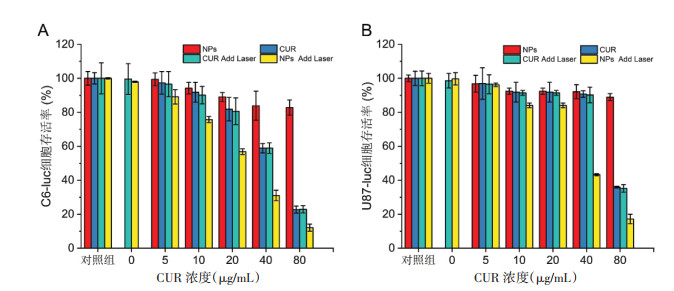
|
| 图 8 体外细胞毒性实验 Fig. 8 In vitro cytotoxicity assay |
CUR是一种有多种治疗效果且一直受到研究者们关注的中药活性成分,目前已有大量研究证明CUR对肺癌[14]、乳腺癌[15]、肝癌[16]、胃癌[17]等有治疗效果,但是CUR存在水溶性低、生物利用度低、代谢快和半衰期短等问题。相较于其他肿瘤,脑胶质瘤由于BBB和血管脑肿瘤屏障(BBTB)的存在[18],使得大多数药物难以越过BBB到达肿瘤部位,目前的常规治疗手段仍然是手术切除这一侵入性治疗[19]。
PDA具有良好的生物相容性、高附着力和出色的光热转换性能的作为药物载体,已被广泛应用于药物控释递送系统,实验结果显示PDA@CUR NPs粒径分布均匀且稳定,平均粒径大于200 nm,有利于在肿瘤组织内滞留[20],纳米粒表面带负电荷更易于其在肿瘤组织的富集。PDA@CUR NPs具有较高的载药量和包封率,显著改善CUR水溶性低的问题;同时纳米粒具有优秀的光热转换能力,既能通过NIR的刺激将光能转化为热能,快速升温杀伤肿瘤细胞,又能将PDA之间非共价π-π介导的相互作用破坏,有效触发药物释放,将药物的可控释性与治疗的微创性、高选择性有机结合。在细胞水平上证明了PDA@CUR NPs有跨越BBB的潜力,能被脑胶质瘤细胞快速摄取,且“CUR+光热疗法”能有效抑制人源和鼠源的脑胶质瘤细胞增殖。实验改善了CUR水溶性、稳定性差、代谢快等问题,也为治疗脑胶质瘤的应用上提供了新的思路,也为日后CUR在临床上的应用奠定了一定基础。
| [1] |
WELLER M, WICK W, ALDAPE K, et al. Glioma[J]. Nature Reviews Disease Primers, 2015, 1: 15017. DOI:10.1038/nrdp.2015.17 |
| [2] |
SAITO T, SUGIYAMA K, TAKESHIMA Y, et al. Prognostic implications of the subcellular localization of survivin in glioblastomas treated with radiotherapy plus concomitant and adjuvant temozolomide[J]. Journal of Neurosurgery, 2018, 128(3): 679-684. DOI:10.3171/2016.11.JNS162326 |
| [3] |
ZIELISKA A, ALVES H, MARQUES V, et al. Properties, extraction methods, and delivery systems for curcumin as a natural source of beneficial health effects[J]. Medicina, 2020, 56(7): 336. DOI:10.3390/medicina56070336 |
| [4] |
PENG Y, AO M Y, DONG B H, et al. Anti-inflammatory effects of curcumin in the inflammatory diseases: status, limitations and countermeasures[J]. Drug Design, Development and Therapy, 2021, 15: 4503-4525. DOI:10.2147/DDDT.S327378 |
| [5] |
SHARIFI S, FATHI N, MEMAR M Y, et al. Anti-microbial activity of curcumin nanoformulations: new trends and future perspectives[J]. Phytotherapy Research, 2020, 34(8): 1926-1946. DOI:10.1002/ptr.6658 |
| [6] |
DECK L M, HUNSAKER L A, VANDER JAGT T A, et al. Activation of anti-oxidant Nrf2 signaling by enone analogues of curcumin[J]. European Journal of Medicinal Chemistry, 2018, 143: 854-865. DOI:10.1016/j.ejmech.2017.11.048 |
| [7] |
JIANG L H, CAI X L, LI S, et al. Hydroxyethyl starch curcumin enhances antiproliferative effect of curcumin against HepG2 cells via apoptosis and autophagy induction[J]. Frontiers in Pharmacology, 2021, 12: 755054. DOI:10.3389/fphar.2021.755054 |
| [8] |
SHAKERI A, WARD N, PANAHI Y, et al. Anti-angiogenic activity of curcumin in cancer therapy: a narrative review[J]. Current Vascular Pharmacology, 2019, 17(3): 262-269. DOI:10.2174/1570161116666180209113014 |
| [9] |
GIORDANO A, TOMMONARO G. Curcumin and cancer[J]. Nutrients, 2019, 11(10): 2376. DOI:10.3390/nu11102376 |
| [10] |
SAHOO J P, BEHERA L, PRAVEENA J, et al. The golden spice turmeric (Curcuma longa) and its feasible benefits in prospering human health-a review[J]. American Journal of Plant Sciences, 2021, 12(3): 455-475. DOI:10.4236/ajps.2021.123030 |
| [11] |
DEI CAS M, GHIDONI R. Dietary curcumin: correlation between bioavailability and health potential[J]. Nutrients, 2019, 11(9): 2147. DOI:10.3390/nu11092147 |
| [12] |
RAFIEE Z, NEJATIAN M, DAEIHAMED M, et al. Application of curcumin-loaded nanocarriers for food, drug and cosmetic purposes[J]. Trends in Food Science & Technology, 2019, 88: 445-458. |
| [13] |
WU H, WEI M, XU Y, et al. PDA-based drug delivery nanosystems: A potential approach for glioma treatment[J]. International Journal of Nanomedicine, 2022, 17: 3751-3775. DOI:10.2147/IJN.S378217 |
| [14] |
WAN MOHD TAJUDDIN W N B, LAJIS N H, ABAS F, et al. Mechanistic understanding of curcumin's therapeutic effects in lung cancer[J]. Nutrients, 2019, 11(12): 2989. DOI:10.3390/nu11122989 |
| [15] |
WANG L H, WANG C W, TAO Z Y, et al. Curcumin derivative WZ35 inhibits tumor cell growth via ROS-YAP-JNK signaling pathway in breast cancer[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 460. |
| [16] |
ZHU J X, WANG Y F, YANG P P, et al. GPC3-targeted and curcumin-loaded phospholipid microbubbles for sono-photodynamic therapy in liver cancer cells[J]. Colloids and Surfaces B, Biointerfaces, 2021, 197: 111358. DOI:10.1016/j.colsurfb.2020.111358 |
| [17] |
JAKUBEK M, KEJÍK Z, KAPLÁNEK R, et al. Strategy for improved therapeutic efficiency of curcumin in the treatment of gastric cancer[J]. Biomedecine & Pharmacotherapie, 2019, 118: 109278. |
| [18] |
ZWAIN T, ALDER J E, SABAGH B, et al. Tailoring functional nanostructured lipid carriers for glioblastoma treatment with enhanced permeability through in-vitro 3D BBB/BBTB models[J]. Materials Science & Engineering C, Materials for Biological Applications, 2021, 121: 111774. |
| [19] |
WEN P Y, WELLER M, LEE E Q, et al. Glioblastoma in adults: a Society for Neuro-Oncology (SNO) and European Society of Neuro-Oncology (EANO) consensus review on current management and future directions[J]. Neuro-oncology, 2020, 22(8): 1073-1113. DOI:10.1093/neuonc/noaa106 |
| [20] |
WILHELM S, TAVARES A J, DAI Q, et al. Analysis of nanoparticle delivery to tumours[J]. Nature Reviews Materials, 2016, 1: 16014. DOI:10.1038/natrevmats.2016.14 |
 2023, Vol. 40
2023, Vol. 40