文章信息
- 关宁宁, 黄涌泽, 陈玥, 白宏羽, 宋彬彬, 黄火强
- GUAN Ningning, HUANG Yongze, CHEN Yue, BAI Hongyu, SONG Binbin, HUANG Huoqiang
- 基于动物实验和网络药理学研究艾纳香对急性肝损伤保护作用机制
- Study on the protective mechanism of blumea balsamifera on acute liver injury based on animal experiment and network pharmacology
- 天津中医药, 2023, 40(2): 241-249
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 241-249
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.19
-
文章历史
- 收稿日期: 2022-11-20
肝脏是人类重要的代谢和解毒器官,急性肝损伤(ALI)以患者的功能性肝细胞迅速损害为特征,药物中毒、病毒感染、免疫反应和代谢紊乱等多种因素均可引发肝脏的病变[1],但是目前临床治疗手段和干预效果较差,病死率较高[2]。近年来中药在治疗ALI方面取得一定成果,其主要作用机制包括抑制体内氧化应激和炎症反应及肝细胞纤维化和肝细胞凋亡[3]。
艾纳香[Blumea balsamifera(L)DC.] 是菊科艾纳香属多年生草本植物,归肝、脾经,具有清热解毒、祛风除湿、活血消肿、消炎镇痛等功效,是中国常用中药和民族药,在少数民族地区有着悠久的入药历史。彝族人民常用其治疗头风头痛、风湿痹病;藏族称其治一切热病;基诺族用其根叶治疗肝炎。现代研究表明艾纳香具有抗肿瘤、镇痛、消炎等多种药理活性[4],能够抑制脂质过氧化、清除自由基,有明显的抗氧化作用,对于肝损伤具有保护作用[5-6],但是其作用机制不清楚、药效物质基础不明确,有待深入研究。
网络药理学作为药理学的分支学科,其通过建立药物与病证的关联机制,为中医药的研究提供了系统性的思路和方法。研究基于动物实验和网络药理学验证艾纳香对ALI的保护作用,探讨艾纳香对于ALI的保护机制和药效关键成分,以期为艾纳香治疗ALI的进一步研究提供理论依据。
1 材料 1.1 动物昆明小鼠,SPF级,雄性,8周龄,体质量(22±2)g,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010。通过中央民族大学实验动物伦理委员会批准,饲养于中央民族大学药学院实验动物中心。每日12 h照明,环境温度为(25±2)℃。实验前适应性喂养5 d,自由饮食水。
1.2 药品、试剂与仪器艾纳香药材购买自河北安国药材市场,阳性药水飞蓟宾(批号D0916A)购自大连美仑生物技术有限公司;谷丙转氨酶(ALT,批号20211223),谷草转氨酶(AST,批号20211222)试剂盒购自南京建成生物工程有限公司;四氯化碳(CCl4分析纯,批号20211120)购自利安隆博华(天津)医药化学有限公司,使用时用花生油配制成0.2%的花生油溶液。Epoch Biotek全波长酶标仪(美国Biotek公司),ST 16R高速离心机(美国Thermo Fisher公司)。
1.3 数据库及软件网络药理学以及分子对接涉及的主要数据库及软件有TCMSP(https://www.tcmsp-e.com/)、Uniport数据库(https://www.uniprot.org/)、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)、SwissADME平台(http://www.swissadme.ch/)、GeneCards(http://www.genecards.org/)、OMMI数据库(https://www.ncbi.nlm.nih.gov/geo/)、String数据库(https://www.string-db.org/)、PDB数据库(http://www.rcsb.org/)和Metascape平台(https://metascape.org/gp/index.html#/main/step1)、Cytoscape3.8.2软件、Autodock4.2软件、Pymol 2.5软件。
2 方法 2.1 动物分组、给药及造模健康雄性小鼠随机分为对照组、模型组、阳性药组(100 mg/kg)、水提物组和醇物提组(生药14.32 g/kg)。各组按照体质量灌胃给药,连续12 d。第12次给药2 h后,除对照组腹腔注射花生油外,其余各组腹腔注射0.2% CCl4花生油溶液(10 mL/kg)建立急性肝损伤模型,12 h禁食不禁水。24 h后称量体质量,摘除眼球取血,颈椎脱臼处死,剥离肝脏用生理盐水洗净,滤纸吸干水分后称质量并计算肝脏指数。
2.2 指标检测血清室温静置1 h后,4 500 r/min离心10 min,离心半径为6.75 cm,吸取上清液,按照生化试剂盒说明书分别对血清中ALT、AST水平进行检测。
2.3 艾纳香活性成分筛选和靶点预测通过TCMSP、HERB数据库和文献检索获得艾纳香的化学成分,通过PubChem化学结构数据库(https://pubchem.ncbi.nl-m.nih.gov/)确认检索所得化合物相关信息。借助SwissADME平台(http://www.swissadme.ch/)进行筛选,选取胃肠吸收(Pharmacokinetics-GIabsorption)为“High”且成药性(Druglikeness)至少满足两个“Yes”的成分作为潜在活性成分。利用潜在活性成分的SMILES号在SwissTargetPrediction平台(http://swisstargetprediction.ch/)进行检索,获得活性成分相关基因靶点。
2.4 ALI相关靶点的筛选以“acute liver injury”、“acute liver damage”“acute hepatotoxicity”为关键词在GeneCards(http://www.genecards.org/)、OMIM数据库(http://www.omim.org)数据库进行检索,获得疾病相关基因,对所获得的靶点信息进行合并去重,获得ALI相关靶点。
2.5 艾纳香治疗ALI潜在靶点预测将活性成分靶点和疾病靶点导入Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)中进行可视化处理,得到交集靶点即为艾纳香治疗ALI的潜在靶点。
2.6 蛋白质-蛋白质相互作用网络构建将所得的交集靶点导入String数据库(https://string-db.org/),隐藏其中的游离节点,获得蛋白互作网络图,借助Cytoscape3.9.1软件进行PPI网络的可视化处理。使用Cytoscape3.9.1软件中的CytoHubba插件对数据进行拓扑分析获得hub基因,即核心靶点基因。
2.7 “药物-活性成分-靶点-疾病”网络构建将艾纳香活性成分和疾病靶点导入Cytoscape软件中构建“药物-活性成分-靶点-疾病”网络。网络中活性成分和靶点用节点表示,节点之间的相互作用用边表示。结合所得核心基因根据网络度值分析筛选艾纳香发挥治疗作用的关键成分。
2.8 GO和KEGG通路富集分析借助Metascape平台(https://metascape.org/gp/index.html#/main/step1),对交集靶点进行基因本体(GO)分析,包括生物过程(BP)、分子功能(MF)、细胞组成(CC),以及京都基因与基因组百科全书(KEGG)富集分析。
2.9 分子对接将筛选所得关键成分和核心靶点进行分子对接。通过RCSB数据库(https://www.rcsb.org/)和Pubchem数据库检索获得核心靶点和关键成分的三维蛋白结构。借助AutoDock1.5.7软件,进行分子对接,结果选取结合能最低且构象较好的结合方式,通过PyMOL软件进行可视化。
2.10 统计学方法采用Graph Pad Prism8软件进行统计学分析,实验数据以均数±标准差(x±s)表示,多组数据间的两两比较采用单因素方差分析和LSD方法,两组间的比较采用独立样本t检验,P < 0.05为差异具有统计学意义。
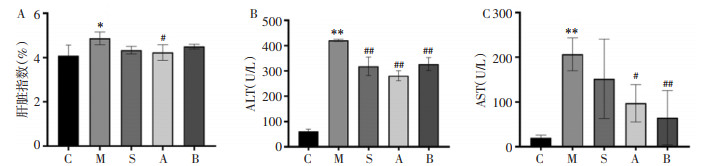
3 结果 3.1 艾纳香对ALI小鼠肝脏指数及血清ALT、AST活性的影响与正常组相比,模型组小鼠肝脏指数和血清ALT、AST活性显著升高,表明其肝脏组织发生病变;与模型组相比,艾纳香水提物组和醇提物组均可降低肝脏指数及ALT、AST的水平,其中水提物组对于肝脏指数和ALT水平的影响较醇提物显著。见图 1。
|
| 注:C.对照组,M.模型组,S.阳性药组,A.水提取物组,B.醇提取物组。与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。 图 1 艾纳香提取物对小鼠肝脏指数(A)、ALT(B)、AST(C)的影响 Fig. 1 Effect of Blumea balsamifera extract on liver index (A), ALT (B), AST (C) in mice |
通过数据库和文献检索共获得85种化合物,经SwissADME筛选后获得36种活性成分。见表 1。
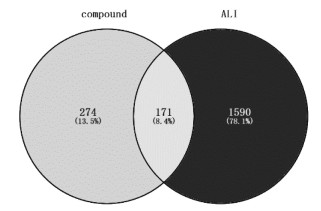
活性成分于SwissTargetPrediction平台进行靶点预测,获得活性成分靶点445个,GeneCards、OMIM数据库检索得到疾病靶点1 761个。绘制韦恩图,得到171个艾纳香潜在治疗靶点。见图 2。
|
| 图 2 艾纳香治疗ALI潜在靶点 Fig. 2 Potential targets of Blumea balsamifera in the treatment of ALI |
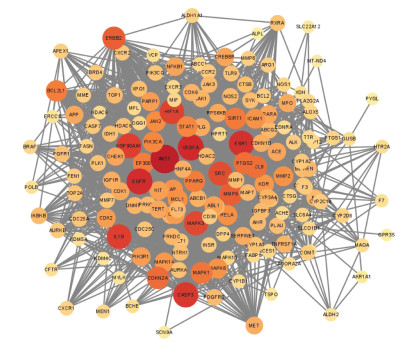
PPI图中节点表示各个靶点,连线表示互相作用,涉及170个节点,2 773条边,节点越大,颜色越深,度值越大,即该靶点的相互作用越强,在网络中的作用越关键。以CytoHubba插件中的Degree值作为条件对PPI中的靶点进行筛选,选取排名前十的基因为丝氨酸/苏氨酸激酶(AKT1)、血管内皮生长因子A(VEGFA)、表皮生长因子受体(EGFR)、雌激素受体(ESR1)、半胱氨酸蛋白酶(CASP3)、白细胞介素-1β(IL-1β)、为热休克蛋白90α家族A级成员1(HSP90AA1)、缺氧诱导因子1(HIF1A)、丝裂原活化蛋白激酶3(MAPK3)、原癌基因酪氨酸激酶(SRC)作为本次研究的核心基因。见图 3。
|
| 图 3 交集靶点PPI网络 Fig. 3 PPI network of intersection targets |
将交集靶点导入Cytoscape软件构建“药物-活性成分-靶点-疾病”网络图。根据网络属性可知其中和核心靶点相关且度值排名前十的化合物为羟基芫花素(3-hydroxygenkwanin)、木犀草素(Luteolin)、山奈酚(Kaempferol)、芫花素(5,4'dihydroxy-7-methoxy-flavone)、华良姜素(kumatakenin)、槲皮素-3,3′-二甲醚(Quercetin 3,3'-dimethyl etheh)、金圣草素(Chrysoeriol)、香叶木素(Diosmetin)、圣草酚(Eriodictyol)、5,3'-二羟基-7,4'-二甲氧基黄酮(Pilloin),表示此10种成分在治疗ALI中发挥重要作用。见图 4。
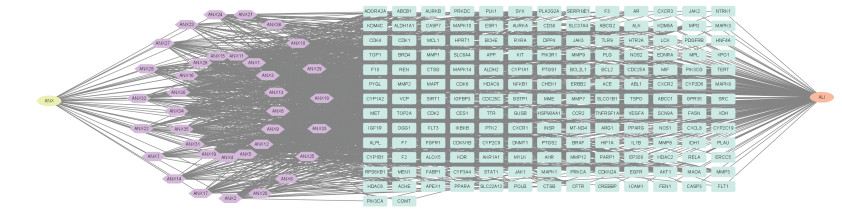
|
| 注:圆形代表单味药和疾病,菱形代表活性成分,长方形代表作用靶点,该网络图有208个节点,1 312条边。 图 4 药物-活性成分-靶点-疾病网络图 Fig. 4 Drug-component-traget-disease network |
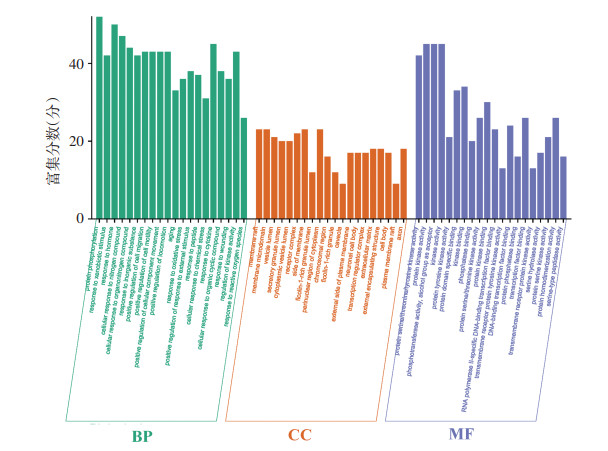
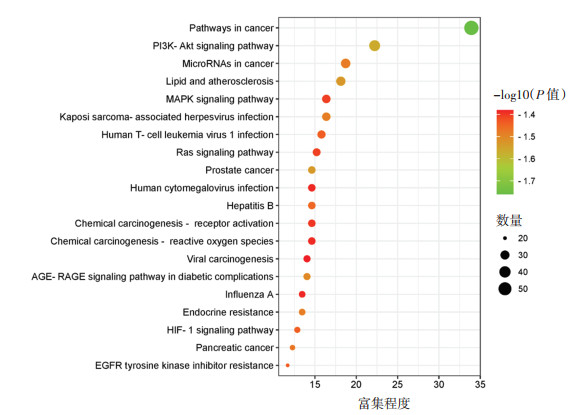
借助Metascape平台对作用靶点进行GO功能分析和KEGG通路富集。根据富集程度的P值由小到大选取排名前二十的条目分别进行分析。GO功能富集显示靶点的催化主要涉及蛋白磷酸化、氮化合物的细胞反应、细胞迁移的正向调节、激酶活性的调节等生物过程。这些靶点主要影响膜筏、核周围胞浆、受体复合物等细胞组分。并且影响蛋白激酶活性、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性、磷酸转移酶活性等分子功能。KEGG富集气泡图显示艾纳香主要影响癌症通路、PI3K-Akt信号通路、癌症中的微小RNA、脂质和动脉粥样硬化、丝裂原活化蛋白激酶信号通路,表明艾纳香治疗ALI的信号通路主要与炎症反应、免疫反应相关。见图 5、图 6。
|
| 图 5 艾纳香治疗ALI的GO功能分析 Fig. 5 GO function analysis of Blumea balsamifera in the treatment of ALI |
|
| 注:KEGG富集越显著颜色越红,富集到的基因数越多点越大;颜色越红、点越大关联更紧密。 图 6 KEGG通路富集分析 Fig. 6 KEGG pathway of Blumea balsamifera in the treatment of ALI |
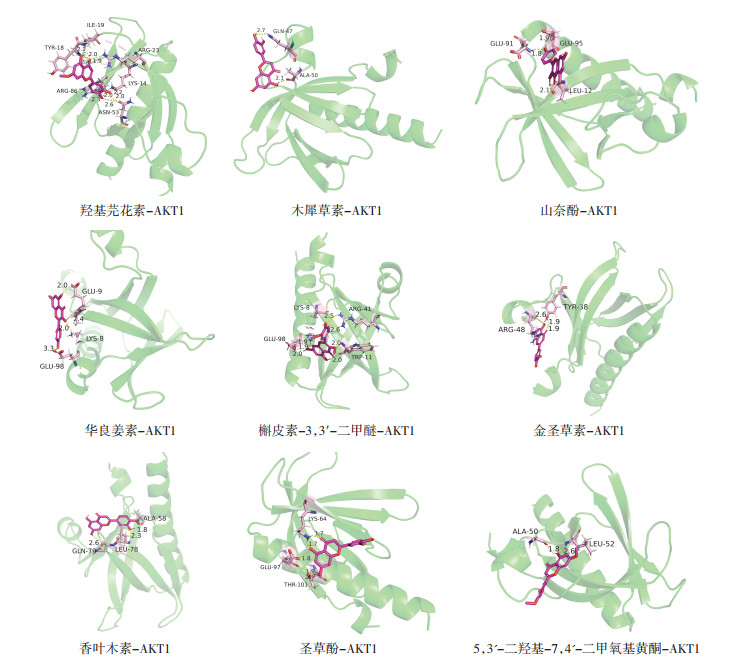
分子对接结果显示,关键成分和核心靶点均能有效结合。其中核心靶点AKT1与其部分关键成分的对接结果,见图 7。
|
| 注:图中紫色结构为化合物,黄色虚线为氢键,数字标记了其键长,粉色结构为结合残基。 图 7 AKT1与关键成分分子对接模式图 Fig. 7 Docking mode between traget AKT1 and key components |
CCl4诱导的ALI模型已广泛用于肝保护药物的研究中[7],其主要是通过CCl4代谢产物产生的自由基引起氧化应激反应导致肝细胞膜被破坏。在肝损伤发生过程中,血清中ALT和AST的活性会升高,因此,血清ALT和AST活性被用作肝损伤的生化标志物[8]。研究中动物实验结果表明,与模型组相比,艾纳香提取物能够降低小鼠血清中ALT、AST活性,差异具有统计学意义(P < 0.05),提示艾纳香能够有效保护肝细胞,治疗CCl4引起的急性肝损伤。
“药物-活性成分-靶点-疾病”网络表明羟基芫花素、木犀草素、山奈酚、芫花素、华良姜素、槲皮素-3,3′-二甲醚、金圣草素、香叶木素、圣草酚、5,3'-二羟基-7,4'-二甲氧基黄酮等10种化合物是艾纳香治疗ALI的关键成分。研究表明羟基芫花素、华良姜素、圣草酚可抑制肝癌细胞的增殖,诱导其凋亡[9-11]。木犀草素、山奈酚、槲皮素-3,3′-二甲醚、金圣草素能够提高抗氧化酶的活性,清除自由基,减轻脂质过氧化,对肝组织产生保护作用[12-15];芫花素和5,3'-二羟基-7,4'-二甲氧基黄酮能显著降低炎症介质的水平[16];香叶木素能够抑制肝脏脂肪生成和炎症反应[17]。
根据PPI网络图得到10个核心靶点AKT1、VEGFA、EGFR、ESR1、CASP3、IL1B、HSP90AA1、HIF1A、MAPK3、SRC。研究发现AKT1是肝癌发生的重要靶点,慢病毒介导Akt1 shRNA载体可抑制HepG2细胞增殖和侵袭,并促进其凋亡,可作为肝癌的潜在治疗靶点[18];VEGFA在肝细胞再生和酒精性肝损伤、肝炎的治疗中发挥重要作用[19];EGFR通过激活后的p-EGFR调控ERK/MAPK下游信号通路,进而调控人肝癌细胞的增殖[20]。ESR1通过下调mt的转录水平抑制人肝癌细胞的增殖和侵袭[21];研究表明可通过对CASP3的抑制来减轻酒精性肝损伤[22];IL1B是一种高效促炎细胞因子,可介导炎症疾病的发生[23],参与许多炎症反应,如心肌梗塞、酒精性脂肪肝、类风湿性关节炎等;HSP90AA1具有抗肝纤维化作用和潜在的保肝作用[24];HIF1A与肝组织中的氧化应激密切相关,且可通过激活PPAR-α-angptl4信号通路参与非酒精性脂肪肝病中的脂质代谢调节[25];MAPK3可促使炎症因子IL-13表达,进而加剧炎症反应,且相关研究表明可通过靶向MAPK信号通路抑制人肝癌细胞的转移[26];Src家族蛋白激酶在生长、增殖、免疫调节等多种细胞功能中发挥重要作用[27]。分子对接结果显示,核心靶点与关键成分均可自发结合,其中AKT1与关键成分的关联程度最高,提示AKT1在艾纳香治疗ALI过程中的作用尤为重要。
KEGG富集主要涉及的通路有癌症通路、PI3K-Akt信号通路、癌症中的miRNA、脂质和动脉粥样硬化、MAPK信号通路等。其中PI3K-Akt通路参与调节细胞周期、细胞增殖、凋亡、代谢和血管生成,研究表明PI3K-Akt信号通路在ALI的防治中具有重要意义,如张华等[28]研究发现AcO-BOA可以抑制AKT的磷酸化,抑制PI3K-Akt信号通路,降低LPS所引起的炎症反应,对ALI起到防治作用。MAPKs信号通路是调节和控制细胞炎症反应的关键途径,诱导下游凋亡蛋白包括Bax、Bcl-2和Caspase-3的表达,在肝脏损伤、应激、细胞凋亡等方面起着重要调节作用[29]。马志梅等[30]发现AO-I可通过调控MAPK信号通路进而改善NF-κB p65介导的炎症因子水平,从而减轻对乙酰氨基酚诱导的肝毒性。
综上所述,本研究通过动物实验初步探究艾纳香对急性肝损伤小鼠的保护作用,并运用网络药理学方法系统讨论了其作用机制,提示艾纳香可能通过作用于AKT1、VEGFA、EGFR等多个靶点,参与调控癌症、PI3K-Akt等多条通路发挥其对急性肝损伤的保护作用。网络药理学方法可以定性地预测药物成分与作用靶点的匹配关系,但不能准确反映成分与靶点相互作用的量效关系、相互作用类型等信息,故本研究后续应该对网络药理学筛选出的潜在活性成分和作用靶点进行体内外实验验证,进一步确证和阐明中药艾纳香发挥急性肝损伤保护作用的有效成分和药理作用机制。
| [1] |
THAWLEY V. Acute Liver Injury and Failure[J]. The Veterinary Clinics of North AmericaSmall Animal Practice, 2017, 47(3): 617-630. DOI:10.1016/j.cvsm.2016.11.010 |
| [2] |
JADAUN K S, MEHAN S, SHARMA A, et al. Neuroprotective effect of chrysophanol as a PI3K/AKT/mTOR signaling inhibitor in an experimental model of autologous blood-induced intracerebral hemorrhage[J]. Current Medical Science, 2022, 42(2): 249-266. DOI:10.1007/s11596-022-2496-x |
| [3] |
卢伟, 潘梦, 方亦可, 等. 中药治疗急性肝损伤作用机制研究进展[J]. 中南药学, 2019, 17(9): 1504-1507. LU W, PAN M, FANG Y K, et al. Advance in traditional Chinese medicine for acute hepatic injury[J]. Central South Pharmacy, 2019, 17(9): 1504-1507. |
| [4] |
马海霞, 杨广安, 谭琪明, 等. 艾纳香化学成分及药理活性研究进展[J]. 化工管理, 2021(10): 69-70, 72. MA H X, YANG G A, TAN Q M, et al. Research progress on chemical constituents and pharmacological activities of Blumea Balsamifera DC[J]. Chemical Management, 2021(10): 69-70, 72. |
| [5] |
赵金华, 许实波. 艾纳香二氢黄酮对脂质过氧化及活性氧自由基的作用[J]. 中国药理学通报, 1997, 13(5): 438-441. ZHAO J H, XU S B. Effects of Blumea flavanones on lipid peroxidation and active oxygen radicals[J]. Chinese Pharmacological Bulletin, 1997, 13(5): 438-441. DOI:10.3321/j.issn:1001-1978.1997.05.018 |
| [6] |
许实波, 胡莹, 林永成, 等. 艾纳香素对护肝及血小板聚集的作用[J]. 中山大学学报论丛, 1994(6): 48-53. XU S B, HU Y, LIN Y C, et al. Study on protection of blumeatin against experimental liver injury and aggregation of platelet[J]. Sun Yatsen University Forum, 1994(06): 48-53. |
| [7] |
CHEN R, WANG Q, ZHAO L J, et al. Lomatogonium rotatum for treatment of acute liver Injury in mice: A metabolomics study[J]. Metabolites, 2019, 9(10): 227. DOI:10.3390/metabo9100227 |
| [8] |
ZHAO Z W, CHANG J C, LIN L W, et al. Comparison of the hepatoprotective effects of four endemic cirsium species extracts from Taiwan on CCl4-induced acute liver damage in C57BL/6 mice[J]. International Journal of Molecular Sciences, 2018, 19(5): E1329. DOI:10.3390/ijms19051329 |
| [9] |
CHOU L F, CHEN C Y, YANG W H, et al. Suppression of hepatocellular carcinoma progression through FOXM1 and EMT inhibition via hydroxygenkwanin-induced miR-320a expression[J]. Biomolecules, 2019, 10(1): 20. DOI:10.3390/biom10010020 |
| [10] |
姚红, 侯宇芯, 任晋宏, 等. 基于PI3K/Akt信号通路探讨华良姜素抗肝癌细胞HepG2凋亡的作用机制[J]. 中国实验方剂学杂志, 2022, 28(9): 80-87. YAO H, HOU Y X, REN J H, et al. Anti-hepatocarcinoma HepG2 cell mechanism of jaranol: based on PI3K/Akt signaling pathway[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(9): 80-87. |
| [11] |
张昆鹏, 张晓愉, 李少一, 等. 圣草酚通过调节Nrf2通路促进氧化应激诱导的肝癌细胞的凋亡[J]. 中国免疫学杂志, 2021, 37(12): 1449-1453, 1467. ZHANG K P, ZHANG X Y, LI S Y, et al. Eriodictyol promotes oxidative stress-induced apoptosis of liver cancer cells by regulating Nrf2 pathway[J]. Chinese Journal of Immunology, 2021, 37(12): 1449-1453, 1467. |
| [12] |
李林林, 龚国清, 冯贻东, 等. 木犀草素对四氯化碳致大鼠肝纤维化的保护作用及其机制研究[J]. 中国生化药物杂志, 2010, 31(6): 377-380. LI L L, GONG G Q, FENG Y D, et al. Preventive effect of luteolin on rat hepatic fibrosis induced by carbon tetrachloride and its mechanism[J]. Chinese Journal of Biochemical and Pharmaceuticals, 2010, 31(6): 377-380. |
| [13] |
童方念, 罗超, 罗丹, 等. 山奈酚对四氯化碳致小鼠急性肝损伤的保护作用[J]. 西安交通大学学报(医学版), 2014, 35(6): 816-819. TONG F N, LUO C, LUO D, et al. Protective effects of kaempferol on CCl4-induced acute liver injury in mice[J]. Journal of Xi'an Jiaotong University(Medical Sciences), 2014, 35(6): 816-819. |
| [14] |
张军, 滑艳, 王玉平, 等. 洋芹素、槲皮素和槲皮万寿菊素衍生物体外抗氧化作用研究[J]. 中药药理与临床, 2003, 19(4): 12-13. ZHANG J, HUA Y, WANG Y P, et al. Antioxidant action of apigenin, quercetin-3, 3'-dimethyl etherhe and quercetagetin-3, 6-dimethyl ether-7-O-glucoside in vitro[J]. Pharmacology and Clinics of Chinese Materia Medica, 2003, 19(4): 12-13. |
| [15] |
MISHRA B, PRIYADARSINI K I, KUMAR M S, et al. Effect of O-glycosilation on the antioxidant activity and free radical reactions of a plant flavonoid, chrysoeriol[J]. Bioorganic & Medicinal Chemistry, 2003, 11(13): 2677-2685. |
| [16] |
GAO Y, LIU F, FANG L, et al. Genkwanin inhibits proinflammatory mediators mainly through the regulation of miR-101/MKP-1/MAPK pathway in LPS-activated macrophages[J]. PLoS One, 2014, 9(5): e96741. |
| [17] |
罗楠轩. 基于STAT1/CXCL10通路研究香叶木素改善非酒精性脂肪肝炎的作用机制[D]. 重庆: 西南大学, 2021. LUO N X. Diosmetin ameliorates nonalcoholic steatohepatitis through modulating lipogenesis and inflammatory response in a STAT1/CXCL10-dependent manner[D]. Chongqing: Southwest University, 2021. |
| [18] |
马体栋, 赵凡, 李碧香. 慢病毒介导Akt1 shRNA载体转染对人肝母细胞瘤细胞株HepG2凋亡和增殖的影响[J]. 肿瘤药学, 2019, 9(4): 572-577. MA T D, ZHAO F, LI B X. Effects of Lentivirus-mediated Akt1 shRNA vector transfection on apoptosis and proliferation of hepatoblasts HepG2 Cells[J]. Anti-tumor Pharmacy, 2019, 9(4): 572-577. |
| [19] |
李伟平, 任浩洋, 张宝阳, 等. VEGF在大鼠慢性酒精性肝损伤中的表达[J]. 世界华人消化杂志, 2006, 14(18): 1766-1770. LI W P, REN H Y, ZHANG B Y, et al. Expression of vascular endothelial growth factor in chronic alcoholic liver fibrosis in rats[J]. World Chinese Journal of Digestology, 2006, 14(18): 1766-1770. |
| [20] |
蒋丽, 张丽, 彭韬, 等. 表皮生长因子受体信号通路调控人肝细胞癌细胞增殖分子机制的研究[J]. 南京医科大学学报(自然科学版), 2007, 27(6): 523-526, 518. JIANG L, ZHANG L, PENG T, et al. The molecular mechanism of EGFR signal transduction pathway on the proliferation of human hepatocellular carcinoma[J]. Acta Universitatis Medicinalis Nanjing (Natural Science), 2007, 27(6): 523-526, 518. |
| [21] |
DENG L, YANG H, TANG J, et al. Inhibition of MTA1 by ERα contributes to protection hepatocellular carcinoma from tumor proliferation and metastasis[J]. Journal of Experimental & Clinical Cancer Research: CR, 2015, 34: 128. |
| [22] |
MA X Y, ZHANG M, FANG G, et al. Ursolic acid reduces hepatocellular apoptosis and alleviates alcohol-induced liver injury via irreversible inhibition of CASP3 in vivo[J]. Acta Pharmacologica Sinica, 2021, 42(7): 1101-1110. |
| [23] |
GALOZZI P, BINDOLI S, DORIA A, et al. The revisited role of interleukin-1 alpha and beta in autoimmuneand inflammatory disorders and in comorbidities[J]. Autoimmunity Reviews, 2021, 20(4): 102785. |
| [24] |
秦荔荣, 周怡, 邓小芳, 等. 转录组测序结合蛋白组学技术筛选肝癌转移基因[J]. 世界华人消化杂志, 2015, 23(13): 2050-2057. QIN L R, ZHOU Y, DENG X F, et al. Identification of genes related to hepatocellular carcinoma metastasis by a combined transcriptomics and proteomics approach[J]. World Chinese Journal of Digestology, 2015, 23(13): 2050-2057. |
| [25] |
HE Y, YANG W, GAN L, et al. Silencing HIF-1α aggravates non-alcoholic fatty liver disease in vitro through inhibiting PPAR-α/ANGPTL4 singling pathway[J]. Gastroenterologia y Hepatologia, 2021, 44(5): 355-365. |
| [26] |
YU C L, YU Y L, YANG S F, et al. Praeruptorin A reduces metastasis of human hepatocellular carcinoma cells by targeting ERK/MMP1 signaling pathway[J]. Environmental Toxicology, 2021, 36(4): 540-549. |
| [27] |
BRIAN B F, FREEDMAN T S. The src-family kinase lyn in immunoreceptor signaling[J]. Endocrinology, 2021, 162(10): bqab152. |
| [28] |
张华, 周焕芳, 梁英琴, 等. 基于网络药理学探讨4-乙酰氧基苯并噁唑-2-酮对急性肝损伤的作用机制[J]. 广西医科大学学报, 2021, 38(7): 1290-1296. ZHANG H, ZHOU H F, LIANG Y Q, et al. Study on the mechanism of 4-acetoxybenzoxazol-2-one on acute liver injury based on network pharmacology[J]. Journal of Guangxi Medical University, 2021, 38(7): 1290-1296. |
| [29] |
GAO Y, TIAN Y, ZHANG X, et al. Magnesium isoglycyrrhizinate ameliorates concanavalin A-induced liver injury via the p38 and JNK MAPK pathway[J]. Immunopharmacol Immunotoxicol, 2020, 42(5): 445-455. |
| [30] |
马志梅, 赖尚磊, 朱锦彦, 等. 白术内酯Ⅰ抑制MAPK/NF-κB信号通路改善对乙酰氨基酚诱导的小鼠急性肝损伤[J]. 中国中药杂志, 2022, 47(4): 1017-1023. MA Z M, LAI S L, ZHU J Y, et al. Atractylenolide Ⅰ improves acetaminophen-induced acute liver injury in mice by inhibiting MAPK/NF-κB signaling pathway[J]. China Journal of Chinese Materia Medica, 2022, 47(4): 1017-1023. |
 2023, Vol. 40
2023, Vol. 40