文章信息
- 杨昕彤, 张悦, 刘思夏, 冷玲, 黎瑞巧, 王启隆
- YANG Xintong, ZHANG Yue, LIU Sixia, LENG Ling, LI Ruiqiao, WANG Qilong
- GPX4在心血管疾病中的作用及中药干预研究进展
- Role of GPX4 in cardiovascular disease and research progress of traditional Chinese medicine intervention
- 天津中医药, 2023, 40(2): 258-264
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(2): 258-264
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.02.21
-
文章历史
- 收稿日期: 2022-11-16
2. 组分中药国家重点实验室, 天津 301617;
3. 现代中医药海河实验室, 天津 301617
心血管疾病(CVDs)泛指心脏和血管疾病,包括冠心病、心肌梗死、动脉粥样硬化(AS)等疾病[1]。CVDs严重威胁着人类的健康。世界范围内有31%以上的死亡由心血管疾病引起[2],因此,迫切需要对心血管疾病的发病机制及治疗靶点进行研究,寻找新的治疗药物。
谷胱甘肽过氧化物酶4(GPX4)是维持细胞氧化还原稳态所必须的抗氧化酶,具有抑制脂质过氧化的作用,是铁死亡的关键调控因子[3],在心血管疾病的发生发展过程中扮演重要角色。中药对心血管疾病有积极治疗作用,且报道多种中药通过上调GPX4改善心血管疾病,据此文章对GPX4的结构、作用以及抑制铁死亡的机制进行探讨,并对近年来中药通过GPX4相关通路改善心血管疾病的研究进行总结,以期为中药治疗心血管疾病的提供新思路。
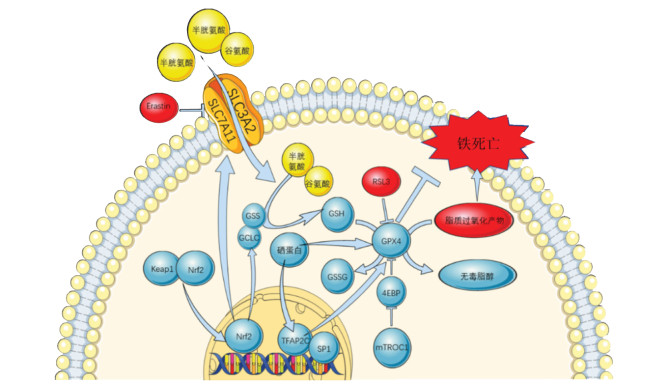
1 GPX4的本质GPX4是8种谷胱甘肽过氧化物酶之一[4],GPX4基因定位于人类19号染色体(小鼠10号染色体)[5],全长4 kbp,广泛分布在细胞质、细胞核和包括线粒体在内的各种细胞器中。在人体中,GPX4存在胞浆(cGPX4)、线粒体(mGPX4)和精子核(snGPX4)3种不同的亚型,在不同的细胞器中发挥抗脂质过氧化作用[6]。GPX4发挥作用的过程依赖硒元素,活性位点含有硒代半胱氨酸,能抑制铁催化的脂质过氧化[7]。硒元素不仅与GPX4的合成有关,还激活转录因子TFAP2C和SP1以促进GPX4的转录,使细胞内GPX4的水平升高[8]。除了对转录的调控外,胱氨酸和硒代半胱氨酸作为同时参与GSH和GPX4合成的原料,可以激活雷帕霉素复合物1(mTORC1),抑制下游的真核翻译起始因子4E结合蛋白(4EBP),促进GPX4的合成[9],见图 1。GPX4是调控谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)互相转化的关键酶[10],GSH在GPX4的催化下可以将有毒性的脂质过氧化物(L-OOH)转化为无毒的脂质醇(L-OH),清除细胞内脂质过氧化物[11]。总的来说,GPX4通过清除细胞内脂质过氧化物抑制细胞氧化应激。
|
| 图 1 GPX4相关通路在铁死亡中的作用 Fig. 1 Role of GPX4 - related pathways in iron death |
GPX4被认为是谷胱甘肽过氧化物酶家族中一种独一无二的抗氧化酶,因其能够直接减少生物膜和脂蛋白中的磷脂过氧化氢[12]。GPX4的3种亚型在不同的细胞器中对局部脂质过氧化起着独立而重要的调节作用,线粒体GPX4可以抑制线粒体中由氧化应激引起的心磷脂过氧化,抑制细胞色素c的解离,抑制细胞损伤[13],同时GPX4过表达恢复了由氧化应激引发的线粒体膜电位的降低[14]。GPX4对维持细胞和机体正常生理功能发育至关重要,过表达GPX4减少了线粒体细胞色素c的释放,抑制了氧化应激引起的细胞凋亡[15],而GPX4基因敲除会造成机体线粒体功能障碍和氧化应激[16],在心脏中特异性敲除GPX4小鼠表现为由氧化应激引发的心源性猝死[3],提示GPX4是细胞中不可缺少的抗氧化酶。
2.2 GPX4与铁死亡铁死亡是一种非凋亡性细胞死亡现象,其特征是铁依赖性的脂质过氧化物的过度累积,引发细胞质膜破坏,细胞死亡。铁死亡的机制复杂,其中半胱氨酸水平、GSH的生物合成和GPX4的正常功能是抑制铁死亡的核心。
GPX4是抑制铁死亡发生的关键,其活性的丧失会导致铁死亡的发生。化合物RSL3通过与GPX4结合使其失活诱导铁死亡,过表达GPX4可以抵消RSL3的作用,证明GPX4是调控铁死亡的关键因子[4]。ML162、DPI化合物、丁硫亚胺和FIN56等化合物也可直接或间接抑制GPX4的活性,引发脂质过氧化物的过度累积从而诱发铁死亡[4]。敲除GPX4的免疫T细胞会发生膜过氧化脂质的快速积累和细胞死亡,表现为铁死亡[17]。
GPX4在铁死亡中的作用主要依赖于核因子红细胞系2相关因子2(Nrf2)/胱氨酸转运蛋白系统xc-(System xc-)轴,System xc-是调控GPX4底物GSH合成的关键系统,在GPX4上游发挥作用。GSH是细胞中重要的抗氧化剂,由溶质载体家族3成员2(SLC3A2)和溶质载体家族7成员11(SLC7A11)组成的System xc-通过调控半胱氨酸合成调节细胞内GSH的水平[18]。System xc-是受转录因子Nrf2调控的关键靶点之一,激活Nrf2可以上调SLC7A11的表达,增加GSH含量并抑制Gpx4的降解[19]。Nrf2在激活GPX4的同时,还促进了GSH合成相关蛋白[谷氨酸-半胱氨酸酶催化亚单位(GCLC)和谷胱甘肽合成酶(GSS)]的表达,增加GSH含量,通过GPX4发挥作用,抑制铁死亡[20]。抑制System xc-也通过影响GPX4的活性诱导铁死亡,小分子化合物Erastin可通过抑制System xc-降低GSH含量,进而影响GPX4活性,使细胞内ROS和脂质过氧化水平升高,从而诱发铁死亡[21],见图 1。综上所述,GPX4是调控铁死亡的关键蛋白,其活性的丧失会引发脂质过氧化进而引发铁死亡。
3 GPX4与心血管疾病心血管疾病的发生涉及细胞死亡、炎症、氧化应激、脂质过氧化等过程,研究发现铁死亡在AS、心肌梗死(MI)导致的缺血/再灌注损伤(MI/RI)以及其他心肌病中均有参与。GPX4作为细胞发挥抗氧化和抗铁死亡的重要靶点,在心血管疾病的发生发展过程中扮演着重要的角色。因此明确GPX4在不同心血管疾病中的作用尤为重要。
3.1 GPX4与ASAS是慢性血管炎症性疾病,以脂代谢紊乱为特征,内皮损伤为主要表型。GPX4通过抑制脂质过氧化和氧化应激,减少平滑肌增殖参与了AS的发展。
内皮损伤是AS发生发展过程中最显著的损伤,在高脂饲料喂养的载脂蛋白E缺陷小鼠(ApoE-/-)和氧化低密度脂蛋白(ox-LDL)诱导的小鼠主动脉内皮细胞中发现GPX4表达的下降,引起脂质过氧化水平增加,进而诱发铁死亡,给予铁死亡抑制剂Fer-1后GPX4表达水平上调,血管内皮细胞脂质过氧化程度降低,表明GPX4通过抑制铁死亡减轻AS的损伤[22]。另有研究发现在ApoE-/-小鼠中过表达GPX4可通过抑制小鼠动脉中的脂质过氧化来延缓AS的发展[23]。同样,在体外实验中,在人脐静脉内皮细胞(HUVECs)中过表达GPX4可以通过抑制氧化应激改善过氧化氢(H2O2)诱导的细胞死亡[24]。这些研究表明GPX4通过发挥抗氧化应激和抗脂质过氧化作用保护内皮,减轻AS的损伤。
平滑肌的增殖是AS的早期事件之一,ox-LDL会引发平滑肌过度增殖。通过逆转录病毒基因转移技术,在兔腹主动脉平滑肌细胞中过表达GPX4显著降低了ox-LDL诱导的平滑肌细胞的增殖[25]。这些结果揭示了GPX4在维持血管壁完整性和正常内皮细胞功能方面的抗氧化应激和抗脂质过氧化作用。综上所述,GPX4是血管内皮细胞中关键抗氧化因子,通过发挥抗氧化作用改善AS损伤,是治疗AS的潜在靶点。
3.2 GPX4与MI和再灌注MI是临床常见的高危心血管疾病。定量蛋白质组学分析表明,左前降支结扎后可诱导心肌细胞GPX4蛋白水平下降,并在早期诱发脂质过氧化物累积,这种脂质累积可被Fer-1抑制[26],证明在MI过程中GPX4表达的降低引发了铁死亡,诱发了心肌损伤。
目前,对MI的主要治疗方法是尽快恢复缺血心肌的血液灌流,称为再灌注(I/R)。然而,I/R的过程中,缺血心肌会通过氧化产生自由基,对心脏组织造成进一步的损伤,包括氧化应激、炎症等,因此,减少I/R对心肌细胞的损伤对MI的治疗和预后至关重要。最近有研究发现,在大鼠I/R模型中,GPX4水平随着I/R时间的延长而下降,同时伴随着铁依赖性脂质过氧化水平的升高,在再灌注期发生了由GPX4表达下降引发的铁死亡[27]。在小鼠心脏I/R模型中,在再灌流开始时给予铁死亡抑制剂(Lip-1),可以缩小缺血梗死范围,改善线粒体结构和功能,并通过增加GPX4的表达和抑制线粒体蛋白VDAC1的表达来保护心脏[28]。在细胞中过表达线粒体GPX4通过降低线粒体脂质过氧化水平改善I/R后的心脏收缩功能[29]。以上结果表明GPX4通过抑制脂质过氧化和铁死亡抑制了心脏中I/R损伤的进展,GPX4可作为预防I/R损伤的潜在治疗靶点。
3.3 GPX4与其他心肌病阿霉素(DOX)是一种广泛用于化疗的药物,由于其会引发心力衰竭,极大的限制了DOX的应用[30]。最近的研究表明,在DOX诱导的心肌损伤小鼠中,GPX4的表达减少,小鼠左心室射血分数降低,出现纤维化和细胞凋亡,并伴有线粒体中脂质过氧化物的积累,在细胞中过表达线粒体GPX4逆转了上述损伤,这表明铁死亡参与了DOX诱导的心肌损伤,GPX4可以作为该损伤的潜在治疗靶点。
心肌三酰甘油蓄积、临床前心肌脂毒性损害和舒张期功能障碍被认为是代谢性心肌病的特征,在高脂饮食诱导的肥胖模型小鼠中,GPX4缺乏会加剧心脏结构重塑和纤维化,同样的在高脂高糖饮食小鼠中敲除GPX4后,线粒体脂质过氧化加重,引发铁死亡,从而引发心肌肥厚的加重[31]。相反,在线粒体中过表达GPX4可以保护心脏免受链脲佐菌素诱导的损伤[32]。上述研究表明代谢性心肌病发展过程中有铁死亡参与,线粒体GPX4是改善代谢性心肌病的可能靶点。
4 中药通过GPX4相关通路对心血管疾病的调控中医在多种疾病中发挥了治疗作用,中药作为天然瑰宝,具有多种活性成分,无论是复方还是单味药提取物,均体现了中药多靶点、多环节的作用特征,本部分对相关中药调控GPX4治疗心血管疾病做总结,以期为临床用药做参考。
4.1 复方二陈汤出自于《太平惠民和剂局方》是燥湿化痰基础用方。桃红四物汤,又称加味四物汤,始见于《医宗金鉴》具有养血活血,化瘀生新之功效,多用于血虚血瘀之证。药理研究表明其具有保护血管内皮、扩血管、抗炎、调节免疫、降脂等作用。两方合用,健脾燥湿以化痰,养血活血以化瘀,与AS痰瘀互结证的治疗原则较为一致。二陈汤合桃红四物汤可以增加ApoE-/-小鼠中SLC7A11的表达,增加GPX4的底物,上调GPX4表达,发挥其抗铁死亡作用改善AS损伤[33]。
鹿红方由鹿角、红花、山萸肉、补骨脂等组成,现代药理研究表明其对心肌缺血再灌注有改善作用,可以提高大鼠血清中GSH含量[34],在心肌I/R大鼠中给予鹿红方后,心脏梗死面积下降,氧化应激下降,增加了心肌中SLC7A11的表达,增加了GSH含量和GPX4的表达,通过上调GPX4的活性抑制氧化应激和铁死亡发挥对心肌缺血再灌注损伤的保护作用[35]。
通心络胶囊是临床常用于治疗心血管和脑血管疾病的中成药[36],由12种具有血管活性的中药组成,具有抑制内皮炎症和氧化应激,保护心、脑微血管内皮细胞的作用[37]。研究表明,在小鼠慢性阻塞性肺病合并AS模型中,通心络抑制了AS斑块的形成,增加了GPX4的表达以及GSH的含量,减轻了脂质过氧化程度,抑制铁死亡,在保护血管内皮方面发挥改善AS损伤的作用[38]。
葛根芩连汤是《伤寒论》中经典方,属清热利湿汤剂,糖尿病在中医属于湿热证的范畴,在Ⅱ型糖尿病小鼠中给予葛根芩连汤后,小鼠左心室舒张功能改善,通过升高GPX4表达抑制脂质过氧化,抑制铁死亡对糖尿病小鼠心脏的损伤[39]。
参麦注射液是由人参和麦冬成方的参麦饮改良制成的中成药,可以减轻心肌MI/RI。在大鼠心肌缺血I/R模型中参麦注射液显著升高了Nrf2蛋白的表达,启动下游GPX4蛋白的表达,发挥GPX4蛋白抗氧化应激,修复脂膜损伤的作用,抑制脂质过氧化和铁死亡,发挥对心肌的保护作用[40]。
4.2 中药单体 4.2.1 黄酮类黄酮类化合物是中药中含量较为丰富的化合物,具有抗氧化、抗炎等活性,对心血管疾病有改善作用。葛根素是最丰富的植物雌激素之一,具有抗氧化等特性[41]。在大鼠主动脉缩窄诱发HF的模型及体外Erastin或异丙肾上腺素处理的H9C2细胞中,葛根素可通过上调GPX4和铁蛋白重链(FTH1)的表达,抑制脂质过氧化和铁超载,有效抑制HF中由铁死亡引发的心肌细胞死亡,改善心功能[42]。
银杏常用于止咳平喘,具有抗氧化、改善循环障碍、抗炎等作用。银杏花乙酸乙酯提取物具有抑制铁死亡的活性,其主要活性化合物是木犀草素。在Erastin诱导的HUVECs铁死亡模型中,木犀草素增加了GPX4的表达,同时抑制与脂质过氧化相关的蛋白ACSL4的表达,发挥了抗铁死亡作用,保护了内皮细胞[43]。
柚皮苷是一种富含多种生物活性的黄酮类化合物,可用于预防AS、高血压、心律失常等心血管疾病[44]。有研究表明柚皮素可以通过抑制铁死亡改善I/R后的心肌损伤。在大鼠心脏I/R模型中,柚皮素显著降低了心肌梗死面积和心肌损伤,降低了心肌氧化应激和亚铁离子(Fe2+)水平,同时升高了GPX4、SLC711、Nrf2的表达,表明柚皮苷通过调节GPX4相关抗氧化系统抑制铁死亡,发挥其对I/R后心肌损伤的保护作用[45]。
黄腐酚是一种异戊烯基黄酮类化合物,具有抗炎、抗氧化等多种药理活性。在RSL3处理的H9C2细胞和大鼠心肌缺血再灌注模型中,通过增加Nrf2水平上调GPX4蛋白表达,降低了脂质过氧化水平,抑制了铁死亡,发挥对心脏的保护作用[46]。
4.2.2 三萜皂苷类柴胡皂苷A是柴胡根中分离得到的三萜皂苷,具有多种药理作用,如抗炎、抗氧化,在过氧化氢(H2O2)诱导的HUVECs损伤模型中,观察到柴胡皂苷A通过激活GPX4,抑制ACSL4以降低细胞内脂质过氧化水平抑制铁死亡[47]。
黄芪甲苷是黄芪的主要活性成分,已有证据表明其在心血管疾病中有积极作用[48]。黄芪甲苷可以通过抗铁死亡作用改善DOX诱导的心肌损伤。在DOX诱导的HF模型中出现了心肌纤维化和心功能不全,并伴有炎症因子增加和铁死亡的发生,黄芪甲苷通过增强Nrf2信号传导上调GPX4抑制氧化应激,抑制铁死亡,发挥对心脏的保护的作用[49]。
龙牙楤木总皂苷具有抗心肌I/R损伤的作用,龙牙楤木总皂苷的主要成分楤木皂苷A在AC16细胞缺氧/复氧模型中,通过糖皮质激素受体(GR)NR3C1/p53/SLC7A11轴,增加GPX4表达量,降低细胞氧化应激水平,改善缺氧诱导的损伤[50]。
4.2.3 多酚类研究表明白藜芦醇通过改善氧化应激、细胞凋亡和自噬、ER应激等参与对心肌保护作用[51]。研究表明白藜芦醇通过改善氧化应激、细胞凋亡和自噬、ER应激等参与对心肌保护作用[52]。有研究发现,在糖氧剥夺H9C2细胞模型及大鼠I/R模型[53]中,白藜芦醇均显著提高GPX4和FTH1的水平,降低铁依赖性的ROS水平,发挥GPX4抗氧化作用,抑制铁死亡,从而改善I/R损伤。
4.2.4 环烯醚萜苷类栀子苷是栀子中的主要活性成分,具有天然抗氧化和心脏保护作用,栀子苷通过激活RNA结合蛋白Grsf1,在翻译水平上直接上调GPX4,发挥抑制脂质过氧化,氧化应激和铁死亡的作用,改善了心肌梗死大鼠自内脏的脂质过氧化损伤[54]。首次证明在氧化应激微环境中,铁死亡在缺血心肌损伤中起着关键作用。
5 总结与展望文章对GPX4的功能以及其对心血管疾病中作用进行阐述,同时对近年来通过GPX4相关抗氧化系统改善心血管疾病的中药进行整理,发现GPX4在缺血再灌注损伤和AS等心血管疾病中具有重要作用,由于GPX4是抗氧化系统的关键调控因子,具有抑制铁死亡、氧化应激和脂质过氧化的作用,提示其可作为由氧化应激引起的心血管疾病的潜在治疗靶点。
中药及复方具有多靶点,整体作用的优势,但目前针对GPX4的中药复方研究较少,且组方药物间相互作用的阐释不够清晰,发挥活性的成分尚不明确,因此中药复方与GPX4靶向关系有待挖掘。中药调控GPX4改善心血管疾病的研究主要集中在中药提取物上,从结构上进行总结,发现中药提取物的结构类型以黄酮和三萜皂苷类为主,与这两类化合物的抗氧化活性相合;从机制上进行总结,发现中药提取物对GPX4的调控多是通过对其上游Nrf2和SLC7A11的影响间接实现,而靶向GPX4蛋白的研究较少,仅针对蛋白表达的上调这一结果,针对蛋白的转录、翻译、活化等过程的研究较少。因此,中药提取物与药理作用间的构效关系需要进一步总结,同时亟待构建GPX4活性筛选药物平台,筛选调控GPX4活性的天然小分子化合物对抑制细胞氧化应激与铁死亡,改善氧化损伤引起的AS等心血管疾病具有重要意义。
| [1] |
秦奎. 中国心脑血管疾病监测现状与发展[J]. 应用预防医学, 2020, 26(3): 265-268. QIN K. Current status and development of cardiovascular and cerebrovascular disease surveillance in China[J]. Applied Preventive Medi- cine, 2020, 26(3): 265-268. |
| [2] |
READ S H, WILD S H. Prevention of premature cardiovascular death worldwide[J]. Lancet (London, England), 2020, 395(10226): 758-760. DOI:10.1016/S0140-6736(19)32034-3 |
| [3] |
IMAI H, MATSUOKA M, KUMAGAI T, et al. Lipid peroxidation-dependent cell death regulated by GPx4 and ferroptosis[J]. Curr Top Microbiol Immunol, 2017, 403: 143-70. |
| [4] |
YANG W S, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1/2): 317-331. |
| [5] |
KELNER M J. Structural organization of the human selenium-dependent phospholipid hydroperoxide glutathione peroxidase gene (GPX4): Chromosomal localization to 19p13.3[J]. Biochemical and Biophysical Research Communications, 1998, 249(1): 53-55. DOI:10.1006/bbrc.1998.9086 |
| [6] |
BRIGELIUS-FLOHÉ R, et al. Glutathione peroxidases[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(5): 3289-3303. DOI:10.1016/j.bbagen.2012.11.020 |
| [7] |
HIRSCHHORN T, et al. The development of the concept of ferroptosis[J]. Free Radical Biology and Medicine, 2019, 133: 130-143. DOI:10.1016/j.freeradbiomed.2018.09.043 |
| [8] |
ALIM I, et al. Selenium drives a transcriptional adaptive program to block ferroptosis and treat stroke[J]. Cell, 2019, 177(5): 1262-1279.e25. DOI:10.1016/j.cell.2019.03.032 |
| [9] |
ZHANG Y L, SWANDA R V, NIE L T, et al. mTORC1 couples cyst(e)ine availability with GPX4 protein synthesis and ferroptosis regulation[J]. Nature Communications, 2021, 12: 1589. DOI:10.1038/s41467-021-21841-w |
| [10] |
YAN H F, TUO Q Z, YIN Q Z, et al. The pathological role of ferroptosis in ischemia/reperfusion-related injury[J]. Zoological Research, 2020, 41(3): 220-230. DOI:10.24272/j.issn.2095-8137.2020.042 |
| [11] |
STOCKWELL B R, FRIEDMANN ANGELI J P, BAYIR H, et al. Ferroptosis: a regulated cell death Nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [12] |
SATTLER W. Reduction of HDL-and LDL-associated cholestery- lester and phospholipid hydroperoxides by phospholipid hydroperoxide glutathione peroxidase and ebselen(PZ-51)[J]. Archives of Biochemistry and Biophysics, 1994, 309(2): 214-221. DOI:10.1006/abbi.1994.1105 |
| [13] |
NOMURA K, et al. Mitochondrial phospholipid hydroperoxide glutathione peroxidase suppresses apoptosis mediated by a mitochondrial death pathway[J]. Journal of Biological Chemistry, 1999, 274(41): 29294-29302. DOI:10.1074/jbc.274.41.29294 |
| [14] |
LIANG H Y, et al. Gpx4 protects mitochondrial ATP generation against oxidative damage[J]. Biochemical and Biophysical Research Communications, 2007, 356(4): 893-898. DOI:10.1016/j.bbrc.2007.03.045 |
| [15] |
RAN Q T Ⅱ, et al. Transgenic mice overexpressing glutathione peroxidase 4 are protected against oxidative stress-induced apoptosis[J]. Journal of Biological Chemistry, 2004, 279(53): 55137-55146. DOI:10.1074/jbc.M410387200 |
| [16] |
COLE-EZEA P, et al. Glutathione peroxidase 4 has a major role in protecting mitochondria from oxidative damage and maintaining oxidative phosphorylation complexes in gut epithelial cells[J]. Free Radical Biology and Medicine, 2012, 53(3): 488-497. DOI:10.1016/j.freeradbiomed.2012.05.029 |
| [17] |
MATSUSHITA M, FREIGANG S, SCHNEIDER C, et al. T cell lipid peroxidation induces ferroptosis and prevents immunity to infection[J]. The Journal of Experimental Medicine, 2015, 212(4): 555-568. DOI:10.1084/jem.20140857 |
| [18] |
KUANG F, LIU J, TANG D, et al. Oxidative damage and antioxidant defense in ferroptosis[J]. Frontiers in Cell and Developmental Biology, 2020, 8: 586578. DOI:10.3389/fcell.2020.586578 |
| [19] |
XIE Y C. Identification of baicalein as a ferroptosis inhibitor by natural product library screening[J]. Biochemical and Biophysical Research Communications, 2016, 473(4): 775-780. DOI:10.1016/j.bbrc.2016.03.052 |
| [20] |
SASAKI H. Electrophile response element-mediated induction of the cystine/glutamate exchange transporter gene expression[J]. Journal of Biological Chemistry, 2002, 277(47): 44765-44771. DOI:10.1074/jbc.M208704200 |
| [21] |
XIAO F J. miRNA-17-92 protects endothelial cells from erastin-induced ferroptosis through targeting the A20-ACSL4 axis[J]. Biochemical and Biophysical Research Communications, 2019, 515(3): 448-454. DOI:10.1016/j.bbrc.2019.05.147 |
| [22] |
BAI T, LI M X, LIU Y F, et al. Inhibition of ferroptosis alleviates atherosclerosis through attenuating lipid peroxidation and endothelial dysfunction in mouse aortic endothelial cell[J]. Free Radical Biology & Medicine, 2020, 160: 92-102. |
| [23] |
GUO Z M. Suppression of atherogenesis by overexpression of glutathione peroxidase-4 in apolipoprotein E-deficient mice[J]. Free Radical Biology and Medicine, 2008, 44(3): 343-352. DOI:10.1016/j.freeradbiomed.2007.09.009 |
| [24] |
SNEDDON A A. Regulation of selenoprotein GPx4 expression and activity in human endothelial cells by fatty acids, cytokines and antioxidants[J]. Atherosclerosis, 2003, 171(1): 57-65. DOI:10.1016/j.atherosclerosis.2003.08.008 |
| [25] |
BRIGELIUS-FLOHÉ R. Overexpression of PHGPx inhibits hydroperoxide-induced oxidation, NFκB activation and apoptosis and affects oxLDL-mediated proliferation of rabbit aortic smooth muscle cells[J]. Atherosclerosis, 2000, 152(2): 307-316. DOI:10.1016/S0021-9150(99)00486-4 |
| [26] |
PARK T J, PARK J H, LEE G S, et al. Quantitative proteomic analyses reveal that GPX4 downregulation during myocardial infarction contributes to ferroptosis in cardiomyocytes[J]. Cell Death & Disease, 2019, 10: 835. |
| [27] |
TANG L J, LUO X J, TU H, et al. Ferroptosis occurs in phase of reperfusion but not ischemia in rat heart following ischemia or ischemia/reperfusion[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2021, 394(2): 401-410. DOI:10.1007/s00210-020-01932-z |
| [28] |
FENG Y S, et al. Liproxstatin-1 protects the mouse myocardium against ischemia/reperfusion injury by decreasing VDAC1 levels and restoring GPX4 levels[J]. Biochemical and Biophysical Research Communications, 2019, 520(3): 606-611. DOI:10.1016/j.bbrc.2019.10.006 |
| [29] |
DABKOWSKI E R, et al. Mitochondria-specific transgenic overexpression of phospholipid hydroperoxide glutathione peroxidase (GPx4) attenuates ischemia/reperfusion-associated cardiac dysfunction[J]. Free Radical Biology and Medicine, 2008, 45(6): 855-865. DOI:10.1016/j.freeradbiomed.2008.06.021 |
| [30] |
ZHANG S, LIU X B, BAWA-KHALFE T, et al. Identification of the molecular basis of doxorubicin-induced cardiotoxicity[J]. Nature Medicine, 2012, 18(11): 1639-1642. DOI:10.1038/nm.2919 |
| [31] |
KATUNGA L A, GUDIMELLA P, EFIRD J T, et al. Obesity in a model of gpx4 haploinsufficiency uncovers a causal role for lipid-derived aldehydes in human metabolic disease and cardiomyopathy[J]. Molecular Metabolism, 2015, 4(6): 493-506. DOI:10.1016/j.molmet.2015.04.001 |
| [32] |
BASELER W A, DABKOWSKI E R, JAGANNATHAN R, et al. Reversal of mitochondrial proteomic loss in Type 1 diabetic heart with overexpression of phospholipid hydroperoxide glutathione peroxidase[J]. American Journal of Physiology Regulatory, Integrative and Comparative Physiology, 2013, 304(7): R553-R565. DOI:10.1152/ajpregu.00249.2012 |
| [33] |
何信用. 二陈汤合桃红四物汤调控p53/SLC7A11介导的氧化损伤及铁死亡抗AS的机制研究[D]. 沈阳: 辽宁中医药大学, 2021. HE X Y. Effects and mechanism of Erchen Decoction and Taohong Siwu Decoction on the regulation of p53/SLC7A11 mediated oxidative damage and ferroptpsis on atherosclerosis[D]. Shenyang: Liaoning University of Traditional Chinese Medicine, 2021. |
| [34] |
杨晓利, 瞿惠燕, 戎靖枫, 等. 基于TGF-β1/Smads通路的鹿红方对心肌梗死后心力衰竭大鼠心肌纤维化的影响[J]. 中国中医药信息杂志, 2021, 28(9): 92-98. YANG X L, QU H Y, RONG J F, et al. Effects of Luhong prescription on myocardial fibrosis in rats with heart failure after myocardial infarction based on TGF-β1/smads pathway[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2021, 28(9): 92-98. |
| [35] |
蔡婉, 周华, 徐基杰, 等. 鹿红方通过SLC7A11/GPX4信号通路减轻心肌缺血再灌注损伤的机制研究[J]. 上海中医药大学学报, 2022, 36(S1): 137-142. CAI W, ZHOU H, XU J J, et al. Study on mechanism of Luhong Formula reducing myocardial ischemia-reperfusion injury through SLC7A11/GPx4 signal pathway[J]. Academic Journal of Shanghai University of Traditional Chinese Medicine, 2022, 36(S1): 137-142. |
| [36] |
CHENG X, HOU Z J, SUN J B, et al. Protective effects of Tongxinluo on cerebral ischemia/reperfusion injury related to Connexin 43/Calpain Ⅱ/Bax/Caspase-3 pathway in rat[J]. Journal of Ethnopharmacology, 2017, 198: 148-157. DOI:10.1016/j.jep.2017.01.004 |
| [37] |
LIU S, WEI C, KANG N, et al. Chinese medicine Tongxinluo capsule alleviates cerebral microcirculatory disturbances in ischemic stroke by modulating vascular endothelial function and inhibiting leukocyte-endothelial cell interactions in mice: A two-photon laser scanning microscopy study[J]. Microcirculation (New York, N Y: 1994), 2018, 25(2). |
| [38] |
WANG Y F, KUANG X N, YIN Y J, et al. Tongxinluo prevents chronic obstructive pulmonary disease complicated with atherosclerosis by inhibiting ferroptosis and protecting against pulmonary microvascular barrier dysfunction[J]. Biomedecine & Pharmacotherapie, 2022, 145: 112367. |
| [39] |
余洁英, 林育浩, 周凤华, 等. 葛根芩连汤对糖尿病湿热型小鼠心脏舒张功能的影响[J]. 中国中药杂志, 2022, 47(10): 2705-2711. YU J Y, LIN Y H, ZHOU F H, et al. Effect of Gegen Qinlian Decoction on cardiac diastolic function of diabetic mice with damp-heat syndrome[J]. China Journal of Chinese Materia Medica, 2022, 47(10): 2705-2711. |
| [40] |
梅胜兰, 夏中元, 吴晓静, 等. Nrf2-Gpx4信号通路在参麦注射液减轻大鼠心肌缺血再灌注损伤中的作用: 与铁死亡的关系[J]. 中华麻醉学杂志, 2019, 39(11): 1395-1398. MEI S L, XIA Z Y, WU X J, et al. Role of NrF2-gpX4 signaling pathway in Shenmai injection alleviating myocardial ischemia-reperfusion injury in rats: relationship with iron death[J]. Chin J Anesthesiology, 2019, 39(11): 1395-1398. |
| [41] |
ZHOU Y X, ZHANG H, PENG C. Puerarin: A review of pharmacological effects[J]. Phytotherapy Research, 2014, 28(7): 961-975. DOI:10.1002/ptr.5083 |
| [42] |
LIU B, ZHAO C X, LI H K, et al. Puerarin protects against heart failure induced by pressure overload through mitigation of ferroptosis[J]. Biochemical and Biophysical Research Communications, 2018, 497(1): 233-240. DOI:10.1016/j.bbrc.2018.02.061 |
| [43] |
李敏, 张丹, 张林, 等. 银杏花化学成分对血管内皮细胞铁死亡的抑制作用[J]. 国际药学研究杂志, 2020, 47(10): 857-862. LI M, ZHANG D, ZHANG L, et al. The inhibitory effect of chemical components from Ginkgo biloba flower on ferroptosis in vascular endothelial cells[J]. Journal of International Pharmaceutical Research, 2020, 47(10): 857-862. |
| [44] |
SALEHI B, FOKOU P V T, SHARIFI-RAD M, et al. The therapeutic potential of naringenin: a review of clinical trials[J]. Pharmaceuticals (Basel, Switzerland), 2019, 12(1): 11. DOI:10.3390/ph12010011 |
| [45] |
XU S J, WU B X, ZHONG B Y, et al. Naringenin alleviates myocardial ischemia/reperfusion injury by regulating the nuclear factor-erythroid factor 2-related factor 2 (Nrf2)/System xc-/glutathione peroxidase 4(GPX4) axis to inhibit ferroptosis[J]. Bioengineered, 2021, 12(2): 10924-10934. DOI:10.1080/21655979.2021.1995994 |
| [46] |
LIN J H, YANG K T, LEE W S, et al. Xanthohumol protects the rat myocardium against ischemia/reperfusion injury-induced ferroptosis[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 9523491. |
| [47] |
黄紫霞, 吴明月, 许峰, 等. 柴胡皂苷A通过抑制氧化应激和铁死亡减轻过氧化氢诱导的人脐静脉内皮细胞损伤[J]. 中国动脉硬化杂志, 2022, 30(1): 43-48. HUANG Z X, WU M Y, XU F, et al. Saikosaponin A inhibits oxidative stress and ferroptosis and reduces the injury of human umbilical vein endothelial cells induced by hydrogen peroxide[J]. Chinese Journal of Arteriosclerosis, 2022, 30(1): 43-48. |
| [48] |
NIE P, MENG F J, ZHANG J G, et al. Astragaloside IV exerts a myocardial protective effect against cardiac hypertrophy in rats, partially via activating the Nrf2/HO-1 signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 4625912. |
| [49] |
LUO L F, GUAN P, QIN L Y, et al. Astragaloside IV inhibits adriamycin-induced cardiac ferroptosis by enhancing Nrf2 signaling[J]. Molecular and Cellular Biochemistry, 2021, 476(7): 2603-2611. DOI:10.1007/s11010-021-04112-6 |
| [50] |
梁芳, 鲁卫星, 周天琪, 等. 基于NR3C1/p53/SLC7A11通路探讨龙牙楤木总皂苷及其成分楤木皂苷A对缺氧/复氧诱导的心肌细胞铁死亡的影响[J]. 中国中医药信息杂志, 2022, 29(5): 63-68. LIANG F, LU W X, ZHOU T Q, et al. Effects of aralosides and its component araloside A on hypoxia/reoxygenation induced ferroptosis of myocardial cells based on NR3C1/p53/SLC7A11 pathway[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2022, 29(5): 63-68. |
| [51] |
PASTOR R F, RESTANI P, DI LORENZO C, et al. Resveratrol, human health and winemaking perspectives[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(8): 1237-1255. |
| [52] |
HE Y F, FU Y, XI M Y, et al. Zn2+ and mPTP mediate resveratrol-induced myocardial protection from endoplasmic Reticulum stress[J]. Metallomics: Integrated Biometal Science, 2020, 12(2): 290-300. |
| [53] |
LI T, TAN Y, OUYANG S, et al. Resveratrol protects against myocardial ischemia-reperfusion injury via attenuating ferroptosis[J]. Gene, 2022, 808: 145968. |
| [54] |
SHEN Y H, WANG X D, SHEN X Y, et al. Geniposide possesses the protective effect on myocardial injury by inhibiting oxidative stress and ferroptosis via activation of the Grsf1/GPx4 axis[J]. Frontiers in Pharmacology, 2022, 13: 879870. |
2. State Key Laboratory of Component-Based Chinese Medicine, Ministry of Education, Tianjin 301617, China;
3. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40