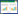文章信息
- 闫理想, 姜静, 杨向东, 何敬, 杨曦, 陈海静, 李德冠, 史哲新
- YAN Lixiang, JIANG Jing, YANG Xiangdong, HE Jin, YANG Xi, CHEN Haijing, LI Deguan, SHI Zhexin
- 微残清颗粒逆转复发/难治性急性髓系白血病(非APL)耐药的临床观察
- Clinical observation of Weicanqing Granule reversed multidrug resistance in relapse/refractory acute myeloid leukemia (non-acute promyelocytic leukemia)
- 天津中医药, 2023, 40(3): 273-280
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(3): 273-280
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.03.01
-
文章历史
- 收稿日期: 2022-12-10
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津市中医药研究院附属医院消化二科, 天津 300120;
4. 中国医学科学院放射医学研究所, 天津 300193
复发/难治性急性髓系白血病(R/R AML)以对化疗反应程度差、缓解率低、复发率高、生存期短为生物学特征[1],因而是急性白血病临床治疗中的难题,其化疗失败及复发难治的主要原因是多药耐药(MDR)[2]。研究发现,MDR最经典的机制是白血病多药耐药基因1(MDR1)的激活,其mRNA编码的P-糖蛋白(P-gp)可以利用水解腺嘌呤核苷三磷酸(ATP)的能量将化疗药物从细胞内转运到细胞外,从而降低药物的杀伤作用[3]。因此,抑制P-gp的药物泵作用成为逆转白血病MDR现象并改善患者预后的关键机制之一。
随着现代研究的深入,中医药在治疗白血病中的作用逐渐被认识。白血病在中医古籍中并无记载,但依据多年的临床经验及同行专家共识,认为其病机是正气虚损,内邪滋生,邪毒内侵而致病,其治疗以扶正解毒为原则。基于白血病复发耐药发病机制及治疗原则,天津中医药大学第一附属医院血液科在经典方剂当归补血汤、四君子汤及青黄散的基础上,并结合多年临床实践总结出的有效方剂微残清颗粒(益气养阴解毒方,黄芪30 g,当归15 g,全蝎9 g,青黛9 g,雄黄0.3 g,人参10 g,茯苓15 g,白术15 g,甘草10 g)具有较好的临床疗效,并列入本院协议方应用临床,因此,为进一步提高临床疗效及探讨其逆转R/R AML耐药的机制,本研究采用微残清颗粒联合化疗的方案观察了72例R/R AML患者的临床疗效,并对患者骨髓细胞进行了MDR1 mRNA、P-gp、细胞周期的检测。
1 资料与方法 1.1 病例资料72例患者为2018年5月—2020年4月在天津中医药大学第一附属医院血液科住院治疗的R/R AML患者。采用随机数字表法随机分为治疗组(微残清颗粒+常规化疗)和对照组(单用常规化疗)。根据纳入和排除标准,筛选了72例患者进行统计分析,其中治疗组39例,对照组33例。两组在年龄、性别、疾病类型、预后评分、基础疾病和病程方面差异无统计学意义(P > 0.05),见表 1。本研究符合赫尔辛基宣言且通过天津中医药大学第一附属医院伦理委员会审批。
纳入标准:1)符合急性髓性白血病(AML)和R/R AML的诊断标准[4-5]。2)18岁以上。3)完成至少1个常规化疗周期和(或)联合口服微残清颗粒3个月。4)治疗前1个月内及治疗期间,患者未使用其他可能影响疗效评价的治疗方案。5)定期随访和电话随访。6)自愿试验并签署知情同意书。排除标准:1)患有严重疾病,如心、脑、肝、肾疾病。2)精神系统疾病。3)怀孕或哺乳妇女。4)已知对处方中的某些草药过敏。5)急性早幼粒细胞白血病(APL)患者。退出或终止标准:1)如果发现患者不符合临床试验的纳入标准,应立即退出。2)患者依从性差、未按要求服药或无法收集数据和样本。3)试验中发现的严重不良反应或并发症不适合继续参加试验。4)如果患者病情恶化,临床确定需要其他治疗方案,则应立即终止临床试验。随访时间:从入组开始随访24个月,记录患者生存情况。
1.3 治疗方案72例符合纳入和排除标准的患者随机分为治疗组(微残清颗粒+常规化疗)和对照组(单用常规化疗),两组均采用常规化疗和对症治疗,包括抗感染、控制恶心呕吐、碱化水化、输注悬浮红细胞和血小板等。
常规化疗方案根据《中国复发/难治性急性髓细胞白血病诊断和治疗指南》(2017),两组患者均接受以下常规化疗:一般情况良好且耐受性良好的患者选择以下强化疗方案。1)大剂量Ara-C(如果以前未使用)加或不加蒽环类药物:Ara-C 1~3 g/m2,Q 12 h,第1、3、5天;柔红霉素(DNR)45 mg/m2或IDA 10 mg/m2,在第2、4、6天,或米托蒽醌10~12 mg/m2或足叶乙苷(VP16)100 mg/m2,第1~7天。或Ara-C 3 g/m2,每12 h 1次,第1~3天。2)CAG方案:G-CSF 150 μG/m2,每12 h 1次,0~14 d;阿克拉霉素(Acla)20 mg/d,第1~4天;阿糖胞苷20 mg/m2,皮下注射2次,第1~14天。3)HAA(或HAD)方案:高三尖杉酯碱(HHT)2 mg/m2,第1~7天(或HHT 4 mg/m2,分2次给药,第1~3天);Ara-C 100~200 mg/m2,第1~7天;ACLA 20 mg/d,第1~7天(或DNR 40 mg/m2,第1~7天)。4)低剂量阿糖胞苷:阿糖胞苷10 mg/m2,皮下注射,每12 h 1次,第1~14天。对于耐受性差的患者,可选择以下非强化化疗方案。1)去甲基化药物:地西他滨20 mg/m2,1~5 d,28 d为1个周期。氮胞苷75 mg/m2,1~7 d,28 d为1个周期。2)FLT3突变患者使用去甲基化药物(氮胞苷或地西他滨)联合索拉非尼治疗。
同时,在化疗当天治疗组患者加用微残清颗粒口服,早晚各1袋,至少应用微残清颗粒达到3个月或(和)完成1个化疗周期。微残清颗粒由以下中药组成:黄芪30 g,当归15 g,全蝎9 g,青黛9 g,雄黄0.3 g,人参10 g,茯苓15 g,白术15 g,甘草10 g,以上药物均由天津中医药大学第一附属医院中药制剂实验室采用单药颗粒制备技术制备而成,每剂2袋,无菌干燥后密封于塑封袋中备用。
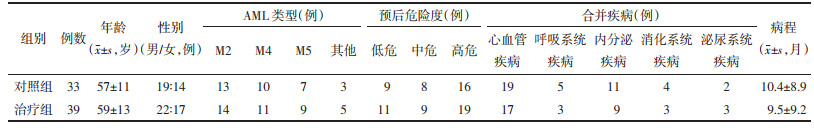
1.4 观测指标及评价方法治疗前为入组时或化疗前采集数据及标本,治疗后为至少应用微残清颗粒达到3个月或(和)完成1个化疗周期时采集数据及标本。1)血常规、骨髓原始细胞比例:收集患者治疗前后的血常规数据[白细胞计数(WBC)、血红蛋白(HGB)、血小板计数(PLT)]和骨髓细胞形态。2)微小残留病(MRD):由北京海斯特医学检验公司检测MRD,以CD45为设门,流式细胞术检测CD34+与CD117+细胞比例。3)WT1:WT1由北京海斯特医学检验公司检测,WT1的mRNA表达水平由Taqman探针荧光定量聚合酶链反应(PCR)检测。WT1表达水平以WT1/10 000 ABL表示。4)骨髓缓解率:根据《血液病诊断与疗效标准》(第4版)[6],观察各组的完全缓解(CR)、部分缓解(PR)、无效(NR)和有效率。5)总生存率(OS):从患者入组开始计算生存时间,并随访24个月。6)缓解时间(RT):治疗后统计骨髓缓解患者的复发率和缓解时间。7)骨髓细胞MDR1、P-gp和细胞周期:逆转录-聚合酶链反应(RT-PCR)检测治疗前后MDR1的mRNA表达,流式细胞术检测P-gp和细胞周期。8)不良反应:收集患者治疗后骨髓抑制、肝肾功能和感染等不良反应数据。
1.5 RT-PCR和流式细胞术分析 1.5.1 标本处理方法抽取治疗前后患者2 mL骨髓液,分别加入4 mL人淋巴细胞分离液,离心[1 400 r/min,离心半径8 cm(下同),20 min,室温]。将淋巴细胞层从离心管中移除并放置在1.5 mL微型离心管中,然后添加1 mL磷酸盐缓冲液(PBS),离心(1 000 r/min,5 min,室温),弃去上清液备用,用于RT-PCR、流式细胞术分析。
1.5.2 RT-PCR检测MDR1 mRNA使用Trizol extraction kit(Thermo Scientific Co.,Ltd.,USA)分离样本中总细胞RNA,并根据说明书Prime Script RT Master Mix kit(中国北京Cwbiotech Co.,Ltd.)反转录成cDNA。以β-actin为对照,使用SYBR premixed System(中国北京bioteke有限公司)进行RT-PCR检测。DNA反应体系如下:2×预混10 μL,上游引物0.4 μL,下游引物0.4 μL,模板cDNA 1 μL,无RNase水20 μL。反应条件:DNA在95 ℃变性10 min,然后在95 ℃变性40个周期15 s,在60 ℃变性1 min。MDR1基因的引物序列由上海生工科技有限公司合成,上游:5’-CCCATGCAATAGCAGAG-3’,下游:5’-GTTCAACTTCTGCTCCTGA-3’,157 bp;β-actin:上游:5’-TGACGGGTCACCACACACATGTGCCATCTA-3’,下游:5’-CTAGAGCATTGCGGTGGACGATGG-3’,495 bp。定义对照组治疗前的相对定量值为1,根据2-ΔΔCt方法计算各样本中MDR1的平均相对表达[7]。
1.5.3 流式细胞术检测P-gp、细胞周期各组标本取1×106细胞用100 μL PBS悬浮备检,分别加入10 μL FITC-P-gp(美国BD有限公司),混合后室温避光培养30 min。然后,添加1 mL PBS混匀后离心(1 500 r/min,5 min),弃上清液流式细胞仪(C6,BD Co.,Ltd.,USA)检测。另取1×106细胞用100 μL PBS悬浮备检,用2 mL 70%乙醇固定,-20 ℃冷却,RNase消化,4 ℃放置24 h,PBS洗涤2次,每管加入1 mL PI(50 μg/mL),流式细胞仪检测细胞周期。
1.6 统计学方法所有数据分析均使用SPSS 19.0统计软件进行。计量资料采用均数±标准差(x±s)表示,组内前后比较采用配对t检验,组间比较采用独立样本t检验,计数资料采用构成比或率表示,组间比较采用卡方检验。两组生存时间数据采用kaplan-Meier分析,并绘制生存曲线计算生存率。所有检验均为双侧检验,显著性水平为0.05。
2 结果 2.1 两组治疗前后血象和骨髓象的比较两组治疗前血象与骨髓象指标比较均无统计学差异(P > 0.05)。与治疗前比较,两组治疗后骨髓原始细胞(原始+幼稚)比例、外周血白细胞计数均明显改善(P < 0.05);与对照组比较,治疗组在治疗后外周血象和骨髓原始细胞均得到明显改善,差异有统计学意义(P < 0.05)。见表 2。
|
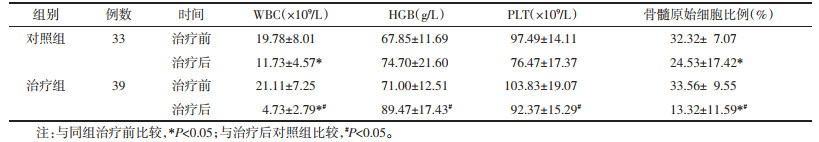
两组治疗前MRD、WT1水平无统计学差异。治疗后,两组MRD、WT1水平均较治疗前降低,但与对照组比较治疗组MRD、WT1水平降低较显著,差异具有统计学意义(P < 0.05)。见图 1。
|
| 注:组间比较,*P < 0.05。 图 1 两组治疗前后MRD和WT1的比较 Fig. 1 Comparison of MRD and WT1 between the two groups before and after treatment |
治疗后,治疗组骨髓缓解率为61.54%(24/39),对照组为36.36%(12/33),差异有统计学意义(P < 0.05)。见表 3。
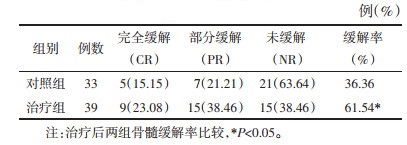
|
治疗后,12个月总生存率对照组为45.45%,治疗组为69.23%,差异有统计学意义(P < 0.05),24个月总生存率治疗组(40.05%)虽高于对照组(27.27%),但差异无统计学意义(P > 0.05)。见图 2。
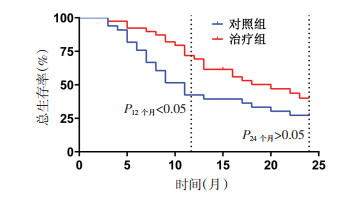
|
| 图 2 治疗后两组总生存率比较 Fig. 2 Comparison of total survival rate between the two groups after treatment |
对照组12例患者骨髓缓解,最长缓解时间21个月,最短缓解时间5个月,中位缓解时间8.5个月,平均缓解时间9.83个月。治疗组有24例患者病情缓解,最长缓解时间21个月,最短缓解时间2个月,中位缓解时间14个月,平均缓解时间13.63个月。两组之间的平均缓解时间差异有统计学意义(P < 0.05)。见图 3。
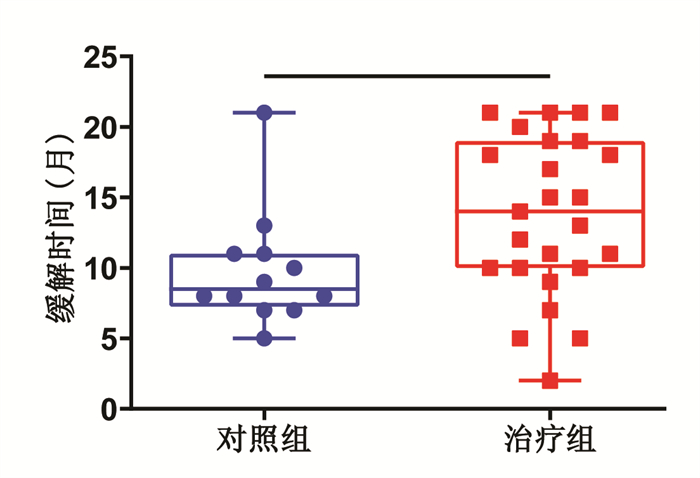
|
| 注:与对照组比较,*P < 0.05。 图 3 两组骨髓缓解患者缓解时间比较 Fig. 3 Comparison of remission time between two groups of patients with bone marrow remission |
两组治疗前P-gp表达无统计学差异(P > 0.05)。治疗后,治疗组的P-gp比例显著低于对照组(P < 0.05)。以治疗前对照组MDR1 mRNA为参照治疗前两组MDR1表达差异无统计学意义(P>0.05),治疗后对照组的MDR1表达显著增加,治疗组的MDR1表达显著降低(P < 0.05)。见图 4。
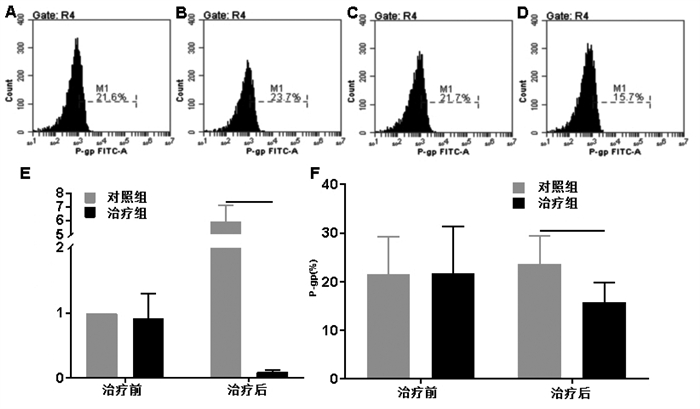
|
| 注:A.对照组治疗前流式图;B.对照组治疗后流式图;C.治疗组治疗前流式图;D.治疗组治疗后流式图;E.两组MDR1 mRNA表达比较;F:两组骨髓细胞P-gp表达比较;组间比较,*P < 0.05。 图 4 两组骨髓细胞P-gp和MDR1 mRNA的比较 Fig. 4 Comparison of P-gp and MDR1 mRNA in bone marrow cells of two groups |
两组治疗前骨髓细胞周期无统计学差异(P>0.05)。治疗后,治疗组细胞周期S期和G2/M期比例增加,G0期比例下降,与治疗前和对照组相比,差异有统计学意义(P < 0.05)。见图 5。
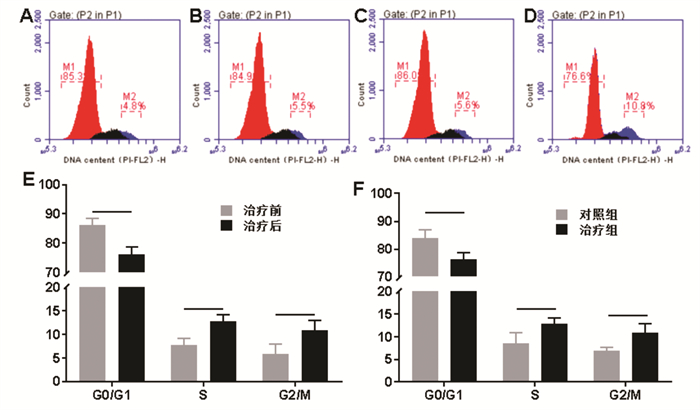
|
| 注:A.对照组治疗前流式图;B.对照组治疗后流式图;C.治疗组治疗前流式图;D.治疗组治疗后流式图;E.治疗组治疗前后细胞周期比较;F.治疗后,两组骨髓细胞周期比较。组间比较,*P < 0.05。 图 5 两组骨髓细胞周期比较 Fig. 5 Comparison of bone marrow cell cycle between the two groups |
两组均有骨髓抑制、胃肠道反应、肝肾功能不全、脱发等不良反应,对症治疗后改善,两组不良反应发生率无统计学差异。
3 讨论目前化疗是白血病的主要治疗方法,但复发率高。研究发现,白血病MDR是白血病复发和耐药的主要原因之一,也是急性白血病复发/难治的关键因素。白血病MDR是白血病细胞对多种化疗药物交叉耐药的现象,它不仅对一种化疗药物具有耐药性,而且对其他结构和作用机制完全不同的药物也具有耐药性[8-9]。研究证实,白血病MDR的发生与膜转运体ABC(ABCB1)的过度表达密切相关[10],这些蛋白质可以转运(或药物外流)化疗药物,导致血药浓度达不到化疗药物的有效浓度,这可能是产生耐药性的关键原因之一。目前研究发现ABC转运蛋白家族有48个成员,它们均与白血病化疗药物的转运和多药耐药性有关,其中ABCB1编码的P-gp[11]是白血病细胞多药耐药性的最典型代表。P-gp是一种跨膜糖蛋白,由多药耐药基因MDR编码,分子量为1.7×105道尔顿[12],可与化疗药物和疏水亲油性化合物(如生物碱和蒽环类化疗药物)结合。通过ATP水解的能量,P-gp可以逆转浓度梯度并将药物泵出细胞,导致耐药细胞中的药物浓度降低[13]。同时,白血病复发难治的另一个重要原因是一些残留细胞处于细胞静止状态,这大大降低了细胞周期性化疗药物的杀伤效果。研究证实,白血病患者的骨髓细胞G0期明显高于正常人骨髓细胞。因此,抑制过度表达的P-gp或诱导白血病细胞进入细胞周期都有助于降低白血病MDR的发生率,提高复发耐药白血病患者的临床疗效。
中医药在白血病的辅助化疗过程中发挥着重要作用,寻找低毒高效的中药多药耐药逆转剂已成为热点。白血病在中医古籍中并无记载,根据急性白血病的临床症状,本病可归为中医范畴的“积劳”“虚劳”“血证”等范畴,依据多年的临床经验及同行专家共识,认为其病机是:正气虚损,内邪滋生,邪毒内侵而致病[14]。基于白血病复发难治“髓虚邪伏,邪毒致变”的病机,治则当以益气养阴以扶正,解毒以祛邪,笔者团队根据这一中医病理变化提出益气养阴解毒法为治疗原则,经多年临床实践证实该治法在复发难治白血病的治疗中具有较好的临床效果。该治法选用经典方剂当归补血汤、四君子汤合青黄散加减共奏益气养阴解毒之功,方药选用黄芪、当归益气养血为君,全蝎、青黛、雄黄解毒攻毒为臣,人参、白术、茯苓、甘草益气健脾为佐使,全方攻补兼施,顾护正气,驱邪不伤正,扶正不留邪。该治法方药在临床应用20余年,先后以扶正解毒方[15]、扶正祛邪方[16]、益气养阴方[17]、微残清颗粒等命名进行临床治疗,近年因其确切疗效被列为院内协议方(微残清颗粒)推广应用。前期基础研究表明,益气养阴解毒法方药可以通过降低骨髓内活性氧(ROS)水平来改善骨髓微环境,促进骨髓损伤后的再修复[18],同时可以负调控白血病干细胞(LSC)中磷酸脂酶与张力蛋白同源物(PTEN)、哺乳动物雷帕霉素靶蛋白(mTOR)因子[19],下调LSC细胞核中MDR1、核因子-κB(NF-κB)的表达从而逆转LSC耐药[20-21];而其拆方中的全蝎提取物可抑制LSC在模拟Niche中的迁移率[22],具有下调LSC细胞膜上P-gp,细胞质乙醛脱氢酶(ALDH)、人磷脂酰肌醇三羟基激酶(PI3K)及细胞核中mTOR的表达水平,从而干预K562白血病干细胞的增殖和抗耐药[23]。
目前白血病的主要治疗策略为化疗药物、干细胞移植、单克隆抗体、分子靶向、免疫治疗及中医中药等,其中化疗药物是白血病治疗的主流。化疗药物治疗白血病缓解率高,但治愈率低。随着对白血病多药耐药研究的深入,更多研究认为白血病细胞多药耐药的根源是具有自我更新和增殖能力的白血病干细胞,多药耐药使LSC残留患者体内,从而使白血病复发难治。研究证实,95%LSC处于G0期不进入细胞周期,处于G0期休眠状态的LSC很少进行分裂增殖,因而常规细胞周期性化疗药物对LSC无效,尤其是对5-氟尿嘧啶、甲氨蝶呤和阿糖胞苷等抗代谢药不敏感[24]。临床上使用的标准化疗方案只对白血病细胞有杀伤作用,但对处于G0期的LSC却不起作用。使用大剂量的化疗,甚至应用致死剂量的造血干细胞移植预处理也难以完全杀灭处于休眠状态中的LSC。这些残留下来的LSC一旦受到适当刺激就可重新进入细胞分裂周期,增殖分化出新的白血病细胞,造成白血病的难治或复发。因此,如果能够消除LSC多药耐药,化疗药物是可以清除患者的LSC及白血病细胞,达到治愈白血病的目的。Guan等[25]经过短期无血清培养或培养中不含有Steel因子(SF),Fins样酪氨酸激酶3配体FL)和白介素-3(IL-3)等生长因子时,NOD/SCID鼠的AML起始细胞进入细胞活化状态,而同时来自于正常骨髓的G0期细胞依然处于静止状态。此研究结果表明某些细胞因子有可能使静止的LSC活化,对化疗药物产生敏感。而微残清颗粒具有益气养阴解毒的功效,属于补法,配伍药物其性多属“阳”具有活化、兴奋、促进等作用,其可能通过活化LSC,上调多药耐药负调节信号水平,增敏化疗药物作用靶点,消除LSC多药耐药,清除患者体内残留LSC,从而提高复发难治白血病的疗效,其作用机制有待进一步研究。
本研究表明,微残清颗粒能改善R/R AML患者的血象和骨髓象,降低MRD和WT1水平,延长缓解时间,提高骨髓缓解率和总生存率,对R/R AML患者有良好的临床疗效。进一步的研究表明,微残清颗粒可以降低MDR1、P-gp的表达,并诱导R/R AML患者骨髓白血病细胞进入细胞周期,从而提高化疗的敏感性。上述研究表明,微残清颗粒联合化疗可提高R/R AML患者的临床疗效,其机制可能与微残清颗粒降低MDR1编码P-gp蛋白的表达,诱导白血病细胞进入细胞周期,从而提高化疗药物的敏感性有关。虽然本研究初步表明微残清颗粒逆转白血病耐药性与细胞跨膜转运、细胞周期有关,但多药耐药涉及许多机制,如PI3K/NF-κB/RAS等信号转导途径和细胞因子、蛋白磷酸化、基因甲基化等,因此微残清颗粒逆转R/R AML耐药的机制仍需进一步研究。
| [1] |
GÖKBUGET N, KELSH M, CHIA V, et al. Blinatumomab vs historical standard therapy of adult relapsed/refractory acute lymphoblastic leukemia[J]. Blood Cancer Journal, 2016, 6(9): e473. DOI:10.1038/bcj.2016.84 |
| [2] |
JI Q, DING Y H, SUN Y, et al. Antineoplastic effects and mechanisms of micheliolide in acute myelogenous leukemia stem cells[J]. Oncotarget, 2016, 7(40): 65012-65023. DOI:10.18632/oncotarget.11342 |
| [3] |
DA L S, SOARES V L, JARDIM A S, et al. P-glycoprotein and multidrug resistance-associated protein-1 expression in acute myeloid leukemia: biological and prognosis implications[J]. International Journal of Laboratory Hematology, 2020, 42(5): 594-603. DOI:10.1111/ijlh.13241 |
| [4] |
中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J]. 中华血液学杂志, 2017, 38(3): 177-182. Leukemia and Lymphoma Group, Hematology Branch, Chinese Medical Association. Chinese guidelines for diagnosis and treatment of adult acute myeloid leukemia (not APL) (2017 edition)[J]. Chinese Journal of Hematology, 2017, 38(3): 177-182. |
| [5] |
中华医学会血液学分会白血病淋巴瘤学组. 复发难治性急性髓系白血病中国诊疗指南(2017年版)[J]. 中华血液学杂志, 2017, 38(3): 183-184. Leukemia and Lymphoma Group, Hematology Branch, Chinese Medical Association. The guidelines for diagnosis and treatment of acute myelogenous leukemia(relapse/refractory) in China (2017 edition)[J]. Chinese Journal of Hematology, 2017, 38(3): 183-184. |
| [6] |
沈悌, 赵永强. 血液病诊断及疗效标准[M]. 4版. 北京: 科学出版社, 2018. SHEN T, ZHAO Y Q. Blood disease diagnosis and curative effect standard[M]. 4th edition. Beijing: Science Press, 2018. |
| [7] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [8] |
TAKARA K, SAKAEDA T, OKUMURA K. An update on overcoming MDR1-mediated multidrug resistance in cancer chemotherapy[J]. Current Pharmaceutical Design, 2006, 12(3): 273-286. DOI:10.2174/138161206775201965 |
| [9] |
KRISHNA R, MAYER L D. Multidrug resistance(MDR) in cancer. Mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics of anticancer drugs[J]. European Journal of Pharmaceutical Sciences: Official Journal of the European Federation for Pharmaceutical Sciences, 2000, 11(4): 265-283. DOI:10.1016/S0928-0987(00)00114-7 |
| [10] |
WU C P, V AMBUDKAR S. The pharmacological impact of ATP-binding cassette drug transporters on vemurafenib-based therapy[J]. Acta Pharmaceutica Sinica B, 2014, 4(2): 105-111. DOI:10.1016/j.apsb.2013.12.001 |
| [11] |
THOMAS H, COLEY H M. Overcoming multidrug resistance in cancer: an update on the clinical strategy of inhibiting p-glycoprotein[J]. Cancer Control: Journal of the Moffitt Cancer Center, 2003, 10(2): 159-165. |
| [12] |
DOMICEVICA L, BIGGIN P C. Homology modelling of human P-glycoprotein[J]. Biochemical Society Transactions, 2015, 43(5): 952-958. DOI:10.1042/BST20150125 |
| [13] |
FERREIRA R J, DOS SANTOS D J V A, FERREIRA J U. P-glycoprotein and membrane roles in multidrug resistance[J]. Future Medicinal Chemistry, 2015, 7(7): 929-946. DOI:10.4155/fmc.15.36 |
| [14] |
闫理想. 老年急性髓系白血病(非急性早幼粒细胞白血病)中西医结合诊疗专家共识[J]. 中国中西医结合杂志, 2019, 39(4): 405-411. YAN L X. Consensus on diagnosis and treatment of elderly acute myeloid leukemia with integrative medicine[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2019, 39(4): 405-411. |
| [15] |
史哲新, 杨文华, 高宏, 等. 中西医结合治疗难治性白血病临床观察[J]. 新中医, 2011, 43(1): 95-96. SHI Z X, YANG W H, GAO H, et al. Clinical observation on treatment of refractory leukemia with integrated traditional Chinese and western medicine[J]. Journal of New Chinese Medicine, 2011, 43(1): 95-96. |
| [16] |
史哲新, 王秀婷, 闫理想, 等. 中西医个体化分层治疗老年急性髓系白血病回顾性分析[J]. 中国中西医结合杂志, 2017, 37(9): 1069-1072. SHI Z X, WANG X T, YAN L X, et al. Retrospective analysis on the individualized stratified treatment of senile acute myeloid leukemia by integrated traditional Chinese and Western medicine[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2017, 37(9): 1069-1072. |
| [17] |
闫理想, 史哲新, 姜静, 等. 益气养阴方逆转难治性急性白血病多药耐药临床观察[J]. 北京中医药大学学报, 2015, 38(1): 68-72. YAN L X, SHI Z X, JIANG J, et al. Clinical observation of replenishing qi and nourishing yin formula reversing multidrug resistance of patients with refractory acute leukemia[J]. Journal of Beijing University of Traditional Medicine, 2015, 38(1): 68-72. |
| [18] |
ZHANG J L, LI H Y, LU L, et al. The Yiqi Yangyin Formula ameliorates injury to the hematopoietic system induced by total body irradiation[J]. Journal of Radiation Research, 2017, 58(1): 1-7. |
| [19] |
SHI Z X, LI H Y, YANG X D, et al. Yiqi Yangyin Decoction increases the sensitivity of KG1a leukemia stem cells to daunorubicin by promoting cell cycle progression and regulating the expression of PTEN, TOPOⅡ and mTOR[J]. Oncology Letters, 2017, 14(6): 6441-6448. |
| [20] |
闫理想, 史哲新, 杨向东, 等. 益气养阴方对白血病干细胞MDR1 mRNA和P-gp表达的影响[J]. 中国中西医结合杂志, 2017, 37(12): 1491-1495. YAN L X, SHI Z X, YANG X D, et al. Effect of Yiqi Yangyin Formula on the mRNA expression of MDR1 and P-glycoprotein of leukemic stem cells[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2017, 37(12): 1491-1495. |
| [21] |
闫理想, 史哲新, 杨向东, 等. 益气养阴方对CD34+CD38-KG1a白血病干细胞活性的影响[J]. 中华中医药杂志, 2017, 32(11): 5180-5183. YAN L X, SHI Z X, YANG X D, et al. Effects of Yiqi Yangyin Formula on CD34+CD38-KG1a leukemia stem cells activity[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(11): 5180-5183. |
| [22] |
杨向东, 史哲新, 姚芳, 等. 蝎毒多肽对白血病干细胞MDR1mRNA和P-gp表达的影响[J]. 中医药学报, 2016, 44(1): 36-40. YANG X D, SHI Z X, YAO F, et al. Effect of PESV on expression levels of MDR1mRNA and P-gp in leukemic stem cells[J]. Acta Chinese Medicine and Pharmacology, 2016, 44(1): 36-40. |
| [23] |
杨向东, 史哲新, 闫理想, 等. 从白血病干细胞水平研究蝎毒多肽提取物逆转多药耐药机制[J]. 中国中西医结合杂志, 2016, 36(7): 867-874. YANG X D, SHI Z X, YAN L X, et al. Reversion mechanism study of PESV to multidrug resistance at leukemia stem cell level[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2016, 36(7): 867-874. |
| [24] |
YE H, ADANE B, KHAN N, et al. Leukemic stem cells evade chemotherapy by metabolic adaptation to an adipose tissue niche[J]. Cell Stem Cell, 2016, 19(1): 23-37. |
| [25] |
GUAN Y, GERHARD B, HOGGE D E. Detection, isolation and stimulation of quiescent primitive leukemic progenitor cells from patients with acute myeloid leukemia (AML)[J]. Blood, 2003, 101(8): 3142-3149. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China;
3. Department of DigestiveⅡ, Tianjin Academy of Traditional Chinese Medicine Affiliated Hospital, Tianjin 300120, China;
4. Institute of Radiation Medicine Chinese Academy of Medical Sciences, Tianjin 300193, China
 2023, Vol. 40
2023, Vol. 40