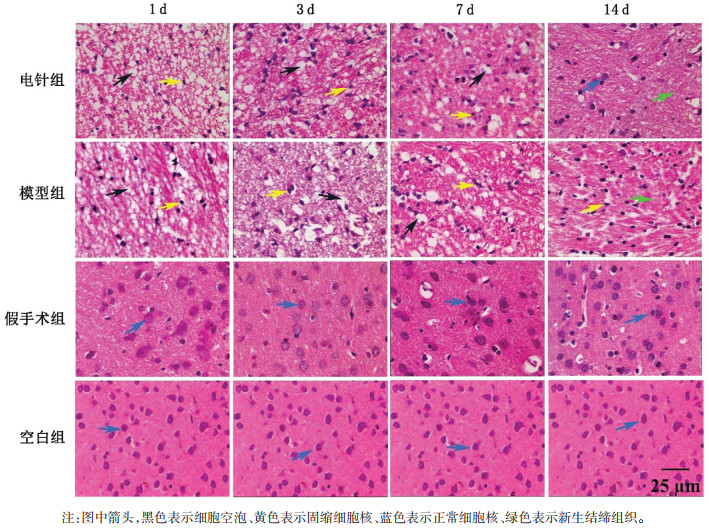
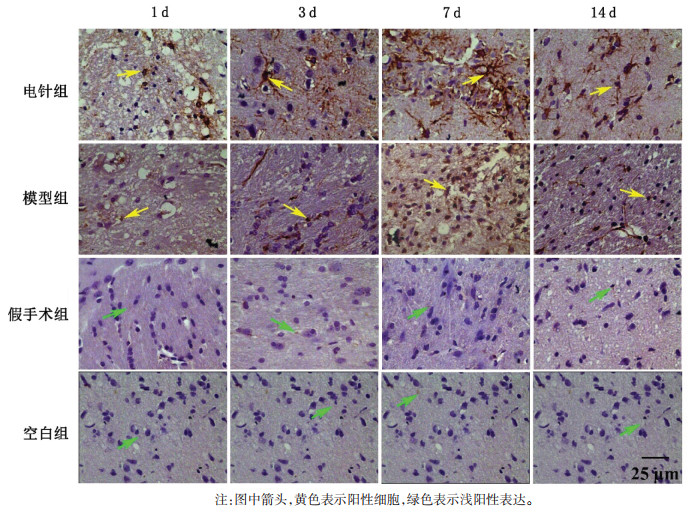
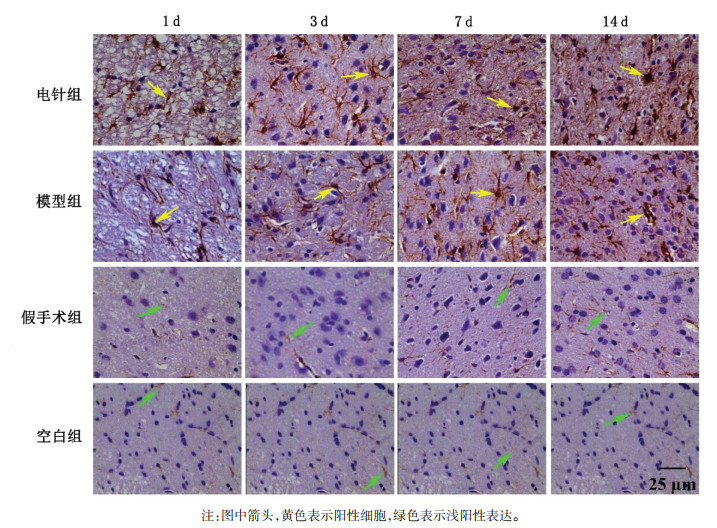
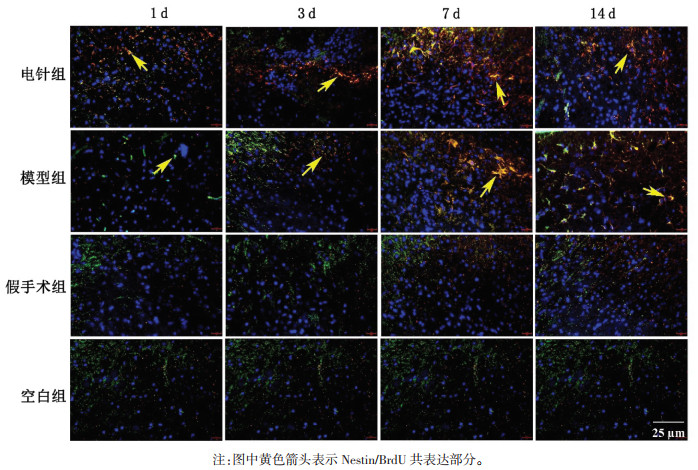
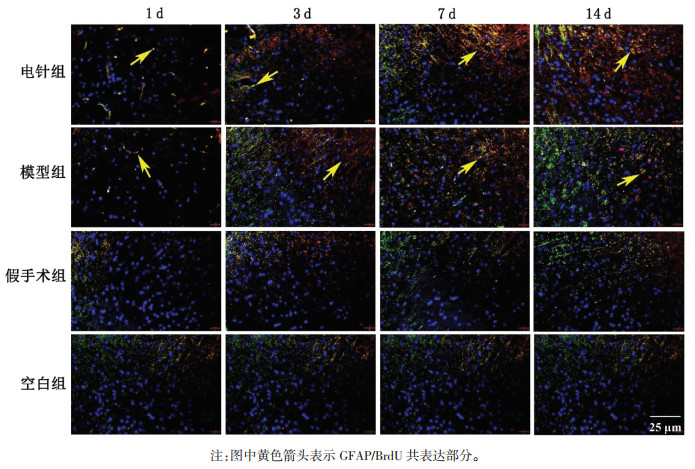
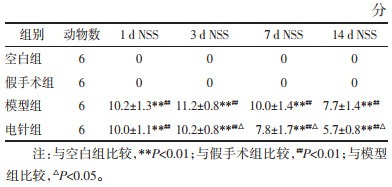
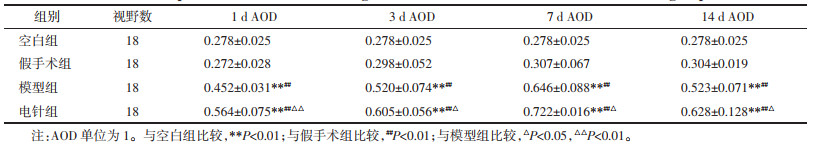
| [1] |
中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南2018[J]. 中华神经科杂志, 2018, 51(9): 666-682. Chinese Society of Neurology, Chinese Stroke Society. Chinese guidelines for diagnosis and treatment of acute ischemic stroke 2018[J]. Chinese Journal of Neurology, 2018, 51(9): 666-682. DOI:10.3760/cma.j.issn.1006-7876.2018.09.004 |
|
| [2] |
HAMBLIN M H, LEE J P. Neural stem cells for early ischemic stroke[J]. International Journal of Molecular Sciences, 2021, 22(14): 7703. DOI:10.3390/ijms22147703 |
|
| [3] |
TAO J, XUE X H, CHEN L D, et al. Electroacupuncture improves neurological deficits and enhances proliferation and differentiation of endogenous nerve stem cells in rats with focal cerebral ischemia[J]. Neurological Research, 2010, 32(2): 198-204. DOI:10.1179/174313209X414506 |
|
| [4] |
杨丽红, 杜元灏, 李晶. 电针对脑梗死大鼠脑血管内皮细胞Apelin-APJ系统的影响[J]. 针刺研究, 2017, 42(1): 9-13. YANG L H, DU Y H, LI J. Effect of electroacupuncture on expression of Apelin-APJ system of cerebral vascular endothelial cell in rats with cerebral infarction[J]. Acupuncture Research, 2017, 42(1): 9-13. |
|
| [5] |
华兴邦, 周浩良. 大鼠穴位图谱的研制[J]. 实验动物与动物实验, 1991, 1(1): 1-5.
HUA X B, ZHOU H L. Development of rat acupuncture maps[J]. Laboratory animals and animal experiments, 1991, 1(1): 1-5. |
|
| [6] |
CHEN J, LI Y, WANG L, et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats[J]. Stroke, 2001, 32(4): 1005-1011. DOI:10.1161/01.STR.32.4.1005 |
|
| [7] |
贾建平, 陈生弟. 神经病学[M]. 8版. 北京: 人民卫生出版社, 2018: 194-195.
JIA J P, CHEN S D. Neurology[M]. 8th edition. Beijing: People's Medical Publishing House, 2018: 194-195.
|
|
| [8] |
杜思敬. 针灸资生经[M]. 北京: 人民卫生出版社, 2007: 29.
DU S J. Zhen jiu zi shen jing[M]. Beijing: People's Medical Publishing House, 2007: 29.
|
|
| [9] | |
|
| [10] | |
|
| [11] |
贾蓝羽, 杜元灏, 李晶, 等. 电针"水沟"穴对脑缺血大鼠缺血脑组织血管新生相关因子表达的影响[J]. 针刺研究, 2019, 44(10): 715-721. JIA L Y, DU Y H, LI J, et al. Effects of electroacupuncture on morphology of neovascularization and expression of angiogenesis-related factors in ischemic brain tissue of cerebral ischemia rats[J]. Acupuncture Research, 2019, 44(10): 715-721. |
|
| [12] |
MARTI H J, BERNAUDIN M, BELLAIL A, et al. Hypoxia-induced vascular endothelial growth factor expression precedes neovascularization after cerebral ischemia[J]. The American Journal of Pathology, 2000, 156(3): 965-976. DOI:10.1016/S0002-9440(10)64964-4 |
|
| [13] |
陈宜张. 分子神经生物学[M]. 北京: 人民军医出版社, 1995: 146.
CHEN Y Z. Molecular neurobiology[M]. Beijing: People's Military Medical Press, 1995: 146.
|
|
| [14] | |
|
| [15] |
王少军, 朱兵. 不同刺激强度电针对正常大鼠大脑p-Akt表达的影响[J]. 针刺研究, 2005, 30(2): 72-74, 124. WANG S J, ZHU B. Effect of different stimulus intensities of electroacupuncture on the expression of phospho-Akt in rat brain[J]. Acupuncture Research, 2005, 30(2): 72-74, 124. |
|
| [16] |
孙克兴. 不同参数电针对人体超微发光的影响[J]. 中国中医基础医学杂志, 2003, 4(3): 51.
SUN K X. The effect of different parameters of electricity on ultraluminescence in the human body[J]. Chinese Journal of Basic Medicine of Traditional Chinese Medicine, 2003, 4(3): 51. |
|
| [17] |
张莺, 韩德雄, 刘喆, 等. 基于数据挖掘的脑缺血机制研究中电针参数应用规律分析[J]. 中华中医药学刊, 2017, 35(3): 554-557. ZHANG Y, HAN D X, LIU Z, et al. Analysis of application of electroacupuncture parameters in study of cerebral ischemia mechanism based on data mining[J]. Chinese Archives of Traditional Chinese Medicine, 2017, 35(3): 554-557. |
|
| [18] |
JOO S, YEON KIM J, LEE E, et al. Effects of ECM protein micropatterns on the migration and differentiation of adult neural stem cells[J]. Scientific Reports, 2015, 5: 13043. |
|
| [19] |
TAMPAKI E C, NAKOPOULOU L, TAMPAKIS A, et al. Nestin involvement in tissue injury and cancer: a potential tumor marker?[J]. Cellular Oncology (Dordrecht), 2014, 37(5): 305-315. |
|
| [20] |
PELINKA L E, KROEPFL A, SCHMIDHAMMER R, et al. Glial fibrillary acidic protein in serum after traumatic brain injury and multiple trauma[J]. The Journal of Trauma, 2004, 57(5): 1006-1012. |
|
| [21] |
王珊, 李萍萍, 王晓良, 等. 神经干细胞微环境在神经再生中的作用[J]. 药学学报, 2018, 53(5): 684-690. WANG S, LI P P, WANG X L, et al. Effect of neural stem cell niche in neurogenesis[J]. Acta Pharmaceutica Sinica, 2018, 53(5): 684-690. |
|
| [22] |
ZHOU B, ZUO Y X, JIANG R T. Astrocyte morphology: diversity, plasticity, and role in neurological diseases[J]. CNS Neuroscience & Therapeutics, 2019, 25(6): 665-673. |
|
| [23] |
何欣然, 孙浩, 秦晓颖, 等. 星形胶质细胞在突触可塑性中的研究进展[J]. 神经损伤与功能重建, 2022, 17(4): 215-217, 233. HE X R, SUN H, QIN X Y, et al. Research progress of astrocytes in synaptic plasticity[J]. Neural Injury and Functional Reconstruction, 2022, 17(4): 215-217, 233. |
|
| [24] |
罗丁, 樊小农, 赵海英, 等. 针刺人中穴对MCAO大鼠中枢神经系统神经干细胞增殖影响的研究[J]. 天津中医药, 2014, 31(9): 548-551. LUO D, FAN X N, ZHAO H Y, et al. Study on the effect of acupuncturing renzhong on proliferation of neural stem cells in central nervous system of MCAO rat[J]. Tianjin Journal of Traditional Chinese Medicine, 2014, 31(9): 548-551. |
|
| [25] |
李钦潘, 韩永升, 韩咏竹, 等. "醒脑开窍"针刺法对脑缺血再灌注大鼠模型早期脑内血管内皮生长因子与胶质纤维酸性蛋白表达的影响[J]. 中国康复医学杂志, 2015, 30(7): 645-650. LI Q P, HAN Y S, HAN Y Z, et al. Effects of the "Xingnao Kaiqiao" acupuncture therapy on expressions of vascular endothelial growth factor and glial fibrillary acidic protein after cerebral ischemia reperfusion in rats at early stage[J]. Chinese Journal of Rehabilitation Medicine, 2015, 30(7): 645-650. |
|
| [26] | |
|
| [27] |
许文婷, 薛玉满, 王策, 等. 不同频率电针刺激对脑出血大鼠血肿脑组织脑红蛋白及NLRP3信号通路的影响[J]. 现代中西医结合杂志, 2022, 31(1): 10-15. XU W T, XUE Y M, WANG C, et al. Effects of different frequencies of electric acupuncture stimulation on neuroglobin and NLRP3 signaling pathways in hematoma brain tissue in rats with cerebral hemorrhage[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2022, 31(1): 10-15. |
|
| [28] |
赵俊红, 林阳阳, 何晓阔, 等. 电针对脑梗死大鼠海马齿状回Notch1调控作用的研究[J]. 中国康复医学杂志, 2018, 33(5): 520-524. ZHAO J H, LIN Y Y, HE X K, et al. A study on the regulation effect of electroacupuncture on Notch1 at dentate gyrus in rats with acute cerebral infarction[J]. Chinese Journal of Rehabilitation Medicine, 2018, 33(5): 520-524. |
|
 2023, Vol. 40
2023, Vol. 40