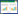文章信息
- 窦一田, 王玉明, 瞿晶田, 李雪, 李翀, 韩燕燕, 尚懿纯, 刘春柳
- DOU Yitian, WANG Yuming, QU Jingtian, LI Xue, LI Chong, HAN Yanyan, SHANG Yichun, LIU Chunliu
- 基于代谢组学的肾苏Ⅱ干预阿霉素肾病小鼠作用机制研究
- Metabolomics-based study of Shensu Ⅱ intervention in mouse with adriamycin-induced nephropathy
- 天津中医药, 2023, 40(3): 355-363
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(3): 355-363
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.03.14
-
文章历史
- 收稿日期: 2022-12-20
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津中医药大学中药学院, 天津 301617;
4. 天津中医药大学中医学院, 天津 301617;
5. 天津中医药大学研究生院, 天津 301617
复方肾苏Ⅱ是天津中医药大学第一附属医院肾病科依托“曹式丽全国名老中医药专家传承工作室”辛通畅络法慢性肾脏病防治体系系列研究,经反复临床实践与实验研究不断筛选优化而形成的、确有疗效的复方载体[1]。方以柴胡、黄芩为君,疏利少阳,枢转气机,畅达三焦;以黄芪、当归为臣,补益脾肾,扶正补虚;以女贞子、泽兰为佐,辛通入肾,畅达肾络。临床研究显示,肾苏Ⅱ作为辛通畅络法代表方,可有效延缓肾小球及肾间质病变患者肾功能减退进程,具有抑制尿蛋白排泄、减轻肾功能损伤、改善脂质代谢等多重治疗作用[2-4]。前期基础研究亦证实,肾苏Ⅱ可能通过调节免疫应答,阻抑肾小球足细胞(PCs)凋亡和上皮-间充质转化(EMT)进程,减少尿蛋白排泄,延缓局灶节段性肾小球硬化(FSGS)模型大鼠肾脏病变进展[5-6]。然而,以肾苏Ⅱ为代表的辛通畅络法肾脏保护作用机制系统研究当前尚未完全展开,相关分子机制仍亟需大量、深入的基础研究予以阐释。代谢组学作为阐释机体代谢产物谱变化的重要研究方法,通过对机体代谢物的“整体模式”动态变化进行分析,实现对疾病发病及药物治疗作用机制的探索。因此,本研究拟以阿霉素肾病小鼠模型为研究对象,应用代谢组学技术探讨肾苏Ⅱ对阿霉素肾病小鼠的作用机制,以期为序贯开展的辛通畅络法物质基础阐释系列研究奠定前期基础。
1 材料与方法 1.1 实验材料 1.1.1 实验仪器超高效液相色谱仪(ACQUITY UPLCTM型,美国Waters公司)、飞行时间质谱(Xevo G2-XS型,美国Waters公司)。QL-901 Vortex微型旋涡混合仪(海门市其林贝尔仪器制造有限公司),MIKRO 22OR台式冷冻高速离心机(由天津理工大学提供),KDM型电热套(山东省鄄城永兴仪器厂)。
1.1.2 药品与试剂盐酸多柔比星脂质体注射液(生产批号:691181007),氯沙坦钾片(生产批号:1357F19001),乙腈(色谱纯,天津市康科德科技有限公司),甲醇(色谱纯,天津市康科德科技有限公司),乙醇(分析纯,美国ROE公司),北柴胡(安国路路通中药饮片有限公司,批号:1711036),黄芩(安国市光明饮片加工厂,批号:1709057),黄芪(安国路路通中药饮片有限公司批号:170901),当归(安国路路通中药饮片有限公司,批号:171101),女贞子(安国路路通中药饮片有限公司,批号:171207),泽兰(河北美威药业股份有限公司,批号:171101)。以上中药饮片均由天津中医药大学第一附属医院臧滨主管药师鉴定,北柴胡为伞形科植物柴胡Bupleurum chinense DC.的干燥根,黄芩为唇形科植物黄芩Scutellaria baicalensis Georgi的干燥根,黄芪为豆科植物蒙古黄芪Astragalus membranaceus(Fisch.)Bge.var.mongholicus(Bge.)Hsiao的干燥根,当归为伞形科植物当归Angelica sinensis(Oliv.)Diels的干燥根,女贞子为木犀科植物女贞Ligustrum lucidum Ait.的干燥成熟果实,泽兰为唇形科植物毛叶地瓜儿苗Lycopus lucidus Turcz. var. hirtus Regel的干燥地上部分。
1.1.3 实验动物SPF级雄性BALB-Cd小鼠(北京维通利华实验动物技术有限公司,许可证号:SCXK[京]2016-0006)40只,体质量(20±1)g。本实验经天津中医药大学动物伦理委员会批准,动物实验伦理审批号:TCM-LAEC2019051。
1.2 实验方法 1.2.1 肾苏Ⅱ给药溶液的制备肾苏Ⅱ复方由北柴胡12 g,黄芩10 g,黄芪30 g,当归10 g,女贞子15 g,泽兰15 g等组成。将药材置于1 000 mL圆底烧瓶,加入600 mL蒸馏水浸泡30 min后,加热并冷凝回流45 min,滤过药液。药渣再加800 mL蒸馏水,加热回流30 min后,滤过,合并2次滤液,蒸发浓缩至100 mL(0.85 g生药/mL)。重复提取4次,合并滤液备用。
1.2.2 动物实验小鼠随机分为5组,每组8只。各组分别为空白对照组(A)、模型组(B)、高剂量组(C)、低剂量组(D)和阳性对照组(E)。B、C、D、E各组小鼠尾静脉注射阿霉素溶液(2 mg/mL,0.1 mL);A组尾静脉注射给予同等体积生理盐水。标准饲料喂养,自由摄食、饮水。A、B组给予蒸馏水,C、D组分别给予肾苏Ⅱ 68.8 g/kg(高剂量)和34.4 g/kg(低剂量),E组给予10 mg/kg氯沙坦钾溶液,每日1次。连续给药2周后,各组小鼠摘眼球取血0.5 mL,离心10 min,取血浆100 μL于离心管中,保存于-80 ℃冰箱中;取血后将小鼠处死,迅速取出小鼠肾脏,浸泡于10%甲醛溶液中保存,进行脱水、透明、石蜡包埋、切片、苏木精-伊红(HE)、过碘酸雪夫(PAS)染色处理,光镜下观察肾小球和肾小管-间质变化。
1.3 血浆代谢组学研究 1.3.1 血浆样本制备将1.2.2采集的100 μL小鼠血浆样本从-80 ℃冰箱取出,室温下解冻融解,加入300 μL乙腈,冰水浴超声10 min,涡旋混匀1 min,以13 200×g、4 ℃离心15 min后,移取上清液,超高效液相色谱-飞行时间质谱联用(UPLC-Q-TOF/MS)技术进样分析。
1.3.2 质量控制(QC)样品的制备每组血浆样本各吸取15 μL于离心管中,混合涡旋1 min,使得QC样品包含所有样品的生物学信息[7]。随后以8 000×g、4 ℃离心10 min,吸取上清液。之后用涡旋机涡旋1 min。再以13 200×g、4 ℃离心15 min后,吸取上清液进行UPLC-Q-TOF/MS代谢组学分析。
1.3.3 UPLC-Q-TOF/MS分析条件1)色谱条件:ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm),流动相0.1%甲酸水溶液(A)-乙腈(B)梯度洗脱(0~1 min,2%~25%B;1~4 min,25%B;4~5 min,25%~50%B;5~7 min,50%~60%B;7~10 min,60%~90%B;10~12 min,90%~100%B;12~14 min,100%B),流速设定0.4 mL/min,柱温40℃,进样量5 μL。
2)质谱条件:电喷雾离子源(ESI),分别进行正、负离子扫描,毛细管电压3 kV,锥孔电压40 V,离子源温度100 ℃,脱溶剂气温度450 ℃,反向锥孔气流50 L/h,脱溶剂气流速度选择800 L/h,低电压6 V,高电压10~40 V,扫描时间设定0.2 s,扫描范围质荷比(m/z)100~1 200,准确质量测定采用亮氨酸-脑啡肽溶液(ESI+:m/z 556.277 1,ESI-:m/z 554.261 5)为锁定质量溶液。
1.3.4 方法学考察1)仪器精密度考察:取同一QC样品溶液,连续进样6次,随机选取20个色谱峰,考察色谱峰峰面积和保留时间的一致性,分别计算20个色谱峰的峰面积和保留时间的RSD,考察仪器的精密度。
2)方法精密度考察:平行制备6份QC样品溶液,连续进样分析,随机选取20个色谱峰,分别计算20个色谱峰峰面积和保留时间的RSD,考察方法精密度。
3)样品稳定性考察:取同一QC样品溶液,分别在0、6、12、18和24 h进样分析,随机选取20个色谱峰,计算20个色谱峰峰面积和保留时间的RSD,考察样品的稳定性。
1.4 统计学方法将数据通过Masslynx(Water,美国)软件分别采集后,利用数据处理系统Masslynx对谱图进行离子对的提取、峰对齐、峰匹配和原始数据的峰值滤过等操作,数据进行归一化处理后导出,而后将80%修约后的数据(即同一组别中80%以上的数据为有效值,并将其保留)导入SIMCA-P 11.5统计软件(Umetrics,瑞典)进行多元统计分析。
最先进行无监督的主成分分析(PCA)检测,观察各组之间的联系,检测并剔除离群值,而后进行有监督的偏最小二乘-判别分析(PLS-DA),确定建立模型的可靠性,在实验数据结果中筛选出VIP>1的物质作为候选标志物,继而使用SPSS 19.0软件进行独立样本t检验以确定代谢物是否符合统计学的显著差异性,并利用各物质的m/z值在人类代谢组数据库(HMDB)网站中通过对比数据库寻找可能物质,通过代谢物数据库碎片离子信息以及文献等信息来确认候选生物标志物,进而对其生物标志物进行分析讨论,最终采用受试者工作曲线(ROC curve)对所得到的生物标志物进行优化分析,进一步筛选出符合条件并且有意义的标志物。
2 结果 2.1 病理结果病理形态观察结果表明,空白组小鼠肾脏组织结构无明显异常;模型组小鼠肾脏结构出现明显病理性改变;肾苏Ⅱ高剂量组、肾苏Ⅱ低剂量组和阳性对照组相比较于模型组,肾组织病变均有不同程度的减轻。见图 1。

|
| 注:A.空白组肾组织;B.模型组肾组织;C.肾苏Ⅱ高剂量组肾组织;D.肾苏Ⅱ低剂量组肾组织;E.阳性对照组肾组织。 图 1 小鼠肾组织病理结果(HE,×400) Fig. 1 Pathological results of mice kidney tissue (HE, ×400) |
模型组的系膜区显著节段性增宽,毛细血管襻大部分闭锁塌陷,基底膜弥漫性重度增厚;肾小管上皮细胞颗粒及空泡变性、片状萎缩,腔内可见大量蛋白管型。肾苏Ⅱ高剂量组的系膜区轻度节段增宽,个别血管襻闭锁塌陷,基底膜轻度增厚;肾小管上皮细胞轻度颗粒变性,腔内可见少量蛋白管型;间质局灶性轻度纤维化。肾苏Ⅱ低剂量组系膜区中度节段性增宽,部分血管襻闭锁塌陷,基底膜弥漫性中度增厚;肾小管上皮细胞颗粒变性、小片状萎缩,腔内可见大量蛋白管型;间质轻度纤维化。阳性对照组的系膜区大部分节段性轻度增宽、局灶部位中度增宽,部分血管襻闭锁塌陷,基底膜弥漫性中度增厚;肾小管上皮细胞颗粒、空泡变性,灶性萎缩,腔内可见蛋白管型;间质局灶性轻度纤维化。
2.2 代谢组学结果 2.2.1 方法学考察 2.2.1.1 仪器精密度实验按照1.3.4中1)项下仪器精密度考察,结果显示色谱峰峰面积RSD<11%,保留时间RSD<0.9%,表明仪器精密度良好。
2.2.1.2 方法精密度实验按照1.3.4中2)项下方法精密度考察,结果显示色谱峰峰面积RSD<13%,保留时间RSD<1.1%,表明方法精密度良好。
2.2.1.3 样品稳定性实验按照1.3.4中3)项下样品稳定性考察,结果显示色谱峰峰面积RSD<10%,保留时间RSD<0.7%,表明样品在24 h内稳定。
2.2.2 基峰强度(BPI)色谱图采用UPLC-Q-TOF/MS分析技术对不同组小鼠血浆样本进行代谢组学分析,数据导入Masslynx软件处理,得到血浆样品正负离子模式下的BPI色谱图。见图 2。
|
| 注:A.正离子模式;B.负离子模式。 图 2 血浆QC正、负离子模式BPI图 Fig. 2 BPI of QC positive and negative ion modes in plasma |
将UPLC-Q-TOF/MS采集得到的血浆样本代谢组学数据,应用多元统计对数据进行分析,最先对空白组、模型组和给药高剂量组数据进行PCA模式分析。见图 3。
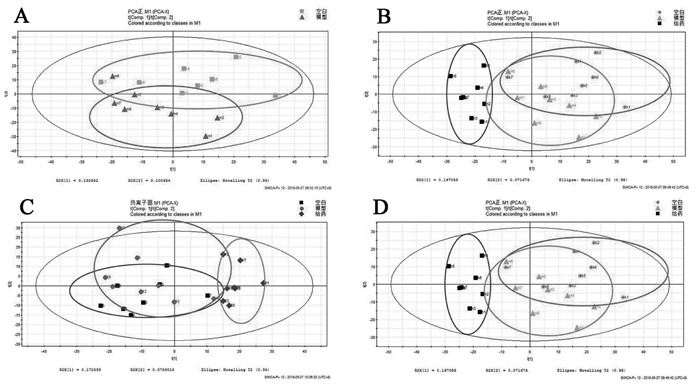
|
| 注:A.空白和模型组正负离子模式;B.空白和模型组负离子模式;C.空白、模型和给药组负离子模式;D.空白、模型和给药组正离子。 图 3 正、负离子模式下PCA图 Fig. 3 PCA of positive and negative ion modes |
采用PLS-DA进行有监督的数据分析,以确定空白组和模型组之间是否存在差异性代谢物。同时将给药组数据与空白、模型组数据对比分析,观察代谢物的趋势变化,为后续的药物代谢机制性研究提供依据。见图 4。

|
| 注:A.空白和模型组正离子模式;B.空白和模型组负离子模式;C.空白、模型和给药组正离子模式;D.空白、模型和给药组。 图 4 正、负离子模式下PLS-DA图 Fig. 4 PLS-DA in positive and negative ion modes |
基于PLS-DA模型,按照1.4统计学分析项下进一步筛选显著性变化的小分子代谢物,得到生物标志物。见表 1。
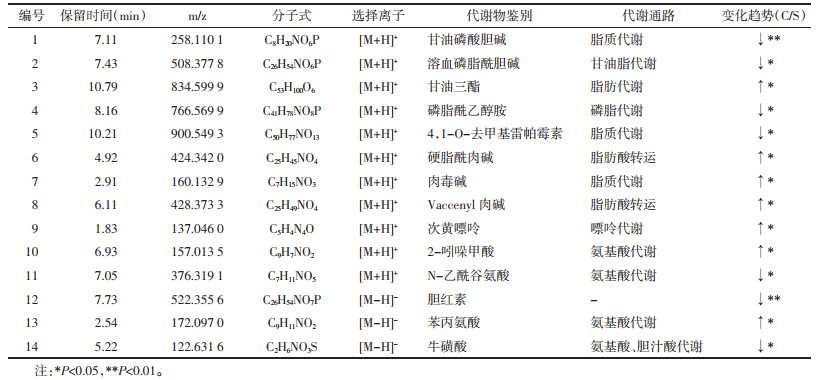
经过实验数据分析优化,筛选出14个生物标记物,其AUC值均大于0.7,表明标志物的诊断价值较高。见图 5、表 2。
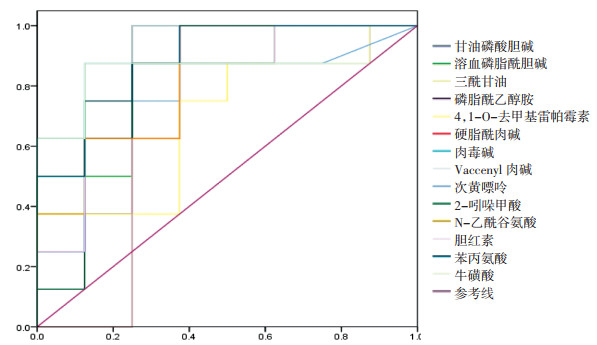
|
| 图 5 14个生物标志物的ROC曲线图 Fig. 5 ROC curves of 14 biomarkers |
将筛选出的生物标志物在空白组、模型组中的数据与给药高、低剂量组的数据进行比较,发现给药后有11种物质发生回调,见图 6。
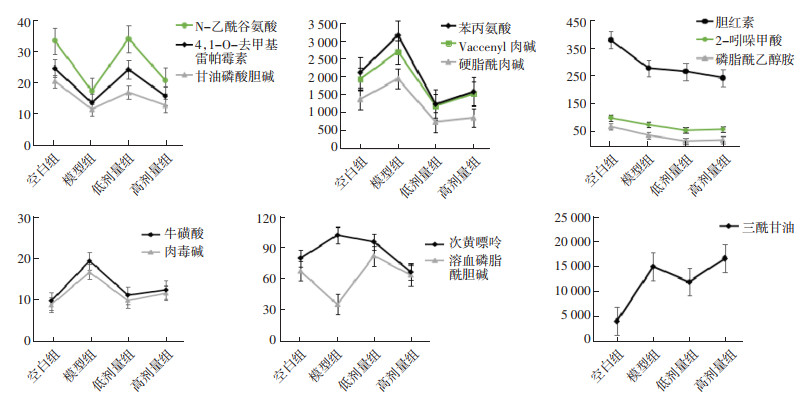
|
| 图 6 14个生物标志物的物质趋势图 Fig. 6 Material trends of 14 biomarkers |
近年来大量研究表明,中医药在改善患者肾功能和延缓慢性肾脏病(CKD)进展等方面具有较强优势[8-10]。天津市名中医曹式丽教授通过长期临床实践,逐步形成的特色中医肾病学术观点。临证用药强调“辛味治肾”,肾苏Ⅱ系辛通畅络治法的重要载体复方[11-12]。临床研究显示,该方可较好地抑制肾小球硬化患者的肾功能减退,减少尿蛋白排泄量、改善高凝状态。同时,现代研究亦证实[13-15],肾苏复方的主要组成药物多可延缓肾小球硬化进程。在前期研究基础上,进一步寻找其抗肾小球硬化的有效活性成分,探讨其具体机制,有助于CKD的临床防治。
本研究通过观察肾组织病理形态发现,阿霉素肾病模型组小鼠肾小球系膜细胞和基质重度增生,肾小管上皮细胞变性,大量蛋白管型。对照阿霉素肾病模型组,肾苏Ⅱ高、低剂量组及阳性对照组病变程度较轻,提示肾苏Ⅱ具有改善阿霉素肾病小鼠肾脏功能、抑制肾小球硬化的作用。相关药理学研究证实,肾苏Ⅱ组成药物之药效成分多可改善肾组织病理改变,延缓肾小球硬化进程。如黄芪多糖(APS)作为中药黄芪发挥作用的活性成分,可通过影响人血小板衍生生长因子-BB(PDGF-BB)、核因子-κB抑制蛋白(IκB)、核因子-κB(NF-κB)等表达,抑制系膜细胞增生及基质增多,达到保护肾小球系膜细胞的作用[16];姜梦真等[17]的研究表明,黄芪、水蛭有效成分均能诱导大鼠肾小球系膜细胞凋亡,并降低B淋巴细胞瘤-2基因(Bcl-2)的表达。
对空白组、模型组和肾苏Ⅱ给药高、低剂量组进行PCA分析,结果如图 3所示。通过图 3A、图 3B发现A组和B组分离趋势明显,推测造模后的小鼠体内物质代谢发生异常,各代谢物的种类、水平等相比较正常小鼠可能发生变化;同时,观察发现并无离群值的出现,表明数据稳定,可用于分析。如图 3C、图 3D所示,C、D组呈现出偏离模型组且向正常组趋近的趋势,表明肾苏Ⅱ可能对肾脏损伤发挥治疗作用。
在PCA分析的基础上,对空白组和模型组进行PLS-DA分析,结果如图 4A、图 4B所示。通过PLS-DA分析确定模型小鼠体内与肾脏异变相关的代谢物质,并通过对VIP值的筛选(VIP>1)以及t-检验(P<0.05)进一步筛选出潜在生物标志物,利用生物标志物的m/z值通过HMDB数据库进一步鉴定标志物的分子量与结构,最终通过物质的保留时间和二级图谱予以再次确认。本研究经过PLS-DA筛选出14个生物标志物,其中,正离子模式下11个,负离子模式下3个,结果如表 1所示。通过对比京都基因与基因组百科全书(KEGG)数据库,将大部分标记物的代谢通路予以查找完善。以上研究结果表明,阿霉素肾病小鼠模型可能存在氨基酸代谢、胆汁酸代谢、脂肪代谢、脂质代谢、脂肪酸代谢、甘油脂代谢及嘌呤代谢异常。同时,通过ROC曲线进一步对生物标志物进行筛选确认,结果如图 5所示。根据表 2信息,发现14个生物标志物的AUC值均大于0.7,表明上述物质用于诊断肾病具有一定的准确性。通过将筛选出的14个生物标志物的空白组、模型组和给药组数据进行比对,发现给药组小鼠血浆样本中有11种标志物水平有所回调,结果如图 6所示。证实肾苏Ⅱ方可能通过改善阿霉素肾病小鼠体内的氨基酸代谢、胆汁酸代谢、脂质及脂肪酸代谢及嘌呤代谢等过程,实现对肾脏损伤的治疗作用。
目前认为,甘油磷酸胆碱等胆碱类衍生物,系肾髓质的主要细胞渗透调节物[18],而在模型组血清中甘油磷酸胆碱、溶血磷脂酰胆碱水平均降低,提示存在肾脏代谢紊乱,与既往报道结果相符[19-20]。在本研究中,肾苏Ⅱ可能通过回调甘油磷酸胆碱、溶血磷脂酰胆碱来减轻肾脏的损伤。氨基酸代谢对肾脏病变的发生、发展存在着重要影响,相关研究表明[21],肾病患者血液中氨基酸代谢水平与正常人的差异存在统计学意义。本研究中,苯丙氨酸、牛磺酸和N-乙酰谷氨酸水平和空白组相比均发生异常改变,给药后发生回调,提示肾苏Ⅱ可通过调节氨基酸代谢发挥延缓肾脏病变进程的作用。氧化应激反应系CKD病变进展的重要原因,抗氧化干预可在一定程度上缓解肾损害的进程,胆红素作为体内内源性抗氧化系统的重要成员,生理状态下作为强抗氧化剂,可有效清除氧自由基。本研究中,模型组胆红素水平下降,提示胆汁酸代谢影响肾脏损伤,与先前报道之研究结果一致[22]。嘌呤代谢系维持体内线粒体氧化应激稳态的重要组成部分,次黄嘌呤在黄嘌呤氧化酶的作用下,最终氧化生成尿酸[23],而肾苏Ⅱ通过调节次黄嘌呤可强化体内嘌呤核苷酸代谢。三酰甘油、硬脂酰肉碱、肉毒碱、Vaccenyl肉碱等参与脂肪代谢,脂质代谢紊乱可导致一系列炎症反应,造成小管间质纤维化和肾小球硬化,以及肾功能损伤的进展与恶化[24],本研究表明,肾苏Ⅱ可回调脂质代谢相关物质。综上所述,肾苏Ⅱ有效减缓阿霉素肾病小鼠的病理进程,可能通过调控氨基酸代谢、胆汁酸代谢、脂质及脂肪酸代谢及嘌呤代谢发挥作用,为序贯开展的肾苏Ⅱ临床应用与机制阐释系列研究提供参考依据。
4 结论本研究首先建立阿霉素肾病小鼠模型,在此基础上,对小鼠的肾组织和血浆进行分析,较为系统地分析了阿霉素诱导的肾病模型小鼠的代谢特征。同时,分析经肾苏Ⅱ治疗后的代谢物变化差异,综合运用PCA及PLS-DA等多元统计分析方法,挖掘模型组与正常组及给药组之间变化显著的差异物质。本研究结果表明,给药组小鼠与模型组和空白组小鼠相比,其肾组织病变程度减轻;多元统计结果显示:从各组别中共筛选出与肾损伤密切相关的14个生物标志物,通过对比这些代谢物在空白组、模型组和给药组中的变化,发现其中11个生物标志物在给药后发生回调。对于相关生物标志物的进一步通路富集分析发现,辛通畅络法肾苏Ⅱ复方对阿霉素肾病小鼠肾脏病变的改善,主要通过氨基酸代谢、胆汁酸代谢、脂质代谢、脂肪酸代谢及嘌呤代谢等代谢途径实现。本研究从代谢组学的角度为辛通畅络法复方肾苏Ⅱ作用机制阐释系列研究的序贯开展提供了科学数据,亦为辛通畅络法肾苏Ⅱ复方的临床合理应用提供参考。
| [1] |
窦一田, 瞿晶田, 王玉明, 等. 复方肾苏Ⅱ的HPLC指纹图谱及化学成分鉴定[J]. 中国实验方剂学杂志, 2018, 24(20): 68-74. DOU Y T, QU J T, WANG Y M, et al. HPLC fingerprint analysis and chemical component analysis of traditional Chinese medicine compound Shensu Ⅱ[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2018, 24(20): 68-74. |
| [2] |
柳磊, 马鸿杰. 复方肾苏Ⅱ治疗肾间质纤维化临床观察[J]. 湖北中医杂志, 2018, 40(3): 14-16. LIU L, MA H J. Clinical observation of Shensu Ⅱ granule in treatment of renal interstitial fibrosis[J]. Hubei Journal of Traditional Chinese Medicine, 2018, 40(3): 14-16. |
| [3] |
王帅, 马鸿杰. 肾苏Ⅱ号治疗慢性肾炎的临床观察[J]. 湖北中医杂志, 2017, 39(10): 6-8. WANG S, MA H J. Clinical observation of Shensu Ⅱ decoction in treatment of chronic glomerulonephritis[J]. Hubei Journal of Traditional Chinese Medicine, 2017, 39(10): 6-8. |
| [4] |
梁栋. 肾苏Ⅱ对局灶节段性肾小球硬化患者氧化低密度脂蛋白、血脂及血肌酐的影响[J]. 山西中医学院学报, 2014, 15(2): 38, 40. LIANG D. Effect of Shensu Ⅱ recipe on oxidized low-density lipoprotein and serum creatinine of patients with focal segmental glomerulosclerosis[J]. Journal of Shanxi College of Traditional Chinese Medicine, 2014, 15(2): 38, 40. |
| [5] |
尚懿纯, 曹式丽, 杨洪涛, 等. 肾苏Ⅱ方对局灶节段性肾小球硬化大鼠Notch-P53通路及足细胞凋亡的影响[J]. 中国中西医结合杂志, 2017, 37(8): 973-978. SHANG Y C, CAO S L, YANG H T, et al. Effect of Shensu Ⅱ recipe on Notch-P53 pathway and podocyte apoptosis in rats with focal segmental glomerulosclerosis[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2017, 37(8): 973-978. |
| [6] |
尚懿纯, 曹式丽, 杨洪涛, 等. 肾苏Ⅱ方对局灶节段性肾小球硬化大鼠Notch-PI3K/PKB通路串话及足细胞EMT的影响[J]. 中华中医药杂志, 2016, 31(12): 5271-5276. SHANG Y C, CAO S L, YANG H T, et al. Effects of Shensu Ⅱ Formula on Notch-PI3K/PKB signaling crosstalk and podocyte EMT in rats with focal segmental glomerular sclerosis[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2016, 31(12): 5271-5276. |
| [7] |
卞振华, 张文明, 唐静月, 等. 基于代谢组学和血清药物化学研究益肾固络合剂治疗慢性肾小球肾炎的效应物质及作用机制[J/OL]. (2022-09-06)[2023-01-11]中国中药杂志: 1-16. BIAN Z H, ZHANG W M, TANG J Y, et al. Effective substances and mechanism of Yishen Guluo Mixture in treatment of chronic glomerulonephritis based on metabolomics and serum pharmacochemistry[J/OL]. (2022-09-06)[2023-01-11]China Journal of Chinese Materia Medica: 1-16. |
| [8] |
WANG M Q, HU R, WANG Y J, et al. Atractylenolide Ⅲ attenuates muscle wasting in chronic kidney disease via the oxidative stress-mediated PI3K/AKT/mTOR pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 1875471. |
| [9] |
WANG H, SONG H X, YUE J R, et al. Rheum officinale (a traditional Chinese medicine) for chronic kidney disease[J]. The Cochrane Database of Systematic Reviews, 2012(7): CD008000. |
| [10] |
XI Y, LU X, ZHU L K, et al. Clinical trial for conventional medicine integrated with traditional Chinese medicine (TCM) in the treatment of patients with chronic kidney disease[J]. Medicine, 2020, 99(21): e20234. |
| [11] |
窦一田, 杨洪涛, 林燕, 等. 名老中医曹式丽治疗慢性肾脏病3期经验概述[J]. 中华中医药杂志, 2017, 32(11): 4978-4980. DOU Y T, YANG H T, LIN Y, et al. Treatment experience of chronic kidney disease stage Ⅲ by famous TCM expert CAO Shili[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2017, 32(11): 4978-4980. |
| [12] |
窦一田, 杨洪涛, 林燕, 等. 名老中医曹式丽辛通畅络法治疗特发性足细胞病学术经验撷要[J]. 辽宁中医杂志, 2017, 44(8): 1604-1606. DOU Y T, YANG H T, LIN Y, et al. CAO Shili's academic experience of treatment of idiopathic podocytopathies by Xintong Changluo method[J]. Liaoning Journal of Traditional Chinese Medicine, 2017, 44(8): 1604-1606. |
| [13] |
窦一田, 李翀, 马鸿杰, 等. 辛通畅络法复方肾苏Ⅱ阻抑局灶节段性肾小球硬化大鼠肾间质纤维化及转化生长因子β1表达的影响[J]. 天津医药, 2017, 45(3): 239-244. DOU Y T, LI C, MA H J, et al. The effect of Xintong Changluo complex prescription Shensu Ⅱ on renal interstitial fibrosis and TGF-β1 expression in FSGS rats[J]. Tianjin Medical Journal, 2017, 45(3): 239-244. |
| [14] |
窦一田, 杨洪涛, 曹式丽. 肾苏Ⅱ号方对局灶节段性肾小球硬化大鼠TGF-β1及PAI-1表达的影响[J]. 中国中西医结合杂志, 2011, 31(11): 1531-1537. DOU Y T, YANG H T, CAO S L. Effects of shensu Ⅱ recipe on the expressions of transforming growth factor-β1 and plasminogen activator inhibitor-1 in the focal segmental glomerulosclerosis rats[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2011, 31(11): 1531-1537. |
| [15] |
窦一田, 任桐, 曹式丽. 辛通畅络法干预局灶节段性肾小球硬化大鼠细胞外基质积聚的实验研究[J]. 时珍国医国药, 2011, 22(9): 2070-2072. DOU Y T, REN T, CAO S L. Effects of dredging vessels by Xintong on mesangial matrix proliferation in FSGS rat glomerulus[J]. Lishizhen Medicine and Materia Medica Research, 2011, 22(9): 2070-2072. |
| [16] |
顾叶云, 胡莹杰, 徐蕾, 等. 黄芪、水蛭有效组分对经脂多糖诱导增生的大鼠肾小球系膜细胞IκB、NF-κB、PDGF-BB表达的影响[J]. 中华中医药杂志, 2020, 35(2): 866-868. GU Y Y, HU Y J, XU L, et al. Effects of the effective components in milkvetch root and leeches on IκB, NF-κB, PDGF-BB expression of rats' glomerular mesangial cells[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2020, 35(2): 866-868. |
| [17] |
姜梦真, 任惠娟, 徐蕾, 等. 黄芪、水蛭有效成分对大鼠肾小球系膜细胞凋亡的影响[J]. 中成药, 2017, 39(5): 902-906. JIANG M Z, REN H J, XU L, et al. Influences of Astragalus and Hurido effective components on apoptosis of rat glomerular mesangial cells[J]. Chinese Traditional Patent Medicine, 2017, 39(5): 902-906. |
| [18] |
文锦丽, 欧阳昕, 王宇罡, 等. 代谢组学在糖尿病肾病患者诊断中的应用[J]. 广东医学, 2012, 33(23): 3553-3555. WEN J L, OUYANG X, WANG Y G, et al. Metabonomic analysis in the diagnosis of diabetic nephropathy[J]. Guangdong Medical Journal, 2012, 33(23): 3553-3555. |
| [19] |
LIN L, HUANG Z Z, GAO Y, et al. LC-MS based serum metabonomic analysis for renal cell carcinoma diagnosis, staging, and biomarker discovery[J]. Journal of Proteome Research, 2011, 10(3): 1396-1405. |
| [20] |
ZHAO Y Y, CHENG X L, WEI F, et al. Serum metabonomics study of adenine-induced chronic renal failure in rats by ultra performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J]. Biomarkers: Biochemical Indicators of Exposure, Response, and Susceptibility to Chemicals, 2012, 17(1): 48-55. |
| [21] |
王旭方, 李梦婕, 葛永纯, 等. 糖尿病肾病患者血清及尿液代谢组学特点及临床意义[J]. 肾脏病与透析肾移植杂志, 2012, 21(3): 201-209. WANG X F, LI M J, GE Y C, et al. Serum and urinary metabolomic analysis in patients with diabetic nephropathy[J]. Chinese Journal of Nephrology, Dialysis & Transplantation, 2012, 21(3): 201-209. |
| [22] |
马力群. 血清总胆红素水平对3~5期慢性肾病患者进程影响性研究[J]. 中国中西医结合肾病杂志, 2016, 17(5): 419-422. MA L Q. Study on the influence of serum total bilirubin level on the progress of patients with stage 3-5 chronic kidney disease[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2016, 17(5): 419-422. |
| [23] |
徐晓敏, 李姗姗, 卢芳. 基于肾脏代谢组学探讨黄芩汤对DN模型小鼠的调节作用[J]. 时珍国医国药, 2022, 33(5): 1075-1080. XU X M, LI S S, LU F. To investigate the regulatory effect of Huangqin Decoctien on DN model mice based on kidney metabolo- mics[J]. Lishizhen Medicine and Materia Medica Research, 2022, 33(5): 1075-1080. |
| [24] |
潘玲, 廖蕴华, 尹瑞兴. 血脂异常在慢性肾脏病中的作用及机制研究进展[J]. 中国中西医结合肾病杂志, 2020, 21(2): 184-186. PAN L, LIAO Y H, YIN R X. Research progress on the role and mechanism of dyslipidemia in chronic kidney disease[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2020, 21(2): 184-186. |
2. National Clinica Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China;
3. School of Pharmacy, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
4. School of Traditional Chinese Medicine, Tianjin University of Chinese Medicine, Tianjin 301617, China;
5. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40