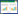文章信息
- 柴士伟, 戈明蕾, 吴梦暄, 何俊
- CHAI Shiwei, GE Minglei, WU Mengxuan, HE Jun
- 疏血通注射液UPLC指纹图谱及5种核苷类成分含量测定研究
- Study on UPLC fingerprint and content determination of 5 nucleosides in Shuxuetong Injection
- 天津中医药, 2023, 40(3): 364-370
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(3): 364-370
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.03.15
-
文章历史
- 收稿日期: 2022-12-10
2. 国家中医针灸临床医学研究中心, 天津 300381;
3. 天津中医药大学组分中药国家重点实验室, 天津 301617
疏血通注射液由水蛭和地龙两种中药提取制备而成,具有活血化瘀,通经活络的功效[1]。水蛭性平,味苦、咸,具有破血通经,逐淤消癥的功效。地龙性寒,味咸,可清热定惊,通络,平喘,利尿[2]。两者相须使用能增强活血化瘀之功,临床常用于治疗中风类疾病[3]。疏血通注射液疗效确切,现代药理研究表明其具有溶栓、扩张血管、改善血液流变学、抑制血小板聚集、调节血脂、保护神经细胞等药理作用[4-7],临床被广泛应用于治疗缺血性脑血管疾病、慢性肾功能衰竭、高血脂症、糖尿病及其并发症[8-11]。
疏血通注射液的化学成分复杂,其药效物质基础尚不明确。有关疏血通注射液的研究主要集中在药理方面,而对其成分及含量测定的研究报道较少,目前仅报道过氨基酸及多肽类[12-13]、短链脂肪酸[14]、微量元素[15]和糖类[16]的含量测定,疏血通注射液的质量评价指标尚不完善。核苷类成分是动物类中药发挥药效的主要成分之一,也是鉴别地龙真伪的重要依据。次黄嘌呤作为地龙的主要药效成分之一,易于透过细胞膜,能够参与体内多种代谢过程,调节多种生物酶的活性[17]。以次黄嘌呤为代表的核苷类成分具有抗菌、抗病毒、调节免疫等作用[18]。有学者以次黄嘌呤为检测指标,单独对其进行测定研究[19-20],然而仅以次黄嘌呤作为疏血通注射液的质量评价指标,难以全面评价其质量现状。
中药指纹图谱作为一种可靠的中药质量评价模式,能够综合性地评价中药成方制剂质量的真实性和一致性,监控成品批间质量的稳定性[21]。近年来,中药指纹图谱结合多成分含量测定的方法逐渐应用于中药成方制剂的质量评价[22]。疏血通注射液中的核苷类化合物作为其主要活性成分之一,对人体的免疫系统、神经系统、心血管系统均发挥着重要作用[23-24]。因此,本研究建立了33批疏血通注射的超高液相色谱(UPLC)指纹图谱,同时对其中的尿嘧啶、次黄嘌呤、黄嘌呤、肌苷、鸟嘌呤核苷进行含量测定,以期为疏血通注射液的质量评价提供参考。
1 仪器、试剂与药物 1.1 仪器Waters Acquity超高效液相色谱仪(美国Waters公司),配有在线脱气机、二元泵、恒温自动进样器、柱温箱和二极管阵列检测器(PAD);AX 205型十万分之一天平(瑞士MettlerToledo公司);Milli-Q超纯水制备仪(Millipore公司);XW-80A型旋涡混合器(上海沪西分析仪器厂)。
1.2 试剂与药物尿嘧啶(批号:T14A8X33880)、次黄嘌呤(批号:TM0313XC13)、黄嘌呤(批号:AJ0722MA14)、肌苷(批号:TM0313XA13)、鸟嘌呤核苷(批号:KM0522CA14)均购自上海源叶生物科技有限公司,纯度均≥98%;33个批次的疏血通注射液(编号S1~S33)均购自牡丹江友搏药业有限责任公司,具体信息见表 1。乙腈(色谱纯)购自美国Fisher公司;甲酸(色谱纯)购自美国ROE公司;超纯水为实验室自制。
色谱柱:ACQUITY UPLC BEH Amide柱(2.1 mm×100 mm,1.7 μm);流动相:A相为0.1%甲酸水,B相为乙腈;梯度洗脱,洗脱梯度:0~1 min,97%~86% B;1~8 min,86%~65% B;8~9 min,65%~97% B;流速:0.3 mL/min;柱温:25 ℃;进样量:1 μL;检测波长:254 nm。
2.2 溶液的制备 2.2.1 对照品溶液的制备分别精密称取尿嘧啶、次黄嘌呤对照品2.0 mg,取10 mL容量瓶,用超纯水定容至10 mL,配制成分别含尿嘧啶、次黄嘌呤200 μg/mL的储备液;分别精密称取黄嘌呤、鸟嘌呤核苷对照品1.0 mg,加超纯水定容至10 mL,配制成分别含黄嘌呤、鸟嘌呤核苷100 μg/mL的储备液;精密称取肌苷对照品5.0 mg,加超纯水定容至5 mL,配制成含肌苷1 mg/mL的储备液,4 ℃冰箱储存备用。
2.2.2 样品溶液的制备精密吸取不同批次疏血通注射液(S1~S33)各1 mL,用超纯水稀释5倍,4 ℃冰箱储存备用。
2.3 指纹图谱研究 2.3.1 精密度实验精密吸取100 μL“2.2.2”项下制备的疏血通供试品溶液(S16),按“2.1”项下色谱条件连续进样6次。各色谱峰峰面积的RSD值在0.48%~4.03%,相对保留时间的RSD值在0.01%~0.08%,表明该方法精密度较好,具体结果见表 2。

|
取疏血通注射液(S16)按“2.2.2”项下方法制备6份,分别按“2.1”项下色谱条件进样,各色谱峰峰面积的RSD值在0.23%~4.24%,相对保留时间的RSD值在0.01%~0.07%,表明该方法重复性较好,具体结果见表 2。
2.3.3 稳定性实验精密吸取100 μL“2.2.2”项下制备的供试品溶液(S16),分别在室温下放置0、2、4、6、8、12 h后,按“2.1”项下色谱条件进样,各色谱峰峰面积的RSD值在0.65%~5.29%,相对保留时间的RSD值在0.01%~0.21%,表明样品室温放置12 h稳定,具体结果见表 2。
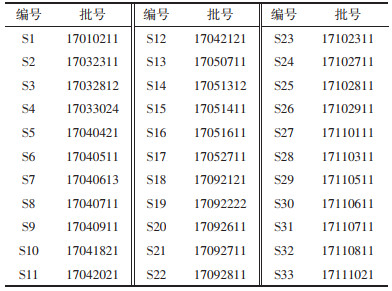
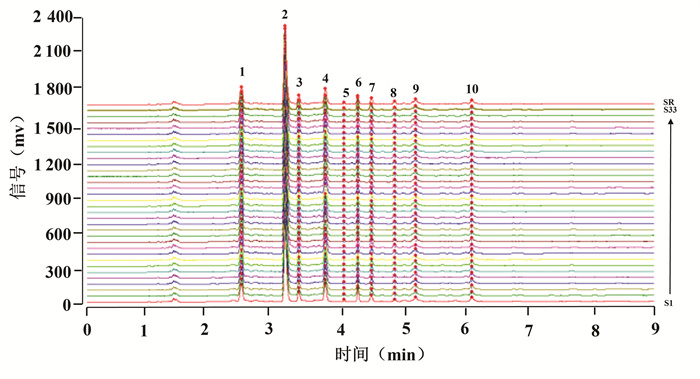
2.3.4 指纹图谱的建立及相似度分析分别精密吸取“2.2.2”项下制备的33批供试品溶液(S1~S33)各100 μL,按照“2.1”项色谱条件分别测定,得到不同批次的疏血通注射液UPLC图谱。使用中药色谱指纹图谱相似度评价软件(2.0版,国家药典委员会,2010),以S1为参照色谱图,对33批疏血通注射液的实验数据进行分析,得到33个不同批次的疏血通注射液指纹图谱和对照指纹图谱R,见图 1。共标定出10个共有峰,以对照图谱R为参考,33批疏血通注射液相似度均高于0.998,具体结果见表 3。
|
| 注:1.尿嘧啶;2.次黄嘌呤;3.黄嘌呤;4.肌苷;7.鸟嘌呤核苷。 图 1 33批疏血通注射液UPLC指纹图 Fig. 1 UPLC fingerprint of 33 batches of Shuxuetong Injection |
精密取100 μL“2.2.2”项下制备的供试品溶液(S16)、对照品溶液及供试品溶液按照“2.1”项色谱条件分别测定,记录UPLC色谱图,见图 2。次黄嘌呤作为参照峰,以色谱峰保留时间为依据,通过与对照品比对指认出5个已知峰,分别为尿嘧啶(1号峰)、次黄嘌呤(2号峰)、黄嘌呤(3号峰)、肌苷(4号峰)、鸟嘌呤核苷(7号峰)。
|
| 注:1.尿嘧啶;2.次黄嘌呤;3.黄嘌呤;4.肌苷;7.鸟嘌呤核苷。 图 2 样品色谱图(A)和对照品色谱图(B) Fig. 2 Sample chromatogram (A) and control chromatogram (B) |
取各对照品储备液适量,用超纯水配制成含尿嘧啶、黄嘌呤、肌苷、鸟嘌呤核苷25 μg/mL;含次黄嘌呤50 μg/mL的混合对照品溶液,将此溶液用超纯水依次稀释2.5、2、2、2.5、2倍,得6个浓度的对照品混合溶液。取各浓度的上述溶液,按照“2.1”项下色谱条件进样分析。以各对照品峰面积(Y)为纵坐标,对照品浓度(X)为横坐标,得到尿嘧啶、次黄嘌呤、黄嘌呤、肌苷、鸟嘌呤核苷的回归方程。将该混合对照品溶液逐步稀释,分别以S/N≥3和S/N≥10时各对照品的浓度作为最低检测限(LLOD)和最低定量限(LLOQ)。结果见表 4。
|
精密吸取100 μL“2.2.2”项下制备的供试品溶液(S16),按“2.1”项下色谱条件连续进样6次。记录5种成分峰面积,计算得尿嘧啶、次黄嘌呤、黄嘌呤、肌苷和鸟嘌呤核苷的RSD值分别为2.2%、1.9%、2.4%、2.3%、2.4%,表明该方法日内精密度较好。
精密吸取100 μL“2.2.2”项下制备的供试品溶液(S16),按“2.1”项下色谱条件重复进样2次,连续进样3 d。记录5种成分峰面积,计算得尿嘧啶、次黄嘌呤、黄嘌呤、肌苷和鸟嘌呤核苷的RSD值分别为1.5%、1.7%、3.2%、1.5%、3.7%,表明该方法日间精密度良好。
2.4.3 重复性实验取疏血通注射液(S16)按“2.2.2”项下方法制备6份,分别按“2.1”项下色谱条件进样。记录5种化合物的含量,计算得尿嘧啶、次黄嘌呤、黄嘌呤、肌苷和鸟嘌呤核苷的RSD值分别为0.6%、0.6%、0.9%、1.7%、3.0%,表明该方法重复性较好。
2.4.4 稳定性实验精密吸取100 μL“2.2.2”项下制备的供试品溶液(S16),分别在室温下放置0、2、4、6、8、12 h后,按“2.1”项下色谱条件进样,记录5种成分色谱峰峰面积,计算得尿嘧啶、次黄嘌呤、黄嘌呤、肌苷和鸟嘌呤核苷的RSD值分别为1.1%、1.9%、2.6%、1.5%、2.4%,结果表明样品室温放置12 h稳定。
2.4.5 加样回收率实验取已知含量的疏血通注射液6份(S16),加入一定量混合对照品溶液涡旋混合完全,按“2.1”项下色谱条件进样分析,计算得尿嘧啶、次黄嘌呤、黄嘌呤、肌苷和鸟嘌呤核苷的加样回收率分别为99.9%、100.0%、108.4%、95.1%、104.6%,RSD值分别为0.9%、0.9%、1.3%、1.1%、1.7%,具体结果见表 5。
|
分别精密吸取“2.2.2”项下制备的33批供试品溶液(S1~S33)各100 μL,并根据已建立的色谱分析方法进行测定,计算得不同批次中尿嘧啶、次黄嘌呤、黄嘌呤、肌苷、鸟嘌呤核苷5种核苷类成分的平均含量分别为34.57、153.50、52.76、53.23、14.46 μg/mL,测定结果见图 3。
|
| 图 3 不同批次中5种核苷类成分的平均含量 Fig. 3 Average content of five nucleoside components in different batches |
疏血通注射液中化学成分复杂,主要包括蛋白质、多肽、氨基酸、酶类、酯类、核苷酸类、金属微量元素等。核苷类成分是人体代谢必不可少的成分,也是动物类中药发挥功效的主要成分。其由碱基和核糖两部分组成,碱基主要包括腺嘌呤、鸟嘌呤、尿嘧啶等,而次黄嘌呤、黄嘌呤是腺嘌呤、鸟嘌呤的中间体。核苷类成分不仅是组成DNA、RNA单体的前体,也是生物氧化及代谢过程中的能源物质,并参与调节生物体内多种生理代谢过程[25]。核苷类成分具有多种生物学活性[26],如肌苷能够调节人体免疫功能,保护肝细胞[27];鸟苷通过增强巨噬细胞的释放来调节免疫功能[28];尿苷可以调节体温以及控制能量平衡[29]。因此,核苷类成分可以作为疏血通注射液质量评价指标之一。
本研究建立了33批疏血通注射液UPLC指纹图谱,相似度分析结果显示,其与对照图谱R的相似度均在0.998以上,提示33批疏血通注射液的化学成分基本一致。33批样品共标定了10个共有峰,其中有5个已知峰,分别为尿嘧啶、次黄嘌呤、黄嘌呤、肌苷、鸟嘌呤核苷。同时建立了此5种核苷类成分含量测定的方法。结果表明,33个批次中各化合物含量差异不大,疏血通注射液的制备工艺相对稳定。五个化合物中次黄嘌呤平均含量最高,为153.50 μg/mL;鸟嘌呤核苷平均含量最低,为14.46 μg/mL;尿嘧啶、黄嘌呤、肌苷平均含量分别为34.57、52.76、53.23 μg/mL。
综上所述,本实验建立了疏血通注射液UPLC指纹图谱和5种核苷类成分的定量方法。此方法稳定可靠、操作简便,可以为疏血通注射液的质量评价提供参考。
| [1] |
姜俊杰, 廖星, 谢雁鸣. 疏血通注射液安全性证据体的构建[J]. 中国中药杂志, 2014, 39(18): 3630-3632. JIANG J J, LIAO X, XIE Y M. Building safety evidence body of Shuxuetong Injection[J]. China Journal of Chinese Materia Medica, 2014, 39(18): 3630-3632. |
| [2] |
国家药典委员会. 中华人民共和国药典[S]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the people's republic of China[S]. Beijing: China Medical Science Press, 2020. |
| [3] |
王新志, 许可可. 虫类药治疗中风研究现状[J]. 北京中医药, 2015, 34(7): 526-528. WANG X Z, XU K K. Research status of insect drugs in treating stroke[J]. Beijing Journal of Traditional Chinese Medicine, 2015, 34(7): 526-528. DOI:10.16025/j.1674-1307.2015.07.006 |
| [4] |
SUN W, ZHANG L S, FANG Z R, et al. Shuxuetong Injection and its peptides enhance angiogenesis after hindlimb ischemia by activating the MYPT1/LIMK1/Cofilin pathway[J]. Journal of Ethnopharmacology, 2022, 292: 115166. DOI:10.1016/j.jep.2022.115166 |
| [5] |
张胜碧, 刘燕玲, 徐俪颖. 疏血通注射液对急性肺栓塞大鼠的保护作用及对细胞凋亡的影响[J]. 中国医药导报, 2022, 19(8): 5-10. ZHANG S B, LIU Y L, XU L Y. Protective effect of Shuxuetong Injection on acute pulmonary embolism rats and its effect on cell apoptosis[J]. China Medical Herald, 2022, 19(8): 5-10. |
| [6] |
崔晓燕, 王圣, 岑运光, 等. 疏血通注射液联合瑞舒伐他汀治疗急性脑梗死疗效及对血脂和炎性因子的影响[J]. 中华中医药学刊, 2021, 39(6): 213-216. CUI X Y, WANG S, CEN Y G, et al. Effect of Shuxuetong Injection combined with rosuvastatin on patients with acute cerebral infarction and its effect on blood lipids and inflammatory factors[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(6): 213-216. |
| [7] |
YU H X, HAN M R, LIN W, et al. Efficacy of Chinese herbal injections for the treatment of primary nephrotic syndrome: a Bayesian network meta-analysis of randomized controlled trials[J]. Frontiers in Pharmacology, 2020, 11: 579241. DOI:10.3389/fphar.2020.579241 |
| [8] |
赵佳源, 王小玲, 王小芳, 等. 疏血通注射液治疗进展性卒中有效性的Meta分析及GRADE证据质量评价[J]. 中国中药杂志, 2022, 47(3): 807-818. ZHAO J Y, WANG X L, WANG X F, et al. Meta-analysis and GRADE evaluation of Shuxuetong Injection in treatment of stroke in progressive[J]. China Journal of Chinese Materia Medica, 2022, 47(3): 807-818. |
| [9] |
吴婉玉, 左毅, 廖峻. 疏血通注射液联合吡拉西坦对高血压并急性脑梗死患者的临床疗效[J]. 中成药, 2021, 43(5): 1195-1199. WU W Y, ZUO Y, LIAO J. Clinical effects of Shuxuetong Injection combined with piracetam on hypertensive patients with acute cerebral infarction[J]. Chinese Traditional Patent Medicine, 2021, 43(5): 1195-1199. |
| [10] |
李夏, 李博, 王天园, 等. 疏血通注射液治疗糖尿病周围神经病变有效性和安全性的系统评价与Meta分析[J]. 中国中药杂志, 2022, 47(11): 3088-3094. LI X, LI B, WANG T Y, et al. Systematic review and Meta-analysis of efficacy and safety of Shuxuetong injection in treatment of diabetic peripheral neuropathy[J]. China Journal of Chinese Materia Medica, 2022, 47(11): 3088-3094. |
| [11] |
李瑞, 樊振. 疏血通注射液对急诊室急性ST段抬高型心肌梗死患者血流变学水平的影响[J]. 辽宁中医杂志, 2019, 46(12): 2586-2589. LI R, FAN Z. Effect of Shuxuetong Injection on hemorrheology level of acute ST-segment elevation myocardial infarction in emergency room[J]. Liaoning Journal of Traditional Chinese Medicine, 2019, 46(12): 2586-2589. |
| [12] |
鄢丹, 张毅, 韩玉梅, 等. HPLC-ELSD法测定疏血通注射液中17种未衍生氨基酸含量[J]. 药物分析杂志, 2007, 27(4): 558-560. YAN D, ZHANG Y, HAN Y M, et al. HPLC-ELSD direct determination of 17 underivatized amino acids in Shuxuetong Injection[J]. Chinese Journal of Pharmaceutical Analysis, 2007, 27(4): 558-560. |
| [13] |
蔡子微, 袁晓环, 关世民, 等. 疏血通注射液氨基酸及多肽的检测[J]. 中国药学杂志, 2005, 40(18): 1418-1420. CAI Z W, YUAN X H, GUAN S M, et al. Determination of amino acid and peptides in Shuxuetong Injection[J]. Chinese Pharmaceutical Journal, 2005, 40(18): 1418-1420. |
| [14] |
金滢, 张金兰, 贾志鑫, 等. 柱前衍生化HPLC法测定疏血通注射液及其原药材中糖的含量[J]. 中国新药杂志, 2013, 22(1): 111-115, 122. JIN Y, ZHANG J L, JIA Z X, et al. Determination of saccharide in Shuxuetong Injection, hirudo and pheretima by HPLC with pre-column derivatization method[J]. Chinese Journal of New Drugs, 2013, 22(1): 111-115, 122. |
| [15] |
李灵云, 倪开岭, 李敏, 等. 气相色谱法快速测定疏血通注射液中乙酸、丙酸、丁酸的含量[J]. 天津中医药, 2020, 37(1): 99-103. LI L Y, NI K L, LI M, et al. Rapid determination of acetic acid, propionic acid and butyric acid in Shuxuetong Injection by gas chromatography[J]. Tianjin Journal of Traditional Chinese Medicine, 2020, 37(1): 99-103. |
| [16] |
陈艳明, 张忠兵, 姜威. ICP-MS快速测定疏血通注射液中多种元素的含量[J]. 中国现代中药, 2016, 18(2): 222-224. CHEN Y M, ZHANG Z B, JIANG W. Rapid determination of various elements content in Shuxuetong Injection by ICP-MS[J]. Modern Chinese Medicine, 2016, 18(2): 222-224. |
| [17] |
杨媛媛, 郭兆刚, 孙玉坤, 等. HPLC法测定蝮龙抗栓丸中次黄嘌呤和肌苷的含量[J]. 武警后勤学院学报(医学版), 2021, 30(3): 22-25. YANG Y Y, GUO Z G, SUN Y K, et al. Determination of hypoxanthine and carnine in fulong Kangshuan Pill by HPLC[J]. Journal of Logistics University of PAP (Medical Sciences), 2021, 30(3): 22-25. |
| [18] |
王献瑞, 赵西子, 王晓明, 等. 固相萃取LC-MS/MS法测定疏血通注射液中次黄嘌呤浓度[J]. 天津中医药大学学报, 2019, 38(5): 478-481. WANG X R, ZHAO X Z, WANG X M, et al. SPE-LC-MS/MS method for determination of hypoxanthine concentration in Shuxuetong Injection[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2019, 38(5): 478-481. |
| [19] |
顾健, 王云峰, 施天慧. 疏血通注射液的提取工艺和质量控制[J]. 当代医学, 2019, 25(18): 91-93. GU J, WANG Y F, SHI T H. Shuxuetong Injection of the extraction process and quality control[J]. Contemporary Medicine, 2019, 25(18): 91-93. |
| [20] |
袁晓环, 王春涛, 胡静. 高效液相色谱检测疏血通注射液中次黄嘌呤[J]. 中国生化药物杂志, 2008, 28(3): 192-194. YUAN X H, WANG C T, HU J. Determination of hypoxanthine in Shuxuetong Injection by HPLC[J]. Chinese Journal of Biochemical Pharmaceutics, 2008, 28(3): 192-194. |
| [21] |
邹纯才, 鄢海燕. 中国中药色谱指纹图谱相似度评价方法30年(1988—2017年)研究进展与展望[J]. 中国中药杂志, 2018, 43(10): 1969-1977. ZOU C C, YAN H Y. Research progress on chromatographic fingerprint similarity evaluation method for traditional Chinese medicine in the past 30 years (1988-2017) and its prospect[J]. China Journal of Chinese Materia Medica, 2018, 43(10): 1969-1977. |
| [22] |
鄢海燕, 邹纯才. 《中国药典》(2010年版~2020年版)中药指纹(特征)图谱应用进展与展望[J]. 南方医科大学学报, 2022, 42(1): 150-155. YAN H Y, ZOU C C. Progress and prospect of application of traditional Chinese medicine fingerprint (specific chromatogram) in Chinese pharmacopoeia (2010-2020)[J]. Journal of Southern Medical University, 2022, 42(1): 150-155. |
| [23] |
孙塑伦, 高颖, 孙建宁, 等. 疏血通注射液治疗缺血性脑血管病临床应用专家共识[J]. 中医杂志, 2018, 59(2): 175-180. SUN S L, GAO Y, SUN J N, et al. Expert consensus on clinical application of Xuetong Injection in treating ischemic cerebrovascular disease[J]. Journal of Traditional Chinese Medicine, 2018, 59(2): 175-180. |
| [24] |
李静, 朱静毅. 核苷类化合物含量测定方法的研究进展[J]. 天津药学, 2013, 25(6): 53-55. LI J, ZHU J Y. Research progress of determination methods of nucleoside compounds[J]. Tianjin Pharmacy, 2013, 25(6): 53-55. |
| [25] |
张元杰, 钱正明, 陈肖家, 等. HPLC法同时测定补益中药中尿苷、腺嘌呤、鸟苷和腺苷的含量[J]. 药物分析杂志, 2010, 30(1): 33-36. ZHANG Y J, QIAN Z M, CHEN X J, et al. Simultaneous HPLC determination of uridine, adenine, guanosine, and adenosine in six tonic traditional Chinese medicines[J]. Chinese Journal of Pharmaceutical Analysis, 2010, 30(1): 33-36. |
| [26] |
丁兴杰, 熊亮, 周勤梅, 等. 天然核苷类成分的化学结构和药理活性研究进展[J]. 成都中医药大学学报, 2018, 41(2): 102-108. DING X J, XIONG L, ZHOU Q M, et al. Advances in studies on chemical structure and pharmacological activities of natural nucleosides[J]. Journal of Chengdu University of Traditional Chinese Medicine, 2018, 41(2): 102-108. |
| [27] |
周明, 胡亮, 黄婧, 等. LC-MS法测定肌苷片和肌苷口服溶液中的杂质[J]. 华西药学杂志, 2021, 36(5): 574-578. ZHOU M, HU L, HUANG J, et al. Determinnation of impurities in inosine tablets and inosine oral solution by LC-MS[J]. West China Journal of Pharmaceutical Sciences, 2021, 36(5): 574-578. |
| [28] |
王勋, 罗珊珊, 蒋嘉烨, 等. 鸟苷对大鼠胸主动脉血管环的舒张作用及机制[J]. 中国药理学通报, 2011, 27(11): 1540-1543. WANG X, LUO S S, JIANG J Y, et al. Effect of guanosine on rat isolated thoracic arterial rings[J]. Chinese Pharmacological Bulletin, 2011, 27(11): 1540-1543. |
| [29] |
叶雅红, 邓春霞, 高凌. 尿苷对物质代谢影响的研究进展[J]. 中国医药, 2022, 17(7): 1104-1106. YE Y H, DENG C X, GAO L. Research progress of uridine on substance metabolism[J]. China Medicine, 2022, 17(7): 1104-1106. |
2. National Clinical Research Center for Chinese Medcine Acupuncture and Moxibastion, Tianjin 301617, China;
3. State Key Laboratory of Component-based Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40