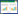文章信息
- 韩春生, 闻涛, 周伟, 慎浩鑫
- HAN Chunsheng, WEN Tao, ZHOU Wei, SHEN Haoxin
- 小檗碱通过调控ELK-3抑制人肝癌细胞的上皮-间质转化
- Berberine inhibits the epithelial-mesenchymal transition of human liver cancer cells by regulating ELK-3
- 天津中医药, 2023, 40(3): 395-401
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(3): 395-401
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.03.19
-
文章历史
- 收稿日期: 2022-11-15
2. 信阳市第三人民医院神经内科, 信阳 464000;
3. 信阳市第三人民医院普外科, 信阳 464000
肝癌是全球癌症相关的第三大原因,其恶性程度高,易复发,易转移并且病死率高的肿瘤之一[1]。80%肝癌患者主要是由慢性病毒肝炎、乙醇滥用、代谢综合征、DNA损伤和环境毒素等引起[2]。最新研究发现上皮-间质转化在肝癌的发生发展过程中发挥重要作用[3]。近年肝癌的临床治疗手段有手术,放疗和介入治疗等,但肝癌发病机制复杂,并且预后效果差,生存率低[4]。因此,迫切需要寻找治疗肝癌的药物。
小檗碱,又称黄连素,属于异喹啉生物碱,主要用于临床治疗胃肠炎,细菌性痢疾等疾病[5]。研究表明,小檗碱对胃癌、肝癌、结肠癌等多种恶性肿瘤均有抑制作用,其主要是抑制肿瘤细胞的增殖,诱导肿瘤细胞的凋亡等[6-8]。小檗碱可以抑制乙型转化生长因子-1(TGF-β1)诱导的肝癌HepG2细胞的迁移和侵袭能力[9]。小檗碱能与肿瘤细胞中DNA分子直接结合,从而调控肿瘤相关基因的转录和表达,从而调控肿瘤细胞的增殖、侵袭和转移,最终抑制肿瘤的发生[10]。
转录因子ELK-3是丝裂原活化蛋白激酶(MAPK)信号通路下游靶点,参与多种生理和病理过程中,如细胞迁移、血管新生和伤口愈合[11]。研究表明,ELK-3在肝癌细胞中高表达,促进肝癌细胞的侵袭和迁移[12]。当ELK-3沉默后,上皮-间质转化受到阻碍,并且MAPK信号通路受到抑制[13]。目前,小檗碱和ELK-3对肝癌细胞的上皮-间质转化作用尚不明确。基于此,本研究分析小檗碱和ELK-3在肝癌细胞HuH7中的作用,观察ELK-3的靶基因EGR-1、上皮-间质转化相关因子波形蛋白(vimentin)和钙黏附素E蛋白(E-cadherin)的表达量以及TGF-β1/MAPK信号通路的变化,通过划痕实验和Transwell小室实验检测对细胞迁移和侵袭能力的影响。
1 材料与方法 1.1 细胞、主要试剂及试剂盒HuH7细胞(中科院上海细胞库);FBS胎牛血清、DMEM培养基和0.05%的胰蛋白酶(Gibco,美国);pcDNA3.1-ELK-3慢病毒和pcDNA3.1慢病毒(上海吉凯基因科技有限公司,中国);Trizol试剂和BCA试剂(Invitrogen,Thermo Fisher Scientific,lnc.,美国);0.25%甲紫溶液(索莱宝科技有限公司,中国);Transwell小室(密理博科技有限公司,中国);PrimeScript RT试剂盒(Takara Biotechnology,日本);SYBR-Green实时荧光定量聚合酶链反应(qPCR)Master Mix(北京康润诚业生物科技有限公司,中国);RIPA缓冲液、一抗稀释液、二抗稀释液、聚丙烯酰氨凝胶电泳(SDS-PAGE)和聚偏二氟乙烯(PVDF)膜(上海碧云天生物技术有限公司,中国);鼠抗人E-cadherin、vimentin、ELK-3、重组人早期生长反应蛋白-1(EGR-1)、TGF-β1、细胞外调节蛋白激酶(ERK1/2)、磷酸化细胞外调节蛋白激酶(p-ERK1/2)、p38、磷酸化p-38(p-p38)和GAPDH单分子抗体(Cell Signaling Technology,Inc.,美国);兔抗鼠二抗(Cell Signaling Technology,Inc.,美国);超敏发光液ECL(北京四正柏生物科技有限公司,中国)。
1.2 实验方法 1.2.1 细胞培养HuH7细胞通过常规复苏后,用含10% FBS的DMEM培养液,于37 ℃ 5% CO2的培养箱中进行培养。隔日进行传代1次,实验使用细胞为对数生长期的细胞。
1.2.2 细胞转染和分组将HuH7细胞接种于6孔板,待其长至密度40%~50%后,将其分为空转组、pcDNA3.1-ELK-3组、小檗碱组和小檗碱+pcDNA3.1-ELK-3组。空转组和小檗碱组是含无效序列过表达质粒的慢病毒转染HuH7细胞后,空转组加入正常培养基,而小檗碱组加入1 mL 1×10-4 mol/L小檗碱组。pcDNA3.1-ELK-3组和小檗碱+pcDNA3.1-ELK-3组是将含pcDNA3.1-ELK-3过表达质粒的慢病毒转染HuH7细胞后,pcDNA3.1-ELK-3组加入正常培养基,而小檗碱+pcDNA3.1-ELK-3组加入1 mL 1×10-4 mol/L小檗碱。具体转染步骤:分别取1 μL空载过表达慢病毒和pcDNA3.1-ELK-3慢病毒加入1 mL DMEM,混匀后再加入1 μL polybrene后,加入孔内。待转染8 h后,弃去转染液,添加正常培养基进行培养,当细胞长至80%~90%,加入8 μg嘌呤霉素进行药筛2~3 d。放在荧光倒置显微镜观察转染效率,转染率超过80%,可进行下一步实验。
1.2.3 细胞划痕实验待空转组、pcDNA3.1-ELK-3组、小檗碱组和小檗碱+pcDNA3.1-ELK-3组的HuH7细胞长至80%~90%,用10 μL枪头尖端在培养皿中央垂直划1道痕迹,用PBS洗去脱壁的细胞,于培养箱培养0、24 h后,放于倒置显微镜观察划痕两侧细胞迁移的距离,迁移率=(划痕宽度0 h-划痕宽度24 h)/划痕宽度0 h×100%。该实验需独立重复3次。
1.2.4 Transwell小室检测细胞侵袭能力100 μL的Matrigel生物胶放入Transwell小室上层培养40 min,再分别加入100 μL不含血清培养基混合1×104个空转组、pcDNA3.1-ELK-3组、小檗碱组和小檗碱+pcDNA3.1-ELK-3组的HuH7细胞。而在下室加100 μL含10% FBS的DMEM培养基,于培养箱培养12 h。用甲醇固定15 min后,再向孔内添加0.25%甲紫溶液染色30 min。将小室放在倒置显微镜下随机选取5个视野(×200),拍照记录迁移下室的细胞总数。每组设立3个复孔,实验需独立重复3次。
1.2.5 实时荧光定量逆转录聚合酶链反应(RT-qPCR)法检测相关基因mRNA表达水平将空转组、pcDNA3.1-ELK-3组、小檗碱组和小檗碱+pcDNA3.1-ELK-3组的HuH7细胞的细胞收集后,通过Trizol试剂分别提取各组总RNA。通过NanoDrop 2000分光光度计检测RNA纯度和浓度,再使用mRNA第一链cDNA合成(加尾法)试剂盒将总mRNA逆转录扩增为cDNA(反转录条件:37 ℃ 60 min,85 ℃ 5 min)。将目的模板cDNA,SYBR-Green qPCR Master Mix和对应的引物混合后进行实时荧光定量聚合酶链反应(PCR)实验。PCR扩增条件为:95 ℃预变性2 min,95 ℃变性15 s,60 ℃退火45 s,72 ℃延伸30 s,共计40个循环。以GAPDH作为mRNA的标准内参,基因表达结果均以2-ΔΔCT进行统计。本实验所有PCR引物序列见表 1。
|
将所有组细胞收集后,用蛋白裂解液(RIPA缓冲液:苯甲基碘酰氟(PMSF)抑制蛋白降解液:磷酸蛋白酶抑制剂=100∶1∶1)裂解提取总蛋白。通过BCA试剂检测蛋白质的总浓度,将各组的总蛋白浓度调为一致后,将其于100 ℃进行变性后保存至-20 ℃。SDS-PAGE电泳分离总蛋白后,将其转膜至PVDF膜。然后用5%脱脂牛奶封闭2 h,TBST洗涤3次,每次10 min后,将其放入对应的一抗(E-cadherin、vimentin、ELK-3、EGR-1、TGF-β1、ERK1/2、p-ERK1/2、p38、p-p38和GAPDH)和一抗稀释混悬液(1∶1 000)中,4 ℃孵育过夜。再用TBST洗涤3次,放入二抗和二抗稀释液(1∶4 000)混悬液中,室温孵育2 h。TBST洗涤3次,每次10 min,将超敏发光液ECL滴在膜上,放入化学发光成像仪(Invitorgen,美国)进行蛋白显影。通过Image J软件进行分析结果,相对蛋白表达以GAPDH标准化。
1.3 统计学方法应用SPSS 20.0软件对数据进行统计学处理。各组数据均服从正态分布,组间方差齐,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,析因设计资料采用析因设计方差分析。P<0.05为差异有统计学意义。
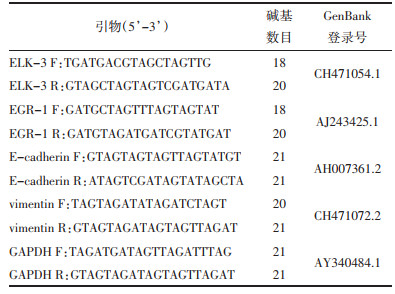
2 结果 2.1 小檗碱抑制HuH7细胞中ELK-3的表达与空转组比较,pcDNA3.1-ELK-3组的ELK-3和EGR-1基因和蛋白表达量显著增加(P<0.05),而小檗碱组的ELK-3和EGR-1基因和蛋白表达量显著减少(P<0.05)。与pcDNA3.1-ELK-3组比较,小檗碱+pcDNA3.1-ELK-3组的ELK-3和EGR-1基因和蛋白表达量显著减少(P<0.05);与小檗碱组比较,小檗碱+pcDNA3.1-ELK-3组的ELK-3和EGR-1基因和蛋白表达量显著增加(P<0.05),提示小檗碱、pcDNA3.1-ELK-3间存在交互作用,该交互作用为反向制约作用。RT-qPCR和Western Blot结果见图 1A、1B和1C。
|
| 注:A. Western Blot法检测HuH7细胞ELK-3和EGR-1蛋白表达;B.柱状图表示Western Blot统计结果;C.实时定量PCR检测HuH7细胞ELK-3和EGR-1 mRNA表达。与空转组比较,*P<0.05;与pcDNA3.1-ELK-3组比较,#P<0.05。 图 1 小檗碱对HuH7细胞内ELK-3和EGR-1的mRNA和蛋白的影响 Fig. 1 Effect of berberine on the mRNA and protein expression of ELK-3 and EGR-1 in HuH7 cells |
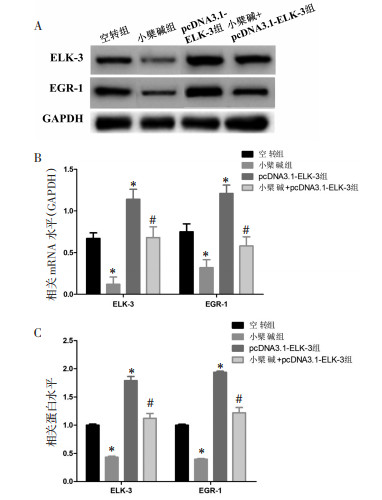
小檗碱组穿过基质胶膜的细胞数为(31±2)个显著少于空转组(63±5)个(P<0.05),pcDNA3.1-ELK-3组穿过细胞数为(115±8)个显著高于空转组(P<0.05)。与pcDNA3.1-ELK-3组比较,小檗碱+pcDNA3.1-ELK-3组穿过基质胶膜的细胞数为(75±4)个,显著低于pcDNA3.1-ELK-3组(P<0.05)。Transwell实验结果见图 2A和2B。
|
| 注:A. Transwell侵袭实验检测细胞侵袭能力(甲紫染色,×200);B.侵袭细胞数统计图。与空转组比较,*P<0.05;与pcDNA3.1-ELK-3组比较,#P<0.05。 图 2 小檗碱对过表达ELK-3的HuH7侵袭的影响 Fig. 2 Effect of berberine on invasion of HuH7 overexpressing ELK-3 |
与空转组比较,小檗碱组在24 h内迁移率减少22%(P<0.05),pcDNA3.1-ELK-3组在24 h内迁移率增加26%(P<0.05)。与pcDNA3.1-ELK-3组比较,小檗碱+pcDNA3.1-ELK-3组在24 h内迁移率减少14%(P<0.05)。划痕实验结果见图 3A和3B。

|
| 注:A.划痕愈合实验检测细胞迁移能力(相差显微镜,×200);B.划痕愈合率半定量分析。与空转组比较,*P < 0.05,与pcDNA3.1-ELK-3组比较,#P < 0.05。 图 3 小檗碱对过表达ELK-3的HuH7迁移能力的影响 Fig. 3 Effect of berberine on the migration ability of HuH7 overexpressing ELK-3 |
与空转组比较,小檗碱组的vimentin和TGF-β1蛋白以及p-ERK1/2/ERK1/2和p-p38/p38蛋白比值显著降低(P<0.05),E-cadherin蛋白表达量显著增加(P<0.05),而pcDNA3.1-ELK-3组的vimentin和TGF-β1蛋白以及p-ERK1/2/ERK1/2和p-p38/p38蛋白比值显著增加(P<0.05),E-cadherin蛋白表达量显著降低(P<0.05)。与pcDNA3.1-ELK-3组比较,小檗碱+ pcDNA3.1-ELK-3组的vimentin和TGF-β1蛋白以及p-ERK1/2/ERK1/2和p-p38/p38蛋白比值显著降低(P<0.05),E-cadherin蛋白表达量显著增加(P<0.05)。
与空转组比较,小檗碱组的vimentin基因表达量显著降低(P<0.05),E-cadherin基因表达量显著增加(P<0.05),而pcDNA3.1-ELK-3组的vimentin基因表达量显著增加(P<0.05),E-cadherin基因表达量显著减少(P<0.05)。与pcDNA3.1-ELK-3组比较,小檗碱+pcDNA3.1-ELK-3组的vimentin基因表达量显著降低(P<0.05),E-cadherin基因表达量显著增加(P<0.05)。Western Blot结果见图 4A和4C。RT-qPCR结果见图 4B。
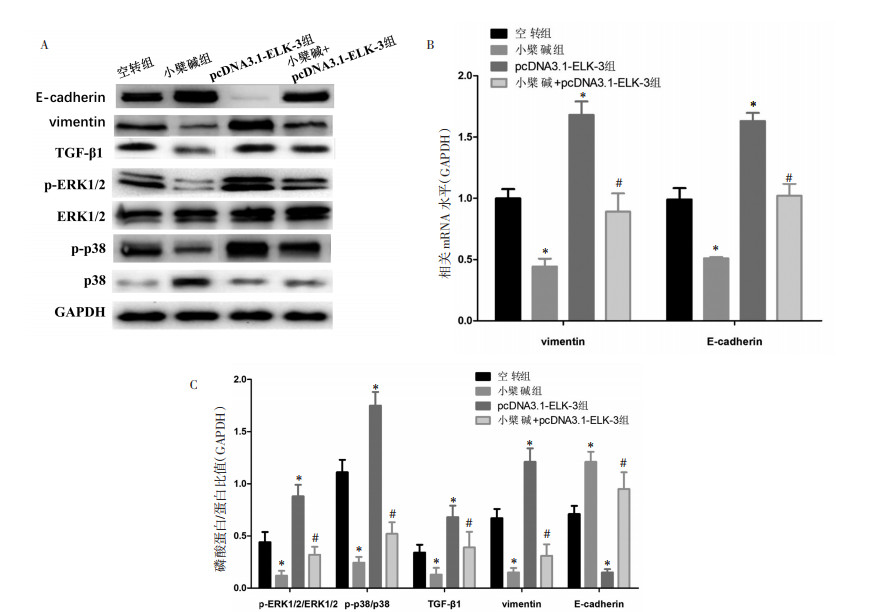
|
| 注:A. Western Blot法检测HuH7细胞vimentin、E-cadherin和TGF-β1/MAPK信号通路蛋白表达;B. RT-qPCR检测HuH7细胞vimentin、E-cadherin;C.柱状图表示Western Blot统计结果。与空转组比较,*P<0.05;与pcDNA3.1-ELK-3组比较,#P<0.05。 图 4 小檗碱对过表达ELK-3的HuH7细胞内上皮-间质转化和TGF-β1/MAPK信号通路的影响 Fig. 4 Effect of berberine on epithelial-mesenchymal transformation and TGF in HuH7 cells overexpressing ELK-3- β 1/Effect of MAPK signal pathway |
肝癌是全球6大常见癌症之一,主要发生于中老年人,病程短,预后较差,5年生存率估计低于9%,对人类健康构成严重威胁[14]。肝癌细胞发生转移时,常伴有上皮-间质转化的发生,主要是上皮细胞的表型标志物蛋白表达会减少,如E-cadherin,同时肝癌细胞的间质标志物蛋白会增加,如Vimentin[1]。肝癌细胞间黏附能力下调,迁移和侵袭能力增加,使得癌细胞向其他组织浸润,或者通过血管和淋巴管转移至远端,导致肿瘤患者的病死率增加[15]。因此,需要一种毒性低,又能抑制肝癌细胞转移,侵袭和上皮间质转化的药物尤为重要。研究表明,小檗碱具有较好的抗肿瘤作用,能诱导肝癌细胞凋亡和抑制其转移[16]。本研究结果显示,小檗碱干预HuH7细胞后,其迁移和侵袭能力明显降低,并且上皮间质转化相关蛋白Vimentin表达量显著降低,E-cadherin蛋白和基因的表达增加,说明小檗碱可以抑制上皮-间质转化,转移和侵袭能力。
本研究结果还发现,小檗碱对ELK-3和ELK-3的靶基因EGR-1蛋白和基因的表达均有抑制作用。ELK-3是Ras-MAPK信号通路的激活剂,具有抑制原癌基因c-fos转录的作用[17]。研究表明,ELK-3通过MAPK信号通路调控上皮-间质转化,从而促进肝纤维化的进展,也是肝癌发生发展的重要靶点[13]。本研究为了验证小檗碱是否通过ELK-3发挥作用,通过过表达HuH7中ELK-3后,再加入小檗碱干预,观察细胞的迁移,侵袭和上皮-间质转化能力。结果表明,小檗碱可以逆转ELK-3过表达引发的Huh7细胞的迁移和侵袭以及上皮-间质转化相关蛋白(E-cadherin、Vimentin)的表达,主要是通过抑制ELK-3基因和蛋白的表达。Western Blot结果显示,小檗碱干预Huh7细胞后,TGF-β蛋白表达量以及p-ERK1/2/ERK1/2和p-p38/p38蛋白比值明显受到抑制,说明小檗碱可调控TGF-β/MAPK信号通路。当在Huh7细胞中过表达ELK-3后,TGF-β1蛋白表达量以及p-ERK1/2/ERK1/2和p-p38/p38蛋白比值增加,这也与ELK-3是MAPK信号通路的激活剂结论相符合。当小檗碱干预过表达ELK-3的HuH7细胞后,TGF-β1/MAPK信号通路明显受到抑制,主要表现在TGF-β1蛋白表达量下降,ERK1/2和p38磷酸化减少。提示小檗碱可以逆转ELK-3过表达激活的TGF-β1/MAPK信号通路。
综上所示,小檗碱通过抑制ELK-3的表达,阻碍TGF-β1/MAPK信号通路传导,减少Vimentin蛋白表达,增加E-cadherin蛋白表达,从而抑制人肝癌细胞的上皮-间质转化,侵袭和迁移能力。本研究初步分析和体外验证在人肝癌细胞内,小檗碱和ELK-3的关系,未曾进行体内实验验证。本课题组下一步将在体内基础上深入研究小檗碱和ELK-3的作用,并且分析两者对肝癌细胞的上皮-间质转化作用。
| [1] |
CEAUSU A R, CIOLOFAN A, CIMPEAN A M, et al. The mesenchymal-epithelial and epithelial-mesenchymal cellular plasticity of liver metastases with digestive origin[J]. Anticancer Research, 2018, 38(2): 811-816. |
| [2] |
WAN H Q, LI J M, ZHANG K D, et al. A new meroterpenoid functions as an anti-tumor agent in hepatoma cells by downregulating mTOR activation and inhibiting EMT[J]. Scientific Reports, 2018, 8(1): 13152. DOI:10.1038/s41598-018-31409-2 |
| [3] |
MARIN J J G, MACIAS R I R, MONTE M J, et al. Molecular bases of drug resistance in hepatocellular carcinoma[J]. Cancers, 2020, 12(6): 1663. DOI:10.3390/cancers12061663 |
| [4] |
ANWANWAN D, SINGH S K, SINGH S, et al. Challenges in liver cancer and possible treatment approaches[J]. Biochimica et Biophysica Acta Reviews on Cancer, 2020, 1873(1): 188314. DOI:10.1016/j.bbcan.2019.188314 |
| [5] |
ZHANG C H, SHENG J Y, LI G Q, et al. Effects of berberine and its derivatives on cancer: a systems pharmacology review[J]. Frontiers in Pharmacology, 2019, 10: 1461. |
| [6] |
SHENG Z, SUN Y, ZHU R X, et al. Functional cross-talking between differentially expressed and alternatively spliced genes in human liver cancer cells treated with berberine[J]. PLoS One, 2015, 10(11): e0143742. DOI:10.1371/journal.pone.0143742 |
| [7] |
ZHANG Q, WANG X B, CAO S J, et al. Berberine represses human gastric cancer cell growth in vitro and in vivo by inducing cytostatic autophagy via inhibition of MAPK/mTOR/p70S6K and Akt signaling pathways[J]. Biomedecine & Pharmacotherapie, 2020, 128: 110245. |
| [8] |
PARK J J, SEO S M, KIM E J, et al. Berberine inhibits human colon cancer cell migration via AMP-activated protein kinase-mediated downregulation of integrin β1 signaling[J]. Biochemical and Biophysical Research Communications, 2012, 426(4): 461-467. DOI:10.1016/j.bbrc.2012.08.091 |
| [9] |
陈春苗, 张国哲, 刘平平, 等. 小檗碱通过TGF-β/Smad通路抑制TGF-β1诱导的人肝癌HepG2细胞上皮间质转化的研究[J]. 中国药理学通报, 2020, 36(2): 261-267. CHEN C M, ZHANG G Z, LIU P P, et al. Berberine inhibits TGF-β1-induced epithelial-mesenchymal transition in human liver cancer HepG2 cells via TGF-β/Smad pathway[J]. Chinese Pharmacological Bulletin, 2020, 36(2): 261-267. DOI:10.3969/j.issn.1001-1978.2020.02.021 |
| [10] |
TAN Y L, GOH D, ONG E S. Investigation of differentially expressed proteins due to the inhibitory effects of berberine in human liver cancer cell line HepG2[J]. Molecular BioSystems, 2006, 2(5): 250-258. DOI:10.1039/b517116d |
| [11] |
李天柱, 史铁伟, 周静, 等. 干扰ELK-3抑制人肝癌细胞的上皮-间质转换[J]. 基础医学与临床, 2017, 37(2): 211-216. LI T Z, SHI T W, ZHOU J, et al. ELK-3 interference inhibits the epithelialmesenchymal transition of human hepatocellular carcinoma cells[J]. Basic & Clinical Medicine, 2017, 37(2): 211-216. DOI:10.3969/j.issn.1001-6325.2017.02.020 |
| [12] |
李天柱, 王加茹, 张俊毅, 等. ELK-3蛋白在肝癌组织中的表达及其对肝癌HepG2细胞迁移和侵袭能力的影响[J]. 吉林大学学报(医学版), 2018, 44(4): 736-740, 892. LI T Z, WANG J R, ZHANG J Y, et al. Expression of ELK-3 protein in hepatocellular carcinoma tissue and its effects on migration and invasion abilities of HepG2 cells[J]. Journal of Jilin University (Medicine Edition), 2018, 44(4): 736-740, 892. DOI:10.13481/j.1671-587x.20180408 |
| [13] |
LI T Z, KIM S M, HUR W, et al. Elk-3 contributes to the progression of liver fibrosis by regulating the epithelial-mesenchymal transition[J]. Gut and Liver, 2017, 11(1): 102-111. DOI:10.5009/gnl15566 |
| [14] |
RASHIDIAN N, ALSEIDI A, KIRKS R C. Cancers metastatic to the liver[J]. The Surgical Clinics of North America, 2020, 100(3): 551-563. DOI:10.1016/j.suc.2020.02.005 |
| [15] |
AMIN K, EL-RAYES D, SNOVER D, et al. Patterns of immunohistochemistry utilization in metastases to the liver[J]. Applied Immunohistochemistry & Molecular Morphology: AIMM, 2019, 27(6): 441-447. |
| [16] |
HUANG Y Z, WANG K Y, GU C X, et al. Berberine, a natural plant alkaloid, synergistically sensitizes human liver cancer cells to sorafenib[J]. Oncology Reports, 2018, 40(3): 1525-1532. |
| [17] |
CHEN Y H, LAYNE M D, CHUNG S W, et al. Elk-3 is a transcriptional repressor of nitric-oxide synthase 2[J]. The Journal of Biological Chemistry, 2003, 278(41): 39572-39577. DOI:10.1074/jbc.M308179200 |
2. Department of Neurology, Xinyang Third People's Hospital, Xinyang 464000, China;
3. Department of General Surgery, Xinyang Third People's Hospital, Xinyang 464000, China
 2023, Vol. 40
2023, Vol. 40