文章信息
- 张畅, 郭姗琦, 刘金锋, 等.
- ZHANG Chang, GUO Shanqi, LIU Jinfeng, et al.
- 西黄丸调控MDSCs改善乳腺癌肺转移的作用及机制研究
- Effect and mechanism of Xihuang Wan regulating MDSCs to improve lung metastasis of breast cancer
- 天津中医药, 2023, 40(4): 484-489
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(4): 484-489
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.04.14
-
文章历史
- 收稿日期: 2022-12-11
2. 平煤神马医疗集团总医院中医科, 平顶山 467000;
3. 南开大学附属南开医院中西医结合肿瘤研究中心, 天津 300102;
4. 天津医科大学总医院风湿免疫科, 天津 300052
西黄丸由清代名医王维德所创并载于《外科全生集》,其后分别在1770年《续名医类案》,1831年《外科证治全生集》,1878年《验方新编》中提及其治疗“乳岩”功效[1]。西黄丸由乳香、没药、牛黄、麝香组成,具有清热解毒,消肿散结的作用,传统用于热毒壅结所致痈疽疔毒、瘰疬、流注、癌肿等[2-3]。前期研究发现西黄丸能够抑制小鼠乳腺癌动物模型荷瘤量,而其主要活性药物是活血化瘀药乳香、没药[4]。现代药理学研究发现,活血化瘀类中药可以干预肿瘤转移,西黄丸是否影响乳腺癌肺转移值得进一步探究。
肿瘤在发生转移前,会先诱导远处器官内环境发生适应性改变,使其利于肿瘤细胞定植、生存而后形成转移灶,这种预先形成的支持性内环境被称为“转移前微环境”(PMN),其最主要的特征是免疫抑制;其中,髓源性抑制细胞(MDSCs)作为重要的负性调控细胞,是PMN免疫抑制的关键参与者[5]。当前研究发现,活血化瘀药姜黄能够诱导MDSCs分化,抑制MDSCs与肝癌细胞的相互作用;活血化瘀药桃仁也可通过降低血液中MDSCs抑制,抑制肿瘤转移[6],因此,西黄丸能否通过抑制MDSCs抑制乳腺癌肺转移值得探究。鉴于三阴性乳腺癌患者血瘀证远比其他病理类型多[7],本研究采用三阴性乳腺癌细胞株4T1小鼠荷瘤模型进行研究。
1 资料与方法 1.1 实验动物及细胞4周龄健康清洁级雌性BALB/c小鼠购自北京华阜康生物科技股份有限公司,生产许可证号:SCXK(京)2014-0004。自适应喂养1周后开始实验。所有实验均获得南开大学实验动物伦理委员会批准。乳腺癌4T1细胞购买自中国科学院上海生命科学研究院细胞资源中心。
1.2 实验药品及给药方法西黄丸(天津中新药业集团股份有限公司乐仁堂制药厂,Z12020545),乳香、没药(江苏万邦生化医药集团有限责任公司提供);阿霉素(Solarbio公司,货号:SD9280-20mg)。阿霉素注射剂:阿霉素2.5 mg,溶于10 mL 0.9%无菌生理盐水,配置成浓度为0.2 mg/mL的阿霉素注射剂,4 ℃避光保存,腹腔注射,每2 d注射1次,剂量1 mg/kg。西黄丸、乳香、没药、麝香配成100 μg/μL储备浓度,根据实验需求用培养基稀释。乳香+没药组:75 mg/kg+75 mg/kg,每日灌胃0.1 mL,每日1次;西黄丸组:150 mg/kg/d,每日灌胃0.1 mL。
1.3 主要试剂及仪器RPMI Medium 1640培养基,美国Gibco公司;胎牛血清,美国Gibco公司;0.25%胰蛋白酶,美国Gibco公司;磷酸盐缓冲溶液(PBS),中国索莱宝公司;4%的多聚甲醛固定剂,中国索莱宝公司;水合氯醛,美国默克公司;伊红染液,苏木素染液,中国索莱宝公司;红细胞裂解液,中国索莱宝公司;胶原酶D,DNase I,德国默克公司;美国CD45(PE/CY7),CD11b(EITC),Gr-1(APC),美国BioLegend公司。倒置显微镜,日本奥林巴斯株式会社;细胞培养超净台,美国Thermo公司;二氧化碳培养箱,美国Thermo公司;电热恒温水浴锅,中国泰斯特公司;低温高速迷离心机,德国Eppendorf公司;全自动组织脱水机,包埋机,切片机,德国Leica公司;流式细胞仪,中国达科为公司。
1.4 乳腺癌小鼠造模BALB/c小鼠第四对乳房右侧皮下接种3×107/0.1 mL 4T1乳腺癌细胞悬液,当肿瘤直径约为0.8 cm时,选取大小适宜,无坏死、出血,韧度适中的瘤块,剪切研磨为约2 mm3大小,移植于正常小鼠第4对乳垫下;将小鼠随机分为荷瘤对照组(Ctr)、西黄丸组(XH)、乳香+没药组(Oli+M)、阿霉素组(ADM),每日上午对照组、西黄丸组、乳香+没药组分别胃注0.9%无菌生理盐水0.1 mL;150 mg/kg西黄丸0.1 mL;乳香+没药混悬液(75 mg/kg+75 mg/kg),每日灌胃0.1 mL,每日1次;阿霉素注射剂:阿霉素组小鼠隔日腹腔注射1 mg/kg阿霉素0.1 mL。
1.5 小鼠原位肿瘤体积、质量和肺部转移瘤形成情况每周用游标卡尺测量实体瘤的长、宽,并计算实体瘤体积(cm3)=(长×宽2)/2;计算实体瘤质量/小鼠体质量;留取小鼠血液、肺组织及剥出瘤块称重、切片;抑瘤率=(对照组瘤质量-实验组瘤质量)/对照组瘤质量×100%。
1.6 免疫组化和苏木精-伊红(HE)染色取出小鼠肺脏1/3的组织,厚度约4 mm,用4%多聚甲醛固定肺组织,进行脱水、包埋、切片;将制备好的小鼠肺脏组织切片置于45 ℃的烤片机中30 min。二甲苯脱蜡后入不同浓度乙醇中水化。后进行苏木素染核、伊红染细胞质,最后脱水封片。显微镜下观察,图像采集分析。
1.7 流式细胞仪检测固定小鼠,采用眼球取血法,收集血液至含抗凝剂的收集管内;加入2倍体积红细胞裂解液混匀,冰上裂解15 min,4 ℃,2 000 r/min离心,10 min(离心半径10 cm)。弃去上清,再次重复上述过程后,加入100 μL PBS重悬细胞,取100 μL细胞悬液,分别加入5 μL CD45、CD11b,Gr-1抗体冰上孵育20 min,PBS洗涤1遍,预冷PBS重悬细胞,上机检测。
取荷瘤小鼠新鲜肺脏组织,加入胶原酶D和DNA酶消化,研磨,红细胞裂解液裂解红细胞,PBS重悬制备单细胞悬液。调整上述细胞浓度,约为1×107/mL,取100 μL细胞悬液,分别加入5 μL CD45、CD11b,Gr-1抗体冰上孵育20 min,PBS洗涤1遍,预冷PBS重悬细胞,上机检测。
1.8 统计学方法数据处理采用SPSS 21.0软件。计量资料采用均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。两个连续变量之间的线性相关关系采用Pearson积差相关分析。P < 0.05表示差异有统计学意义。
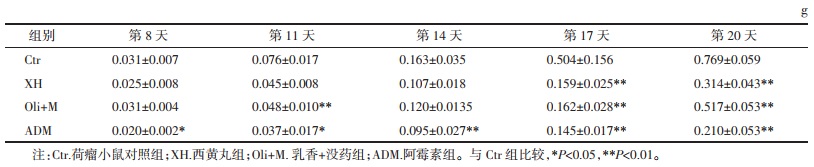
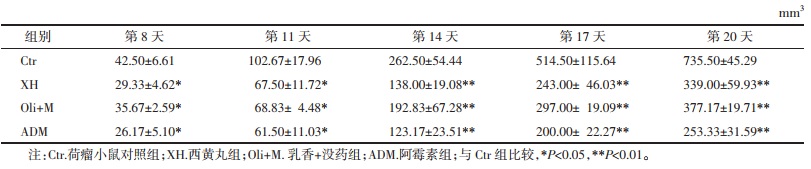
2 结果 2.1 西黄丸对乳腺癌小鼠移植瘤抑制作用与模型组比较接种第11天时,阿霉素已显示出对4T1移植瘤的抑制作用(0.076±0.017 g vs. 0.037±0.017 g,P < 0.05);接种第14天后,西黄丸组小鼠移植瘤质量较对照组出现统计学差异(0.106 7±0.015 g vs. 0.163 3±0.028 g,P < 0.05);同样小鼠瘤体体积在接种瘤块11 d后,与模型组相比,西黄丸组和阿霉素组瘤体体积较小,各治疗组体积已表现出统计学差异;接种20 d后剥离瘤块模型组小鼠瘤体体积为(735.50±45.29)mm3,西黄丸组小鼠瘤体体积为(339.00±59.53)mm3,阿霉素组小鼠瘤体体积为(253.26±31.59)mm3。表 1和2展示了各组荷瘤质量和体积改变。见图 1。
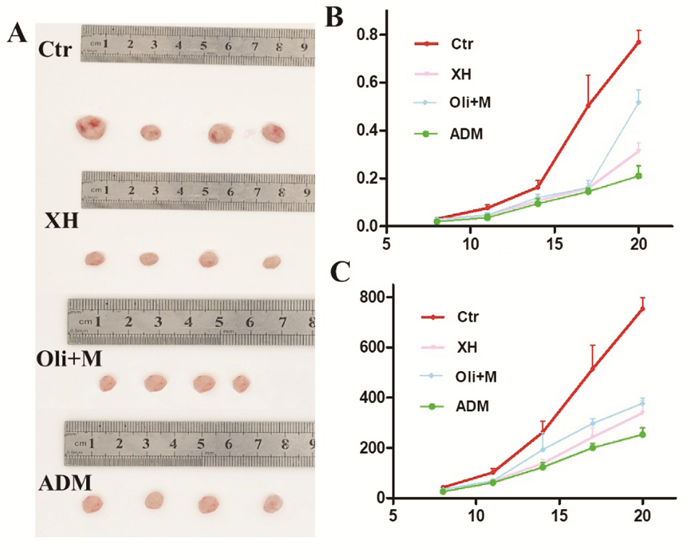
|
| 注:A.第20天小鼠荷瘤情况;B.小鼠肿瘤质量变化;C.小鼠荷肿瘤体积变化。Ctr.荷瘤小鼠对照组;XH.西黄丸组;Oli+M.乳香+没药组; 图 1 给药后各组4T1移植瘤质量和体积变化 Fig. 1 Mass and volume changes of 4T1 transplanted tumors in each group after administration |
HE染色观察小鼠肺组织结果发现,模型组在14 d时可观察到肿瘤转移灶,西黄丸组、阿霉素组均在17 d时观察到转移的肿瘤转移灶(图 2)。结果表明,西黄丸组、乳香+没药组与阿霉素组小鼠发生肺转移时间在接种瘤块14~17 d之间。
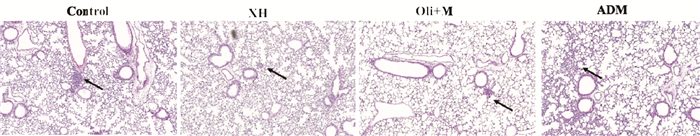
|
| 注:Ctr.荷瘤小鼠对照组;XH.西黄丸组;Oli+M. 乳香+没药组;ADM.阿霉素组。 图 2 接种后第17天各组肺组织肿瘤转移灶(×10) Fig. 2 Tumor metastasis in lung tissue of each group on day 17 after inoculation(×10) |
小鼠瘤块接种后自第8天开始取材,每3 d处死小鼠开胸取肺,20 d时,3组均发生转移,肿瘤小结节遍布全肺,肺质变硬,颜色深红(图 3A)。比较各组荷瘤小鼠肺表面结节数可知(图 3B),其中模型组转移最为明显,出现的转移肺结节数量最多,为(21.00±2.65)个;其次为阿霉素组,为(15.33±2.52)个(P < 0.05);西黄丸组和乳香没药组最少,分别为(12.33±1.53)个和(12.67±2.08)个,明显低于模型组(P < 0.01);西黄丸组和乳香+没药组抑制肺转移灶的作用与阿霉素组相比差异无统计学意义(P > 0.05)。
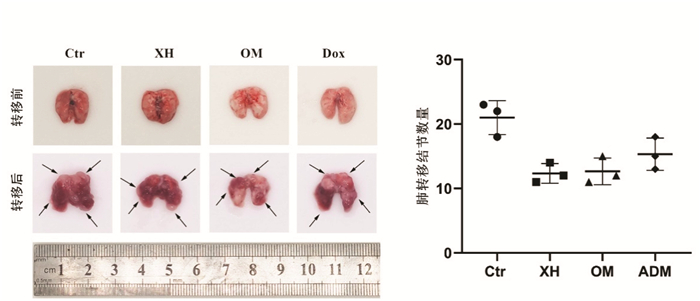
|
| 注:A.给药后各组荷瘤小鼠肺转移结节;B.各组肺转移结节数量统计。箭头所示为每组代表性肺表面转移结节;Ctr.荷瘤小鼠对照组;XH.西黄丸组;Oli+M.乳香+没药组;ADM.阿霉素组。与Ctr组比较,*P<0.05,**P<0.01。 图 3 西黄丸对荷瘤小鼠肺转移影响 Fig. 3 Effect of Xihuang Pill on lung metastasis of tumorous mice |
通过流式细胞仪对荷瘤小鼠骨髓,外周血和肺脏中的MDSCs进行检测,发现在转移前后各组MDSCs与转移程度有一定关系。在转移前(种瘤后第8天,图 4),模型组的骨髓(P < 0.01)、外周血(P < 0.01)和肺脏(P < 0.05)中MDSCs细胞比例明显高于西黄丸组和乳香没药组,而与阿霉素组没有统计学差异。在转移后(种瘤后第20天,图 5),模型组的骨髓、外周血和肺脏中MDSCs细胞比例明显高于其他3个组。相比于阿霉素组来说,西黄丸组和乳香+没药组中骨髓(P < 0.01)、外周血(P < 0.01)和肺脏(P < 0.05)的MDSCs细胞比例更低,说明在肿瘤的生长转移过程中,西黄丸可以降低小鼠体内MDSCs细胞数量。
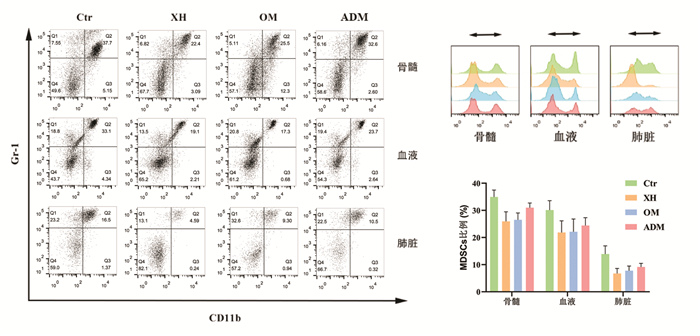
|
| 注:Ctr.荷瘤小鼠对照组;XH.西黄丸组;Oli+M.乳香+没药组;ADM.阿霉素组。与Ctr组比较,*P<0.05,**P<0.01。 图 4 转移前各组小鼠骨髓、外周血和肺脏中MDSCs的比例 Fig. 4 Proportion of MDSCs in bone marrow, peripheral blood and lung of mice in each group before metastasis |
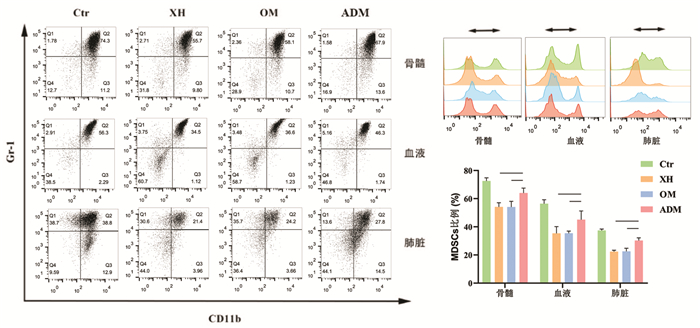
|
| 注:Ctr.荷瘤小鼠对照组;XH.西黄丸组;Oli+M.乳香+没药组;ADM.阿霉素组。与Ctr组比较,*P<0.05,**P<0.01;与ADM组比较,#P<0.05,##P<0.01。 图 5 转移后各组小鼠骨髓、外周血和肺脏中MDSCs的比例 Fig. 5 Proportion of MDSCs in bone marrow, peripheral blood and lung of mice in each group after metastasis |
小鼠乳腺癌肺转移切片中(图 6),与模型组相比,西黄丸和阿霉素可显著降低肺组织中MMP9、S100A8/A9的表达(P < 0.01)。
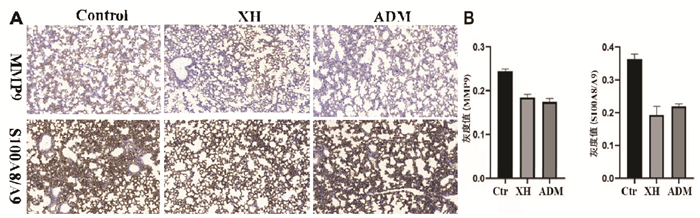
|
| 注:Ctr.荷瘤小鼠对照组;XH.西黄丸组;ADM.阿霉素组。与Ctr组比较,*P<0.05,**P<0.01。 图 6 小鼠乳腺癌肺组织中MMP9、S100A8/A9表达情况(×20) Fig. 6 Expression of MMP9, S100A8/A9 in lung tissue of mouse breast cancer (×20) |
MDSCs是一群源于造血干细胞分化出的未成熟髓系细胞,是树突状细胞、巨噬细胞和粒细胞的前体[8-9],具有免疫抑制性。乳腺癌患者外周血中MDSCs的比例比健康对照组高约10倍,MDSCs增殖与动员与乳腺癌患者不良预后及分期关系密切[10]。MDSCs的动员与招募参与了炎症微环境形成、免疫抑制、血管新生、淋巴管生成及循环肿瘤细胞定植等过程,在转移前微环境构建中发挥不可替代的作用[11-12]。通过抑制MDSCs动员及拮抗MDSCs的生物作用,干扰肿瘤转移前微环境的形成,是抗肿瘤转移的重要途径。在本研究中,西黄丸可以抑制骨髓中MDSCs的扩增,限制MDSCs进入外周血液,并影响MDSCs在靶器官肺组织中的募集。进一步来说,西黄丸可以通过影响MDSCs的免疫抑制功能来抑制乳腺癌的肺转移。不同的是,阿霉素作为治疗乳腺癌的常用药物,可以有效抑制乳腺癌细胞的活力,从癌细胞角度打破“癌细胞-转移微环境”闭环。
基质金属蛋白酶9(MMP9)在组织重构、器官发生、炎症调控和肿瘤等多种生理和病理过程中发挥作用[13]。在转移微环境形成过程中,MMP9蛋白水平是持续升高的,这对心血管的生成起到重要作用。而且,降低MMP9蛋白活性可以抑制MDSCs发挥免疫抑制作用[14]。S100A8/A9蛋白是钙结合蛋白S100蛋白家族的重要成员,具有促炎及抗炎的双重作用[15]。近年来研究发现,MDSCs具有S100A8/A9复合物受体,并通过自分泌环增强肿瘤微环境中S100A8/A9的水平[16]。通过构建三阴性乳腺癌小鼠原位瘤模型,检测西黄丸对乳腺癌原位瘤及肺转移灶的影响,研究发现,西黄丸能够抑制乳腺癌荷瘤小鼠原位瘤的生长,抑制乳腺癌肺转移,其抑制作用主要通过显著降低肿瘤微环境中MDSCs数量及降低微环境中MMP9、S100A8/A9表达相关。鉴于前期研究发现西黄丸中抗乳腺癌的主要药物为具有活血化瘀作用的乳香、没药,因此,本研究中同时设立乳香、没药药对组。通过该研究发现,乳香、没药药对对荷瘤小鼠移植瘤增殖、肺内转移均具有显著抑制作用。该研究为活血化瘀药干预乳腺癌肺转移进展的初步探索。
| [1] |
王维德. 外科证治全生集[M]. 北京: 人民卫生出版社, 2006: 99. WANG W D. Life-saving Manual of Diagnosis and Treatment of External Diseases[M]. Beijing: People's Medical Publishing House, 2006: 99. |
| [2] |
芦琴, 项景芳, 张秉. 西黄丸/胶囊辅助治疗乳腺癌有效性和安全性Meta分析[J]. 中国老年学杂志, 2015, 35(24): 7092-7094. LU Q, XIANG J F, ZHANG B. Meta-analysis of efficacy and safety of Xihuang Pill/Capsule in adjuvant treatment of breast cancer[J]. Chinese Journal of Gerontology, 2015, 35(24): 7092-7094. DOI:10.3969/j.issn.1005-9202.2015.24.056 |
| [3] |
王超, 娄彦妮. 西黄丸治疗乳腺癌的临床及实验研究进展[J]. 中日友好医院学报, 2020, 34(3): 170-172. WANG C, LOU Y N. Clinical and experimental research progress of Xihuang Pill in treating breast cancer[J]. Journal of China-Japan Friendship Hospital, 2020, 34(3): 170-172. DOI:10.3969/j.issn.1001-0025.2020.03.011 |
| [4] |
郝剑. 西黄丸通过ERα和HSP90在乳腺癌中发挥抗雌激素作用[D]. 天津: 天津医科大学, 2018. HAO J. Antiestrogenic activity of Xihuang Wan for breast cancer: targeting of ERα and HSP90[D]. Tianjin: Tianjin Medical University, 2018. |
| [5] |
TU S P, JIN H Y, SHI J D, et al. Curcumin induces the differentiation of myeloid-derived suppressor cells and inhibits their interaction with cancer cells and related tumor growth[J]. Cancer Prevention Research, 2012, 5(2): 205-215. DOI:10.1158/1940-6207.CAPR-11-0247 |
| [6] |
严令耕. 活血化瘀药及隐丹参酮对肿瘤转移的影响及机理研究[D]. 南京: 南京中医药大学, 2012. YAN L G. The effect and mechanism of Huoxuehuayu Chinese medicine and cryptotanshinone on neoplasm metastasis[D]. Nanjing: Nanjing University of Chinese Medicine, 2012. |
| [7] |
陈桂芬. 血瘀证乳腺癌与分子分型及预后关系的相关性研究[J]. 中国现代医药杂志, 2019, 21(7): 5-8. CHEN G F. Study on the relationship between breast cancer with blood stasis syndrome and molecular typing and prognosis[J]. Modern Medicine Journal of China, 2019, 21(7): 5-8. |
| [8] |
CONDAMINE T, RAMACHANDRAN I, YOUN J I, et al. Regulation of tumor metastasis by myeloid-derived suppressor cells[J]. Annual Review of Medicine, 2015, 66(3): 97-110. |
| [9] |
SAFARZADEH E, ORANGI M, MOHAMMADI H, et al. Myeloid-derived suppressor cells: important contributors to tumor progression and metastasis[J]. Journal of Cellular Physiology, 2018, 233(4): 3024-3036. DOI:10.1002/jcp.26075 |
| [10] |
PYZER A R, COLE L, ROSENBLATT J, et al. Myeloid-derived suppressor cells as effectors of immune suppression in cancer[J]. International Journal of Cancer, 2016, 139(9): 1915-1926. DOI:10.1002/ijc.30232 |
| [11] |
SCENEAY J, PARKER B S, SMYTH M J, et al. Hypoxia-driven immunosuppression contributes to the pre-metastatic niche[J]. Oncoimmunology, 2013, 2(1): e22355. DOI:10.4161/onci.22355 |
| [12] |
SAFARZADEH E, ORANGI M, MOHAMMADI H, et al. Myeloid-derived suppressor cells: Important contributors to tumor progression and metastasis[J]. Journal of Cellular Physiology, 2018, 233(4): 3024-3036. |
| [13] |
LI X, WU J F. Recent developments in patent anti-cancer agents targeting the matrix metalloproteinases(MMPs)[J]. Recent Patents on Anti-Cancer Drug Discovery, 2010, 5(2): 109-141. DOI:10.2174/157489210790936234 |
| [14] |
ZHANG J, HAN X, SHI H, et al. Lung resided monocytic myeloid-derived suppressor cells contribute to premetastatic niche formation by enhancing MMP-9 expression[J]. Molecular and Cellular Probes, 2020, 50(3): 101498. |
| [15] |
WANG S, SONG R, WANG Z, et al. S100A8/A9 in Inflammation[J]. Frontiers in Immunology, 2018, 9(1): 1298. |
| [16] |
SRIVASTAVA MK, ANDERSSON Å, ZHU L, et al. Myeloid suppressor cells and immune modulation in lung cancer[J]. Immunotherapy, 2012, 4(3): 291-304. |
2. Department of Traditional Chinese Medicine, Pingmei Shenma Medical Group General Hospital, Pingdingshan 467000, China;
3. Cancer Research Center of Integrated Chinese and Western Medicine, Nankai Hospital Affiliated to Nankai University, Tianjin 300102, China;
4. Rheumatology and Immunology Department, Tianjin Medical University General Hospital, Tianjin 300052, China
 2023, Vol. 40
2023, Vol. 40