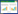文章信息
- 安子萌, 付乾芳, 薛雅若, 等.
- AN Zimeng, FU Qianfang, XUE Yaruo, et al.
- 基于网络药理学、分子对接、分子动力学模拟探讨茸菖胶囊治疗小儿癫痫的靶点机制
- Exploration of the target mechanism of Rongchang Capsule in the treatment of epilepsy in children based on network pharmacology, molecular docking and molecular dynamics simulation
- 天津中医药, 2023, 40(4): 495-505
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(4): 495-505
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.04.16
-
文章历史
- 收稿日期: 2022-10-25
2. 国家中医针灸临床医学研究中心, 天津 300193;
3. 南京中医药大学附属医院, 南京 210000
癫痫(epilepsy)是由于大脑皮层神经元异常放电,导致大脑功能短暂性障碍的神经系统疾病[1]。在儿童中,癫痫是常见的慢性神经系统疾病,影响全球0.5%~1%的儿童[2]。经过规范的抗癫痫西药治疗,有70%的患者可以得到有效的控制,然而长期服用抗癫痫西药存在一定的不良反应,且有30%的患者出现耐药[3-4]。此外,此病常共患抑郁、注意缺陷/多动障碍、自闭症等[5],给患儿及家庭造成了严重的影响。中医药治疗小儿癫痫历史悠久,基础及临床研究均已证实中医药治疗癫痫效果可靠,且在抗痫的同时具有改善认知,调节免疫,减轻西药毒副作用等优势,其作用机制与氧化应激、细胞凋亡、炎症反应、细胞自噬等通路有关[6-7]。
茸菖胶囊是天津中医药大学第一附属医院马融教授通过40余年治疗小儿癫痫的临床实践,总结出的有效经验方剂(石菖蒲、天南星、天麻、陈皮、半夏、茯苓、甘草、全蝎、僵蚕、鹿茸、菟丝子、冰片),由于癫痫患儿常合并认知障碍,马融教授认为患儿的核心病机为“肾精亏损,风痰内阻”[8],故治疗以“填精益髓,豁痰息风”法为主,注重抗痫与增智并举。
笔者团队前期研究以自噬调控、线粒体功能调控、雌激素调控为核心,探讨茸菖胶囊治疗癫痫的作用机制。1)自噬调控:茸菖胶囊可通过影响LC3 mRNA[9]、Beclin-1[10]的表达,在形成、融合阶段干预自噬过程,从而保护神经元。2)线粒体功能调控:茸菖胶囊可通过稳定线粒体膜电位、影响ATP与活性氧以及维护细胞内钙稳态,调节其凋亡信号通路相关蛋白表达[11],起到抗癫痫的作用。3)雌激素水平:茸菖胶囊可通过降低血清中雌激素水平、抑制海马神经元雌激素α、β受体减少癫痫大鼠动情期的癫痫发作[12]。4)茸菖胶囊可对负向调控通路AMPK/mTOR信号有意义,并呈时间依赖性。目前对于茸菖胶囊干预癫痫的机制研究均为单靶点或单通路,然而由于中药复方的复杂性,作用机制是通过多种活性分子作用于多种靶点,所以需要多靶点、多通路研究,随着网络药理学的发展,可以从微观角度探寻茸菖胶囊治疗癫痫的分子机制,故本文通过网络药理学、分子对接及分子动力学模拟探讨茸菖胶囊的多靶点机制。
1 资料和方法 1.1 活性成分筛选通过检索中药系统药理学数据库和分析平台(TCMSP,https://tcmsp-e.com/tcmsp.php)、中医药信息数据库(TCMID,https://bidd.group/TCMID/index.html)、中药分子机制生物信息学分析工具(BATMAN-TCM,http://bionet.ncpsb.org.cn/batman-tcm/index.php)以及文献检索,对茸菖胶囊中所含药物成份进行检索,并将检索的成份根据TCMSP数据库中口服生物利用度(OB)≥30%[13],药物相似性(DL)≥0.18[14]进行筛选,最终确定茸菖胶囊中药物生物活性成分。
1.2 生物活性成份靶点预测通过TCMSP数据库检索生物活性成分中对应的靶点名称,并根据蛋白质功能知识库(UniProt,https://www.uniprot.org/)将靶点名称通过“Reviewed”及“Human”进行筛选,转换为基因名称并删除重复靶点信息,最终获得基因名称。
1.3 潜在作用靶点预测根据癫痫疾病关键词“epilepsy”在人类基因数据库(GeneCards,https://www.genecards.org/)、在线人类孟德尔遗传数据库(OMIM,https://omim.org/)、DisGeNET数据库(https://www.disgenet.org/)中检索数据,并删除重复靶点。将疾病靶点信息与药物靶点信息取交集,得到茸菖胶囊干预癫痫的潜在靶点。
1.4 “药物-活性成分-靶点”网络构建将1.2中相关靶点与1.3的潜在作用靶点取交集,并导入到Cytoscape3.7.2软件中,构建“茸菖胶囊-活性成分-靶点”网络图,并使用Network Analyzer功能计算活性成分连接度。
1.5 蛋白相互作用(PPI)网络构建及拓扑分析将交集靶点输入到String数据库(https://string-db.org/)中,限定研究生物为人类,设置最低互作评分为0.4,并删除孤立点,获取蛋白相互作用网络关系,通过Cytoscape软件内插件CytoNCA对蛋白质相互作用关系进行分析,并筛选出大于2倍中位数的蛋白。
1.6 GO、KEGG功能富集分析使用R软件获取癫痫潜在作用靶点的基因ID,并对潜在作用靶点进行GO、KEGG富集分析,得到生物学过程富集分析(BP)、细胞组成富集分析(CC)、分子功能富集分析(MF)以及潜在的作用通路。设定pvalueCutoff = 0.05,qvalueCutoff = 0.05,最终根据p值选取排名前10、20位的绘制GO、KEGG功能富集分析图。
1.7 药物成份-靶点-KEGG网络关系图根据KEGG中前20条通路、连接度排名前10的药物成份,及对应的相关靶点,建立药物成份-靶点-KEGG通路关系,通过Cytoscape中Network Analyzer功能计算药物成份及靶点的连接度、中介中心性以及接近中心性,并绘制药物成份-靶点-KEGG网络关系图。
1.8 分子对接选取1.7中连接度排名前6的靶点及连接度前5的活性分子,通过Pub Chem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载活性成份2D结构并进行能量最小化处理。通过Uniprot数据库下载靶点蛋白,使用PyMOL软件将靶点蛋白进行去水处理。使用AutoDockTools 1.5.7对活性成分进行加氢处理。使用Vina软件进行分子对接,根据Affinity数值来判断靶点蛋白与活性成份间结合情况。其中Affinity数值越小对接活性越好。当Affinity≤-4.25 kcal/mol时,认为靶点与分子间存在结合活性;Affinity≤-5时,认为结合较为紧密;Affinity≤-7时,认为靶点蛋白与活性分子有强烈的结合活性[15]。
1.9 分子动力学模拟采用Gromacs 2020.6软件对体系进行模拟。力场选择Charmm36力场,水模型选择TIP3P模型。对体系进行溶剂化、离子平衡(设定离子浓度为0.145 M,模拟人体环境)后,分别将体系升温至310 K以及1bar,最后对该体系进行100 ns的分子动力学模拟。非键相互作用的cut-off值设定为1.2 nm,并运算长距离静电的相互作用。
2 结果 2.1 药物生物活性成份筛选通过BATMAN-TCM、TCMID、TCMSP数据库及文献检索茸菖胶囊活性成分,并根据TCMSP中OB≥30%、DL≥0.18进行筛选,并剔除无对应靶点的活性成份,最终共筛选出135个活性成分,其中石菖蒲4个、天南星5个、天麻3个、陈皮5个、半夏9个、茯苓4个、甘草85个、全蝎1个、僵蚕5个、鹿茸3个、菟丝子8个、冰片3个,其中有9种交集化合物,删除重复项后共获得117个茸菖胶囊活性成份。
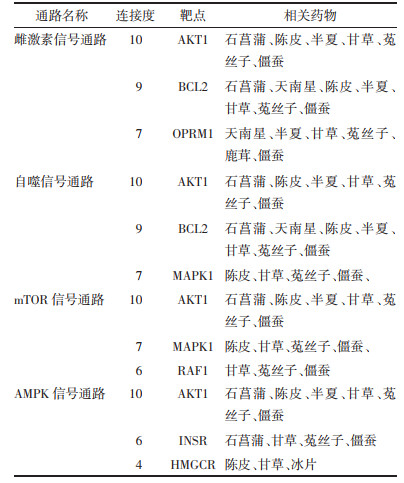
2.2 茸菖胶囊治疗癫痫潜在靶点的预测结果通过TCMSP数据库下载茸菖胶囊中所对应的靶点信息,共获得323个靶点;分别在GeneCards、OMIM、DisGeNET数据库获得癫痫相关靶点,合并删除重复项,最终获得2 148个靶点。将两者取交集,最终获得115个茸菖胶囊治疗癫痫的潜在作用靶点,并绘制Venn图(图 1)。
|
| 图 1 茸菖胶囊与癫痫相关靶点Venn图 Fig. 1 Venn diagram of Rongchang capsule and epilepsy related targets |
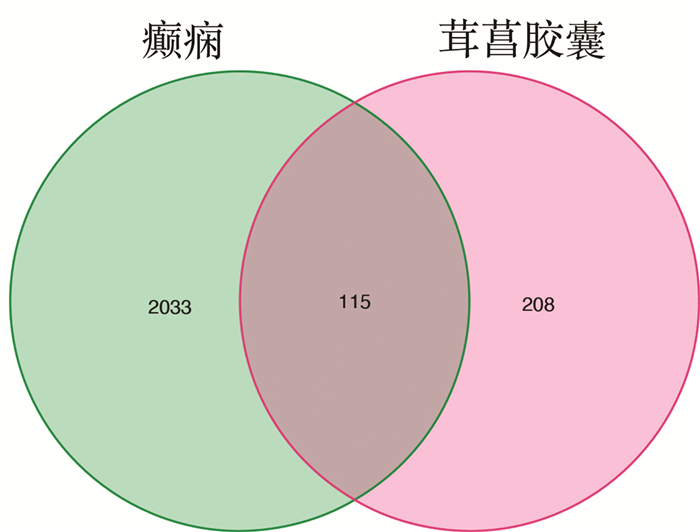
使用Cytoscape软件,构建“药物-活性成分-靶点”网络图(图 2),并计算活性成分度值。通过度值可以判断茸菖胶囊治疗癫痫中排名前5的核心化合物为槲皮素、山柰酚、β-谷甾醇、柚皮素以及川陈皮素,其中前4种化合物均在多种药物中出现,对治疗癫痫具有重要作用(表 1)。
|
| 图 2 “药物-活性成分-靶点”网络图 Fig. 2 "Drug active ingredient target" network diagram |
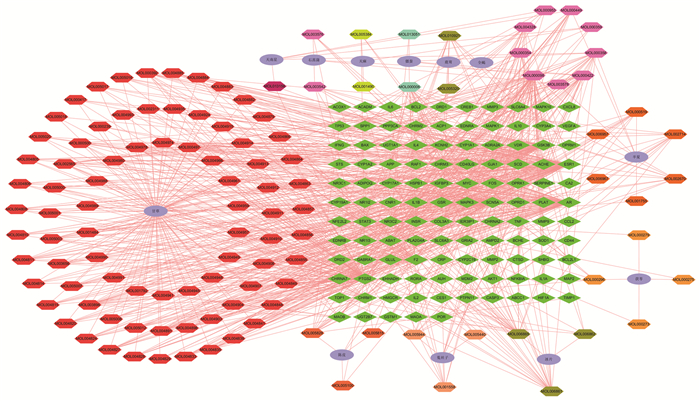
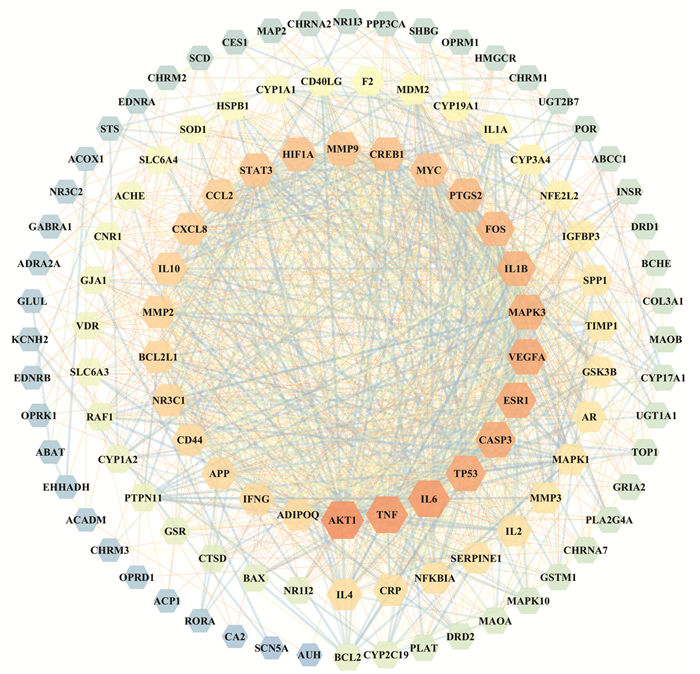
将交集靶点输入到String数据库,获得PPI信息,共含有113个节点信息,1 353条边,平均度值为23.9,使用Cytoscape软件绘制PPI网络图(图 3),颜色越深,体积越大,表明其连接度越大,其中连接度排名前6的靶点为AKT1、TNF、IL6、TP53、CASP3、ESR1,这些靶点在治疗癫痫中可能具有重要作用。使用Cytoscape中CytoNCA插件,进一步分析PPI数据,筛选出所有条件均大于2倍中位数的靶点为核心靶点(图 4),共含18个节点信息,这些靶点可能是茸菖胶囊治疗癫痫的关键靶点。
|
| 图 3 茸菖胶囊-癫痫PPI网络图 Fig. 3 Rongchang Capsule-epilepsy PPI network |

|
| 图 4 核心靶点PPI网络图 Fig. 4 PPI network diagram of core target |
通过Bioconductor插件对茸菖胶囊治疗癫痫相关靶点进行GO、KEGG功能富集分析(图 5),GO分析中共得到2 330条数据,其中包含2 113条BP相关条目,主要涉及类固醇代谢过程、对金属离子的反应、细胞对药物的反应,包含84条CC相关条目,主要涉及突触前膜的内在成分、膜筏、膜微区,包含133条MF相关条目,主要涉及细胞因子活性、铵离子结合、核受体活性。在KEGG通路分析中,茸菖胶囊治疗癫痫的通路机制可能与脂质和动脉粥样硬化通路、AGE-RAGE信号通路、白介素-17(IL-17)信号通路。
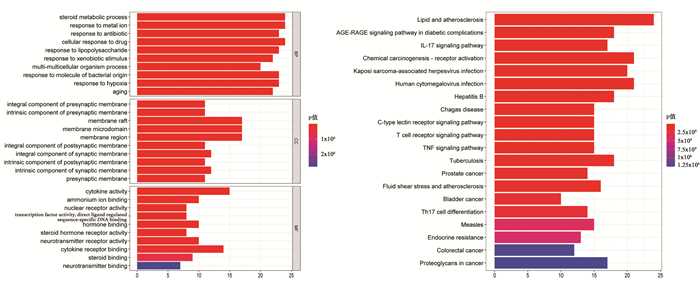
|
| A:GO与BP、CC、MF富集分析;B:KEGG富集分析,颜色越红表明富集越显著,线条越长表明富集在该通路的基因数量越多 图 5 GO、KEGG功能富集分析图 Fig. 5 Functional enrichment analysis of GO and KEGG |
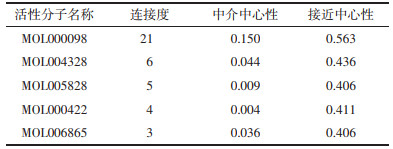
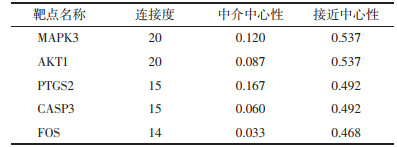
使用Cytoscape软件构建茸菖胶囊-靶点-KEGG网络关系图(图 6),该网络图共包含59个节点,252条边,其中红色倒三角代表KEGG信号通路,橙色菱形代表茸菖胶囊的活性成分,蓝色长方形代表靶点信息,蓝色面积越大,表明该靶点对癫痫的影响越大。对网络进行拓扑分析可知,MOL000098(槲皮素)连接度、中心性最高,预测槲皮素为茸菖胶囊干预癫痫的主要活性分子(表 2)。MAPK3、AKT1、PTGS2、CASP3、FOS为网络中连接度排名前5的靶点(表 3)。通过该图可知茸菖胶囊活性分子可干预多个靶点,各靶点相互关联作用于不同通路,证明茸菖胶囊可通过多条通路协同干预癫痫。

|
| 图 6 茸菖胶囊-靶点-KEGG网络关系图 Fig. 6 Rongchang capsule target KEGG network |
使用Cytoscape软件构建药物-靶点-前期研究通路图(图 7),其中红色倒三角表示前期研究的信号通路,橙色菱形代表茸菖胶囊药物组成,绿色长方形代表靶点信息,并绘制药物-靶点-前期研究通路表(表 4)。
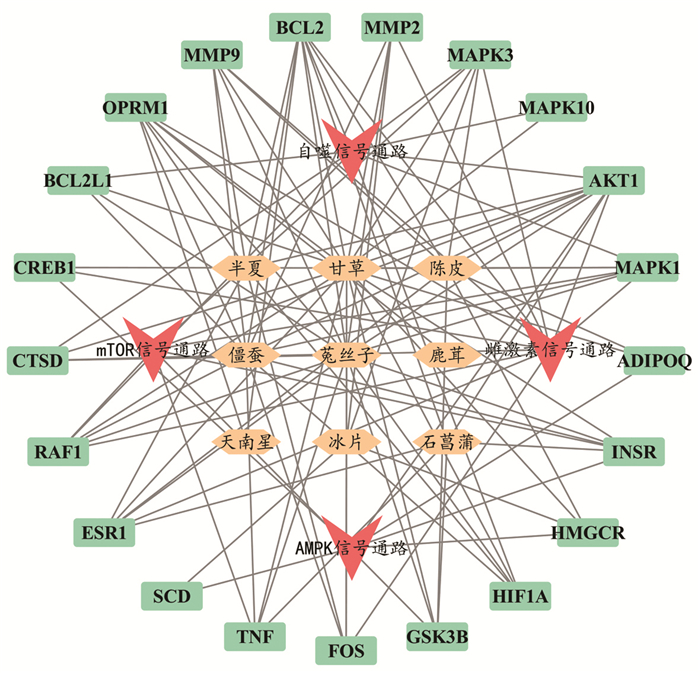
|
| 图 7 药物-靶点-前期研究通路图 Fig. 7 Drug target previous study pathway |
将活性成分中连接度排名前5的分子以及连接度排名前6的靶点蛋白进行分子对接,共获得30对对接结果(图 8)。其中对接结合最紧密的为ESR1与柚皮素,得分为-8.9 kcal/mol,并将结合能力前6的组合进行可视化(图 9)。
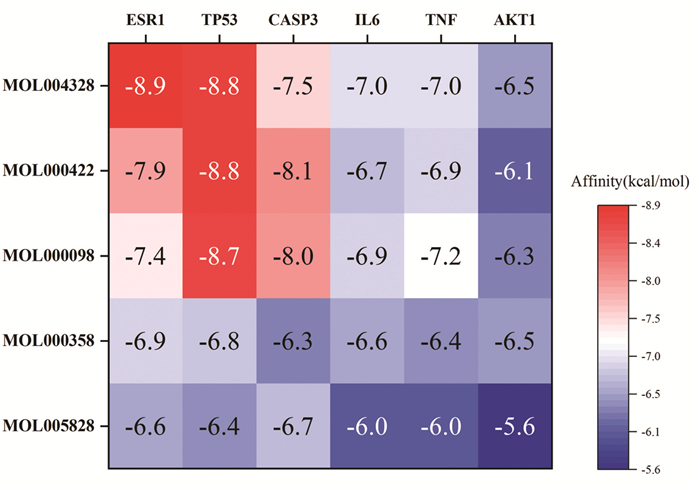
|
| 图 8 分子对接结果热图 Fig. 8 Heat diagram of molecular docking results |
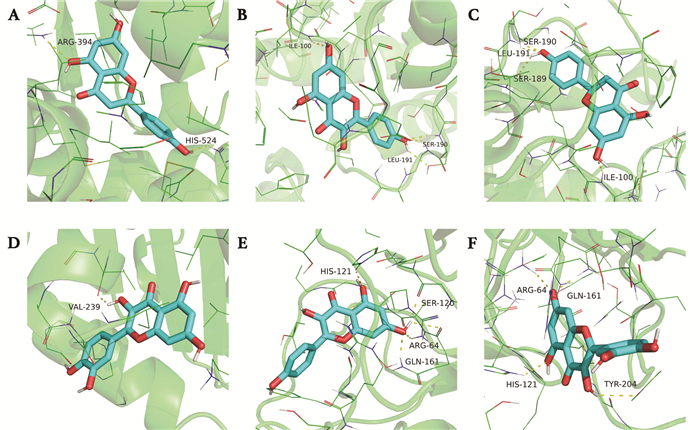
|
| A: naringenin-ESR1;B: kaempferol-TP53;C: naringenin-TP53;D: quercetin-TP53;E: kaempferol-CASP3;F: quercetin-CASP3 图 9 部分靶点-活性分子对接可视化 Fig. 9 Visualization of partial target active molecule docking |
选取分子对接中结合最紧密的组合ESR1与柚皮素进行分子动力学模拟。
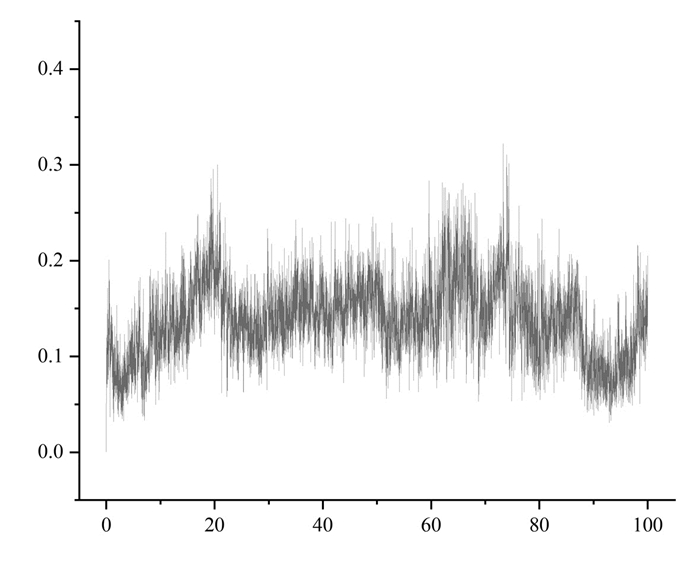
2.9.1 均方根偏差均方根偏差(RMSD)[16]被认为是衡量体系稳定性的标准。平均RMSD值越小,体系越稳定。在模拟的100 ns过程中,RMSD值一直保持较低且平稳的状态(图 10)。显示配体与受体的结合比较紧密,复合物较稳定。
|
| 图 10 均方根偏差折线图 Fig. 10 RMSD line chart |
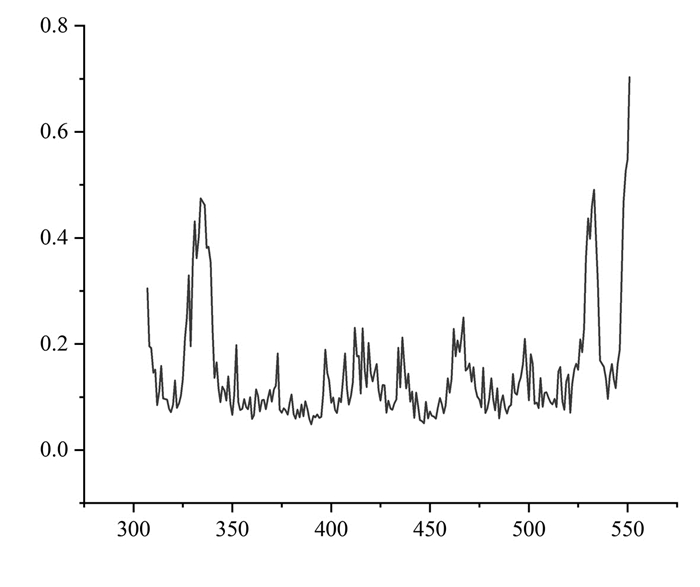
均方根涨落(RMSF)[17]可以表征小分子配体对蛋白质空间结构的波动。值越大,证明蛋白质的残基与小分子相互作用越重。根据图 11观察可知,Res 307-Res 350、Res525-Res551在模拟过程中的RMSF值较大,提示这些残基可能是关键残基,并对关键残基标为黄色展示(图 12)。
|
| 图 11 均方根涨落折线图 Fig. 11 RMSF line chart |

|
| 图 12 柚皮素关键残基可视化 Fig. 12 Visualization of key residues of naringen |
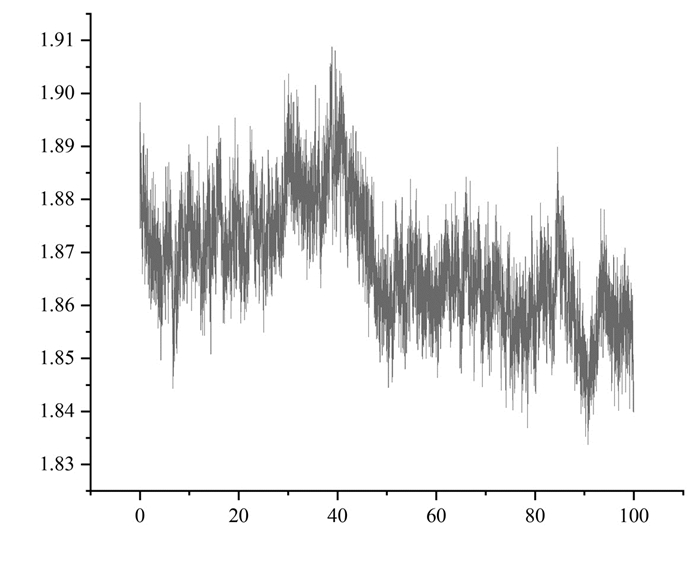
回旋半径(ROG)[18]可以表征模拟过程中蛋白质结构的紧实度。分析可得,蛋白质在模拟过程中,回旋半径较小,均小于2 nm,说明蛋白质结构比较紧密,复合物较稳定(图 13)。
|
| 图 13 回旋半径折线图 Fig. 13 ROG line chart |
中医认为,癫痫,以肾精亏虚多见,“肾藏精生髓”“脑为髓之海”,肾虚则髓空,髓少则脑失所养而引发癫痫,并可导致认知障碍等表现[19]。茸菖胶囊中鹿茸、石菖蒲豁痰开窍,温肾益髓共为君药;菟丝子温补脾肾,助鹿茸温肾益髓,全蝎、天南星、天麻、僵蚕化痰通络,息风止痉,共为臣药。半夏、茯苓、陈皮燥湿化痰健脾,共为佐药。诸药共用可达“豁痰开窍,补益脾肾”之功。
3.1 活性成分分析癫痫与炎症反应、氧化应激密切相关,其中大脑的异常放电区可激活神经炎症分子[20],大脑产生的活性氧分子可参与氧化应激反应,诱发癫痫的发生[21]。研究中连接度最高的槲皮素对炎症反应、氧化应激均有抑制作用,其可降低小胶质细胞释放促炎细胞因子IL-1β及TNF-α[22];也可穿透血脑屏障,改善氧化损伤、下调炎症反应[23];并且动物实验表明,槲皮素可改善认知障碍[24]。核心化合物中的山奈酚、柚皮素、槲皮素均归属黄酮类化合物,该化合物可与苯二氮卓受体位点结合,调节GABA-A受体,改善氧化损伤[25-26]。此外甾醇类化合物中β-谷甾醇也有抗癫痫作用,动物实验表明,β-谷甾醇可提高海马神经元细胞活力,且无毒副作用[27]。因此茸菖胶囊中活性成分可能通过减轻神经炎症反应、下调氧化应激反应可起到抗癫痫的作用。
3.2 相关靶点分析相关靶点研究中,关系密切的为细胞凋亡、炎症反应及雌激素受体。其中核心靶点中的AKT1、CASP3、TP53均参与细胞凋亡过程。AKT1在许多神经系统疾病中发挥抗凋亡、保护神经元的作用[28]。AKT1磷酸化是机体的一种保护性反应,癫痫发作时可引起该反应,激活PI3K/Akt信号通路,从而保护神经元[29],在癫痫伴海马硬化症的患者中可检测到AKT1的水平显著升高也验证其作用[30]。同时CASP3处于凋亡程序的下游[31],TP53则参与转录[32],两者也与细胞凋亡及细胞周期调控有关。此外,炎症因子与癫痫的发生密不可分,一方面,癫痫的发作可引起神经炎症改变,另一方面,炎症因子继而改变神经的兴奋性,进一步加重神经损伤[33],而研究的核心靶点TNF、IL-6被认为与脑内炎症有关[34],两者与体内自由基的形成有关,可导致神经元毒性的增加[35]。团队前期研究也发现,雌激素具有致痫作用[36],而ESR1作为雌激素受体,显示其与子痫的发生密切相关[37]。因此茸菖胶囊中核心靶点可能通过调控细胞凋亡、炎症反应及雌激素水平起到抗癫痫的作用。
3.3 GO分析GO分析中主要BP涉及类固醇代谢、对金属离子的反应、对抗生素的反应等;MF涉及细胞因子活性、铵离子结合、核受体活性等。这与部分专家的研究结果类似,如潘岗等[38]总结了类固醇激素在难治性癫痫中的应用,M Lévesque等[39]认为神经类固醇可能是治疗局灶性癫痫病的新靶点。
3.4 KEGG分析团队前期研究已证实:茸菖胶囊可降低血清中雌激素水平、干预自噬过程、负向调控AMPK、mTOR信号通路,发挥抗癫痫作用,但尚无活性成分-靶点之间的研究。研究在验证了团队前期研究的基础上,预测了4条通路中的活性成分-靶点关系,形成活性成分-靶点-通路完整的作用方式,为后续药物-靶点的基础研究提供参考。
此外文章中预测了茸菖胶囊治疗癫痫最为密切的3个KEGG通路。1)脂质和动脉粥样硬化通路:人体中枢神经系统中约60%是脂质,海马体中脂质的过氧化会导致癫痫的发生。有证据表明,颞叶癫痫患者中脂质的稳定性遭到破坏,磷脂酰胆碱和磷脂酰乙醇胺均会减少[40],而两者具有抗惊厥作用,它们可以通过过氧化物酶体激活受体、拮抗神经炎性反应而抗痫[41]。2)AGE-RAGE信号通路:在生理状态下,人体RAGE含量不高,但炎症状态时RAGE含量增加[42],其可通过该通路激活NF-κB的核转位,增加促炎因子的释放[43],而NF-κB的激活也诱导RAGE进一步合成,导致炎症反应加重。同时,该通路的激活可产生大量的活性氧,通过氧化应激反应介导血管内皮损伤[44],而抗氧化剂已被证明为神经保护剂,可减缓癫痫引起的大脑损伤[21]。3)IL-17信号通路癫痫的发作与神经炎性反应息息相关,而该通路则是其中重要的一支。IL-17主要来源于辅助性T细胞17,它可以破坏血脑屏障,并通过激活中性粒细胞和刺激促炎细胞因子的产生,来诱导神经元凋亡、促进炎症反应发生[45],相关研究也证实其浓度与癫痫发病的严重程度成正比[46]。IL-17在难治性癫痫[47]、自身免疫性癫痫[48]患者血清及脑脊液中的含量均显著升高,也验证了癫痫与IL-17的密切关系。这些通路与炎症反应、氧化应激密切相关,也验证了活性成分、靶点分析中潜在的作用机制。
3.5 分子对接及分子动力学模拟分析分子对接中结果均Affinity≤-5 kcal/mol,表明所有对接结果均较紧密。Affinity≤-7 kcal/mol的共有12组,表明40%的对接结果有强烈的结合性,提示茸菖胶囊可能通过黄酮类、甾醇类化合物发挥抗痫作用。选取结合最紧密的组合ESR1与柚皮素进行分子动力学模拟,提示该化合物结合紧密,复合物稳定,提示调节雌激素水平可能是茸菖胶囊治疗癫痫的潜在作用机制。
4 总结研究通过网络药理学、分子对接及分子动力学模拟的方法,构建茸菖胶囊药物活性分子,蛋白质相互作用网络、GO及KEGG富集分析,总结出茸菖胶囊中核心活性分子、靶点及通路。预测了茸菖胶囊通过下调氧化应激反应、神经炎性反应及雌激素水平达到控制癫痫的作用。然而,网络药理学是基于当前数据库及已验证的实验数据进行分析的,由于实验的方法,操作不尽相同,可能导致研究结果出现假阴性及假阳性的概率[49]。后续笔者将继续关注茸菖胶囊治疗癫痫的药理机制,进一步进行基础实验验证,更加深入探讨其活性成分、靶点、通路间的关系。
| [1] |
ALI A. Global health: Epilepsy[J]. Seminars in Neurology, 2018, 38(2): 191-199. DOI:10.1055/s-0038-1646947 |
| [2] |
SHINNAR S, PELLOCK J M. Update on the epidemiology and prognosis of pediatric epilepsy[J]. Journal of Child Neurology, 2002, 17(Suppl 1): S4-S17. |
| [3] |
RAUT D, BHATT L K. Evolving targets for anti-epileptic drug discovery[J]. European Journal of Pharmacology, 2020, 887(7): 173582. |
| [4] |
THIJS R D, SURGES R, O'BRIEN T J, et al. Epilepsy in adults[J]. Lancet (London, England), 2019, 393(10172): 689-701. DOI:10.1016/S0140-6736(18)32596-0 |
| [5] |
SIRVEN J I. Management of epilepsy comorbidities[J]. Continuum (Minneapolis, Minn), 2016, 22(1 Epilepsy): 191-203. |
| [6] |
邓惠, 何乾超, 高玉广, 等. 中药治疗癫痫的实验研究进展[J]. 环球中医药, 2021, 14(9): 1717-1721. DENG H, HE Q C, GAO Y G, et al. Experimental research progress of traditional Chinese medicine in the treatment of epilepsy[J]. Global Traditional Chinese Medicine, 2021, 14(9): 1717-1721. |
| [7] |
尚峰. 中西医结合治疗癫痫的临床效果分析[J]. 中国现代药物应用, 2020, 14(24): 225-227. SHANG F. Clinical effect analysis of integrated traditional Chinese and Western medicine on epilepsy[J]. Chinese Journal of Modern Drug Application, 2020, 14(24): 225-227. DOI:10.14164/j.cnki.cn11-5581/r.2020.24.104 |
| [8] |
戎萍, 张喜莲, 马融, 等. "从肾论治"小儿癫痫的临床研究[J]. 天津中医药大学学报, 2012, 31(3): 140-143. RONG P, ZHANG X L, MA R, et al. Clinical study on treatment from the kidney with pediatric epilepsy[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2012, 31(3): 140-143. |
| [9] |
张雪荣, 张喜莲, 赵伟, 等. 基于益肾填精法的茸菖胶囊对海马神经元自噬LC3 mRNA及Cathepsin B mRNA蛋白表达水平的实验研究[J]. 时珍国医国药, 2019, 30(7): 1613-1614. ZHANG X R, ZHANG X L, ZHAO W, et al. Experimental study of Rongchang capsule on autophagy LC3 mRNA and Cathepsin B mRNA expression in hippocampal neurons based on tonifying kidney and replenishing essence[J]. Lishizhen Medicine and Materia Medica Research, 2019, 30(7): 1613-1614. |
| [10] |
戎萍, 彭博, 张喜莲, 等. 基于益肾填精法的茸菖胶囊对无镁诱导癫痫模型自噬相关蛋白影响的研究[J]. 天津中医药, 2018, 35(7): 531-534. RONG P, PENG B, ZHANG X L, et al. Effects of Rongchang Capsule on autophagy-related proteins in epilepsy model induced by magnesium-free-treatment based on enriching kidney essence method[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(7): 531-534. |
| [11] |
杨常泉, 王伟, 马融. 茸菖胶囊对幼年大鼠癫痫后NRSF和BDNF蛋白表达的影响[J]. 天津中医药, 2015, 32(9): 555-557. YANG C Q, WANG W, MA R. Effect of Rongchang capsules on expressions of NRSF and BDNF in hippocampus of epilepsy rats[J]. Tianjin Journal of Traditional Chinese Medicine, 2015, 32(9): 555-557. |
| [12] |
郭婷, 陈海鹏, 闫海虹, 等. 茸菖胶囊对雌性癫痫大鼠动情期雌激素及其受体的影响[J]. 中华中医药杂志, 2021, 36(11): 6400-6404. GUO T, CHEN H P, YAN H H, et al. Effects of Rongchang Capsules on estrogen and estrogen receptor of female epilepsy rats in estrus phase[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(11): 6400-6404. |
| [13] |
XU X, ZHANG W, HUANG C, et al. A novel chemometric method for the prediction of human oral bioavailability[J]. International Journal of Molecular Sciences, 2012, 13(6): 6964-6982. DOI:10.3390/ijms13066964 |
| [14] |
TAO W Y, XU X, WANG X, et al. Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J]. Journal of Ethnopharmacology, 2013, 145(1): 1-10. DOI:10.1016/j.jep.2012.09.051 |
| [15] |
HSIN K Y, GHOSH S, KITANO H. Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J]. PLoS One, 2013, 8(12): e83922. DOI:10.1371/journal.pone.0083922 |
| [16] |
CAZALS F, TETLEY R. Characterizing molecular flexibility by combining least root mean square deviation measures[J]. Proteins, 2019, 87(5): 380-389. DOI:10.1002/prot.25658 |
| [17] |
PITERA J W. Expected distributions of root-mean-square positional deviations in proteins[J]. The Journal of Physical Chemistry B, 2014, 118(24): 6526-6530. DOI:10.1021/jp412776d |
| [18] |
YANAO T, KOON W S, MARSDEN J E, et al. Gyration-radius dynamics in structural transitions of atomic clusters[J]. The Journal of Chemical Physics, 2007, 126(12): 124102. DOI:10.1063/1.2710272 |
| [19] |
马融. 中医儿科学[M]. 4版. 北京: 中国中医药出版社, 2016. MA R. Traditional Chinese medicine pediatrics[M]. 4th ed. Beijing: China Traditional Chinese Medicine Press, 2016. |
| [20] |
VEZZANI A, BALOSSO S, RAVIZZA T. Neuroinflammatory pathways as treatment targets and biomarkers in epilepsy[J]. Nature Reviews Neurology, 2019, 15(8): 459-472. DOI:10.1038/s41582-019-0217-x |
| [21] |
YANG N, GUAN Q W, CHEN F H, et al. Antioxidants targeting mitochondrial oxidative stress: Promising neuroprotectants for epilepsy[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020(12): 6687185. |
| [22] |
WU D M, ZHENG Z H, FAN S H, et al. Ameliorating effect of quercetin on epilepsy by inhibition of inflammation in glial cells[J]. Experimental and Therapeutic Medicine, 2020, 20(2): 854-859. DOI:10.3892/etm.2020.8742 |
| [23] |
FIORANI M, GUIDARELLI A, BLASA M, et al. Mitochondria accumulate large amounts of quercetin: Prevention of mitochondrial damage and release upon oxidation of the extramitochondrial fraction of the flavonoid[J]. The Journal of Nutritional Biochemistry, 2010, 21(5): 397-404. DOI:10.1016/j.jnutbio.2009.01.014 |
| [24] |
RISHITHA N, MUTHURAMAN A. Therapeutic evaluation of solid lipid nanoparticle of quercetin in pentylenetetrazole induced cognitive impairment of zebrafish[J]. Life Sciences, 2018, 199(7): 80-87. |
| [25] |
JOHNSTON G A R. Flavonoid nutraceuticals and ionotropic receptors for the inhibitory neurotransmitter GABA[J]. Neurochemistry International, 2015, 89(6): 120-125. |
| [26] |
HANRAHAN J R, CHEBIB M, JOHNSTON G A R. Flavonoid modulation of GABA(A) receptors[J]. British Journal of Pharmacology, 2011, 163(2): 234-245. DOI:10.1111/j.1476-5381.2011.01228.x |
| [27] |
董雪, 刘小广, 杨美丽, 等. β-谷甾醇对原代大鼠海马神经元细胞活力的毒性[J]. 黑龙江医药科学, 2013, 36(4): 1-2. DONG X, LIU X G, YANG M L, et al. The toxicity of β-sitosterol on the vitality of hippocampal neuron cell in original generation rats[J]. Heilongjiang Medicine and Pharmacy, 2013, 36(4): 1-2. |
| [28] |
陈海, 王建. PI3K/AKT信号通路在缺血性脑卒中后细胞程序性死亡中的研究进展[J]. 中药药理与临床, 2022, 38(2): 247-252. CHEN H, WANG J. Research progress on PI3K/AKT signaling pathway in programmed cell death after ischemic stroke[J]. Pharmacology and Clinics of Chinese Materia Medica, 2022, 38(2): 247-252. |
| [29] |
王江红, 杨佳丽, 严少博, 等. 化浊解毒疏肝方对癫痫大鼠学习记忆及PI3K/Akt/GSK-3β信号通路的影响[J]. 中国实验方剂学杂志, 2021, 27(17): 57-65. WANG J H, YANG J L, YAN S B, et al. Effect of Huazhuo Jiedu Shugan Prescription on learning, memory, and PI3K/Akt/GSK-3β signaling pathway in epileptic rats[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(17): 57-65. |
| [30] |
VALMIKI R R, VENKATESALU S, Chacko A G, et al. Phosphoproteomic analysis reveals Akt isoform-specific regulation of cytoskeleton proteins in human temporal lobe epilepsy with hippocampal sclerosis[J]. Neurochemistry International, 2020, 134(5): 104654. |
| [31] |
ZHANG Y, GOODYER C, LEBLANC A. Selective and protracted apoptosis in human primary neurons microinjected with active caspase-3, -6, -7, and-8[J]. The Journal of Neuroscience: the Official Journal of the Society for Neuroscience, 2000, 20(22): 8384-8389. DOI:10.1523/JNEUROSCI.20-22-08384.2000 |
| [32] |
包林珠, 时灿, 卢玲儿, 等. 斑马鱼(Danio rerio)mapk1基因对tp53基因调控研究[J]. 生物技术通报, 2021, 37(12): 160-168. BAO L Z, SHI C, LU L E, et al. Regulation of gene mapk1 in Danio rerio on gene tp53[J]. Biotechnology Bulletin, 2021, 37(12): 160-168. |
| [33] |
VEZZANI A, BALOSSO S, RAVIZZA T. Inflammation and epilepsy[J]. Handb Clin Neurol, 2012, 107(6): 163-175. |
| [34] |
BECHER B, SPATH S, GOVERMAN J. Cytokine networks in neuroinflammation[J]. Nature Reviews Immunology, 2017, 17(1): 49-59. |
| [35] |
KOBYLAREK D, IWANOWSKI P, LEWANDOWSKA Z, et al. Advances in the potential biomarkers of epilepsy[J]. Frontiers in Neurology, 2019, 10(1): 685. |
| [36] |
郭婷, 陈海鹏, 闫海虹, 等. 茸菖胶囊对雌性癫痫大鼠动情期雌激素及其受体的影响[J]. 中华中医药杂志, 2021, 36(11): 6400-6404. GUO T, CHEN H P, YAN H H, et al. Effect of Rongchang Capsule on estrogen and its receptor in estrus of female epileptic rats[J]. Chinese Journal of Traditional Chinese Medicine, 2021, 36(11): 6400-6404. |
| [37] |
KE Y, BIN L, LIN L, et al. ESR1 polymorphisms and risk of preeclampsia[J]. Journal of Maternal-Fetal and Neonatal Medicine, 2022, 35(2): 402-409. |
| [38] |
潘岗, 周水珍. 类固醇激素治疗在难治性癫痫中的应用[J]. 中国实用儿科杂志, 2016, 31(1): 36-41. PAN G, ZHOU S Z. Application of steroid hormone therapy in intractable epilepsy[J]. Chinese Journal of Practical Pediatrics, 2016, 31(1): 36-41. |
| [39] |
LÉVESQUE M, BIAGINI G, AVOLI M. Neurosteroids and focal epileptic disorders[J]. International journal of molecular sciences, 2020, 21(24): 9391. |
| [40] |
AJITH A, MONDAL S, CHATTOPADHYAY S, et al. Mass spectrometry imaging deciphers dysregulated lipid metabolism in the human hippocampus affected by temporal lobe epilepsy[J]. ACS Chemical Neuroscience, 2021, 12(21): 4187-4194. |
| [41] |
TAHA A Y, BURNHAM W M, AUVIN S. Polyunsaturated fatty acids and epilepsy[J]. Epilepsia, 2010, 51(8): 1348-1358. |
| [42] |
KUMAR PASUPULATI A, CHITRA P S, REDDY G B. Advanced glycation end products mediated cellular and molecular events in the pathology of diabetic nephropathy[J]. Biomolecular Concepts, 2016, 7(5/6): 293-309. |
| [43] |
CHUAH Y K, BASIR R, TALIB H, et al. Receptor for advanced glycation end products and its involvement in inflammatory diseases[J]. International Journal of Inflammation, 2013, 2013(6): 403460. |
| [44] |
乔爱敏, 李乐, 刘青. 晚期糖基化终产物及其受体RAGE在糖尿病血管并发症中的作用机制[J]. 中国临床药理学与治疗学, 2014, 19(11): 1306-1311. QIAO A M, LI L, LIU Q. Mechanism of action of advanced glycation end products and their receptors RAGE contribute to the development of diabetic vascular complications[J]. Chinese Journal of Clinical Pharmacology and Therapeutics, 2014, 19(11): 1306-1311. |
| [45] |
SOLTANI K A, YAZDANPANAH N, REZAEI N. Neuroinflammation and Proinflammatory Cytokines in Epileptogenesis[J]. Molecular Neurobiology, 2022, 59(3): 1724-1743. |
| [46] |
MAO L Y, DING J, PENG W F, et al. Interictal interleukin-17A levels are elevated and correlate with seizure severity of epilepsy patients[J]. Epilepsia, 2013, 54(9): e142-e145. |
| [47] |
KUMAR P, SHIH D C W, LIM A, et al. Pro-inflammatory, IL-17 pathways dominate the architecture of the immunome in pediatric refractory epilepsy[J]. JCI Insight, 2019, 5(8): e126337. |
| [48] |
HAN Y X, YANG L L, LIU X Y, et al. HMGB1/CXCL12-mediated immunity and Th17 cells might underlie highly suspected autoimmune epilepsy in elderly individuals[J]. Neuropsychiatric Disease and Treatment, 2020, 16(2): 1285-1293. |
| [49] |
周文霞, 程肖蕊, 张永祥. 网络药理学: 认识药物及发现药物的新理念[J]. 中国药理学与毒理学杂志, 2012, 26(1): 4-9. ZHOU W X, CHENG X R, ZHANG Y X. Network pharmacology-a new philosophy for understanding of drug action and discovery of new drugs[J]. Chinese Journal of Pharmacology and Toxicology, 2012, 26(1): 4-9. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China;
3. Affiliated Hospital of Nanjing University of traditional Chinese Medicine, Nanjing 210000, China
 2023, Vol. 40
2023, Vol. 40