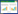文章信息
- 周靖, 郭洋洋, 陆春红, 等.
- ZHOU Jing, GUO Yangyang, LU Chunhong, et al.
- 藏红花素对糖尿病肾病大鼠肾纤维化的影响及机制研究
- Effect and mechanism of crocin on renal fibrosis in rats with diabetic nephropathy
- 天津中医药, 2023, 40(4): 513-517
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(4): 513-517
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.04.18
-
文章历史
- 收稿日期: 2023-02-18
2. 廊坊市第四人民医院, 廊坊 065700
糖尿病肾病(DN)是糖尿病常见微血管并发症,是导致终末期肾病及糖尿病患者死亡的首要因素[1]。持续高血糖所致肾纤维化是DN发生发展的重要病理机制[2],因此,靶向抑制肾纤维化对延缓DN进展至关重要。藏红花素为传统中药藏红花的主要活性成分,具有抗炎、抗氧化等多种生物学活性[3-4];并且藏红花素对博来霉素所致肺纤维化具有明显抑制作用[5]。
有研究发现,藏红花素能够通过抑制氧化应激和炎症反应等对DN大鼠具有一定的保护作用[6-7],但藏红花素对DN大鼠肾纤维化是否具有抑制作用尚未见文献报道。研究通过制备DN大鼠模型并给予藏红花素进行治疗,以二甲双胍做为阳性对照药物,探讨藏红花素对DN大鼠肾纤维化的影响及其可能的作用机制。
1 材料与方法 1.1 实验动物清洁级健康雄性SD大鼠60只,7周龄,体质量210~240 g,由河北医科大学实验动物学部提供[SYXK(冀)2018-004],分笼饲养于温度23~25 ℃、相对湿度55%~65%、光照黑暗12 h∶12 h的清洁环境,自由饮水进食。实验方案经开滦总医院伦理委员会审查批准。
1.2 药物与试剂藏红花素、链尿佐菌素(批号E190805b、024K1211,美国Sigma公司);二甲双胍(批号20200417,天津亚宝药业科技有限公司);尿素氮(BUN)、肌酐(SCr)试剂盒(批号91207、200109,购自南京建成生物工程研究所);苏木精-伊红(HE)染色试剂盒、马森(Masson)染色试剂盒、增强化学发光(ECL)超敏发光试剂盒(批号G1120、G1340、SW2030,北京索莱宝科技有限公司);克洛索蛋白(Klotho)、转化生长因子-β1(TGF-β1)、磷酸化Smad2(p-Smad2)、β-肌动蛋白(β-actin)抗体(批号bs-2925R、bs-0086R、bs-2224R、bs-0061R,北京博奥森生物科技有限公司)。
1.3 主要仪器GT-1640型血糖仪(长春迈德赛斯医疗器械有限公司);UF-1000i型尿液分析仪(日本SYSMEX株式会社);RM2245型切片机(德国Leica公司);DYCZ-24DN型电泳仪、DYCZ-40D型转膜仪(北京六一生物科技有限公司);BX51 F32H01型光学显微镜(日本Olympus公司)。
1.4 实验方法 1.4.1 动物分组、模型制备与给药适应性饲养1周后,按照随机数字表法,将60只大鼠随机分为正常对照组、模型组、二甲双胍组和藏红花素低、中、高剂量组。正常对照组大鼠常规饲料饲养,其余各组大鼠给予高糖高脂饲料(常规饲料67.5%、蔗糖20%、猪油10%、胆固醇2.5%)饲养4周后禁食禁水12 h,腹腔注射浓度1%的链尿佐菌素(30 mg/kg);72 h后检测空腹血糖(FBG)≥16.7 mmol/L,尿糖(+++)或(++++),可认为DN大鼠模型造模成功[8]。正常对照组和模型组均灌胃给予生理盐水,二甲双胍组灌胃500 mg/kg[9],藏红花素低、中、高剂量组分别灌胃25、50、100 mg/kg[10],每日1次,疗程12周。
1.4.2 大鼠FBG水平与体质量检测所有大鼠均于末次给药24 h后称量体质量并检测FBG水平。
1.4.3 肾功能指标检测末次给药完成后,收集24 h尿液,通过磺基水杨酸法测定UPro;末次给药24 h后实施麻醉,经腹主动脉取血并离心(离心半径10 cm,转速1 500 r/min,时间10 min)取血清,然后按照试剂盒说明依步进行处理后检测BUN、Scr含量。
1.4.4 肾组织病理学及纤维化检查、胶原容积分数(CVF)计算采血完成后,颈椎脱臼处死后取双侧肾组织,左侧肾脏置于4%甲醛溶液固定72 h,常规脱水和透明处理后,石蜡包埋、切片(厚度5 μm),按照试剂盒说明行HE染色和Masson染色,然后通过光学显微镜观察肾组织病理学改变和纤维化状况(蓝色为胶原着色)。通过图像分析系统检测CVF,CVF(%)=(胶原面积/视野总面积)×100%。
1.4.5 肾组织蛋白表达检测取右侧肾脏剪碎后加入蛋白裂解液,匀浆后4 ℃离心(离心半径10 cm,转速12 000 r/min,时间20 min)取沉淀,二喹啉甲酸(BCA)法检测总蛋白浓度,以30 μg蛋白量上样、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(80 V,40 min,160 V,90 min)分离蛋白、湿法转聚偏二氟乙烯(PVDF)膜(300 mA,90 min)、5%脱脂奶粉常温封闭90 min后,加目标蛋白和内标(β-actin)一抗4 ℃孵育12 h,TBST洗膜后加二抗37 ℃孵育1 h,TBST洗膜后加ELC发光剂,通过凝胶成像仪显示蛋白条带,以β-actin为内参、通过条带灰度值半定量目标蛋白表达。
1.5 统计学方法应用SPSS 20.0进行统计分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 藏红花素对DN大鼠FBG的影响与正常对照组比较,模型组大鼠FBG水平显著升高(P < 0.01);与模型组比较,二甲双胍组和藏红花素中、高剂量组FBG水平显著降低(P < 0.01),二甲双胍组与藏红花素高剂量组间FBG水平差异无统计学意义(P > 0.05)。见表 1。
|
与正常对照组比较,模型组大鼠体质量显著降低(P < 0.01);与模型组比较,二甲双胍组和藏红花素中、高剂量组体质量显著升高(P < 0.05或P < 0.01),且藏红花素高剂量组大鼠体质量显著高于二甲双胍组(P < 0.05)。见表 1。
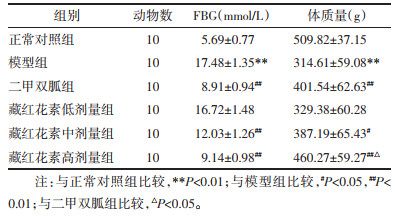
2.3 藏红花素对DN大鼠肾功能的影响与正常对照组比较,模型组大鼠UPro和血清BUN、Scr水平显著升高(P < 0.01);与模型组比较,二甲双胍组和藏红花素中、高剂量组UPro和BUN、Scr水平显著降低(P < 0.01),且藏红花素高剂量组大鼠UPro和BUN、Scr水平显著低于二甲双胍组(P < 0.05或P < 0.01)。见表 2。
|
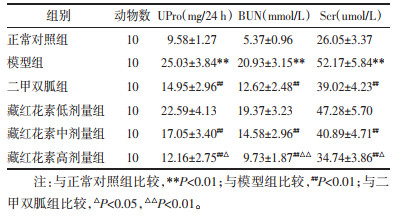
正常对照组大鼠肾组织结构未见异常;模型组呈现肾小球体积增大,系膜区增宽、基底膜增厚,肾小管扩张,大量炎性细胞浸润等病理性改变;与模型组比较,二甲双胍组和藏红花素各剂量组肾组织病变不同程度减轻;藏红花素高剂量组仅可见肾小球体积轻度增大、基底膜增厚,效果优于其他组。见图 1。
|
| 注:A. 正常对照组;B. 模型组;C. 二甲双胍组;D. 藏红花素低剂量组;E. 藏红花素中剂量组;F. 藏红花素高剂量组。 图 1 藏红花素对DN大鼠肾组织病变的影响(HE,×100) Fig. 1 Effect of crocin on the pathological changes of renal tissue in DN rats (HE, ×100) |
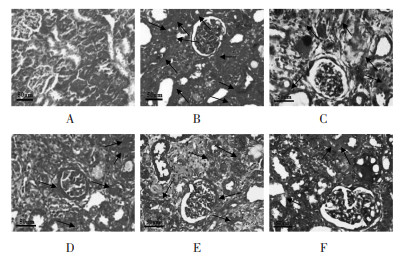
正常对照组大鼠肾组织结构清晰,肾小球和肾间质可见少量胶原;模型组肾小球系膜和基底膜、肾间质区可见大量呈弥漫性分布的胶原沉积;与模型组比较,二甲双胍组和各剂量藏红花素组肾小球、肾间质区胶原沉积减少,其中藏红花素高剂量组肾小球、肾间质仅可见丝状胶原沉积。VF计算结果:与正常对照组CVF(12.06±1.97)%比较,模型组CVF(66.83±7.54)%显著升高(P < 0.01);与模型组比较,二甲双胍组(23.57±3.86)%和藏红花素低剂量组(50.13±6.24)%、中剂量组(37.92±5.03)%、高剂量组(17.05±2.88)%CVF显著降低(P < 0.01);藏红花素高剂量组CVF(17.05±2.88)%显著低于二甲双胍组(23.57±3.86)%,差异有统计学意义(P < 0.01)。见图 2。
|
| 注:A. 正常对照组;B. 模型组;C. 二甲双胍组;D. 藏红花素低剂量组;E. 藏红花素中剂量组;F. 藏红花素高剂量组。 图 2 藏红花素对DN大鼠肾纤维化的影响(Masson,×100) Fig. 2 Effect of crocin on renal fibrosis in DN rats(Masson, ×100) |
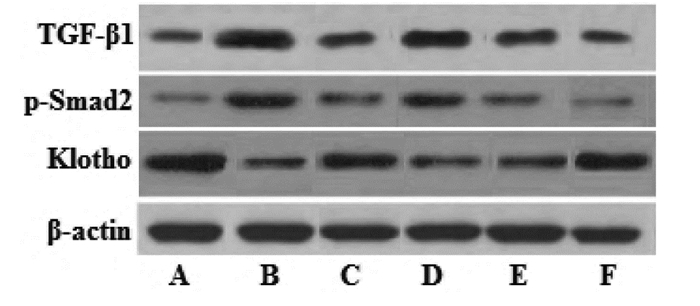
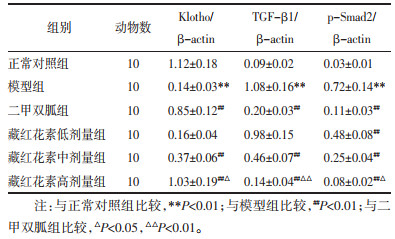
与正常对照组比较,模型组Klotho相对表达量显著降低而TGF-β1、p-Smad2相对表达量显著升高(P < 0.01);与模型组比较,二甲双胍组和藏红花素中、高剂量组Klotho相对表达量显著升高且TGF-β1、p-Smad2相对表达量显著降低(P < 0.01);与二甲双胍组比较,藏红花素高剂量组Klotho相对表达量显著升高且TGF-β1、p-Smad2相对表达量显著降低(P < 0.05或P < 0.01)。见图 3、表 3。
|
| 注:A. 正常对照组;B. 模型组;C. 二甲双胍组;D. 藏红花素低剂量组;E. 藏红花素中剂量组;F. 藏红花素高剂量组。 图 3 藏红花素对DN大鼠肾组织Klotho、TGF-β1、p-Smad2蛋白表达的影响 Fig. 3 Effect of crocin on the expression of Klotho, TGF-β1, p-Smad2 proteins of renal tissue in DN rats |
|
随着中医药发展战略的实施,中医药防治DN得到广大医患的关注与认可[11]。DN在中医属于“消渴”范畴,其病机在于气阴两虚,王秀萍等[12]研究发现,益气活血能够改善气阴两虚型临床症状,降糖调脂,对肾功能具有保护作用。藏红花为中国名贵中药材,具有活血化瘀、散郁开结之功效,其主要活性成分藏红花素具有多种生物学作用。ABOU-HANY等[13]发现藏红花素能够提高抗氧化酶活性减轻DN大鼠氧化应激损伤,并抑制核因子-κB(NF-κB)信号通路减轻DN大鼠炎症反应。Xun等[14]和Shen等[15]研究发现二甲双胍能够抑制肾纤维化而延缓DN进行性损伤,因此研究选择二甲双胍做为阳性对照药物。研究发现,给予二甲双胍或藏红花素治疗12周能够明显降低DN大鼠FBG水平、提高体质量,降低UPro和血清BUN、Scr水平,明显改善DN大鼠肾小球体积增大、系膜区增宽、基底膜增厚、炎性细胞浸润等病变,降低肾纤维化,并且藏红花素高剂量组效果优于二甲双胍组。
细胞应激性衰老是引发组织纤维化的重要机制,Klotho是一种在肾组织高表达的抗衰老蛋白[16-17]。TGF-β1是一种强致纤维化因子,与肾纤维化密切相关[18]。Huang等[19]发现Klotho表达量降低时能够促使TGF-β1与转化生长因子受体结合,进而激活TGF-β1纤维化信号通路。高血糖诱导细胞外基质过度生成是导致组织纤维化的重要物质基础,TGF-β1能够诱导Smads磷酸化(p-Smads),p-Smads则能够诱导细胞外基质过度生成并抑制其降解[20],并且刘宗亮等[21]发现抑制TGF-β/Smads信号通路能够抑制成纤维细胞增殖与分化。研究发现,给予二甲双胍或藏红花素治疗12周能够明显上调Klotho表达并下调TGF-β1、p-Smad2,并且藏红花素高剂量组调控作用优于二甲双胍组。
综上所述,藏红花素对DN大鼠肾纤维化具有抑制作用,其作用机制可能与抑制Klotho/TGF-β/Smad信号通路有关。
| [1] |
中华医学会糖尿病学分会微血管并发症学组. 中国糖尿病肾脏疾病防治临床指南[J]. 中华糖尿病杂志, 2019, 11(1): 15-28. Microvascular Complications Group of Chinese Diabetes Association. Chinese clinical practice guideline of diabetic kidney disease[J]. Chinese Journal of Diabetes Mellitus, 2019, 11(1): 15-28. DOI:10.3760/cma.j.issn.1674-5809.2019.01.004 |
| [2] |
周志锋, 罗瑞, 况煌, 等. 糖尿病肾脏疾病发病机制研究进展[J]. 中国糖尿病杂志, 2020, 28(4): 303-308. ZHOU Z F, LUO R, KUANG H, et al. Advances in research on the pathogenesis of diabetic kidney disease[J]. Chinese Journal of Diabetes, 2020, 28(4): 303-308. DOI:10.3969/j.issn.1006-6187.2020.04.013 |
| [3] |
YARIBEYGI H, NOROOZADEH A, MOHAMMADI M T, et al. Crocin improves oxidative stress by potentiating intrinsic anti-oxidant defense systems in pancreatic cells during uncontrolled hyperglycemia[J]. Journal of Pharmacopuncture, 2019, 22(2): 83-89. DOI:10.3831/KPI.2019.22.010 |
| [4] |
谢圆媛, 杨丹芬, 王莉. 藏红花素通过PGC-1α/SIRT3信号通路抑制慢性阻塞性肺疾病模型大鼠的气道炎症[J]. 临床肺科杂志, 2020, 25(11): 1648-1654. XIE Y Y, YANG D F, WANG L. Crocin inhibiting inflammatory response of rats with chronic obstructive pulmonary disease by mediating PGC-1α/SIRT3 signaling pathway[J]. Journal of Clinical Pulmonary Medicine, 2020, 25(11): 1648-1654. DOI:10.3969/j.issn.1009-6663.2020.11.006 |
| [5] |
董雅莲, 王德海. 藏红花素对肺纤维化的治疗作用[J]. 毒理学杂志, 2020, 34(4): 315-320. DONG Y L, WANG D H. Protective effect of crocin on pulmonary fibrosis[J]. Journal of Toxicology, 2020, 34(4): 315-320. DOI:10.16421/j.cnki.1002-3127.2020.04.009 |
| [6] |
YARIBEYGI H, MOHAMMADI M T, REZAEE R, et al. Crocin improves renal function by declining Nox-4, IL-18, and p53 expression levels in an experimental model of diabetic nephropathy[J]. Journal of Cellular Biochemistry, 2018, 119(7): 6080-6093. DOI:10.1002/jcb.26806 |
| [7] |
ALTINOZ E, ONER Z, ELBE H, et al. Protective effects of saffron (its active constituent, crocin) on nephropathy in streptozotocin-induced diabetic rats[J]. Human & Experimental Toxicology, 2015, 34(2): 127-134. |
| [8] |
张丽芬, 吕仁和, 黄文政. 链脲佐菌素糖尿病肾病大鼠模型的建立及稳定性评价[J]. 中国比较医学杂志, 2014, 24(4): 8-12, 18. ZHANG L F, LYU R H, HUANG W Z, et al. Establishment and evaluation of the stability of rat models of diabetic nepropathy induced by unilateral nephrectomy and streptozotocin injection[J]. Chinese Journal of Comparative Medicine, 2014, 24(4): 8-12. DOI:10.3969/j.issn.1671.7856.2014.004.003 |
| [9] |
高利超, 徐兵, 刘永安, 等. 三七皂苷R1抑制TGF-β1/Smad3信号传导对糖尿病肾病大鼠肾脏纤维化和炎症细胞因子的调节作用研究[J]. 中国免疫学杂志, 2020, 36(10): 1188-1193. GAO L C, XU B, LIU Y A, et al. Regulatory effect of Notoginsenoside R1 on renal fibrosis and inflammatory cyto-kines in diabetic nephropathy rats via inhibiting of TGF-β1/Smad3 signal transduction[J]. Chinese Journal of Immunology, 2020, 36(10): 1188-1193. DOI:10.3969/j.issn.1000-484X.2020.10.008 |
| [10] |
王立哲, 王振贤, 马晓伟. 藏红花素对糖尿病大鼠胰腺组织保护作用的研究[J]. 医学研究杂志, 2019, 48(5): 102-106. WANG L Z, WANG Z X, MA X W. Protective effect of crocin on pancreatic tissue injury in diabetic rats[J]. Journal of Medical Research, 2019, 48(5): 102-106. |
| [11] |
汤志奇, 徐靓萍, 沈丕安. 沈丕安教授治疗糖尿病肾病经验方解析[J]. 现代中西医结合杂志, 2019, 28(25): 2781-2783. TANG Z Q, XU L P, SHEN P A. Analysis of Professor SHEN Pi'an's experience in treating diabetic nephropathy[J]. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2019, 28(25): 2781-2783. DOI:10.3969/j.issn.1008-8849.2019.25.011 |
| [12] |
王秀萍, 张莹雯. 当归补血汤对糖尿病肾病大鼠高密度脂蛋白及微量蛋白尿的影响[J]. 中国中西医结合肾病杂志, 2015, 16(12): 1044-1047. WANG X P, ZHANG Y W. Effect of astragals and angelica mixture on the high density lipoprotein and urinary microalbuminuria in diabetic nephropathy rats[J]. Chinese Journal of Integrated Traditional and Western Nephrology, 2015, 16(12): 1044-1047. |
| [13] |
ABOU-HANY H O, ATEF H, SAID E, et al. Crocin mediated amelioration of oxidative burden and inflammatory cascade suppresses diabetic nephropathy progression in diabetic rats[J]. Chemico-Biological Interactions, 2018, 284(11): 90-100. |
| [14] |
XUE J, WANG L, SUN Z X, et al. Basic research in diabetic nephropathy health care: A study of the renoprotective mechanism of metformin[J]. Journal of Medical Systems, 2019, 43(8): 266. DOI:10.1007/s10916-019-1412-4 |
| [15] |
SHEN Y, MIAO N J, XU J L, et al. Metformin prevents renal fibrosis in mice with unilateral ureteral obstruction and inhibits ang Ⅱ-induced ECM production in renal fibroblasts[J]. International Journal of Molecular Sciences, 2016, 17(2): 146. DOI:10.3390/ijms17020146 |
| [16] |
LEE H J, GONZALEZ O, DICK E J, et al. Marmoset as a model to study kidney changes associated with aging[J]. The Journals of Gerontology Series A, Biological Sciences and Medical Sciences, 2019, 74(3): 315-324. |
| [17] |
缪静龙, 刘其锋. Klotho抑制肾间质纤维化的作用及机制[J]. 医学综述, 2019, 25(20): 3985-3990. MIU J L, LIU Q F. Effect and mechanism of klotho against renal interstitial fibrosis[J]. Medical Recapitulate, 2019, 25(20): 3985-3990. |
| [18] |
LI Y, LI L, ZENG O, et al. H 2 S improves renal fibrosis in STZ-induced diabetic rats by ameliorating TGF-β1 expression[J]. Renal Failure, 2017, 39(1): 265-272. |
| [19] |
HUANG J S, CHUANG C T, LIU M H, et al. Klotho attenuates high glucose-induced fibronectin and cell hypertrophy via the ERK1/2-p38 kinase signaling pathway in renal interstitial fibroblasts[J]. Molecular and Cellular Endocrinology, 2014, 390(1/2): 45-53. |
| [20] |
MENG X M, NIKOLIC-PATERSON D J, LAN H Y. TGF-β: the master regulator of fibrosis[J]. Nature Reviews Nephrology, 2016, 12(6): 325-338. |
| [21] |
刘宗亮, 张建东, 彭湾, 等. 二氢杨梅素对糖尿病肾病大鼠肾纤维化的影响[J]. 赣南医学院学报, 2019, 39(6): 541-545. LIU Z L, ZHANG J D, PENG W, et al. The effect of dihydromyricetin on renal fibrosis in diabetic nephropathy rats[J]. Journal of Gannan Medical University, 2019, 39(6): 541-545. |
2. Fourth People's Hospital of Langfang City, Langfang 065700, China
 2023, Vol. 40
2023, Vol. 40