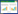文章信息
- 王智, 武蕾.
- WANG Zhi, WU Lei.
- 穿山龙总皂苷通过JAK2/STAT3通路对哮喘大鼠肺功能及肺组织炎症和气道重塑的影响
- Effects of total saponins of pangolin on lung function, lung tissue inflammation and airway remodeling in asthmatic rats through JAK2/STAT3 pathway
- 天津中医药, 2023, 40(4): 518-523
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(4): 518-523
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.04.19
-
文章历史
- 收稿日期: 2022-12-15
2. 河北省中医院呼吸内科, 石家庄 050013
哮喘是一种气道慢性炎症性疾病,以气道高反应性、气道炎症和气道重塑为主要特征,患者多表现出呼吸短促、胸闷、咳嗽和可变气流受限等临床症状,严重影响患者的生活质量[1]。穿山龙为薯蓣科薯蓣属植物穿龙薯蓣的干燥根茎,其主要有效成分为甾体皂苷类化合物,具有多种药理学活性,研究发现,穿山龙总皂苷可有效降低臭氧诱导产生的气道高反应性小鼠气道阻力,减轻肺脏炎症反应,因此笔者推测穿山龙总皂苷可能对治疗支气管哮喘具有潜在价值[2]。另有研究表明,穿山龙总皂苷可改善哮喘小鼠气道重塑[3]。但是,穿山龙总皂苷对哮喘小鼠发挥保护作用的具体机制尚不清楚。研究发现,哮喘小鼠肺组织中Janus激酶2/信号转导与转录激活子3(JAK2/STAT3)信号通路被异常激活[4]。STAT3信号通路抑制剂AG490干预可显著减轻慢性哮喘小鼠呼吸道重塑[5]。此外,穿山龙总皂苷可抑制STAT3蛋白表达起到抑制类风湿关节炎大鼠血管新生的作用[6]。通过筛选穿山龙治疗痛性糖尿病周围神经病变的潜在靶点发现,JAK2/STAT3信号通路是穿山龙发挥治疗作用的重要通路之一[7]。基于以上研究,实验通过建立哮喘大鼠模型,探讨穿山龙总皂苷对哮喘大鼠的作用及其具体机制。
1 材料与方法 1.1 实验动物SPF级雄性SD大鼠60只,6~8周龄,体质量180~200 g,购自北京实验动物研究中心,许可证号:SYXK(京)2020-0038,大鼠自由进食进水,室温(22±2)℃,湿度50%~60%,12 h明暗交替,适应性饲养3 d后用于实验。
1.2 试剂和仪器穿山龙总皂苷(纯度≥98%,陕西慈缘生物科技有限公司,批号:19057-60-4);卵清蛋白(美国Sigma公司,批号:A5253);白介素(IL)-4、IL-6和干扰素γ(IFN-γ)试剂盒(南京建成生物工程研究所,批号:H005,H007-1-1,H025-1-2);转化生长因子β1(TGF-β1)和Smad2引物序列(广州锐博生物科技有限公司);兔抗鼠p-JAK2、JAK2、p-STAT3和STAT3抗体(美国Abcam公司,批号:ab32101,ab108596,ab267373,ab68153);iMark多功能酶标仪(美国Bio-Rad公司);CKX53型倒置显微镜(日本奥林巴斯);DYY-6D型电泳仪(北京六一仪器厂)。
1.3 模型制备随机选取50只大鼠腹腔注射10% 卵清蛋白致敏液1.0 mL(致敏液主要由100 mg卵清蛋白、100 mg氢氧化铝和800 mg生理盐水配制而成)第4天、第7天和第14天各注射1次,从第15天开始用2%卵清蛋白溶液雾化激发,每日1次,每次30 min,共进行10 d,其余10只大鼠作为正常对照组腹腔注射生理盐水,并用生理盐水进行激发。大鼠出现喘息、呼吸急促、烦躁不安、站立不稳等症状则为模型制备成功[8]。将模型制备成功的48只大鼠随机分为模型组、穿山龙总皂苷低剂量组、穿山龙总皂苷中剂量组和穿山龙总皂苷高剂量组,每组12只。穿山龙总皂苷各剂量组大鼠分别灌胃穿山龙总皂苷20、40和80 mg/kg[9],每日1次,连续28 d,药物剂量根据哮喘患者临床用量的等效剂量和动物体表面积折算得到,正常对照组和模型组大鼠分别灌胃等体积生理盐水,模型制备和给药时间轴如图 1。
|
| 图 1 哮喘大鼠模型制备和给药治疗时间轴 Fig. 1 Timeline of preparation and administration of asthmatic rat models |
末次给药结束后2 h,各组大鼠10%戊巴比妥钠腹腔注射麻醉,仰卧位置于鼠板上,剥离支气管皮下组织,切开气管,进行气管插管并固定,连接生理记录仪,记录大鼠的肺顺应性和肺弹性阻力。
1.5 肺泡灌洗液中炎症因子水平测定将导管深入至大鼠右肺,1 mL磷酸盐缓冲溶液(PBS)进行灌肺3次,收集肺泡灌洗液,离心半径10 cm,3 000 r/min离心后取上清液,根据ELISA试剂盒说明书测定IL-6、IL-4和IFN-γ水平。
1.6 实时荧光定量(qRT-PCR)法检测气道重塑指标TGF-β1和Smad2 mRNA水平将大鼠断头处死,剥离左侧支气管,取部分组织,液氮中研磨,Trizol试剂提取组织中总RNA,根据逆转录试剂盒将RNA逆转录成cDNA,以cDNA为模板,反应条件为95℃预变性1 min,95 ℃变性20 s,60 ℃退火1 min,72℃延伸30 s,共进行40个循环,2-ΔΔCT法计算TGF-β1和Smad2 mRNA水平。引物序列见表 1。
取左侧肺组织进行石蜡包埋,制成4 μm厚的切片,烤箱中烘30 min后,二甲苯脱蜡,梯度乙醇脱水,进行HE染色,中性树胶封片,显微镜下观察并拍照。
1.8 蛋白印迹法检测肺组织中蛋白表达水平冰上快速摘取大鼠左肺组织,液氮中研磨,裂解液裂解,4 ℃ 12 000 r/min(离心半径8 cm)离心取上清液,BCA试剂盒测定蛋白浓度,加入上样缓冲液,100 ℃煮沸变性。50 μg蛋白进行聚丙烯酰胺凝胶电泳,将蛋白湿转至PVDF膜上,室温封闭,GAPDH、p-JAK2、JAK2、p-STAT3和STAT3抗体(1∶1 000)4 ℃孵育过夜,二抗(1∶5 000)室温孵育2 h,ECL法显色,分析条带灰度值,目的蛋白条带灰度值与GAPDH条带灰度值的比值为相对表达水平。
1.9 统计学方法采用SPSS 21.0统计学软件分析数据,计量资料均以均数±标准差(x±s)描述,多样本计量资料比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
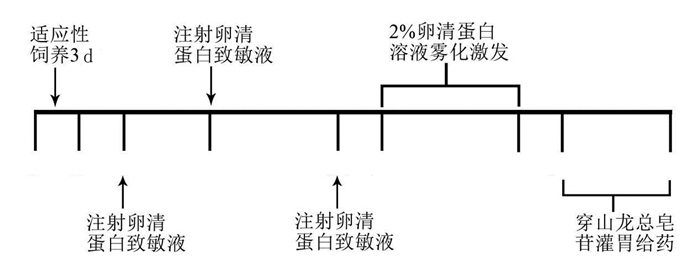
2 结果 2.1 肺顺应性和肺弹性阻力测定结果与正常对照组比较,模型组大鼠肺顺应性降低,肺弹性阻力升高(P<0.05);与模型组比较,穿山龙总皂苷低、中和高剂量组大鼠肺顺应性升高,肺弹性阻力降低(P<0.05);与穿山龙总皂苷低剂量组比较,穿山龙总皂苷中和高剂量组肺顺应性升高,肺弹性阻力降低(P<0.05);与穿山龙总皂苷中剂量组比较,穿山龙总皂苷高剂量组大鼠肺顺应性升高,肺弹性阻力降低(P<0.05)。见表 2。
|
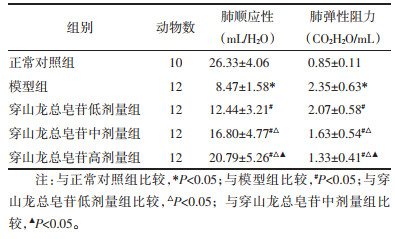
与正常对照组比较,模型组IL-6、IL-4和IFN-γ水平升高(P<0.05);与模型组比较,穿山龙总皂苷低、中和高剂量组IL-6、IL-4和IFN-γ水平降低(P<0.05);与穿山龙总皂苷低剂量组比较,穿山龙总皂苷中和高剂量组IL-6、IL-4和IFN-γ水平降低(P<0.05);与穿山龙总皂苷中剂量组比较,穿山龙总皂苷高剂量组IL-6、IL-4和IFN-γ水平降低(P<0.05)。见表 3。
|
与正常对照组比较,模型组TGF-β1和Smad2 mRNA水平升高(P<0.05);与模型组比较,穿山龙总皂苷低、中和高剂量组TGF-β1和Smad2 mRNA水平降低(P<0.05);与穿山龙总皂苷低剂量组比较,穿山龙总皂苷中和高剂量组TGF-β1和Smad2 mRNA水平降低(P<0.05);与穿山龙总皂苷中剂量组比较,穿山龙总皂苷高剂量组TGF-β1和Smad2 mRNA水平降低(P<0.05)。见表 4。
|
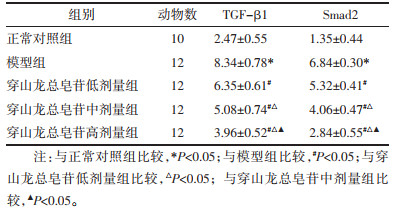
正常组大鼠肺组织结构正常完整,无炎性细胞浸润;模型组大鼠肺组织炎症中性粒细胞浸润、间质水肿、肺泡间隔增厚、肺泡内及间质斑片状出血;穿山龙总皂苷低、中和高剂量组大鼠肺组织病理损伤减轻。见图 2。

|
| 注:A.正常对照组;B.模型组;C.穿山龙总皂苷低剂量组;D.穿山龙总皂苷中剂量组;E.穿山龙总皂苷高剂量组。 图 2 肺组织HE染色(×200) Fig. 2 HE staining of lung tissue(×200) |
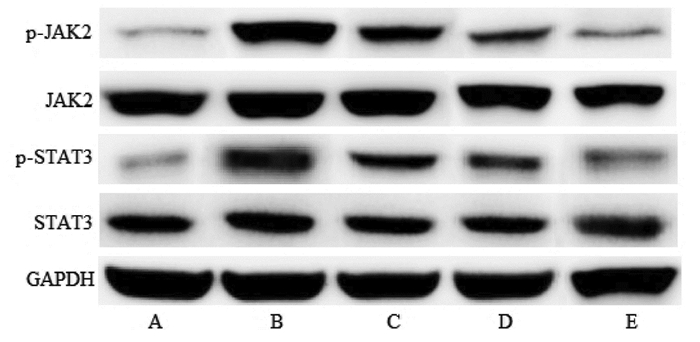
与正常对照组比较,模型组p-JAK2/JAK2和p-STAT3/STAT3升高(P<0.05);与模型组比较,穿山龙总皂苷低、中和高剂量组p-JAK2/JAK2和p-STAT3/STAT3降低(P<0.05);与穿山龙总皂苷低剂量组比较,穿山龙总皂苷中和高剂量组p-JAK2/JAK2和p-STAT3/STAT3降低(P<0.05);与穿山龙总皂苷中剂量组比较,穿山龙总皂苷高剂量组p-JAK2/JAK2和p-STAT3/STAT3降低(P<0.05)。见表 5和图 3。
|
|
| 注:A.正常对照组;B.模型组;C.穿山龙总皂苷低剂量组;D.穿山龙总皂苷中剂量组;E.穿山龙总皂苷高剂量组。 图 3 肺组织中p-JAK2、JAK2、p-STAT3和STAT3蛋白表达 Fig. 3 Expression of p-JAK2, JAK2, p-STAT3 and STAT3 proteins in lung tissue |
哮喘多发生于儿童,且发病率在全球范围内具有逐年升高趋势,目前临床治疗哮喘以糖皮质激素应用最为广泛,但长期使用存在诸多不良反应,且对部分患者治疗效果并不理想[10]。而中药因其毒性小,来源广等特点受到学者广泛关注,穿山龙总皂苷具有抗炎、抗氧化等多种药理学作用,研究发现,穿山龙总皂苷可抑制支气管哮喘大鼠CysLTs炎症信号通路,减轻肺组织病理变化[11]。穿山龙通过抑制TGF-β1介导的上皮间质转化从而改善气道重塑状态,抑制肺功能下降[12]。因此本研究探讨穿山龙总皂苷对哮喘大鼠的改善作用及机制。
大量炎症细胞浸润以及炎性因子释放是哮喘发病的基础[13-14],研究发现,大黄酚通过调节TWEAK/Fn14信号通路降低小鼠肺泡灌洗液中多种炎性细胞数量和炎症因子水平,可有效改善肺组织病理学变化,降低哮喘症状评分[15]。黄芪皂苷Ⅱ减轻哮喘幼年大鼠气道炎症反应,可修复肺组织结构,改善哮喘症状[16]。因此本研究检测大鼠肺泡灌洗液中炎症因子表达水平,结果显示:正常组大鼠肺组织结构正常完整,无炎性细胞浸润;模型组大鼠肺组织炎症中性粒细胞浸润、间质水肿、肺泡间隔增厚、肺泡内及间质斑片状出血;穿山龙低、中和高剂量组大鼠肺组织病理损伤减轻。模型组大鼠IL-6、IL-4和IFN-γ水平升高,穿山龙各剂量组大鼠IL-6、IL-4和IFN-γ水平降低,且具有剂量依赖性,由此可见穿山龙总皂苷可降低哮喘大鼠炎症反应,改善肺组织病理损伤。哮喘发作过程中,大量炎性细胞浸润释放大量炎性因子,导致患者气道平滑肌细胞增殖、支气管上皮细胞损伤,基底膜增厚和上皮下胶原大量沉积,从而发生气道重塑,而气道重塑被认为是引起不可逆性气流阻塞和肺功能障碍的主要原因[17-18]。TGF-β1是一种前纤维化生长因子,对促进气道肌成纤维细胞增殖和胶原合成具有重要作用,被证明是哮喘患者发生气道重塑的重要诱导因子之一[19]。Smad2是介导TGF-β1信号转导的重要因子之一,可将信号直接从细胞膜传递至细胞核,从而调控细胞增殖、分化和凋亡[20]。因此本研究通过qRT-PCR法检测支气管组织中Smad2和TGF-β1 mRNA水平,结果显示:模型组Smad2和TGF-β1 mRNA水平均高于正常组,穿山龙各剂量组Smad2和TGF-β1 mRNA水平均低于模型组,说明穿山龙总皂苷可抑制哮喘大鼠支气管气道重塑。气道重塑引起气道结构改变,因此降低肺功能。肺顺应性和肺弹性阻力均是反映肺功能的重要指标,两者呈负相关性,受外力作用肺的弹性组织扩张时,肺的顺应性越小,肺的弹性阻力越大[21]。本研究通过测定肺功能发现:模型组大鼠肺顺应性降低,肺弹性阻力增大,而穿山龙总皂苷各剂量组大鼠肺顺应性升高,肺弹性阻力减小,说明穿山龙总皂苷可改善肺功能障碍。
JAK2/STAT3信号通路是经典的介导炎症反应的信号通路,在炎症因子的刺激下,JAK2被激活发生磷酸化,通过进一步激活STAT3调节基因转录介导IFN-γ、IL-6和IL-1β等多种炎症因子表达,而大量炎症因子又进一步激活该信号通路的磷酸化进程,从而形成扩大炎症级联反应[22-23]。研究发现,黄芩素通过抑制JAK2/STAT3信号通路抑制哮喘小鼠气道平滑肌细胞增殖和迁移,降低炎症反应[24]。研究结果显示:模型组p-JAK2/JAK2和p-STAT3/STAT3蛋白相对表达量升高,穿山龙各剂量组p-JAK2/JAK2和p-STAT3/STAT3蛋白相对表达量降低,说明穿山龙总皂苷可抑制JAK2/STAT3信号通路异常激活。
综上所述,穿山龙总皂苷可改善哮喘大鼠肺功能,降低炎症反应,抑制肺重塑,减轻肺组织病理损伤,其可能是通过抑制JAK2/STAT3信号通路发挥作用,为临床治疗哮喘提供理论依据。
| [1] |
NETZ M, FEDELE D A, SWEENIE R, et al. Asthma management responsibility, control, and quality of life among emerging adolescents[J]. Journal of Pediatric Psychology, 2020, 45(1): 40-49. DOI:10.1093/jpepsy/jsz069 |
| [2] |
王爱利, 王悦, 郭佳, 等. 穿山龙总皂苷对臭氧诱导的小鼠气道高反应性和IL-17A表达的影响[J]. 生物医学工程研究, 2018, 37(4): 430-435. WANG A L, WANG Y, GUO J, et al. The effect of con-saponin of dioscoreae nipponicae on ozone-induced airway hyperresponsiveness and IL-17A expression in mice[J]. Journal of Biomedical Engineering Research, 2018, 37(4): 430-435. |
| [3] |
江立斌, 戴金峰. 穿山龙总皂苷对哮喘小鼠BRP-39表达及PI3K/AKT信号通路的影响[J]. 中国中西医结合杂志, 2020, 40(1): 75-79. JIANG L B, DAI J F. Effects of con-saponin of dioscoreae nipponicae on BRP-39 expression and PI3K/AKT signal pathway in chronic asthmatic mice[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2020, 40(1): 75-79. |
| [4] |
瞿廷念, 黄波, 雷丽, 等. 西替利嗪抑制哮喘小鼠肺组织JAK2-STAT3通路激活及肥大细胞活化[J]. 细胞与分子免疫学杂志, 2022, 38(3): 193-198. QU T N, HUANG B, LEI L, et al. Cetirizine inhibits activation of JAK2-STAT3 pathway and mast cell activation in lung tissue of asthmatic mice[J]. Chinese Journal of Cellular and Molecular Immunology, 2022, 38(3): 193-198. |
| [5] |
苗青, 王燕, 任亦欣, 等. AG490拮抗STAT3信号通路对慢性哮喘小鼠气道重塑的影响[J]. 中华临床免疫和变态反应杂志, 2020, 14(3): 190-196. MIAO Q, WANG Y, REN Y X, et al. Effect of inhibiting phosphorylation of signal transducer and activator of transcription-3 on airway remodeling in asthmatic mouse model[J]. Chinese Journal of Allergy & Clinical Immunology, 2020, 14(3): 190-196. |
| [6] |
高亚贤, 梁秀军, 董文娟, 等. 穿山龙总皂苷对胶原诱导性关节炎大鼠关节滑膜组织NF-κB p65活性及STAT3表达的影响[J]. 中国医科大学学报, 2012, 41(6): 485-489. GAO Y X, LIANG X J, DONG W J, et al. Effects of total saponin from rhizoma dioscreae nipponicae on NF-κB p65 activity and STAT3 protein expression in joint synovium of CIA rats[J]. Journal of China Medical University, 2012, 41(6): 485-489. DOI:10.3969/j.issn.0258-4646.2012.06.002 |
| [7] |
李建, 冷锦红. 穿山龙治疗痛性糖尿病周围神经病变的网络药理学作用机制[J]. 中成药, 2019, 41(10): 2509-2517. LI J, LENG J H. Network pharmacological mechanism of dioscorea nipponica thunb in treating painful diabetic peripheral neuropathy[J]. Chinese Traditional Patent Medicine, 2019, 41(10): 2509-2517. |
| [8] |
黄武锋, 余常辉, 赵海金, 等. TSLP siRNA干预对哮喘模型大鼠气道重塑的作用及对ERK信号通路的影响[J]. 重庆医学, 2021, 50(14): 2341-2345, 2351. HUANG W F, YU C H, ZHAO H J, et al. Effect of TSLP siRNA intervention on airway remodeling and ERK signaling pathway in asthmatic model rats[J]. Chongqing Medicine, 2021, 50(14): 2341-2345, 2351. |
| [9] |
杨俊侠, 曹述任, 顾文超. 穿山龙总皂苷经TGF-β1/α-SMA通路减轻博莱霉素所致大鼠肺纤维化的实验研究[J]. 中国药师, 2020, 23(10): 1905-1910. YANG J X, CAO S R, GU W C. Relieving effect of total saponins from rhizoma dioscorea nipponica on bleomycin-induced pulmonary fibrosis by regulating TGF-β1/α-SMA pathway in rats[J]. China Pharmacist, 2020, 23(10): 1905-1910. |
| [10] |
MCDOWELL P J, STONE J H, ZHANG Y Q, et al. Quantification of glucocorticoid-associated morbidity in severe asthma using the glucocorticoid toxicity index[J]. The Journal of Allergy and Clinical Immunology in Practice, 2021, 9(1): 365-372. |
| [11] |
李保君, 王园, 张亚军. 穿山龙对支气管哮喘大鼠CysLTs炎症通路的影响研究[J]. 亚太传统医药, 2022, 18(11): 14-18. LI B J, WANG Y, ZHANG Y J. Effect of dioscorea nipponica makino on CysLTs inflammatory pathway in bronchial asthma rats[J]. Asia-Pacific Traditional Medicine, 2022, 18(11): 14-18. |
| [12] |
徐俪颖, 赵玮, 王媛, 等. 穿山龙对支气管哮喘小鼠气道重构和上皮-间质转化的干预作用[J]. 中华中医药杂志, 2022, 37(12): 7007-7011. XU L Y, ZHAO W, WANG Y, et al. Effects of Dioscoreae Nipponicae Rhizoma on airway remodeling and epithelial- mesenchymal transformation in asthmatic mice[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2022, 37(12): 7007-7011. |
| [13] |
MANUEL A M, VAN DE WETERING C, MACPHERSON M, et al. Dysregulation of pyruvate kinase M2 promotes inflammation in a mouse model of obese allergic asthma[J]. American Journal of Respiratory Cell and Molecular Biology, 2021, 64(6): 709-721. |
| [14] |
王婷, 李海舰, 廖明, 等. 基于TWEAK/Fn14信号通路探讨大黄酚对OVA诱导哮喘小鼠的保护作用[J]. 天津中医药大学学报, 2022, 41(5): 644-648. WANG T, LI H J, LIAO M, et al. Study on the protective effect of rhubarphol on ovalbumin induced asthmatic mice based on TWEAK/Fn14 signal pathway[J]. Journal of Tianjin University of Traditional Chinese Medicine, 2022, 41(5): 644-648. |
| [15] |
伍爽, 李微, 黎达, 等. 黄芪皂苷Ⅱ对哮喘幼年大鼠IL-21/STAT3通路及气道炎症反应的影响[J]. 中国比较医学杂志, 2021, 31(12): 53-59. WU S, LI W, LI D, et al. Effects of astragaloside Ⅱ on the IL-21/STAT3 pathway and airway inflammation in young asthmatic rats[J]. Chinese Journal of Comparative Medicine, 2021, 31(12): 53-59. |
| [16] | |
| [17] |
BANNO A, REDDY A T, LAKSHMI S P, et al. Bidirectional interaction of airway epithelial remodeling and inflammation in asthma[J]. Clinical Science, 2020, 134(9): 1063-1079. |
| [18] |
CHEN X F, XIAO Z, JIANG Z Y, et al. Schisandrin B attenuates airway inflammation and airway remodeling in asthma by inhibiting NLRP3 inflammasome activation and reducing pyroptosis[J]. Inflammation, 2021, 44(6): 2217-2231. |
| [19] |
EVASOVIC J M, SINGER C A. Regulation of IL-17A and implications for TGF-β1 comodulation of airway smooth muscle remodeling in severe asthma[J]. American Journal of Physiology Lung Cellular and Molecular Physiology, 2019, 316(5): L843-L868. |
| [20] |
DING A, BIAN Y Y, ZHANG Z H. SP1/TGF-β1/SMAD2 pathway is involved in angiogenesis during osteogenesis[J]. Molecular Medicine Reports, 2020, 21(3): 1581-1589. |
| [21] |
AMBHORE N S, KALIDHINDI R S R, LOGANATHAN J, et al. Role of differential estrogen receptor activation in airway hyperreactivity and remodeling in a murine model of asthma[J]. American Journal of Respiratory Cell and Molecular Biology, 2019, 61(4): 469-480. |
| [22] |
YANG N N, YANG J W, YE Y, et al. Electroacupuncture ameliorates intestinal inflammation by activating α7nAChR-mediated JAK2/STAT3 signaling pathway in postoperative ileus[J]. Theranostics, 2021, 11(9): 4078-4089. |
| [23] |
TONG J Z, FANG J, ZHU T T, et al. Pentagalloylglucose reduces AGE-induced inflammation by activating Nrf2/HO-1 and inhibiting the JAK2/STAT3 pathway in mesangial cells[J]. Journal of Pharmacological Sciences, 2021, 147(4): 305-314. |
| [24] |
余保, 申严, 卓宋明. 黄芩素对哮喘小鼠气道平滑肌细胞增殖、迁移及JAK/STAT通路的影响[J]. 广西医科大学学报, 2021, 38(9): 1692-1697. |
2. Department of Respiratory Medicine, Hebei Hospital of Traditional Chinese Medicine, Shijiazhuang 050013, China
 2023, Vol. 40
2023, Vol. 40