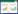文章信息
- 李倩, 肖臻, 姜之炎.
- LI Qian, XIAO Zhen, JIANG Zhiyan.
- 细芥化痰平喘凝胶贴膏对哮喘小鼠气道炎症的影响
- Effect of Xijie Huatan Pingchuan gel plaster on airway inflammation in asthmatic mice
- 天津中医药, 2023, 40(5): 642-648
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(5): 642-648
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.05.18
-
文章历史
- 收稿日期: 2022-12-17
支气管哮喘(简称“哮喘”)是以气道高反应和气道慢性炎症为特点的特异性疾病,临床表现为反复喘息、咳嗽、胸闷和呼吸急促等症状,是影响所有年龄组的全球严重健康问题[1]。该病急性发作期间严重影响患儿的学习、日常活动及社交,影响其生长发育[2]。哮喘是由多种炎性细胞和炎性介质共同参与的慢性呼吸道系统疾病,气道炎症是哮喘发病的核心环节,其发病机制与辅助性T细胞1(Th1)/辅助性T细胞2(Th2)失衡所致。Th2细胞优势或Th2细胞反应亢进是哮喘的主要免疫学发病机制[3],故调节Th1和Th2细胞的分化以及细胞因子的相对平衡是治疗哮喘最有效的途径。
现代大量研究已证明,中药内服加外治综合治疗小儿哮喘在控制急性发作和预防发作中有明显优势[4],可缓解哮喘气道重塑,抑制Th2细胞优势表达,改善哮喘气道炎症[5]。穴位贴敷疗法是以中医经络学为理论依据的一种外治疗法,临床实践证明,穴位贴敷可有效改善哮喘复发,疗效确切,不良反应少,患者易于接受[6]。近年来穴位敷贴不仅用于哮喘缓解期,对于哮喘急性发作期配合穴位敷贴治疗临床效果亦显著,并成为防治哮喘的常用外治疗法。小儿敷贴粉是上海中医药大学附属龙华医院儿科临床应用近50年的有确切疗效的哮喘外用药,由细辛、白芥子、椒目、延胡索、甘遂和干姜组成,具有宣肺化饮、涤痰祛瘀平喘之功效。笔者基于小儿敷贴粉,利用现代药物提纯技术和药物经皮吸收技术制成凝胶贴膏。前期对该制剂的抗炎止咳平喘等药效学及安全性[7]开展了研究,证实该制剂的安全性和有效性。为了进一步探讨其治疗咳喘的作用机制,笔者采用卵蛋白致敏激发的方法建立哮喘小鼠模型,通过观察用药后小鼠的一般状态,统计肺泡灌洗液中炎性细胞的总数及分类计数,肺组织病理学的改变,血清中Th1/Th2代表的γ干扰素(IFN-γ)、白细胞介素(IL)-4、IL-6及IL-17炎症因子的变化,探讨细芥化痰平喘凝胶贴膏(以下简称为XJTG)对哮喘小鼠气道炎症相关作用机制与影响,为中医药治疗哮喘提供一定的理论依据。
1 材料 1.1 实验动物无特定病原体(SPF)级雄性BALB/c小鼠60只,体质量18~22 g,购自上海市计划生育研究所实验动物经营部,合格证号:SCXK(沪)2018-0006,于龙华医院动物实验中心饲养,自由食水,温度(23±2)℃,湿度(55±10)%。实验动物合格证号:20180006038643。
1.2 实验药物细芥敷贴丸剂(以下简称为XJW)及XJTG药物组成为细辛、白芥子、椒目、延胡索、甘遂和干姜。所有药物购于上海中医药大学附属龙华医院中草药药房。XJW为上方中草药按比例打细粉,调和做成圆饼状,以儿童体质量按20 kg左右算,换算成20 g体质量小鼠的每日用药量,采用人与动物的体表面积计算法换算,20 g小鼠中剂量生药需要500 mg。XJTG由上海复耀医药科技有限公司加工为凝胶贴膏制剂。以儿童体质量按20 kg算,换算成20 g体质量小鼠的每日用药量,采用人与动物的体表面积计算法换算。低剂量组小鼠生药剂量为0.65 g/贴,中剂量组小鼠生药剂量1.3 g/贴,高剂量组小鼠生药剂量为2.6 g/贴。
1.3 主要实验试剂、药物与仪器石蜡,上海国药集团(批号:69018961);甲醛,上海国药集团(批号:10010018);二甲苯,上海国药集团(批号:10023418);无水乙醇(批号:10092680);氨水(批号:110002118);苏木素,BASO(批号:714094);伊红,BASO(批号:BA4099);中性树脂,北京索莱宝公司(批号:G8590);卵清蛋白(OVA),美国Sigma公司(A5503-1G);氢氧化铝,美国Thermo公司(77161-5 mL);IFN-γ、IL-4、IL-6、IL-17、酶联免疫吸附实验(ELISA)试剂盒(96T),德国CST公司;苏木素-伊红(HE)染色试剂盒,德国CST公司;改良Masson三色染色试剂盒,北京索莱宝公司(批号:321376);Imject明矾佐剂,美国Thermo公司。正置显微镜,NIKON公司(型号:ECLIPSE Ni);移液器,吉尔森P型移液器公司(型号:P2、P10、P20、P100、P200、P1000);恒温烘箱,上海恒一科学仪器有限公司(型号:DHG-9023A);石蜡切片机,徕克公司(型号:SQ2125);摊片机,徕克公司(型号:PPTHK-21B);显微图象分析系统,NIKON公司(型号:DS-Ri2)。
2 方法 2.1 分组及模型建立将60只小鼠随机分为正常组(A组)、模型组(B组)、XJTG低剂量组(C组)、XJTG中剂量组(D组)、XJTG高剂量组(E组)、XJW组(F组)。每组10只。应性喂养7 d后进行实验。采用国际通用OVA致敏和激发方法进行哮喘模型复制。
模型组和各药物组分别于第1、8、15天予小鼠腹腔注射致敏液0.2 mL(含OVA 200 μg和氢氧化铝粉末1 mg)。激发实验从第21天开始至第28天,每日对模型组及各药物组小鼠进行支气管哮喘的激发。将小鼠置于密闭透明容器内(24 cm×24 cm×30 cm),予2% OVA溶液雾化激发,每日1次,30 min/次,连续7 d。为了保证实验的基本条件一致,正常组于第1、8、15天以生理盐水代替OVA溶液致敏,第21天起予生理盐水进行雾化吸入,方法、时间同上。在激发过程密切观察小鼠的行为、症状反应、哮喘发作状态。
2.2 给药方法造模成功后,模型组、各药物组动物背部“肺俞”穴(第3胸椎下两旁肋间),取穴方法参照王春田编著的《小鼠穴位图谱》及《实验针灸学》。在雾化激发的前1天,即实验的第20天,将动物背部剃毛,范围3~4 cm。第21天起,在雾化激发的同时,将药物敷贴于各药物组动物的肺俞穴,每日1次,每次4~8 h,连续7 d。
2.3 标本采集各实验组于最后1次激发24 h后取材。将各组小鼠颈椎脱臼处死,将小鼠仰卧位固定板上,剪毛,在无菌条件下剪开颈部皮肤,钝性分离,分离皮下组织及肌肉,暴露气管,将一根手术线从气管下穿过,结扎右主支气管,用22G静脉穿刺针插入气管内(注意不要超过气管分叉处),针线结扎,用1 mL注射器将0.5 mL生理盐水经留置针缓慢灌入气道内,来回抽吸3次,共行3次灌洗,用1.5 mL无菌离心管回收全部的支气管肺泡灌洗液(BALF,回收率>80%),收集的BALF于4 ℃,12 000 r/min,离心半径11 cm,离心10 min。离心后收集上清液,置-20 ℃冰箱保存,用于待测上清液中炎性因子的水平。用磷酸盐缓冲液(PBS)重悬细胞沉淀,用细胞计数板计数炎性细胞总数及涂片染色进行细胞分类计数。灌洗后取右肺上叶固定于10%福尔马林液中,用于制作石蜡切片和肺组织病理学检查。
2.4 观察项目及指标观测 2.4.1 动物一般状况通过观察记录各组动物的整体状态,判断是否有异常,包括体质量,皮毛外观,活动程度,呼吸、精神状态,睡眠,进食饮水,二便等状况,并分析相关原因,判断OVA激发哮喘动物模型是否造模成功。以小鼠出现搔鼻抓痒、大小便失禁、点头呼吸、腹部节律性收缩、呛咳等反应典型临床表现,外周血中嗜酸性粒细胞增多,肺组织呈现典型病理改变来确认哮喘小鼠模型造模成功[8]。评价F组与XJTG各剂量组治疗后的疗效,并对治疗后小鼠的临床症状和体征进行量化。具体评分标准为:0分,活泼安静、被毛光滑、呼吸平稳;1分,被毛稍枯燥、呼吸稍促、抓挠面部;2分,烦躁不安、呼吸急促、抓挠面部;3分,惊恐吱叫、呼吸急促、弓背收腹、腹肌痉挛;4分,精神萎靡、蜷缩不动、被毛枯槁、点头呼吸;5分,倒地抽搐甚至死亡。
2.4.2 BALF中炎症细胞计数及分类用100 μL冷的PBS重悬BALF细胞沉渣,取30 μL用细胞计数板计数细胞总染色后光学显微镜下计数200个细胞作分类计数,依据形态学特点将细胞分为巨噬细胞(m?覬)、中性粒细胞(Neu)、嗜酸性粒细胞(Eos)和淋巴细胞(Lym)。
2.4.3 肺组织病理学检查组织块经4%多聚甲醛固定后梯度乙醇脱水,常规石腊包埋,切片后分别行HE染色、Masson染色,光学显微镜下观察肺组织大体形态、炎性细胞浸润情况、胶原纤维沉积、肌纤维等情况。
2.4.4 酶联免疫吸附法(ELLSA)检测BALF中IFN-γ、IL-4、IL-6、IL-17的含量采用ELISA试剂盒使用说明进行实验,检测BALF中IFN-γ、IL-4、IL-6、IL-17的水平。
3 统计学方法采用SPSS 22.0统计软件。计量数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较若方差齐采用LSD-t检验,方差不齐则采用Games-Howell检验,P<0.05为差异有统计学意义。
4 结果 4.1 各组小鼠临床症状评分研究中无小鼠出现严重喘息的发作或死亡。动物造模期间,除A组外,其余各组小鼠在激发前呼吸平稳,雾化过程中逐渐出现搔鼻抓痒、大小便失禁、点头呼吸、喘息、腹部节律性收缩、呛咳等反应。随雾化激发次数的增加,表现有不同程度加重。B组小鼠症状最明显,表现出呼吸急促、抓挠面部等哮喘急性发作的临床表现,而药物干预后的各组(C组、D组、E组、F组)哮喘症状及整体状态均得到改善,E组较C组、D组、F组改善程度更明显。与B组相比,D组、F组改善程度具有统计学意义(P<0.05),E组改善程度具有显著统计学意义(P<0.01)。与C组相比,E组改善程度具有统计学意义(P<0.05)。见表 1。
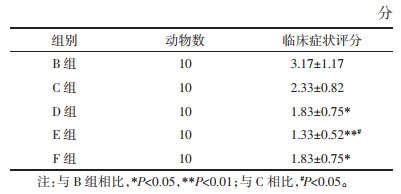
在各组中计算了BALF中的炎性细胞的总数并对其进行分类计数。与A组相比,B组炎症细胞总数及以嗜酸性粒细胞(EOS)为主的各分类炎症细胞均显著增加,而经过XJTG各剂量组(C组、D组、E组)及F组治疗后,均能不同程度地抑制BALF中炎性细胞总数及EOS等炎症细胞的增加。与B组相比,D组、E组、F组的各指标均有统计学意义(P<0.05),B组与C组间,在细胞总数及巨噬细胞上有统计学意义(P<0.05),其余指标无统计学意义(P>0.05)。与C组相比,D组、E组、F组的各指标均有统计学意义(P<0.05)。D组、E组两组除了嗜酸性粒细胞外其余指标组间差异有统计学意义(P<0.05),说明XJTG低、中、高3个剂量组高剂量组效果最好,对白细胞及EOS等炎症细胞的影响总体优于中剂量及低剂量,总体呈剂量依赖性;D组与F组两组各指标间无统计学意义(P>0.05),说明F组与中剂量组对白细胞及EOS等炎症细胞的影响功效相似。结果见表 2。
|
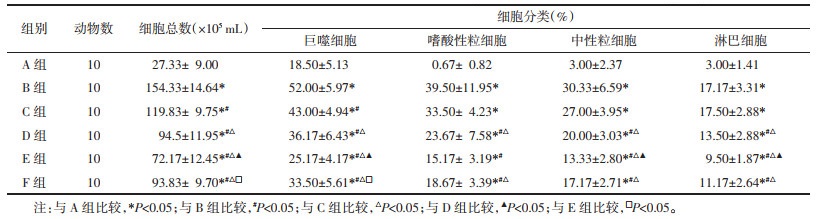
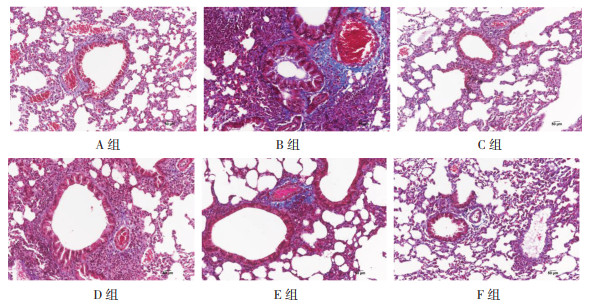
HE、Masson染色结果显示,正常组小鼠气道壁结构完整、轮廓清楚,小气道及血管周围未见炎细胞浸润,无充血、水肿、渗出等表现,无支气管柱状上皮细胞增生。哮喘模型组可见支气管壁皱襞增多、断裂,管腔明显狭窄变形,气道黏膜层及黏膜下层见大量炎性细胞浸润,气管平滑肌明显增厚,黏膜处存在大量上皮细胞增生、变形及脱落现象,周围可见大量蓝色胶原纤维、肌纤维及纤维素的形成,气道内黏液分泌增多。根据HE、Masson染色结果提示,哮喘模型组小鼠肺组织呈现典型病理改变,结合各组小鼠临床症状评分,说明哮喘小鼠模型造模成功。哮喘小鼠模型建立成功与正常组相比,C组、D组、E组与F组均可见气道上皮不完整,气道黏膜水肿,黏膜层、黏膜下层及血管周围有炎性细胞浸润,部分气道管腔狭窄,气道内有黏液,气管平滑肌增厚,蓝色胶原纤维、肌纤维及纤维素形成。与哮喘模型组相比,C组、D组、E组与F组各气道黏膜层、黏膜下层及血管周围炎性细胞浸润、气管平滑肌增厚、杯状细胞增生、变形及脱落现象、蓝色胶原纤维、肌纤维及纤维素均减少。与C组、F组相比,D组与E组小鼠炎性细胞浸润又进一步减少、气管平滑肌增厚现象和黏膜处上皮细胞增生、变形及脱落现象、胶原纤维等更少。E组气管周围仅存在少量炎细胞浸润、气管平滑肌增厚程度不明显、黏膜处上皮细胞增生、胶原纤维及肌纤维的形成。见图 1、2。
|
| 注:A组为正常组,B组为模型组,C组为XJTG低剂量组,D组为XJTG中剂量组,E组为XJTG高剂量组,F组为XJW组。 图 1 各组小鼠肺组织病理改变结果(HE染色,×200,刻度尺:50 μm) Fig. 1 Pathological changes of lung tissue of mice in each group (HE staining, ×200, scale: 50 μm) |
|
| 图 2 各组小鼠肺组织病理改变结果(Masson染色,×200,刻度尺:50 μm) Fig. 2 Results of pathological changes in lung tissue of mice in each group (Masson staining, ×200, scale: 50 μm) |
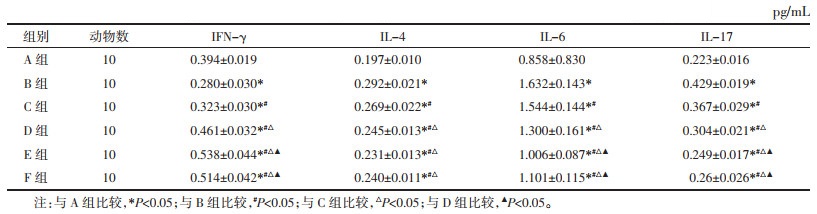
与A组相比,B组BALF中的IL-4、IL-6、IL-17含量增多(P<0.05),IFN-γ水平下降(P<0.05)。与B组相比,D组、E组及F组的IL-4、IL-6、IL-17含量均减少,IFN-γ含量增加,差异有统计学意义(P<0.05);C组与B组对比,L-4、IL-17含量减少,IFN-γ含量增加,差异有统计学意义(P<0.05)。与C组相比,D组、E组及F组的IL-4、IL-6、IL-17含量均减少,IFN-γ含量增加,差异有统计学意义(P<0.05)。与D组相比,E组及F组的IL-6、IL-17含量减少,IFN-γ含量增加,差异有统计学意义(P<0.05),对于IL-4的影响无统计学意义(P>0.05);上述指标中E组和F组差异无统计学意义(P>0.05)。说明XJTG可通过降低IL-4、IL-6、IL-17含量,升高IFN-γ的含量影响气道炎症,且XJTG低、中、高3个剂量组总体呈剂量依赖性。见表 3。
|
哮喘是儿童时期常见的一种慢性气道炎症性疾病,炎症细胞浸润是气道炎症的重要特征之一,其中以EOS的增多为主要表现[8]。
Th1/Th2可能是慢性气道炎症的免疫调节网络的核心。“Th1/Th2漂移”造成细胞因子网络的动态平衡破坏,Th1型细胞减弱,Th2型细胞效应增强,是哮喘发病的重要机制之一。Th1主要是介导机体局部炎症和细胞毒有关的免疫应答,分泌IFN-γ。Th2主要为对抗细胞外细胞寄生虫的免疫反应,多为IL-4所驱动诱发,分泌IL-4、IL-6等细胞因子,刺激B细胞增殖而产生免疫球蛋白[9]。气道炎症发生时,IL-4、IL-6含量增加与IFN-γ含量减少,可反映Th1/Th2失衡。17型辅助性T细胞(Th17)/调节性T细胞(Treg)的免疫失衡也是哮喘发病的重要机制之一[10]。Th17细胞可分泌多种细胞因子,其中最重要的是IL-17,可诱导产生多种细胞因子,激活巨噬细胞以及上皮细胞功能,加速释放人粒细胞巨噬细胞集落刺激因子,加重气道炎症反应。又对中性粒细胞发挥强大的化学趋势作用,活化的中性粒细胞产生的中性粒细胞弹性化蛋白酶不仅可降解弹性蛋白,还可促进气道腺细胞分泌,进而影响气道结构,导致气道重塑。有研究表明,大量IL-17的分泌是通过增强Th2通路效应而导致重症哮喘[11]。
穴位敷贴体现了中医穴位-经络-脏腑系统的“整体观念”,近年来不仅用于“冬病夏治”三伏贴预防哮喘,而且在哮喘急性发作期联合应用时展现出其独特优势。
中医认为,哮喘为痰饮内伏,痰浊与血瘀互结,发作期则肺中伏痰搏结于气道、气道受阻、咳嗽多痰故而生喘。医圣张仲景在《金匮要略·痰饮咳嗽病脉证并治》云:“病痰饮者,当以温药和之”。小儿敷贴粉的组成为细辛、白芥子、椒目、延胡索、甘遂和干姜。其中细辛、白芥子为君药,具有温肺利气、化饮化痰之功,延胡索行气活血为臣药,甘遂逐水化饮为佐药,椒目、干姜温经通络,作为使药共助君药温肺化饮之力。细辛性温,味极辛,外温经而内温脏,具温肺化饮、解表散寒之功。白芥子味辛性温,可温肺豁痰利气、散结通络。延胡索味辛、苦,性温,功擅行气活血,破血逐瘀,能行血中气滞,气中血滞。配合性寒味苦辛的椒目,上能降气,中能燥湿,下能利水,通利三焦,行水消肿平喘,并配合具有温脾阳作用的干姜粉。诸药合之,达到宣肺化饮、涤痰祛瘀平喘之功。
外敷之药多为辛散温通之品,痰饮得温则化,同时温振肺阳,助肺恢复正常宣发肃降之功,则使咳喘得缓。现代药理学研究表明,细辛挥发油有明显的抗菌消炎、止咳平喘、抗氧化等作用。白芥子含多糖、挥发油、脂肪酸等成分,可促进药物透皮吸收,有抗炎、止咳、平喘、祛痰、镇痛等功效。延胡索含多种异喹啉类生物碱,可抗炎、镇静、镇痛。甘遂中的巨大戟二萜醇型化合物可以抑制肥大细胞活化,减少免疫球蛋白E抗体的形成。椒目主要含有脂肪酸、挥发油、氨基酸等成分,具有平喘镇咳、抗炎、抗血栓形成、调血脂等药理作用。干姜含有的精油类成分具有抑菌、抗氧化、抗病原体、改善局部血液循环等多种作用,其中姜酚类化合物有明显的镇痛消炎效果,挥发油可促进药物经皮吸收。
研究中细芥化痰平喘凝胶贴膏各剂量组、细芥敷贴丸组均能不同程度地抑制BALF中炎性细胞总数及炎症细胞的增加,表明细芥化痰平喘凝胶贴膏能有效的抑制哮喘小鼠的气道炎症。细芥化痰平喘凝胶贴膏各剂量组、细芥敷贴丸组能降低Th2细胞因子(IL-4、IL-6)的产生,并提高了Th1细胞因子(IFN-γ)水平,提示细芥化痰平喘凝胶贴膏及细芥敷贴丸可能通过纠正“Th1/Th2漂移”状态,抑制Th17细胞功能,减少炎症细胞的浸润从而改善哮喘气道炎症。
| [1] |
REDDEL H K, BACHARIER L B, BATEMAN E D, et al. Global initiative for asthma strategy 2021. Executive summary and rationale for key changes[J]. Archivos De Bronconeumología, 2022, 58(1): 35-51. DOI:10.1016/j.arbres.2021.10.003 |
| [2] |
TYRIS J, KELLER S, PARIKH K. Social risk interventions and health care utilization for pediatric asthma[J]. JAMA Pediatrics, 2022, 176(2): e215103. DOI:10.1001/jamapediatrics.2021.5103 |
| [3] |
ZHONG B, SUN S L, DU J T, et al. Risk factors for lower respiratory tract infection in children with tracheobronchial foreign body aspiration[J]. Medicine, 2019, 98(10): e14655. DOI:10.1097/MD.0000000000014655 |
| [4] |
荣健, 鲍凤和, 王萱, 等. 中西医治疗支气管哮喘的研究进展[J]. 内蒙古中医药, 2021, 40(10): 153-155. RONG J, BAO F H, WANG X, et al. Research progress of bronchial asthma treated by traditional Chinese and western medicine[J]. Inner Mongolia Journal of Traditional Chinese Medicine, 2021, 40(10): 153-155. |
| [5] |
王坤, 朱慧志, 杨磊, 等. 阳和平喘颗粒对哮喘BMSCs归巢及Notch信号通路的影响[J]. 中国中西医结合杂志, 2021, 41(3): 370-375. WANG K, ZHU H Z, YANG L, et al. Effect of Yanghe Pingchuan Granule on homing and Notch signaling pathway of asthma BMSCs[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2021, 41(3): 370-375. |
| [6] |
胡骏, 翁翎, 张聪, 等. UPLC-Q-TOF-MS结合网络药理学及实验验证探讨穴位贴敷药物成分及其干预支气管哮喘的作用机制[J]. 中国中药杂志, 2022, 47(5): 1359-1369. HU J, WENG L, ZHANG C, et al. Components of drugs in acupoint sticking therapy and its mechanism of intervention on bronchial asthma based on UPLC-Q-TOF-MS combined with network pharmacology and experimental verification[J]. China Journal of Chinese Materia Medica, 2022, 47(5): 1359-1369. |
| [7] |
李倩, 史竞懿, 姜之炎, 等. 细芥化痰平喘巴布贴止咳、祛痰、平喘药效学研究[J]. 上海中医药杂志, 2016, 50(12): 82-85. LI Q, SHI J Y, JIANG Z Y, et al. Pharmacodynamic study on antitussive, antiasthmatic and expectorant effects of Xijie Huatan Pingchuan Cataplasm[J]. Shanghai Journal of Traditional Chinese Medicine, 2016, 50(12): 82-85. |
| [8] |
MIYATA J, FUKUNAGA K, KAWASHIMA Y, et al. Cysteinyl leukotriene metabolism of human eosinophils in allergic disease[J]. Allergology International, 2020, 69(1): 28-34. DOI:10.1016/j.alit.2019.06.002 |
| [9] |
PETT R G, NYE S. Evaluation of a pharmacist-managed asthma clinic in an Indian Health Service clinic[J]. Journal of the American Pharmacists Association: JAPhA, 2016, 56(3): 237-241. DOI:10.1016/j.japh.2015.12.016 |
| [10] |
ZOU X L, CHEN Z G, ZHANG T T, et al. Th17/Treg homeostasis, but not Th1/Th2 homeostasis, is implicated in exacerbation of human bronchial asthma[J]. Therapeutics and Clinical Risk Management, 2018, 14: 1627-1636. |
| [11] |
LAJOIE S, LEWKOWICH I P, SUZUKI Y, et al. Complement-mediated regulation of the IL-17A axis is a central genetic determinant of the severity of experimental allergic asthma[J]. Nature Immunology, 2010, 11(10): 928-935. |
 2023, Vol. 40
2023, Vol. 40