天津中医药大学中医药研究院, 方剂学教育部重点实验室, 天津市中药药理学重点实验室, 方剂组分配伍重点研究室, 天津 301617
收稿日期:2023-03-16
基金项目:国家自然科学基金项目(81102860);国家中医药管理局中医临床疗效提升项目;天津中新药业集团股份有限公司开发项目(HX2021-47)
作者简介:陆兴玥(1997-), 女, 硕士研究生在读, 主要从事不孕症中药药理研究.
在临床上,越来越多年轻女性因为不孕、流产等疾病就诊,其主要原因是卵巢功能紊乱,下丘脑-垂体-卵巢轴(HPOA)对促卵泡生长素(FSH)、促黄体生成素(LH)水平调控失调,使卵巢不能周期性的产生和排出卵泡。卵巢功能紊乱轻者会患有卵巢储备功能低下,当卵巢功能紊乱加剧,HPOA对FSH和LH的分泌水平进一步失调[1-2],FSH和LH的过多分泌导致卵巢中卵母细胞被过度消耗,且被招募的卵泡不能发育为优势卵泡,导致40岁以下的女性甚至会患有早发性卵巢功能不全(POI),POI可致不孕,临床自然妊娠率仅约为5%~10%,严重影响女性生殖健康。POI导致的卵巢功能紊乱及低雌激素状态(血管舒缩症状及泌尿生殖系统萎缩、骨质疏松、心血管疾病等)对患者造成严重不良影响。临床上常以40岁以下女性的月经稀发持续至少4个月或者停经至少4个月,两次血清FSH均 > 25 U/L(两次检测间隔时间应大于4周以上)为POI确诊标准。目前临床上多使用戊酸雌二醇(E2)和醋酸甲羟孕酮共同治疗POI,两种药物的用药时间不能过长,否则在治疗过程患者又会遭受如子宫内膜癌、血管栓塞性疾病等多种不良影响[3-6]。
由明代龚廷贤《寿世保元》卷七的乌鸡丸加减而成乌鸡白凤丸,广泛用于治疗排卵期出血、青春期月经量少、围绝经期综合征、气血两虚、身体瘦弱、腰膝酸软、月经不调、带下等妇科疾病[7-9],疗效显著。方中用大量补肾之品滋阴壮阳,收敛固涩,如熟地黄、生地黄、山药、芡实、天门冬、桑螵蛸、牡蛎等;大量的乌鸡,辅以鳖甲、鹿角胶、鹿角霜等血肉有情之品,滋补功效更甚。此外,人参、黄芪、甘草还可补气健脾;当归、川芎、白芍、丹参尚可补血、活血,再加以香附疏肝理气,调经止痛,银柴胡清退虚热,共奏疏肝理气、补气养血、调经止带之功,与中医补肾疏肝健脾的POI治法相吻合[10]。乌鸡白凤片是在传统中成药乌鸡白凤丸基础上,应用现代工艺生产的新型中药制剂,改善患者的依从性。因此研究提出,乌鸡白凤丸改良剂型乌鸡白凤片是否对肾精气亏虚、肝郁气滞引起的POI有治疗作用?研究拟通过:1)小鼠腹腔注射4-去氧乙烯基环已烯(VCD)复制最佳POI模型。2)并以此POI模型为基础,探究乌鸡白凤片对VCD致POI小鼠的治疗作用,为临床治疗POI提供实验室依据和思路。
1 材料与方法
1.1 实验动物
8周龄35~40 g SPF级雌性昆明小鼠120只,购自斯贝福(北京)生物科技股份有限公司[动物生产许可证号:SCXK(京)2019-0010]。SPF级屏障环境,室温(21±2)℃,湿度(40±10)%,光照周期12/12 h,适应性饲养14 d后用于实验。本研究经过天津中医药大学动物伦理委员会批准,伦理审查编号:TCM-LAEC2021233。
1.2 实验药物、试剂及仪器
乌鸡白凤片,天津中新药业股份有限公司乐仁堂制药厂(批号:1100254),用0.5%羧甲基纤维素钠(CMC-Na)溶液配制成低、中、高3个浓度混悬药液,4 ℃保存备用;E2购自DELPHARM Lille S.A.S.(法国,拜耳医药保健有限公司)用0.5% CMC-Na溶液配制0.3 mg/kg混悬药液,4 ℃保存备用。巴士染色液购自北京索莱宝科技有限公司;血清FSH、LH酶联免疫试剂盒购自武汉云克隆股份有限公司;VCD购自Sigma公司;芝麻油购自上海源叶生物科技有限公司;4%多聚甲醛购自biosharp;苏木精-伊红(HE)染液购自北京中杉金桥生物技术有限公司。多功能酶标仪:TECAN INFINITE F50;光学显微镜:Nikon Y-FL;离心机:Thermo Fisher Sorvall Legend Micro 21R(离心半径为8.6 cm);电子天平:常州万泰天平仪器有限公司(ZN1004HM)。
1.3 实验方法
1.3.1 POI小鼠模型的建立
60只SPF级昆明小鼠自由饮水饮食,适应性饲养14 d。将小鼠随机分为正常(CON)组30只,模型(MOD)组30只。POI小鼠模型的制备参照文献[11-12]稍做调整,MOD组腹腔注射160 mg/(kg·d)VCD,CON组小鼠腹腔注射同体积芝麻油,每日1次,连续15 d。自腹腔注射VCD开始,每日阴道涂片观察小鼠动情周期;第15天开始,每5 d选择动情期小鼠进行眼眶取血0.5 mL,动态观察血清FSH、LH的水平;第45天开始,每5 d选择动情期小鼠处死,快速取出双侧子宫、卵巢称质量,并计算脏器指数,一侧卵巢置于4%多聚甲醛中固定。MOD组随腹腔注射VCD时间延长,小鼠动情周期全部紊乱,故MOD组后期采用随机抓取的方式。脏器指数=(脏器湿质量/体质量)×100%。
1.3.2 乌鸡白凤片灌胃给药
将60只昆明小鼠随机分为CON组、MOD组、E2组、乌鸡白凤片低、中、高剂量组,每组各10只。腹腔注射160 mg/(kg·d)VCD 15 d,观察40 d,总计造模55 d制备POI小鼠模型。第56天开始灌胃给药不同剂量乌鸡白凤片或阳性药E2,灌胃体积为每只0.16 mL。CON组、MOD组灌胃给予同体积溶媒0.5% CMC-Na,每只0.16 mL,共给药45 d。于给药第46天,采集各组小鼠血液,观察血清FSH、LH的水平。处死小鼠后快速取出双侧子宫、卵巢,用电子天平称取双侧子宫和卵巢湿质量后计算脏器指数,一侧卵巢置于4%多聚甲醛中固定。
1.3.3 阴道涂片观察小鼠动情周期
每日小鼠阴道脱落细胞涂片观察动情周期。用移液枪吸取20 μL生理盐水,轻柔插入小鼠阴道慢慢冲洗5次后,涂抹在黏附载玻片上,自然晾干后采用巴士染色法:95%乙醇固定细胞,梯度乙醇脱水。苏木精染细胞核,盐酸乙醇分化液浸泡洗去细胞质中苏木素。自来水冲洗后蓝化液返蓝,自来水再次冲洗。巴士染色液染色,经95%乙醇冲洗、无水乙醇脱水后,在光学显微镜下进行观察,并计算各组小鼠动情周期紊乱率。小鼠动情周期紊乱评判标准为:小鼠发情周期杂乱无章,或停滞于某个阶段,则认为该小鼠动情周期紊乱。
动情周期紊乱率=动情周期紊乱只数/每组总只数×100%。
临床上,以女性月经稀发持续或停经至少4个月为POI的诊断标准之一。因为小鼠的动情周期为5 d,故研究将小鼠至少有4次动情周期紊乱作为小鼠POI模型判定标准之一。
1.3.4 酶联免疫吸附(ELISA)法检测小鼠血清FSH、LH的水平
取血结束静置30 min,4 ℃,10 000×g离心20 min,取上清液。按照ELISA试剂盒说明书要求,向包被抗体的微孔中加入生物素标记的抗原和待测抗原(标准品或样本),待测抗原与生物素标记抗原对特异性抗体进行竞争结合,37 ℃孵育1 h后经洗涤去掉未结合物,然后加入过氧化物酶(HRP)标记的亲和素,37 ℃孵育30 min彻底洗涤后加入底物3,3’,5,5’-四甲基联苯胺(TMB)显色,加入终止液,酶标仪450 nm处检测吸光度。临床上POI的诊断的另一标准为两次血清FSH均 > 25 U/L(两次检测间隔时间应大于4周以上),研究同时采用两次血清FSH均显著升高作为小鼠POI模型判定的另一标准。
1.3.5 卵巢病理学观察
所取卵巢组织于4%多聚甲醛固定24 h以上,将固定好的组织修剪成合适大小后,经梯度乙醇脱水、二甲苯透明后用石蜡包埋、切片,在40 ℃温水中展片后贴于载玻片上,放入60 ℃烘箱中烘干。用二甲苯、梯度乙醇脱蜡至水,苏木精染细胞核,伊红染细胞质后再用梯度乙醇、二甲苯脱水,中性树胶封片,于光学显微镜下观察卵巢的组织学形态。
1.4 统计学方法
采用SPSS 26.0软件统计分析数据,服从正态分布的实验数据以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析(One-Way ANOVA),多组间多重比较方差齐时采用LSD法,不齐时采用Dunnett’s T3法。P < 0.05表示差异具有统计学意义。
2 结果
2.1 腹腔注射VCD后不同时间小鼠一般状态和动情周期观察
VCD造模过程中,CON组小鼠活动正常,皮毛光滑,排便及精神状态良好,反应灵敏,体质量稳定增长。MOD组小鼠腹腔注射VCD后,排便和毛色未见有明显变化,但情绪暴躁,易激惹,体质量虽增长但始终低于CON组小鼠。见图 1。
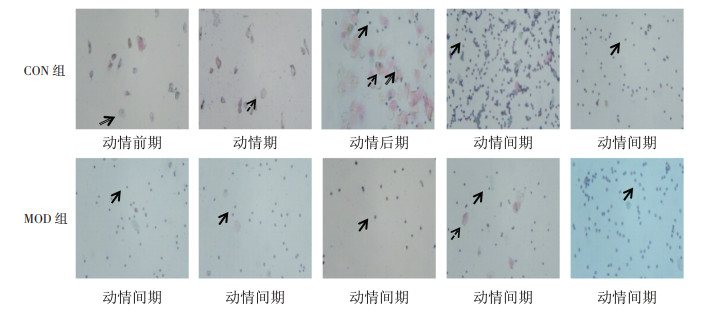
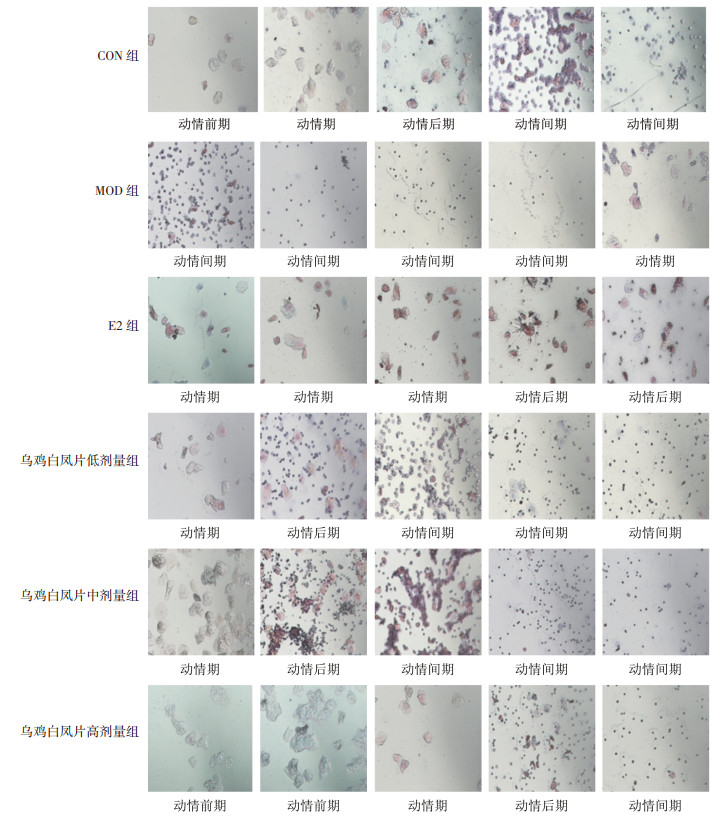
正常小鼠的动情周期一般为4~5 d,从图 1阴道涂片可以看出,CON组小鼠动情前期多为有核上皮细胞,动情期为大量的角质化无核上皮细胞;动情后期则表现为角质化无核上皮细胞、有核上皮细胞和白细胞3种细胞同时存在;进入动情间期后,白细胞占大多数,有核上皮和角质化上皮细胞少见。见图 2。正常情况下,小鼠动情周期按照动情前期,动情期,动情后期,动情间期4个阶段有序进行,构成一个完整的动情周期。
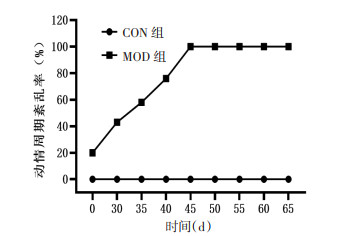
如小鼠发情周期杂乱无章,或停滞于某个阶段,则认为该小鼠动情周期紊乱。从图 2也可以看出,MOD组小鼠动情周期紊乱,常表现为无动情周期或动情周期延长。根据每日阴道涂片结果统计小鼠动情紊乱率,CON组从0~65 d,小鼠无动情紊乱。与CON组相比,MOD组小鼠在造模35 d时动情周期紊乱率达50%以上,45 d开始紊乱率达到100%,并持续至造模65 d。MOD组小鼠动情周期在第60、65天,动情周期紊乱状态达4个周期以上。见图 3。
2.2 腹腔注射VCD后不同时间小鼠血清FSH、LH的变化
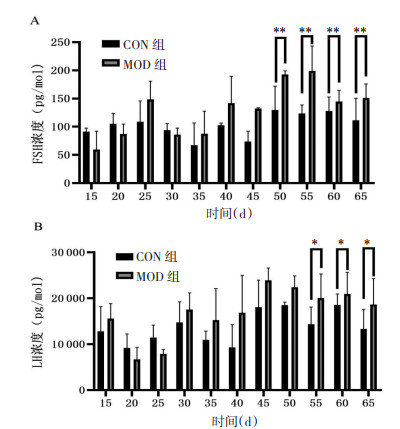
研究采集了VCD造模第15、20、25、30、35、40、45、50、55、60、65天的血清样本,ELISA法检测血清FSH、LH水平。与CON组相比,自造模第35天,MOD组小鼠血清FSH呈上升趋势,第50、55、60、65天,血清FSH极显著升高(P < 0.01);自造模第30天,MOD组小鼠血清LH呈上升趋势,第55天开始LH升高,差异具有统计学意义(P < 0.05)。
结合POI临床诊断标准,VCD造模55 d后小鼠动情周期已持续紊乱4个周期,血清FSH显著升高2次。故研究认为小鼠腹腔注射160 mg/(kg·d)VCD 15 d后观察40 d,总计造模55 d,可制备POI小鼠模型。见图 4。
2.3 腹腔注射VCD后不同时间小鼠卵巢、子宫湿质量及脏器指数的变化
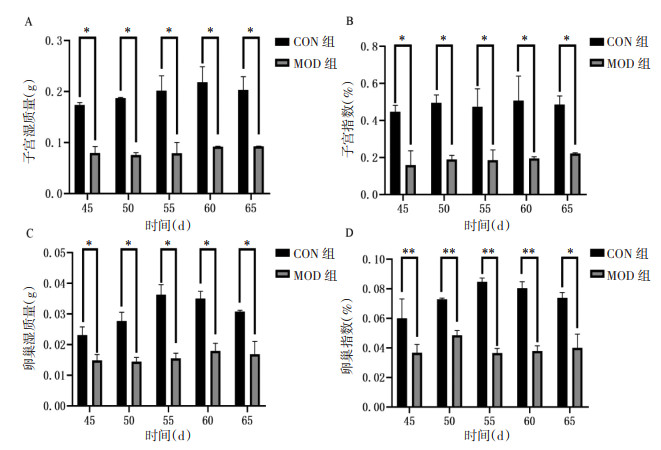
研究同时于第45、50、55、60、65天,处死CON组、MOD组小鼠各3只,称取小鼠子宫、卵巢湿质量,并计算脏器指数。与CON组相比,VCD造模55 d,MOD组小鼠子宫、卵巢湿质量及脏器指数下降,差异具有统计学意义(P < 0.05,P < 0.01)。见图 5。
2.4 腹腔注射VCD对小鼠卵巢形态的影响
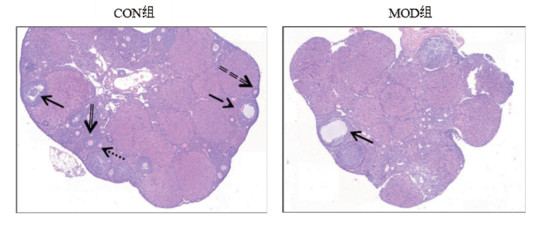
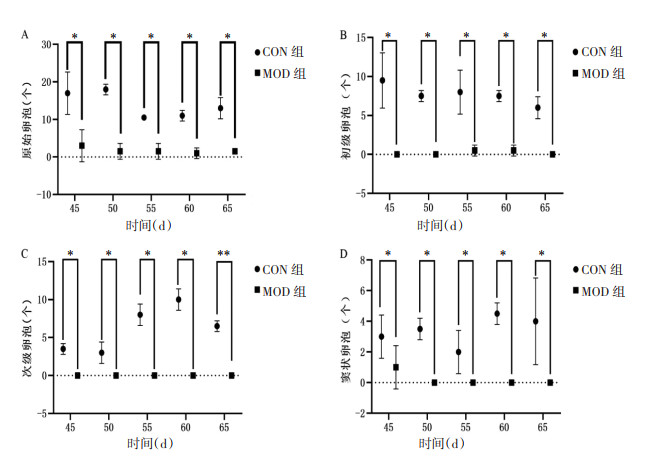
VCD造模55 d时,CON组小鼠卵巢结构清晰,原始卵泡、生长卵泡(初级卵泡和次级卵泡)和窦状卵泡数目较多,MOD组小鼠卵巢偏实质化,未见有原始卵泡和生长卵泡,见图 6。对卵巢中各级卵泡数目进行统计,VCD造模第55天,与CON组相比,MOD组小鼠卵巢中各级数量均降低,差异具有统计学意义(P < 0.05,P < 0.01)。见图 7。
2.5 乌鸡白凤片灌胃给药45 d对小鼠动情周期的影响
POI小鼠造模成功,乌鸡白凤片灌胃给药45 d后,阴道涂片观察显示,CON组小鼠动情周期正常,其余各组小鼠动情周期紊乱,表现为周期延长或无明显周期,经乌鸡白凤片干预后,各剂量组小鼠动情周期逐渐恢复,见图 8。乌鸡白凤片低剂量组小鼠有9只动情周期恢复正常,1只动情周期延长;乌鸡白凤片中、高剂量组小鼠动情周期均已恢复正常,且乌鸡白凤片对POI小鼠动情周期紊乱的改善作用优于E2组。见表 1。
表 1 乌鸡白凤片对POI小鼠动情周期的影响
Tab. 1
The effect of Wuji Baifeng Tablets on the estrous cycle of POI mice
2.6 乌鸡白凤片灌胃给药45 d对POI小鼠血清FSH、LH水平的影响
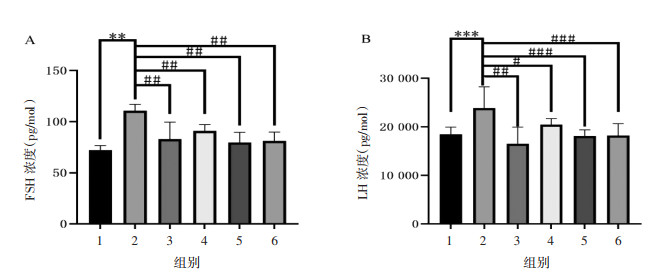
与CON组相比,MOD组小鼠血清FSH、LH水平升高,差异具有统计学意义(P < 0.01,P < 0.001)。与MOD组相比,给药治疗45 d后,乌鸡白凤片各剂量组小鼠血清FSH、LH呈剂量依赖性降低,差异具有统计学意义(P < 0.05,P < 0.01,P < 0.001),乌鸡白凤片中、高剂量组对POI小鼠FSH、LH水平异常升高的调控作用均优于E2。见图 9。
以上结果表明乌鸡白凤片可以显著降低POI小鼠血清FSH、LH水平,其作用可能是通过改善HPOA腺垂体对FSH、LH水平的分泌,改善POI小鼠的卵巢功能,促进卵泡正常发育为优势卵泡实现。
2.7 乌鸡白凤片灌胃给药45 d对POI小鼠子宫、卵巢湿质量及指数的影响
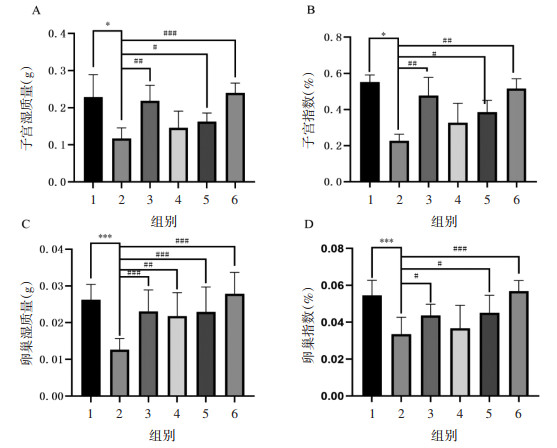
与CON组相比,MOD组小鼠子宫湿质量、子宫指数下降,差异具有统计学意义(P < 0.05);经乌鸡白凤片治疗45 d,与MOD组相比,乌鸡白凤中、高剂量组小鼠子宫湿质量、子宫指数升高,差异具有统计学意义(P < 0.05,P < 0.001)。同样,MOD组小鼠卵巢湿质量和卵巢指数低于CON组,差异具有统计学意义(P < 0.001),而乌鸡白凤中、高剂量组小鼠的卵巢湿质量和卵巢指数显著升高,差异具有统计学意义(P < 0.05,P < 0.001)。见图 10。
2.8 乌鸡白凤片灌胃给药45 d对POI小鼠卵巢形态的影响
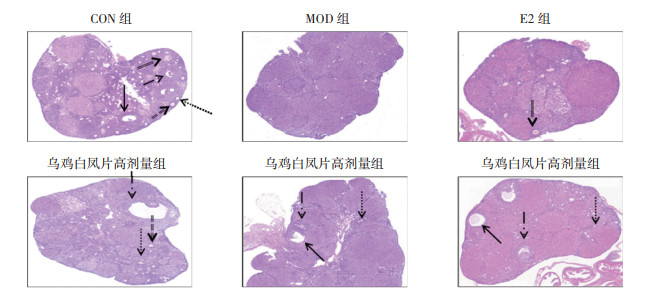
光学显微镜下观察发现,CON组卵巢结构正常,卵巢中可见发育良好的生长卵泡和窦状卵泡,黄体组织结构完整;MOD组卵巢发育较差,未发现生长卵泡、窦状卵泡。乌鸡白凤片给药治疗后,各剂量组卵巢中原始卵泡、生长卵泡数量增加,可见窦状卵泡和结构完整的黄体组织,见图 11。
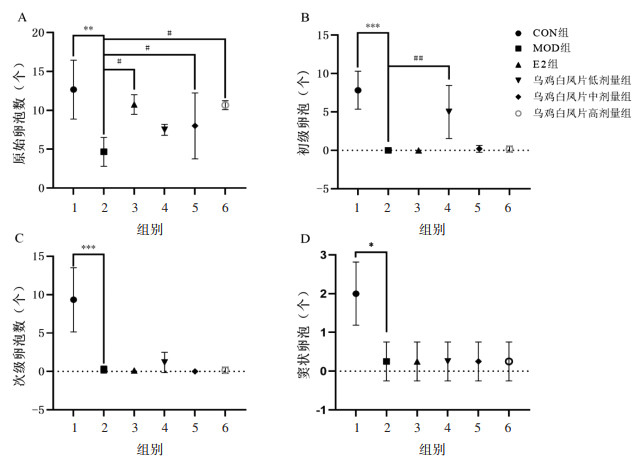
与CON组相比,MOD组各级卵泡数量减少,差异具有统计学意义(P < 0.05,P < 0.01,P < 0.001)。与MOD组相比,乌鸡白凤片中、高剂量组小鼠原始卵泡数量增加,差异具有统计学意义(P < 0.05);乌鸡白凤片低剂量组小鼠初级卵泡数量极增加,差异具有统计学意义(P < 0.01),证明乌鸡白凤片具有促进POI小鼠卵泡发育的作用,提示乌鸡白凤片具有治疗POI的作用。见图 12。
3 讨论
西医认为,月经是子宫周期性出血的一种生理现象,主要由HPOA调控,下丘脑作用于腺垂体,促使其分泌的FSH和LH作用于卵巢。在月经周期的前期,FSH、LH促进卵泡生长发育,并将卵巢内膜分泌的雄激素转化为雌激素。在FSH的作用下,被招募的卵泡中其中一个卵泡由于富含FSH受体且FSH阈值较低,成长为优势卵泡,再经LH分泌高峰的诱发下成为成熟卵泡排卵,排卵后的卵泡萎缩形成黄体,子宫内膜在黄体细胞分泌的雌、孕等激素的作用下逐渐增厚,此时雌激素负反馈作用于HPOA,减少FSH、LH分泌水平。在月经周期的后期,黄体萎缩,子宫内膜失去雌、孕等激素的支持,逐渐脱落,月经来潮[13]。由于POI患者卵巢功能受损,卵泡分泌雌激素能力降低,对HPOA的负反馈作用消失,导致FSH、LH水平在患者体内异常升高,卵泡被不断的招募、消耗,使得卵巢中剩余卵母细胞数量比正常女性少,同时被招募的卵泡由于FSH阈值较高,卵泡不能在FSH、LH促进下正常生长发育为优势卵泡[14],导致患者月经稀发或停经。本研究在此基础上,采用VCD诱导POI小鼠模型,监测小鼠FSH、LH血清水平和卵巢形态学变化,验证VCD对小鼠卵巢功能的损伤,并探究乌鸡白凤片通过调节FSH、LH水平,改善紊乱的HPOA,保护原始卵泡,促进卵泡发育,对抗VCD造成的卵巢功能损伤,使多数卵巢功能衰退的女性月经周期恢复正常[15]。
在实验研究中,POI动物模型的建立方法多样,主要依据其发病原因的不同而采用不同的病理方法来进行模型制备。总体评价而言,目前化疗药物、自身免疫方法以及卵巢毒性物质VCD,为较为公认的POI造模方法。其中,化疗药物会给实验动物带来感染其他疾病的风险,增加实验动物的死亡率;自身免疫性POI模型耗时较长,成功率低,故应用不广泛。相较于以上两组造模方法,卵巢毒性物质VCD不仅能动态模拟卵巢衰退的不同阶段,还在诱导FSH、LH分泌水平的变化与人类卵巢衰退的性激素的变化非常接近,同时还会引起动物行为的改变,例如焦虑、抑郁和攻击性等POI患者常出现的异常状态,且VCD对性腺以外的器官几乎无影响。故本研究采用VCD制备POI小鼠模型[16-17]。
VCD是工业上用作二环氧化物和环乙烯树脂稀释剂的4-乙烯基环己烯(VCH)的主要代谢产物之一。研究表明VCD通过攻击原始卵泡和初级卵泡,影响卵巢中雌激素的分泌,导致患者出现月经不调、流产等POI相关病症[11]。不同文献对于160 mg/(kg·d)VCD注射后判定POI模型成功观察的时间并不统一,如Hoyer报道注射后观察59 d,Romero-Aleshire报道注射后观察0 d。另外还有Cao等报道的VCD的注射剂量为80 mg/(kg·d),不同在研究采用的VCD制备POI动物模型的时间和剂量都不尽相同[12, 18-19]。研究结果显示,腹腔注射160 mg/(kg·d)VCD 15 d后,观察40 d,总计VCD造模55 d时小鼠HPOA功能紊乱,腺垂体对FSH、LH水平调控失调,FSH、LH水平异常升高,各级卵泡数量显著性下降,小鼠动情周期紊乱,与?魻zel等[20]报道的大鼠腹腔注射80 mg/(kg·d)VCD结果相一致,故后续实验采用腹腔注射160 mg/(kg·d)VCD 15 d后,观察40 d,总计VCD造模55 d,制备POI小鼠模型。
研究结果表明,乌鸡白凤片灌胃给药45 d对VCD致POI小鼠的动情周期具有较显著的调节作用,可通过显著下调POI小鼠HPOA腺垂体分泌FSH、LH水平,促进卵泡正常发育,改善小鼠动情周期,促进小鼠卵巢功能恢复,与邱勇飞等[21]、宋翠淼等[22]报道结果相一致。此外,乌鸡白凤片中、高剂量组对POI小鼠的动情周期紊乱和FSH、LH水平异常升高的改善效果优于E2组,能够较好的改善HPOA功能,且在给药期间小鼠未表现出不良反应,有利于提高临床治疗率和患者的依从性。
综上所述,腹腔注射160 mg/(kg·d天)VCD 15 d后,观察40 d,总计VCD造模55 d,可制备POI小鼠模型。乌鸡白凤片灌胃给药45 d后,可通过影响POI小鼠HPOA腺垂体分泌FSH、LH水平,保护原始卵泡并促进卵泡发育,调节POI小鼠动情周期,显著改善VCD所致小鼠POI病症。研究结合临床POI诊断标准,报道了VCD所致小鼠POI模型的动态过程,为后续POI实验动物模型的研究提供了研究基础。同时研究为乌鸡白凤片临床治疗POI提供了实验室依据。
Effect of Wuji Baifeng Tablets on premature ovarian insufficiency in mice induced by VCD
Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Ministry of Education, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40






 角质化上皮细胞;
角质化上皮细胞; 有核上皮细胞;
有核上皮细胞; 白细胞。
白细胞。 原始卵泡;
原始卵泡; 初级卵泡;
初级卵泡; 次级卵泡;
次级卵泡; 窦状卵泡;
窦状卵泡; 黄体。
黄体。
 原始卵泡;
原始卵泡; 初级卵泡;
初级卵泡; 次级卵泡;
次级卵泡; 窦状卵泡;
窦状卵泡; 黄体。
黄体。