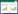文章信息
- 吴海滨, 马志强, 李帅, 等.
- WU Haibin, MA Zhiqiang, LI Shuai, et al.
- 基于SIRT1/SOX2信号通路探究西黄丸抗乳腺癌作用及机制
- Study on the anti breast cancer effect and mechanism of Xihuang Pill based on SIRT1/SOX2 signal pathway
- 天津中医药, 2023, 40(6): 775-781
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(6): 775-781
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.06.16
-
文章历史
- 收稿日期: 2023-02-17
乳腺癌起源于乳腺上皮组织,是女性成人最常见的恶性肿瘤之一[1]。流行病学研究表明,中国女性乳腺癌的发病率逐年上升[2]。目前,手术、化学疗法和放射疗法是乳腺癌的标准治疗方法,然而,晚期乳腺癌患者的5年生存率仍然很低[3]。因此,开发具有最小不良反应的有效抗癌药物至关重要。乳腺癌在中医属于“乳岩”范畴,治疗乳腺癌的关键在于祛痰活血、解毒消痈,而由牛黄、麝香、乳香、没药4味中药组成的西黄丸具有活血祛瘀、解毒消痈、化痰散结的作用,其中方中的君药牛黄具有清热解毒、化痰散结之功效,臣药麝香可散瘀血,佐使药乳香、没药行活血祛瘀之功能[4-5]。已有研究显示,西黄丸可抑制乳腺癌的进展[6]。但具体机制尚不完全明确。相关研究显示,抑制沉默调节蛋白1(SIRT1)/性别决定区Y框蛋白2(SOX2)通路可抑制乳腺癌细胞增殖与转移[7]。但西黄丸能否通过调控SIRT1/SOX2通路影响乳腺癌细胞增殖、迁移和侵袭尚不明确。因此,研究主要探究西黄丸对乳腺癌细胞增殖、迁移和侵袭的影响以及其作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞、动物来源人乳腺癌细胞系MDA-MB-231购自中国科学院上海细胞库。30只雌性BALB/c无胸腺裸鼠,6周龄体,体质量为21~23 g,购自北京维通利华实验动物技术有限公司,生产许可证号:SYXK(京)2022-0050。该研究动物实验得到本院动物伦理委员会的批准。
1.1.2 主要试剂西黄丸购自北京同仁堂科技发展股份有限公司,西黄丸水溶液的制备:将西黄丸浸泡于蒸馏水中泡软、碾碎,用蒸馏水配制成浓度分别为5、7.5、15 g/L西黄丸水溶液备用。SIRT1激活剂SRT 1720购自美国MCE公司;CCK-8试剂盒购自上海科艾博生物公司;兔源一抗增殖细胞核抗原(PCNA)、基质金属蛋白酶(MMP)-2、MMP-9、SIRT1、SOX2、β-actin、辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自英国Abcam公司。
1.2 方法 1.2.1 细胞培养与分组人乳腺癌细胞系MDA-MB-231在补充有10% FBS的DMEM培养基中培养。取对数生长期的MDA-MB-231细胞,分别利用5、7.5、15 g/L西黄丸[8]、6 μmol/L SRT 1720[9]、15 g/L西黄丸和6 μmol/L SRT 1720处理48 h,并命名为西黄丸低、中、高剂量组、SRT 1720组、西黄丸高剂量+SRT 1720组。另取正常培养的MDA-MB-231细胞作为对照组。
1.2.2 CCK-8法检测MDA-MB-231细胞增殖将1×104个MDA-MB-231细胞接种在96孔板的每个孔中,在细胞培养至0、24、48 h时分别向每孔中加入10 μL CCK-8试剂,孵育2 h后,利用酶标仪检测450 nm处的吸光度。并计算48 h时的细胞生长抑制率(%)=(1-实验组OD450值)/对照组OD450值×100%。
1.2.3 平板克隆实验检测MDA-MB-231细胞细胞克隆形成能力将300个MDA-MB-231细胞接种于6 cm细胞培养板中,在DMEM培养基中培养2周,每3 d更换1次培养基,2周后,将细胞在25 ℃下用4%多聚甲醛固定30 min,结晶紫溶液染色20 min。观察并统计每个细胞板上形成的克隆数。克隆形成率(%)=克隆数/接种细胞数×100%。
1.2.4 划痕实验检测MDA-MB-231细胞迁移能力将MDA-MB-231细胞(1×106个)接种于六孔板中,待细胞生长至100%汇合后,使用100 μL移液器吸头在单层细胞中引入划痕。用无血清培养基培养48 h后,用新鲜培养基洗涤六孔板两次以去除未贴壁的细胞,分别拍照0、48 h的细胞图像。划痕愈合率=(0 h划痕宽度-48 h划痕宽度)/0 h划痕宽度×100%。
1.2.5 Transwell检测MDA-MB-231细胞侵袭能力将150 μL无血清DMEM培养基中的MDA-MB-231细胞(1×105个/mL)接种到涂有基质胶的Transwell上室中。然后,将700 μL含10% FBS的DMEM培养基添加到下室中。将Transwell板在37 ℃下孵育24 h。侵入基质胶的细胞用甲醇固定,结晶紫染色,光镜下计数,测定各组侵入细胞数。
1.2.6 蛋白免疫印迹法(Western Blot)检测MDA-MB-231细胞中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达使用RIPA缓冲液裂解MDA-MB-231细胞并提取蛋白质,蛋白质经定量、电泳分离、转膜、封闭后,将膜与一抗PCNA(1∶1 000)、MMP-2(1∶2 000)、MMP-9(1∶1 000)、SIRT1(1∶2 000)、SOX2(1∶1 000)在4 ℃下孵育过夜,然后,将印迹与辣根过氧化物酶偶联的二抗(1∶500)在室温下孵育1 h。使用ECL试剂对印迹进行显影和可视化,Image J软件分析蛋白质条带的灰度值。
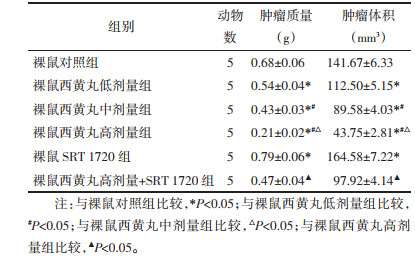
1.2.7 裸鼠体内成瘤实验将MDA-MB-231细胞以1×107个/mL的密度皮下注射到裸鼠体内,5周后,按照随机数字表法将裸鼠分为裸鼠对照组、裸鼠西黄丸低、中、高剂量组、裸鼠SRT 1720组、裸鼠西黄丸高剂量+SRT 1720组,每组5只。裸鼠西黄丸低、中、高剂量组[10]裸鼠分别需灌胃0.45、0.9、1.8 g/kg西黄丸且腹腔注射等体积的生理盐水;裸鼠SRT 1720组[11]裸鼠需腹腔注射1 mg/kg SRT 1720且灌胃等体积的生理盐水;裸鼠西黄丸高剂量+SRT 1720组裸鼠需灌胃1.8 g/kg西黄丸且腹腔注射1 mg/kg SRT 1720;裸鼠对照组裸鼠需灌胃等体积的生理盐水且腹腔注射等体积的生理盐水。每日给药1次,持续4周。4周后,处死裸鼠,分离出肿瘤组织,用游标卡尺测量肿瘤的长径(a)和短径(b),并计算肿瘤的体积,肿瘤的体积=0.5ab2,并称量肿瘤质量。肿瘤质量及体积检测完成后,分别取各组部分肿瘤组织用于PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白的检测,具体步骤参照1.2.6。
1.3 统计学方法使用IBM SPSS 21.0统计软件进行统计分析。计量资料用均数±标准差(x±s)表示。采用单因素方差分析进行多组间比较分析,组间两两比较采用SNK-q检验。P < 0.05为差异具有统计学意义。
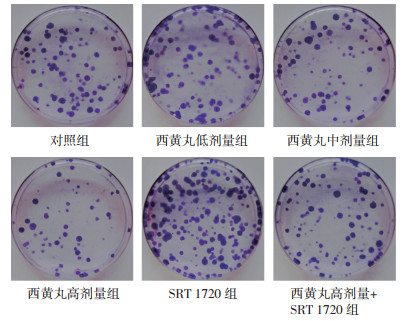
2 结果 2.1 西黄丸对各组MDA-MB-231细胞增殖能力的影响与对照组比较,西黄丸低、中、高剂量组MDA-MB-231细胞OD450值(24、48 h)、克隆形成率降低,生长抑制效率增强,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与对照组比较,SRT 1720组MDA-MB-231细胞OD450值(24、48 h)、克隆形成率升高,生长抑制效率减弱,差异具有统计学意义(P < 0.05);与西黄丸高剂量组比较,西黄丸高剂量+SRT 1720组MDA-MB-231细胞OD450值(24、48 h)、克隆形成率升高,生长抑制效率减弱,差异具有统计学意义(P < 0.05)。见图 1和表 1。
|
| 图 1 平板克隆实验检测MDA-MB-231细胞克隆形成能力 Fig. 1 Plate cloning test to detect the cloning ability of MDA-MB-231 cells |
|
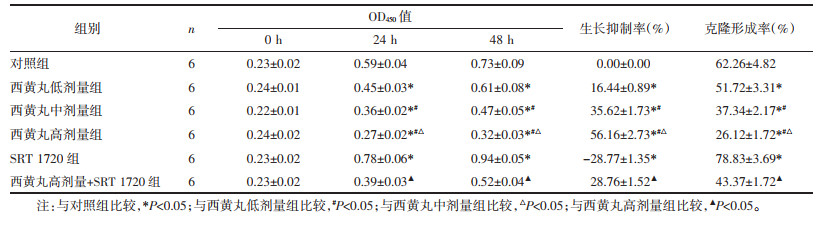
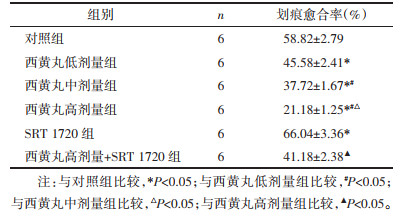
与对照组比较,西黄丸低、中、高剂量组MDA-MB-231细胞划痕愈合率降低,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与对照组比较,SRT 1720组MDA-MB-231细胞划痕愈合率升高,差异具有统计学意义(P < 0.05);与西黄丸高剂量组比较,西黄丸高剂量+SRT 1720组MDA-MB-231细胞划痕愈合率升高,差异具有统计学意义(P < 0.05)。见图 2和表 2。

|
| 图 2 划痕实验检测MDA-MB-231细胞迁移能力 Fig. 2 Scratch test to detect the migration ability of MDA-MB-231 cells |
|
与对照组比较,西黄丸低、中、高剂量组MDA-MB-231细胞侵袭数降低,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与对照组比较,SRT 1720组MDA-MB-231细胞侵袭数升高,差异具有统计学意义(P < 0.05);与西黄丸高剂量组比较,西黄丸高剂量+SRT 1720组MDA-MB-231细胞侵袭数升高,差异具有统计学意义(P < 0.05)。见图 3和表 3。
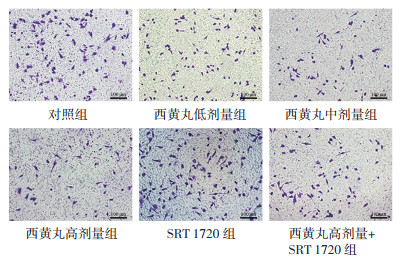
|
| 图 3 Transwell实验检测MDA-MB-231细胞侵袭能力 Fig. 3 Transwell test to detect the invasive ability of MDAMB-231 cells |
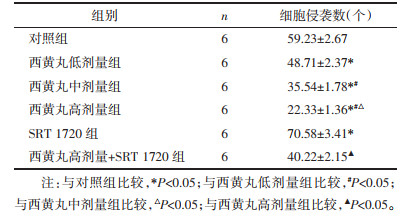
|
与对照组比较,西黄丸低、中、高剂量组MDA-MB-231细胞中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达降低,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与对照组比较,SRT 1720组MDA-MB-231细胞中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达升高,差异具有统计学意义(P < 0.05);与西黄丸高剂量组比较,西黄丸高剂量+SRT 1720组MDA-MB-231细胞中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达升高,差异具有统计学意义(P < 0.05)。见图 4和表 4。

|
| 图 4 western blot检测MDA-MB-231细胞中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达 Fig. 4 Western blot detection of PCNA, MMP-2, MMP-9, SIRT1, SOX2 protein expression in MDA-MB-231 cells |
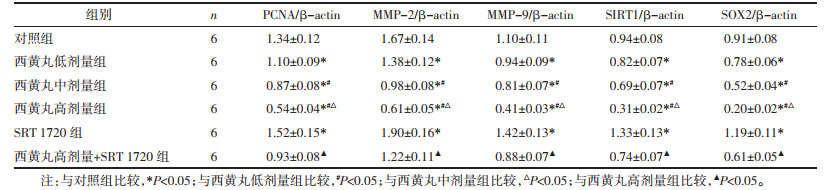
|
与裸鼠对照组比较,裸鼠西黄丸低、中、高剂量组裸鼠移植瘤质量及体积降低,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与裸鼠对照组比较,裸鼠SRT 1720组裸鼠移植瘤质量及体积升高,差异具有统计学意义(P < 0.05);与裸鼠西黄丸高剂量组比较,裸鼠西黄丸高剂量+SRT 1720组裸鼠移植瘤质量及体积升高,差异具有统计学意义(P < 0.05)。见图 5和表 5。
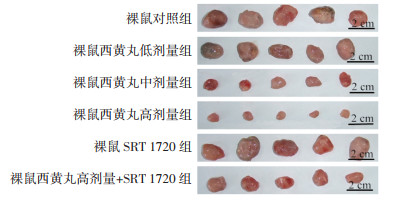
|
| 图 5 各组裸鼠移植瘤生长情况比较 Fig. 5 Comparison of tumor growth in nude mice in each group |
|
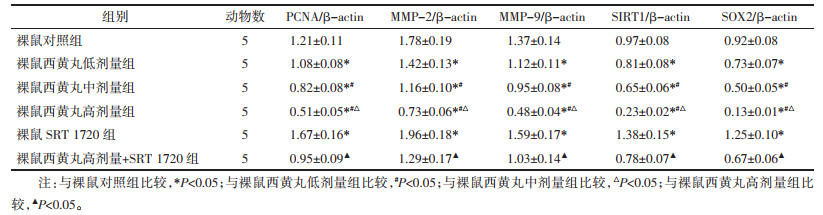
与裸鼠对照组比较,裸鼠西黄丸低、中、高剂量组PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达降低,且呈剂量依赖性,差异具有统计学意义(P < 0.05);与裸鼠对照组比较,裸鼠SRT 1720组PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达升高,差异具有统计学意义(P < 0.05);与裸鼠西黄丸高剂量组比较,裸鼠西黄丸高剂量+SRT 1720组PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达升高,差异具有统计学意义(P < 0.05)。见图 6和表 6。

|
| 注:1. 裸鼠对照组;2. 裸鼠西黄丸低剂量组;3. 裸鼠西黄丸中剂量组;4. 裸鼠西黄丸高剂量组;5. 裸鼠SRT 1720组;6. 裸鼠西黄丸高剂量+SRT 1720组。 图 6 Western blot检测裸鼠肿瘤组织中PCNA、MMP-2、MMP-9、SIRT1、SOX2蛋白表达 Fig. 6 Western blot detection of PCNA, MMP-2, MMP-9, SIRT1, SOX2 protein expression in tumor tissue of nude mice |
|
西黄丸是一种传统的中草药配方,具有活血化瘀、清热解毒、化痰散结、消肿止痛、抗癌等功效[12]。据报道,西黄丸可抑制三阴性乳腺癌进展[13]。研究结果与其是一致的,研究显示,西黄丸可抑制MDA-MB-231细胞增殖、迁移、侵袭及裸鼠移植瘤生长,且呈剂量依赖性。PCNA作为常见的评估细胞增殖能力的蛋白,其水平越高,表明细胞增殖能力越强[14];MMPs属于锌依赖性内肽酶家族,可以共同降解几乎所有的细胞外基质成分,在迄今为止鉴定的所有MMP蛋白中,MMP-2和MMP-9被认为是参与肿瘤迁移和侵袭的最关键成员[15]。研究显示,西黄丸可抑制MDA-MB-231细胞及裸鼠肿瘤组织中PCNA、MMP-2、MMP-9表达,且呈剂量依赖性,再次从蛋白质水平上证实了西黄丸对MDA-MB-231细胞增殖、迁移、侵袭及裸鼠体内移植瘤生长的抑制作用,以上结果提示西黄丸可成为治疗乳腺癌的潜在有效药物。
SIRT1通过转录调节SOX2表达介导细胞自我更新[16]。据报道,抑制SIRT1/SOX2通路可抑制肝癌的发生[17];SIRT1在乳腺癌细胞中高表达,慢病毒sh-SIRT1载体可抑制乳腺癌细胞的增殖、迁移和侵袭[18]。以上研究表明SIRT1/SOX2通路具有促进肿瘤进展的作用。研究结果与其是一致的,研究显示,与对照组比较,SRT 1720组MDA-MB-231细胞及裸鼠肿瘤组织中SIRT1、SOX2蛋白表达升高,提示SIRT1/SOX2通路确实参与了MDA-MB-231细胞增殖、迁移、侵袭及裸鼠体内移植瘤生长过程。此外,西黄丸可呈剂量依赖性地抑制MDA-MB-231细胞及裸鼠肿瘤组织中SIRT1、SOX2蛋白表达,推测西黄丸可能通过抑制SIRT1/SOX2通路抑制MDA-MB-231细胞增殖、迁移及侵袭及裸鼠体内移植瘤生长。为了验证该推测,本研究在高剂量西黄丸作用的基础上再加上SIRT1激活剂SRT 1720干预MDA-MB-231细胞及移植瘤裸鼠,结果显示,SRT 1720减弱了高剂量西黄丸对MDA-MB-231细胞增殖、迁移、侵袭及裸鼠体内移植瘤生长的抑制作用,证实了猜想是正确的,即西黄丸可能通过抑制SIRT1/SOX2通路抑制MDA-MB-231细胞增殖、迁移、侵袭及裸鼠体内移植瘤生长。
综上所述,西黄丸可能通过抑制SIRT1/SOX2通路抑制MDA-MB-231细胞增殖、迁移、侵袭及体内移植瘤的生长。然而,研究尚存在不足之处,西黄丸对MDA-MB-231细胞增殖、迁移、侵袭及体内移植瘤生长的抑制作用可能还涉及其他通路,研究尚未涉及,这将是后续研究的重点内容之一。
| [1] |
GRABINSKI V F, BRAWLEY O W. Disparities in breast cancer[J]. Obstet Gynecol Clin North Am, 2022, 49(1): 149-165. DOI:10.1016/j.ogc.2021.11.010 |
| [2] |
QU J Y, LI J, ZHANG Y M, et al. AKR1B10 promotes breast cancer cell proliferation and migration via the PI3K/AKT/NF-κB signaling pathway[J]. Cell & Bioscience, 2021, 11(1): 163. |
| [3] |
LIU L L, YAN J D, CAO Y, et al. Proliferation, migration and invasion of triple negative breast cancer cells are suppressed by berbamine via the PI3K/Akt/MDM2/p53 and PI3K/Akt/mTOR signaling pathways[J]. Oncology Letters, 2021, 21(1): 70. |
| [4] |
千维娜, 李治, 李仁廷, 等. 西黄丸联合TP方案治疗中晚期乳腺癌效果分析[J]. 辽宁中医杂志, 2020, 47(6): 115-117. QIAN W N, LI Z, LI R T, et al. Effect of Xihuang Pill combined with TP regimen in treatment of advanced breast cancer[J]. Liaoning Journal of Traditional Chinese Medicine, 2020, 47(6): 115-117. |
| [5] |
杨雨婷, 曾瑾, 陈平, 等. 西黄丸抗肿瘤临床应用及药理作用机制研究进展[J]. 中国实验方剂学杂志, 2022, 28(3): 250-258. YANG Y T, ZENG J, CHEN P, et al. Anti-tumor application and pharmacological mechanism of Xihuang Pill: a review[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(3): 250-258. |
| [6] |
XU X C, ZHANG J M, ZHANG Z H, et al. Systems pharmacology in combination with proteomics reveals underlying mechanisms of Xihuang Pill against triple-negative breast cancer[J]. Bioengineered, 2020, 11(1): 1170-1188. DOI:10.1080/21655979.2020.1834726 |
| [7] |
JIA Y J, ZHAO J, YANG J J, et al. MiR-301 regulates the SIRT1/SOX2 pathway via CPEB1 in the breast cancer progression[J]. Molecular Therapy Oncolytics, 2021, 22: 13-26. DOI:10.1016/j.omto.2021.03.007 |
| [8] |
杨忖卿, 郑利华, 程序, 等. 西黄丸抑制乳腺癌MDA-MB-231细胞迁移的分子机制研究[J]. 中国医药, 2021, 16(2): 254-258. YANG C Q, ZHENG L H, CHENG X, et al. Molecular mechanism of Xihuang Pill inhibiting migration of breast cancer MDA-MB-231 cells[J]. China Medicine, 2021, 16(2): 254-258. |
| [9] |
宁海萍. SIRT1激动剂SRT1720对THP-1细胞增殖、凋亡及细胞周期的影响[D]. 南宁: 广西医科大学, 2016. NING H P. Effects of SIRT1 agonist SRT1720 on THP-1 cell proliferation, apoptosis and cell cycle[D]. Nanning: Guangxi Medical University, 2016. |
| [10] |
张晓笛, 何丽娟, 陈会丛, 等. 西黄丸对乳腺癌荷瘤小鼠肿瘤组织凋亡及相关因子表达的影响[J]. 中医药导报, 2021, 27(6): 1-4, 9. ZHANG X D, HE L J, CHEN H C, et al. Effect of Xihuang Pills on tumor tissue apoptosis and relate factors expression in mice with breast cancer[J]. Guiding Journal of Traditional Chinese Medicine and Pharmacy, 2021, 27(6): 1-4, 9. |
| [11] |
郝苗苗. SRT1720在骨癌痛中的作用及病理机制研究[D]. 咸宁: 湖北科技学院, 2020. HAO M M. Research on the role and pathological mechanism of SRT1720 in bone cancer pain[D]. Xianning: Hubei University of Science and Technology, 2020. |
| [12] |
LI D H, FAN H F, DONG J F, et al. Based on BATMAN-TCM to explore the molecular mechanism of Xihuang Pill regulating immune function to treat breast precancerous lesions[J]. Breast Cancer (Dove Medical Press), 2021, 13: 725-742. |
| [13] |
郭秋均, 孙其伟. 基于网络药理学探讨西黄丸抑制三阴性乳腺癌关键靶点及免疫学机制[J]. 中国中医基础医学杂志, 2021, 27(12): 1949-1953. GUO Q J, SUN Q W. Key targets and immunological molecular mechanisms of Xihuang Pill on inhibiting triple negative breast cancer based on network pharmacology[J]. Journal of Basic Chinese Medicine, 2021, 27(12): 1949-1953. |
| [14] |
LI Y, LYU M M, WANG J H, et al. LINC00641 inhibits the proliferation and invasion of ovarian cancer cells by targeting miR320a[J]. Translational Cancer Research, 2021, 10(11): 4894-4904. |
| [15] |
GU Y, YU J J, DING C, et al. Flavonoid GL-V9 suppresses invasion and migration of human colorectal cancer cells by inhibiting PI3K/Akt and MMP-2/9 signaling[J]. Journal of Cancer, 2021, 12(15): 4542-4551. |
| [16] |
CHOI Y, YOON D S, LEE K M, et al. Enhancement of mesenchymal stem cell-driven bone regeneration by resveratrol-mediated SOX2 regulation[J]. Aging and Disease, 2019, 10(4): 818-833. |
| [17] |
XIE Z Q, LI H X, HOU X J, et al. Capsaicin suppresses hepatocarcinogenesis by inhibiting the stemness of hepatic progenitor cells via SIRT1/SOX2 signaling pathway[J]. Cancer Medicine, 2022, 11(22): 4283-4296. |
| [18] |
李新, 田蜜, 王程. 慢病毒sh-SIRT1载体对乳腺癌细胞增殖、迁移和侵袭的影响[J]. 医学信息, 2021, 34(6): 1-5. LI X, TIAN M, WANG C. Effects of lentiviral sh-SIRT1 vector on the proliferation, migration and invasion of breast cancer cells[J]. Journal of Medical Information, 2021, 34(6): 1-5. |
 2023, Vol. 40
2023, Vol. 40