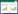文章信息
- 黄文龙, 袁泽, 彭卫卫, 等.
- HUANG Wenlong, YUAN Ze, PENG Weiwei, et al.
- 木香内酯诱导人脑星形胶质母细胞瘤细胞凋亡
- Effect of micheliolide on apoptosis of human astrocytoma cells
- 天津中医药, 2023, 40(6): 782-789
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(6): 782-789
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.06.17
-
文章历史
- 收稿日期: 2023-03-20
2. 赣州市人民医院,赣州 341000;
3. 北大医疗鲁中医院检验科,淄博 255499;
4. 西南医科大学,泸州 646099;
5. 淄博市中心医院病理科,淄博 255036
胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤。具有恶性程度高、侵袭性强、预后差等特性[1]。胶质瘤的治疗存在跨越血脑屏障的难题而面临有效治疗药物不足,常用化疗药物替莫唑胺(TMZ)、丙卡巴肼(PCBZ)能抑制胶质瘤细胞增殖,但存在明显的毒副作用和长期使用带来的耐药性难题[2]。接受放化疗后间变性星形细胞瘤和胶质母细胞瘤患者的5年生存率分别为27%和5%[3],而平均生存时间仅为14~16个月[4]。因此,寻找更加经济有效,且毒副作用较小的胶质瘤治疗药物尤为重要。
木香是一味传统的理气药,中医理论认为:木香具有行气止痛,健脾消食的功效[5]。随着对木香药用价值探索中,发现木香及其化合提取物有着抗肿瘤、抗菌、抗炎等多种功效[5-6]。近来研究表明,天然药物单体因其成分单一、药效明确,在满足抗癌药效条件下具备不良反应少的优点[7]。木香内酯(MCL)主要来源于含笑属植物木香中提取的倍半萜内酯类小分子化合物,化学式为C15H20O3,结构式如图 1,是木香发挥药效作用的主要活性成分[8]。木香内酯及其衍生物具有广泛的抗癌活性,如结肠癌[9]、胃癌[10]、肝癌[11]、肺癌[12-16]、白血病[17]、胆囊癌[18]、骨肉瘤[19]、胶质瘤[20]、乳腺癌[21]。尤其在胶质瘤的研究中,具有较强抑癌效果且低不良反应的优点[22]。木香内酯对胶质瘤具有明显的增殖抑制作用,但其作用机制仍模糊不清。因此,研究旨在考察木香内酯对神经胶质瘤细胞U87的促凋亡效果,并探究其凋亡发生机制。
|
| 图 1 木香内酯结构 Fig. 1 Structure of MCL |
木香内酯(北京倍特仁康生物医药科技有限公司:211221189);胶质瘤U87细胞;DMEM培养基(美国Gibco公司:8122125)、胎牛血清(美国Gibco公司:42G6287K);活性氧检测试剂盒(碧云天有限公司)丙二醛(MDA)含量检测试剂盒(索莱宝科技有限公司)、总SOD活性检测试剂盒(碧云天生物技术公司)、微量还原型谷胱甘肽(GSH)测定试剂盒(南京建成生物工程研究所)、一氧化氮(NO)含量检测试剂盒(索莱宝科技有限公司)、胰蛋白酶(百凯美、批号:GA22020023841)、CCK8(百凯美:8915CK);Annexin V FITC细胞凋亡检测试剂盒、JC-1线粒体膜电位检测试剂盒(碧云天有限公司)、qPCR试剂盒(全试金:#P41013)、逆转录试剂盒(全试金:#O11101);酶标仪(美国BioTek公司);恒温CO2培养箱(美国Thermo Scientific公司);超净工作台(苏净集团空气技术公司);倒置荧光显微镜(日本OLYMPUS公司);Tanon垂直电泳系统(上海天能科技有限公司);流式细胞仪(德国Miltenyi公司)。
2 方法 2.1 细胞培养及分组U87细胞,由赣州市人民医院中心实验室惠赠,使用含10%FBS的DMEM培养基在37 ℃、5%CO2恒温培养箱中培养。24 h更换培养基,2~3 d传代1次,取对数生长期细胞进行实验。实验分为4组,不含木香内酯的对照组,和木香内酯5、10、20 μmol/L给药组。
2.2 CCK-8法检测细胞活力取对数生长期U87细胞消化重悬,按8 000个/孔接种到96孔板中,自然生长24 h后弃掉原培养液,给予含不同浓度木香内酯的无血清培养基。继续培养24 h后以每孔10 μL加入CCK8试剂,1 h后使用酶标仪于490 nm处检测其吸光度。细胞活力的抑制率计算公式:抑制率(%)=(A对照-A处理)/(A对照-A空白)×100%。
2.3 Annexin V-FITC细胞凋亡检测实验取对数生长期的细胞,以0.25%胰酶-EDTA消化,以2.5万细胞/孔接种于24孔板中,待其自然生长24 h后弃掉原培养液,给予含不同浓度(0、5、10、20 μmol/L)木香内酯的无血清培养基,作用24 h。根据碧云天生物技术公司Annexin V-FITC细胞凋亡检测试剂盒说明书进行流式细胞术检测细胞凋亡率。
2.4 细胞线粒体膜电位检测取对数生长期的细胞,以0.25%胰酶-EDTA消化,以2.5万细胞/孔接种于24孔板中,待其自然生长24 h后弃掉原培养液,给予含不同浓度(0、5、10、20 μmol/L)木香内酯的无血清培养基,作用24 h。根据碧云天生物技术公司线粒体膜电位检测试剂盒(JC-1)试剂盒说明书进行流式细胞术检测线粒体膜电位。
2.5 激光共聚焦显微镜检测U87细胞中ROS的积累情况取对数生长期U87细胞消化重悬,以细胞8 000细胞/孔接种于激光共聚焦培养皿,加入含不同浓度(0、5、10、20 μmol/L)木香内酯的无血清培养基处理12 h。使用PBS清洗,加入终浓度为10 mmol/L的DCFH-DA和20 mmol/L的Hoechst混合液染色20 min,在激光共聚焦显微镜捕捉U87细胞内ROS水平。
2.6 检测U87细胞中MDA含量、SOD活性、GSH、NO含量取对数生长期U87细胞消化重悬,以细胞8 000个/孔接种到96孔板中,自然生长24 h后弃掉原培养液,加入含不同浓度(0、5、10、20 μmol/L)木香内酯的无血清培养基处理12 h,根据试剂盒说明书检测细胞内MDA含量、SOD活性、GSH含量、NO含量。
2.7 实时荧光定量聚合酶链式反应(RT-qPCR)取对数生长期的细胞,以0.25%胰酶-EDTA消化,以10万细胞/孔接种于6孔板中,待其自然生长24 h后弃掉原培养液,给予含不同浓度(0、10、20 μmol/L)木香内酯的无血清培养基,作用24 h。用细胞刮刀收集细胞,4 ℃条件下,离心半径10 cm,1 000 r/min,离心3 min。弃掉上清液,加PBS洗涤两遍后,向细胞沉淀中加入TRIzoLT裂解细胞。之后按比例和顺序加入氯仿、异丙醇、乙醇提纯RNA。并使用分光光度计检测RNA的质量。按照试剂盒说明书将RNA逆转为cDNA,实验条件:25 ℃ 10 min,42 ℃ 15 min,85 ℃ 5 s,反应后得到的cDNA作为模板,用实时荧光定量PCR试剂盒进行扩增,检测凋亡相关基因的mRNA表达水平。反应条件:94 ℃预变性30 s,之后94 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,共40个循环。表 1为引物序列,计算出2-ΔΔCt显示mRNA的表达量。
从PubChem在线数据库(http://pubchem.ncbi.nlm.nih.gov)下载木香内酯的mol2格式文件(PubChem CID:442279)。Uniprot蛋白质数据库中下载Bax(Q07812)、Bcl-2(P10415)、Caspase-3(P42574)晶体结构。然后将木香内酯和以上蛋白导入Maestro 11.1软件ligprep模块。在默认参数下对蛋白质进行修饰、脱水和氢化,然后对筛选出的潜在核心成分配体进行能量最小化处理,赋予配体原子类型、计算电荷。最后经过Autodock-vina 1.1.2软件进行分子对接,在PyMOL下对对接结果可视化并绘制“蛋白-分子”对接相互作用模式图。
2.9 统计学方法数据采用SPSS 26.0统计软件处理,数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较若符合方差齐性的采用LSD检验;若不符合方差齐性,则采用Dunnett’s T3检验。假设检验水准按α=0.05判定。与对照组相比,P < 0.05表示差异有统计学意义。
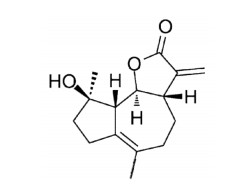
3 结果 3.1 木香内酯抑制U87细胞活力CCK8法测定不同浓度的木香内酯对U87细胞活力的影响如图 2所示,在给予不同浓度的木香内酯处理U87细胞24 h后,木香内酯对细胞活力的抑制作用随着浓度的升高而逐渐增强,细胞半抑制浓度IC50值为11.27 μmol/L,细胞增殖抑制作用明显。
|
| 图 2 木香内酯对U87细胞活力的影响 Fig. 2 Effect of MCL on U87 cell viability |
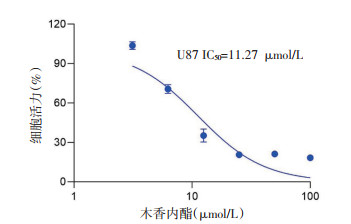
如图 3所示,与对照组相比,木香内酯5、10、20 μmol/L组处理U87细胞24 h后,早期凋亡和晚期凋亡细胞明显增多。凋亡率分别达到16.77%、17.40%、68.65%。其中木香内酯20 μmol/L组诱导U87细胞凋亡作用明显,差异具有统计学意义(P<0.001)。
|
| 注:A.细胞凋亡率典型流式结果图;B.细胞凋亡率的统计结果。数据以x±s表示,n=3。与对照组比较,*P<0.05,**P<0.01,***P<0.001。1.对照组;2.木香内酯5 μmol/L组;3.木香内酯10 μmol/L组;4.木香内酯20 μmol/L组。 图 3 木香内酯对U87细胞凋亡的影响 Fig. 3 Effect of MCL on apoptosis of U87 cells |
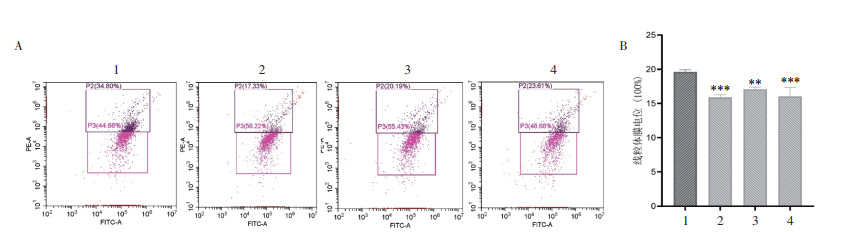
结果如图 4所示,与对照组相比,木香内酯5、10、20 μmol/L组红/绿相对荧光强度(线粒体膜电位)分别降低到15.90%、17.10%、16.04%,差异具有统计学意义(P<0.05)。
|
| 注:A.细胞线粒体膜电位结果图;B.细胞线粒体膜电位的统计结果。数据以x±s表示,n=3。与对照组比较,*P<0.05,**P<0.01,***P<0.001。1.对照组;2.木香内酯5 μmol/L组;3.木香内酯10 μmol/L组;4.木香内酯20 μmol/L组。 图 4 木香内酯对U87细胞线粒体膜电位的影响 Fig. 4 Effect of MCL on mitochondrial membrane potential in U87 cells |
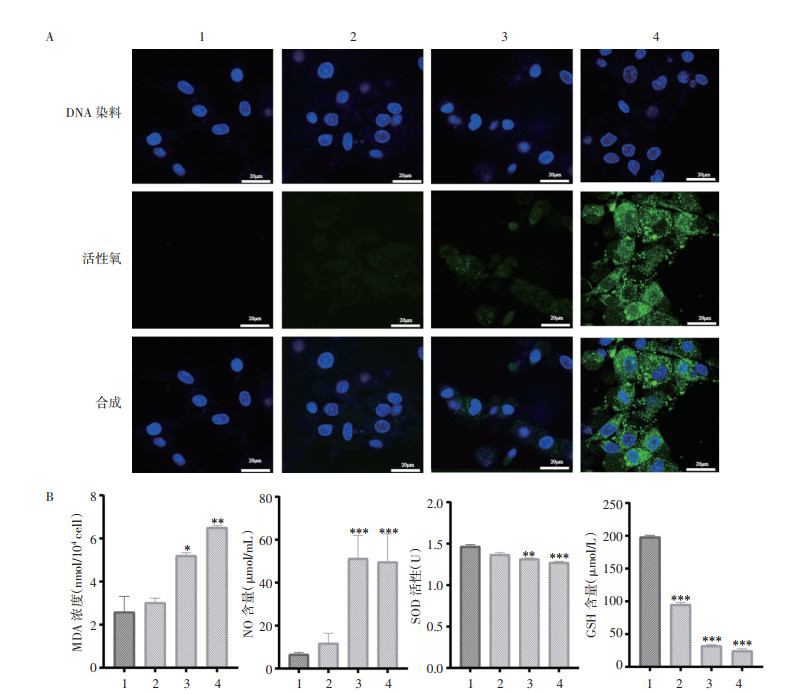
DCFH-DA探针法检测U87细胞内ROS水平结果如图 5A所示,与对照组相比,木香内酯5、10、20 μmol/L组随药物浓度的增大,细胞内ROS生成量呈剂量依赖性增加;在木香内酯20 μmol/L组给药时U87细胞中ROS含量积累最为明显。MDA含量、SOD活性、GSH、NO含量检测如图 5B所示:与对照组相比,木香内酯10、20 μmol/L组细胞内MDA、NO含量上调,差异具有统计学意义(P<0.05);细胞内SOD活性、GSH含量下调,差异具有统计学意义(P<0.01)。
|
| 注:A.细胞ROS水平结果图;B.细胞MDA含量、SOD活性、GSH、NO含量的统计结果。数据以x±s表示,n=3。与对照组比较,*P<0.05,**P<0.01,***P<0.001。1.对照组;2.木香内酯5 μmol/L组;3.木香内酯10 μmol/L组;4.木香内酯20 μmol/L组。 图 5 木香内酯对U87细胞氧化应激的影响 Fig. 5 Effects of MCL on oxidative stress in U87 cells |
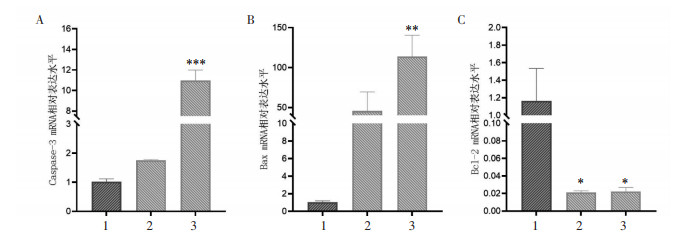
RT-qPCR结果如图 6所示,与对照组相比,木香内酯10、20 μmol/L组给药时Caspase-3、Bax mRNA表达水平均有上调趋势,其中木香内酯20 μmol/L组上调更为明显,差异具有统计学意义(P < 0.01)。与对照组相比,木香内酯10、20 μmol/L组给药时Bcl-2 mRNA表达水平均下调,差异具有统计学意义(P < 0.05)。
|
| 注:A. U87细胞中凋亡相关基因Caspase-3 mRNA的表达情况;B. U87细胞中凋亡相关基因Bax mRNA的表达情况;C. U87细胞中凋亡相关基因Bcl-2 mRNA的表达情况。数据以x±s表示,n=3。与对照组比较,*P<0.05,**P<0.01,***P<0.001。1.对照组;2.木香内酯10 μmol/L组;3.木香内酯20 μmol/L组。 图 6 木香内酯对U87细胞Caspase-3、BAX、Bcl-2基因表达的影响 Fig. 6 Effects of MCL on Caspase-3, BAX, and Bcl-2 gene expression in U87 cells |
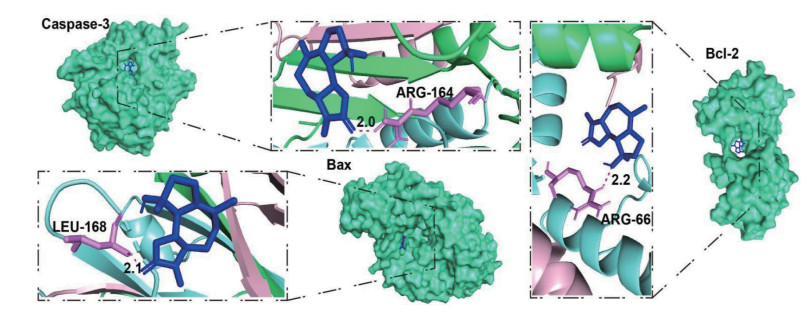
利用分子对接技术研究木香内酯与线粒体凋亡相关蛋白的结合潜力。如图 7所示,木香内酯与Caspase-3蛋白的氨基酸残基ARG-164形成氢键作用力(键长为2.0 Å),结合能-5.02 kcal/mol。与Bax蛋白的氨基酸残基LEU-168形成氢键作用力(键长为2.1 Å),结合能为-2.48 kcal/mol。与Bcl-2氨基酸残基ARG-66形成氢键作用力(键长为2.2 Å),结合能-4.36 kcal/mol。表明药物能稳定的结合Caspase-3、Bax、Bcl-2蛋白。
|
| 图 7 木香内酯与U87细胞Bax、Bcl-2、Caspase-3分子对接图 Fig. 7 Molecular docking diagram of MCL with U87 cells Bax, Bcl-2 and Caspase-3 |
胶质瘤是最常见的中枢神经系统肿瘤,常由化疗耐受、浸润生长、易复发造成患者高病死率[23]。胶质瘤的恶性程度高依赖于肿瘤细胞的无限制增殖和凋亡抑制,通过诱导胶质瘤细胞凋亡而遏制细胞的增殖可以有效控制胶质瘤的发展。以往研究表明,木香内酯的衍生物对神经胶质瘤具有抗肿瘤活性,能有效抑制胶质瘤细胞的增殖并促进凋亡,具有靶向治疗胶质瘤细胞的潜力[22]。研究表明:木香内酯对U87细胞的增殖具有明显抑制作用,并促进U87细胞凋亡。
细胞凋亡是机体维持内环境稳定,由基因控制的细胞自主有序的死亡,在此过程中,线粒体形态完整和生化功能发生变化,线粒体膜通透性增加而膜电位下降。线粒体膜电位降低是细胞早期凋亡的一个标志性事件,能导致细胞通透性改变,细胞色素C从线粒体释放到细胞质中,进而引发细胞凋亡的酶级联效应[24]。研究中,随着木香内酯给药浓度增高,早期凋亡和晚期凋亡细胞率显著增多,线粒体膜电位水平明显降低。因此木香内酯能降低线粒体膜电位促进U87细胞凋亡的发生。
研究表明,细胞内高氧化应激水平能介导细胞线粒体途径凋亡。细胞内产生大量的ROS,导致线粒体膜损伤而发生线粒体去极化。Bax/Bcl2升高和细胞色素C的释放,并介导Caspase-3家族的激活而剪切DNA修复酶(PARP)。使得核小体间的DNA降低,引起细胞凋亡[25]。细胞内氧化应激水平调节着细胞凋亡的发生,氧化物MDA和NO在线粒体释放、通过促氧化作用导致细胞膜破坏使得蛋白质、核酸等受损及生物膜性质改变,细胞发生衰老或凋亡[26-28]。与此同时,SOD和GSH为主要抗氧化剂,它们可以清除超氧化物阴离子和过氧化氢,被认为是一种全身细胞保护性因子,具有抗凋亡、清除氧自由基、抗炎、促进组织修复、减轻细胞损伤等作用。细胞的氧化应激失衡是介导线粒体途径引起的细胞凋亡的主要调控机制[29-30]。研究表明:木香内酯能显著提高U87细胞ROS、MDA、NO水平,降低U87细胞GSH、SOD水平,且呈浓度依赖性;因此木香内酯诱导U87细胞凋亡的发生,可能与细胞内存在的高氧化应激水平引起线粒体途径凋亡相关。
凋亡基因的表达直接调控细胞凋亡的发生,抗凋亡基因代表成员Bcl-2能对抗细胞凋亡的发生,Bcl-2可通过线粒体途径、内质网途径抗细胞凋亡[31-32]。Bcl-2、Bax蛋白位于线粒体上游,是线粒体膜的通透性改变的重要调控因素,其过度表达能控制Cyt-c的释放和下游Caspase-3蛋白酶的活化,介导细胞程序性死亡[33]。本研究表明:木香内酯可显著上调U87细胞中Caspase-3、Bax基因mRNA的表达、下调Bcl-2 mRNA的表达,从而促进细胞凋亡。为了进一步了解药物与蛋白互作关系,笔者应用分子对接寻得木香内酯与Caspase-3、Bax、Bcl-2蛋白的具体结合位点。结果显示,木香内酯与Caspase-3、Bax、Bcl-2蛋白形成稳定的氢键结合能,表明药物能稳定的结合蛋白。
综上所述,木香内酯能明显抑制U87细胞生长和介导细胞高氧化应激水平,降低线粒体膜电位并促进细胞凋亡。
| [1] |
薛林萌, 赵博贤, 陈鑫, 等. 传统中药萃取物抗神经胶质瘤作用的研究进展[J]. 医学综述, 2018, 24(8): 1621-1626. XUE L M, ZHAO B X, CHEN X, et al. Research advances in anti-glioma role of traditional Chinese herbal medicine extracts[J]. Medical Recapitulate, 2018, 24(8): 1621-1626. |
| [2] |
陈志刚, 卢亦成, 丁学华, 等. 恶性胶质瘤化疗新进展[J]. 中华神经外科杂志, 2003, 19(1): 70-72. CHEN Z G, LU Y C, DING X H, et al. New progress of chemotherapy for malignant glioma[J]. Chinese Journal of Neurosurgery, 2003, 19(1): 70-72. |
| [3] |
李振水, 郝春满, 许英霞, 等. 生酮饮食干预在恶性胶质瘤中的应用专家共识[J]. 肿瘤代谢与营养电子杂志, 2021, 8(3): 251-256. LI Z S, HAO C M, XU Y X, et al. Expert consensus on ketogenic diet intervention for patients with malignant glioma[J]. Electronic Journal of Metabolism and Nutrition of Cancer, 2021, 8(3): 251-256. |
| [4] |
SILGINER M, WELLER M, STUPP R, et al. Biological activity of tumor-treating fields in preclinical glioma models[J]. Cell Death & Disease, 2017, 8(4): e2753. |
| [5] |
郑加梅, 尚明越, 王嘉乐, 等. 木香的化学成分、药理作用、临床应用研究进展及质量标志物预测[J]. 中草药, 2022, 53(13): 4198-4213. ZHENG J M, SHANG M Y, WANG J L, et al. Research progress on chemical constituents, pharmacological effects and clinical applications of Aucklandiae Radix and prediction analysis on Q-Marker[J]. Chinese Traditional and Herbal Drugs, 2022, 53(13): 4198-4213. |
| [6] |
唐飞, 刘美辰, 敖慧. 木香与川木香挥发油化学成分及抗菌活性的对比研究[J]. 中华中医药学刊, 2020, 38(6): 165-168, 273. TANG F, LIU M C, AO H. Comparative study on chemical composition and antibacterial activity of essential oil from aucklandiaeRadix and vladimiriae Radix[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(6): 165-168, 273. |
| [7] |
WANG Y Q, CHEN M T, YU H, et al. The role and mechanisms of action of natural compounds in the prevention and treatment of cancer and cancer metastasis[J]. Frontiers in Bioscience, 2022, 27(6): 192. DOI:10.31083/j.fbl2706192 |
| [8] |
BOMMAGANI S, PENTHALA N R, JANGANATI V, et al. 13-(N, N-di-methyl-amino)-micheliolide 0.08-hydrate[J]. Acta Crystallographica Section E, Structure Reports Online, 2013, 69(12): 1789-1790. DOI:10.1107/S1600536813030304 |
| [9] |
吴仁瑞, 刘华峰, 汪琛, 等. 木香内酯对结肠癌细胞增殖和凋亡的影响[J]. 中国现代应用药学, 2021, 38(13): 1559-1565. WU R R, LIU H F, WANG C, et al. Effect of micheliolide on proliferation and apoptosis of colon cancer cells[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(13): 1559-1565. |
| [10] |
邵玉普, 刘斌, 李伟明, 等. 去氢木香内酯诱导胃癌细胞自噬和凋亡及氧化应激[J]. 中国比较医学杂志, 2021, 31(12): 27-34. SHAO Y P, LIU B, LI W M, et al. Dehydrocostus lactone induces autophagy, apoptosis, and oxidative stress in gastric cancer cells[J]. Chinese Journal of Comparative Medicine, 2021, 31(12): 27-34. |
| [11] |
苗加伟, 陈洁, 邓雪松, 等. 去氢木香内酯抑制人肝癌细胞系HepG2增殖及促凋亡[J]. 基础医学与临床, 2020, 40(10): 1369-1373. MIAO J W, CHEN J, DENG X S, et al. Dehydrocostunolide inhibits proliferation and promotes apoptosis of human hepatocellular carcinoma cell line HepG2[J]. Basic and Clinical Medicine, 2020, 40(10): 1369-1373. |
| [12] |
田颖颖, 李依林, 田时秋, 等. 去氢木香内酯激活凋亡与自噬抑制人肺癌A549细胞生长[J]. 中国实验方剂学杂志, 2023, 29(2): 73-80. TIAN Y Y, LI Y L, TIAN S Q, et al. Dehydrocostunolide activates apoptosis and autophagy inhibits the growth of human lung cancer A549 cells[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(2): 73-80. |
| [13] |
吴蒙, 姚开泰. 木香内酯抑制肺癌细胞H460生长的机制研究[J]. 医学研究生学报, 2017, 30(9): 932-936. WU M, YAO K T. The anti-tumor effect and underlying mechanism of micheliolide on H460 lung cancer by Notch4 signal pathway[J]. Journal of Medical Postgraduates, 2017, 30(9): 932-936. |
| [14] |
罗雪, 彭建明, 江秀玲. 木香烃内酯对肺癌细胞A549的凋亡作用及其机制[J]. 现代医药卫生, 2018, 34(22): 3473-3475. LUO X, PENG J M, JIANG X L. Effect of costunolide on apoptosis of human lung cancer A549 cells and its mechanisms[J]. Journal of Modern Medicine & Health, 2018, 34(22): 3473-3475. |
| [15] |
王震. 木香烃内酯诱导人类非小细胞肺癌A549细胞凋亡的信号转导通路研究[D]. 杭州: 浙江大学, 2015. WANG Z. Study on signal transduction pathway of costunolide-induced apoptosis of human non-small cell lung cancer A549 cells[D]. Hangzhou: Zhejiang University, 2015. |
| [16] |
刘韵, 黄文菁, 吴孟华, 等. 去氢木香内酯调控肺癌干细胞干性分子的研究[J]. 中药材, 2018, 41(6): 1471-1474. LIU Y, HUANG W J, WU M H, et al. Study on dehydrocostunolide regulating dry molecules of lung cancer stem cells[J]. Journal of Chinese Medicinal Materials, 2018, 41(6): 1471-1474. |
| [17] |
蔡虹, 杨春辉. 去氢木香内酯对慢性粒细胞白血病K562细胞增殖的影响及其机制[J]. 白血病·淋巴瘤, 2019, 28(3): 145-149. CAI H, YANG C H. Effect of dehydrocostus lactone on the proliferation of chronic myeloid leukemia K562 cells and its mechanism[J]. Journal of Leukemia and Lymphoma, 2019, 28(3): 145-149. |
| [18] |
张晓宇, 翟天宇, 黑振宇, 等. 木香烃内酯对胆囊癌的抗肿瘤活性及其机制[J]. 中华肝脏外科手术学电子杂志, 2020, 9(4): 389-394. ZHANG X Y, ZHAI T Y, HEI Z Y, et al. Anti-tumor activity of costunolide on gallbladder cancer and its mechanism[J]. Chinese Journal of Hepatic Surgery (Electronic Edition), 2020, 9(4): 389-394. |
| [19] |
刘景新, 陈余兴, 王贵. 木香烃内酯通过内质网应激和自噬诱导骨肉瘤细胞凋亡[J]. 中国免疫学杂志, 2022, 38(15): 1803-1807, 1812. LIU J X, CHEN Y X, WANG G. Costunolide induces apoptosis of osteosarcoma cells through endoplasmic reticulum stress and autophagy[J]. Chinese Journal of Immunology, 2022, 38(15): 1803-1807, 1812. |
| [20] |
王金奎. 木香烯内酯和去氢木香内酯抑制胶质瘤相关作用机制的研究[D]. 大连: 大连医科大学, 2017. WANG J K. Study on the mechanism of costunolide and dehydrocostunolide in inhibiting glioma[D]. Dalian: Dalian Medical University, 2017. |
| [21] |
孟文静, 谢晓娟, 周立艳, 等. 含笑内酯对三阴性乳腺癌细胞顺铂化疗敏感性的影响及机制探讨[J]. 山东医药, 2016, 56(42): 14-16. MENG W J, XIE X J, ZHOU L Y, et al. Effect of Micheliolide on chemosensitivity of triple negative breast cancer cells to cisplatin[J]. Shandong Medical Journal, 2016, 56(42): 14-16. |
| [22] |
王成德, 许允求, 苏志鹏. 木香内酯DSPE-PEG纳米胶束的制备、表征及对胶质瘤细胞凋亡的诱导作用[J]. 温州医科大学学报, 2022, 52(8): 613-619. WANG C D, XU Y Q, SU Z P. Preparation, characterization of micheliolide DSPE-PEG nanomicelles and its induction of apoptosis in glioma cells[J]. Journal of Wenzhou Medical University, 2022, 52(8): 613-619. |
| [23] |
苏凯, 杨彦楠, 杨欣刚. 异丙酚对胶质瘤U87细胞增殖、侵袭、迁移及JAK2/STAT3通路的影响[J]. 武警医学, 2021, 32(3): 197-200, 204. SU K, YANG Y N, YANG X G. Effects of propofol on proliferation, invasion, migration and JAK2/STAT3 pathway of glioma U87 cells[J]. Medical Journal of the Chinese People's Armed Police Force, 2021, 32(3): 197-200, 204. |
| [24] |
ZAIB S, HAYYAT A, A LI, et al. Role of mitochondrial membrane potential and lactate dehydrogenase A in apoptosis[J]. Anti-Cancer Agents in Medicinal Chemistry, 2022, 22(11): 2048-2062. |
| [25] |
SINHA K, DAS J, PAL P B, et al. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Archives of Toxicology, 2013, 87(7): 1157-1180. |
| [26] |
赵明洪, 卢天明, 刘莉, 等. 甘草减轻雷公藤多苷片所致肝损伤的作用机制[J]. 中国实验方剂学杂志, 2023, 29(5): 24-31. ZHAO M H, LU T M, LIU L, et al. Mechanism of glycyrrhizae Radix et rhizoma alleviating Tripterygium wilfordii polyglycoside tablets-induced liver injury[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2023, 29(5): 24-31. |
| [27] |
陈明惠, 严苗艺, 陈颖, 等. 葛根异黄酮抗缺血性脑卒中作用机制的研究[J]. 中国临床药理学杂志, 2022, 38(21): 2591-2595. CHEN M H, YAN M Y, CHEN Y, et al. Study on the mechanism of pueraria isoflavones against ischemic stroke[J]. The Chinese Journal of Clinical Pharmacology, 2022, 38(21): 2591-2595. |
| [28] |
SOMASUNDARAM V, BASUDHAR D, BHARADWAJ G, et al. Molecular mechanisms of nitric oxide in cancer progression, signal transduction, and metabolism[J]. Antioxidants & Redox Signaling, 2019, 30(8): 1124-1143. |
| [29] |
姜琴, 张文凯. 脂多糖致急性肺损伤机制研究进展及还原型谷胱甘肽保护作用[J]. 中华临床医师杂志(电子版), 2017, 11(4): 645-649. JIANG Q, ZHANG W K. Advances on mechanism research of lipopolysaccharide-induced acute lung injury and protective effect of reduced glutathione[J]. Chinese Journal of Clinicians (Electronic Edition), 2017, 11(4): 645-649. |
| [30] |
SINGH P P, CHANDRA A, MAHDI F, et al. Reconvene and reconnect the antioxidant hypothesis in human health and disease[J]. Indian Journal of Clinical Biochemistry, 2010, 25(3): 225-243. |
| [31] |
OBENG E. Apoptosis (programmed cell death) and its signals: a review[J]. Revista Brasleira De Biologia, 2021, 81(4): 1133-1143. |
| [32] |
ASHKENAZI A, FAIRBROTHER W J, LEVERSON J D, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nature Reviews Drug Discovery, 2017, 16(4): 273-284. |
| [33] |
刘萌, 曾梦楠, 阚玉璇, 等. 鲜地黄中两个酰胺类化合物通过SIRT3/Bcl-2/Caspase-3信号通路减轻LPS诱导的NRK-52e细胞损伤[J]. 中药材, 2022, 45(5): 1212-1217. LIU M, ZENG M N, KAN Y X, et al. Study on two amides from fresh rehmanniae Radix in alleviating LPS-induced NRK-52e cell damage through SIRT3/bcl-2/caspase-3 signaling pathway[J]. Journal of Chinese Medicinal Materials, 2022, 45(5): 1212-1217. |
2. People's Hospital of Ganzhou City, Ganzhou 341000, China;
3. Clinical Laboratory of PKUCare Luzhong Hospital, Zibo 255499, China;
4. Southwest Medical University, Luzhou 646099, China;
5. Department of Pathology, Zibo Central Hospital, Zibo 255036, China
 2023, Vol. 40
2023, Vol. 40