文章信息
- 詹家国, 宋少飞, 杨颖溪, 等.
- ZHAN Jiaguo, SONG Shaofei, YANG Yingxi, et al.
- 心肌肥厚中医证型和中药作用机制的现代研究进展
- Modern research progress on traditional Chinese medicine syndrome types and action mechanism of traditional Chinese medicine in myocardial hypertrophy
- 天津中医药, 2023, 40(6): 809-816
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(6): 809-816
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.06.20
-
文章历史
- 收稿日期: 2023-02-15
2. 天津中医药大学中医学院, 天津 301617;
3. 组分中药国家重点实验室, 天津 301617;
4. 现代中医药海河实验室, 天津 301617;
5. 重庆大学附属肿瘤医院, 重庆 400030
心脏肥大是由压力或容量超负荷引起的持续心室壁应力的代偿机制,心脏通过减少壁应力和减少氧气消耗从而适应这种应激[1]。心肌肥厚分为两种类型:生理性和病理性。生理性肥厚通常发生在妊娠、婴儿生长和运动活动期间[2],有利于长期维持心脏功能,且刺激缓解后,生理肥大被逆转,心脏恢复到原始大小。而病理性肥厚常导致心室扩张偏心肥厚,伴有收缩功能受损(适应不良重塑)[3],微血管稀疏和心肌纤维化等[4]。持续的病理性心脏肥大会促进慢性心力衰竭的发展,最终导致心律失常和猝死。
研究表明心脏的病理性肥厚主要由神经内分泌激素(如血管紧张素Ⅱ、内皮素1、儿茶酚胺等)和机械力引发的,治疗心肌肥厚常用血管紧张素转换酶抑制剂、β-肾上腺素能阻滞剂等,但是长期服用此类药物会导致严重的不良反应,如血压降低、疲劳、性功能障碍等[5]。
中医治疗疾病分为辨证和用药两个部分,而用药又是在辨证的基础上进行的,两者是一个整体。结合辨证论治,合理用药,可以更加准确的识别病因,提高药物的利用效率,减少药物带来的毒性作用。因此辨证论治对于中医药治疗心血管疾病来说十分重要。
中药通过多成分、多靶点延缓心肌肥厚进展,减轻症状,改善患者心功能。机制研究表明中药通过抗纤维化、抗炎、抗氧化、促血管新生、抑制肾素-血管紧张素-醛固酮系统等多通路治疗心肌肥厚。笔者对中医辨证心肌肥厚的证型及其对应的病理机制、中药治疗心肌肥厚的作用机制进行归纳,为中药防治心肌肥厚的临床应用以及药物研发提供依据。
1 心肌肥厚的病理机制心脏持续收缩需要高能量消耗来泵血为机体组织提供氧气和营养[6]。但高血压病、糖尿病、心肌梗死、慢性肾脏等疾病造成的收缩舒张压,体循环阻力改变等刺激下,心脏和单个心肌细胞会适应性的增大,其心肌细胞的厚度通常增加超过长度,造成心室壁增厚,心室壁应力降低。这些触发因素除了刺激心肌细胞各种非编码RNA的分泌和向心力衰竭过渡的相关信号通路的激活,还可促进非心肌细胞和免疫细胞分泌细胞因子,成纤维细胞生长因子(FGF)等,进一步诱发血管壁周围纤维化、炎症、自噬、活性氧的产生以及心肌功能障碍等。
研究报道极化相关蛋白/腺苷酸活化蛋白激酶/沉默信息调节因子1(LKB1/AMPK/Sirt1)通路的激活有利于抑制内质网应激,从而减轻血管紧张素Ⅱ(AngⅡ)诱导的心肌细胞肥厚[7],丝裂原活化蛋白激酶/细胞外调节蛋白激酶1/2(p38 MAPK/ERK1/2)和蛋白激酶B/核因子κB(AKT/NF-κB)信号通路的抑制能有效缓解去甲肾上腺素诱导的心肌肥厚和炎症反应[8]。另外,磷脂酰肌醇3-激酶/蛋白激酶B/丝氨酸/苏氨酸激酶(PI3K/Akt/mTOR)和丝裂原活化蛋白激酶/细胞外调节蛋白激酶1/2/丝氨酸/苏氨酸激酶(MAPK/ERK/mTOR)信号通路的激活可抑制过度自噬从而改善心肌肥厚[9-11]。抑制转化生长因子/转录激活因子2/3(TGF-β/Smad2/3)和Janus激酶2信号转导子/转录激活子3(JAK2/STAT3)通路可以使血管紧张素Ⅱ或横主动脉缩窄诱导的心肌肥厚和心脏间质纤维化受到显著抑制[12-14]。
2 中医对心肌肥厚辨证论治《灵枢·胀论》载:“心胀者,烦心短气,卧不安。”这是中医关于心肌肥厚现存最早的描述。中医内科临床诊疗指南将高血压左室肥厚根据临床症状命名为“心胀病”,即由各种原因导致的心失所养导致心体扩大的一系列病症。中医认为心肌肥厚其发病多于患者久食膏粱厚味,熬夜伤身,导致气机瘀滞,气滞则血瘀,水湿不化,则凝聚成痰,痰瘀痹阻血脉,心失所养,日久则肥大。若久病不愈,则既有正气亏虚,气阴两虚之不足,又有痰瘀互结,水饮内停之太过,病性以虚实夹杂为主。故治疗予以益气养阴或温阳以扶正,活血利水以治标,以达标本同治的目的。《中医临床诊疗指南——缺血性心肌病》指出心肌缺血病的临床表现主要为心脏肥大、心悸、心律不齐等,证候主要为气虚血瘀证、痰瘀互结证、气阴两虚血瘀证、阳虚水泛血瘀证,治疗应补其不足,泄其有余,分型论治[15]。
2.1 气虚血瘀型气虚血瘀证是指既有气虚之象,同时又兼有血瘀病证。久病气虚,影响血运,导致瘀血,气虚血瘀使心肌失去濡养,进而心肌肥大。《医林改错》云:元气亏虚,无力行血,则血行缓慢,停留而瘀。心失所养导致脏腑气机衰减,气虚推动无力,血行不畅而瘀滞。瘀血内阻,不通则痛故疼痛如刺,拒按不移;血行缓慢,瘀阻络脉,故可见面色晦滞,身倦乏力,少气懒言,皆为气虚之证;临床上气虚血瘀证,以心肝病变为多见,气虚舌淡,沉脉主里,涩脉主瘀,或舌有瘀斑均为气虚血瘀之象。
常见于心肌肥厚的早期,心肌细胞供血不足,能量代谢途径发生改变,能量主要来源于脂肪酸,葡萄糖等物质进行有氧氧化产生的三磷酸腺苷(ATP)。随着心脏压力超负荷的发生,氧气供应以及营养供应等条件的改变,心脏能量代谢途径相应发生变化,参与糖酵解,脂肪酸氧化的转录蛋白的表达和活性发生变化,例如过氧化物酶体增殖物激活的受体α(PPARα),PPARγ共激活因子-1(PGC1-α)和缺氧诱导因子1-α(HIF1-α)等[16]。这些变化协同作用,共同导致了后期能量代谢改变向器质性病变的转变。
心脏压力负荷所导致的肥厚,其病位在心,证属本虚标实。痰饮、瘀血互结于心为其标,心气亏虚为其本[17],应予以益气通脉、活血止痛、补益心气之品。通过补益心气、补益心血、补益心阴、补益心阳,达到推动血行,畅通血行,滑利血行,鼓动血行之功,以达到治病求本的目的。
2.2 痰瘀互结型痰瘀互结是指“痰浊”与“瘀血”相互搏结,相因为患,以局部肿块刺痛,或肢体麻木、痿废,或胸闷多痰,或痰中带紫暗血块,舌紫暗或有斑点、舌苔腻,脉弦涩等为常见证候。张伯礼院士认为:“痰可生瘀,瘀可生痰。”提出了“痰瘀互生”的病因病机理论,痰是瘀的初期阶段,瘀是痰的进一步发展,痰与瘀是冠心病发生、发展、恶化的基本继发因素,痰瘀互生是“病重之源”。在病理条件下,气血运行受阻气虚不足以推血,则血必有瘀,进而影响心脏的代谢功能,以及微循环障碍等。瘀的形成持续发生于心肌重构的全过程,而痰与瘀互相促进,同时发展,共同促使心肌不断肥大,造成恶性循环。
痰是人体水液代谢障碍形成的病理产物,也是一种继发性的致病因素。心肌重构时,细胞间质增多,胶原蛋白含量增加。细胞间质由纤维和基质构成,基质是略带胶黏性的液质。胶原蛋白存在于结缔组织如皮、软骨、筋中。提示痰和瘀的形成与心肌纤维化密切相关。心肌细胞在经历慢性压力或容量超负荷时将触发促纤维化途径,多种细胞类型(成纤维细胞、心肌细胞、血管内皮细胞)可以通过产生基质蛋白直接或间接分泌纤维化介质例如肿瘤坏死因子-α(TNF-α)、转化生长因子β(TGF-β)以及内皮素-1(ET-1)等促进纤维化,进而导致心肌收缩舒张功能障碍。
痰瘀互结是心肌肥厚的重要证候,是心肌肥厚发展到中后期的主要病理机制。中医药防治的研究重点主要为活血化痰,具体应用当注意阴阳虚实之别,阳虚气弱者气化无力,当与温阳化气之品合用,阳足气通则痰瘀自消;阴虚血枯者,阴血黏稠而痰阻内生,法当予护阴养血,滋生津液,百脉和则气血津液畅通无阻。
2.3 气阴两虚型气是构成人体的基本物质之一,气虚不运,温通失职,血脉不利,心脉痹阻,气虚又可导致阴虚,阴血不足,心肌失养,久病则发展为心肌肥厚。《金匮要略》有言:“夫脉当取太过不及,阳微阴弦即胸痹而痛,所以然者,责其虚也。” 《医方考》云:“气化则物生,气盛则物壮,气弱则物衰,气正则物和,气乱即物病,气绝则物死。”气阴两亏,则心气不足,鼓脉无力,心血瘀阻,胸闷气短,舌黯红,苔薄或红光无苔,脉细涩。气虚致气化机能障碍,使津液生成减少,既不能上潮以濡润口舌,又不能四布以营养周身,导致气血虚弱,心脉不充,失于荣养。
常见于心肌肥厚各个病理时期,血液运载着氧气等细胞生长发育及代谢所需的营养物质,血为气母,气虚则表明血液在经脉中运行不畅,心肌细胞供能不足,细胞代谢途径发生变化,能量产生减少和氧气供应的不足会进一步导致机体活性氧(ROS)的生成,高浓度的ROS可以使促肥大信号激酶和转录因子,如c-jun N末端蛋白激酶(JNK)、p38丝裂原活化蛋白激酶(MAPK)和核因子κB(NF-κB)等的激活导致心肌细胞死亡和纤维化,尽管细胞内固有的抗氧化系统可以防止过量ROS的形成,但是慢性压力超负荷的情况下,ROS的产生增加还可导致线粒体功能障碍,线粒体将经历融合、裂变和线粒体自噬。线粒体损伤过度的情况下,会导致Bal2相关X蛋白(Bax)、Bcl-2拮抗蛋白(Bak)、细胞色素C等蛋白的和成及表达增加,进一步诱发细胞凋亡[18]。
在心肌肥厚的各个证型中,气阴两虚型最为多见,且气能行血,气虚则血瘀,因此此证还多有血瘀之症。该证型的治疗当以益气滋阴,活血养心为基本疗法辅以活血化瘀之药物。促进人体的气血循环,纠正气滞血瘀,加速血液循环,使得津液得以散布,心脉充盈。
2.4 阳虚水泛型心气虚弱,累及心阳,心阳亏虚,累及肾阳,致命门火衰。肾阳虚亏,气不化津,津失敷布,水溢则肌肤水肿。心阳内损,加之久病入络化瘀,水瘀互结,终致体内阳虚水泛,血瘀水停。阳虚水泛症常表现常为腰膝酸软,耳鸣,身体水肿,或见心悸,气短,舌质淡胖,苔白滑,脉沉迟无力,小便短少,畏冷肢凉[19]。
常见于心肌肥厚导致的心力衰竭严重期,《血症论》指出“血积即久,其水乃成”,意为淤血日久不散,内积于心,则会引发水肿,因此心肌肥厚晚期患者多可见水肿等症状。靶向肾素-血管紧张素-醛固酮(RAA)系统是一种公认的临床治疗心肌肥厚的方法,研究表明血管紧张素Ⅱ可以激活p38激酶和JUN N末端激酶(JNKs)组成MAPK级联反应并激活GATA4介导的转录以促进病理性肥大[3]。临床常用利尿剂如托拉塞米,氢氯噻嗪等利尿降压药与β受体阻滞剂联用,降低心脏前后负荷,使细胞外液减少,并通过利钠作用使血压下降而心输出量不变。
《证治准绳·杂病·神志门》曰:“若心气不足,肾水凌之,逆上而停心者,必折其逆气,泻其水,补其阳。”提出治疗关键在于泻其水饮,补其心阳,更加符合西医对于心肌肥厚的诊断,并提出了“病痰饮者,当以温药和之”的治疗法则。中医药治疗阳虚水泛型心肌肥厚多选用利水渗湿、益气健脾、化气行水及活血化瘀的药物,可以通过多种途径来发挥其改善心肌肥厚及心功能的作用,达到标本同治之目的。
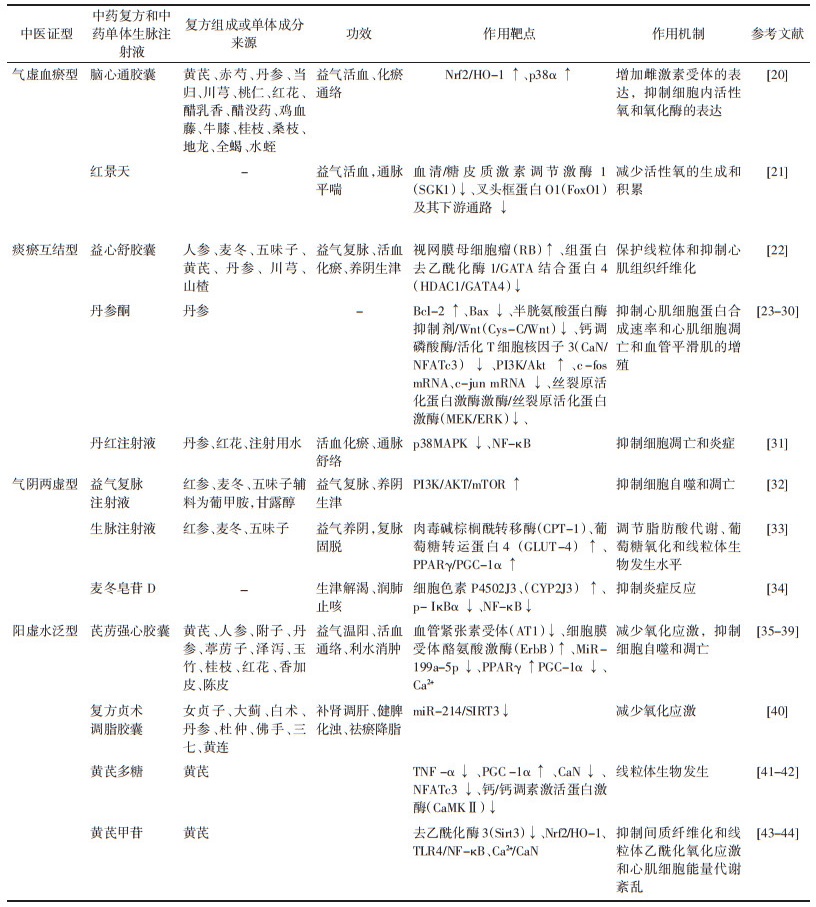
3 中药治疗心肌肥厚的作用机制中医药治疗心肌肥厚的药理机制已被大量研究所探索,现阶段研究的中药剂型多为注射剂、方剂、中成药、单位药及其提取物等。研究表明,中药可以通过多种途径发挥抑制心肌纤维化、抗炎、抗氧化、抗凋亡、促血管新生从而改善心肌肥厚的作用,且各种信号通路之间相互关联共同发挥药效。下面就中药治疗各型心肌肥厚的作用及机制予以归纳总结,见表 1。
|
人核因子E2相关因子2(NRF2)是机体抗氧化应激的重要转录因子,在正常情况下在胞质中被降解,不发挥生理作用。在心肌细胞损伤时被激活入核与抗氧化反应元件(ARE)结合形成Nrf2-ARE信号通路,并激活其下游超氧化物歧化酶(SOD)、血红素加氧酶1(HO-1)等发挥保护心肌损伤的作用。脑心通胶囊由黄芪、赤芍、丹参、当归、川芎、桃仁、鸡血藤、牛膝、桂枝、桑枝、地龙、全蝎、水蛭等组成,具有益气活血,化瘀通络的作用,临床常用于胸痹心痛、冠心病等。Cheng等[20]发现脑心通可以通过激活人核因子E2相关因子2/血红素加氧酶1(Nrf2/HO-1)信号通路,并通过雌激素受体抑制了p38α通路的磷酸化,有效地抑制AngⅡ诱导的心肌肥厚,心脏纤维化和过度氧化应激。
FOXOs是心肌细胞中重要的转录因子,胰岛素或其他细胞因子的分泌水平增加,诱导ROS的产生,进一步促进心肌细胞肥大。红景天为景天科大花红景天的干燥根和根茎,具有益气活血,通脉平喘之效,红景天提取物草质素作为天然的SGK1抑制剂,降低SGK1的磷酸化,并通过调节其下游的(FoxO1)信号通路,减少活性氧(ROS)的生成和积累,显著抑制体内和体外的心肌细胞肥大[21]。尽管体内的TAC实验和体外的细胞实验均证明了草质素对于心肌肥厚的药用价值,但草质素是否只对SGK1具有靶向抑制作用,以及草质素吸收入血后分布广泛,对除心脏以外的其他脏器的药理作用也尚不明确。
3.2 痰瘀互结型心肌肥厚的中药治疗益心舒胶囊由人参、麦冬、五味子、黄芪、丹参、川芎、山楂等组成,具有活血化瘀通窍止痛,扩张血管的作用。Zhang等[22]通过蛋白质组学分析和质谱图像分析确定了益心舒胶囊可以通过调节RB/HDAC1/GATA4信号通路,抑制血清中ANP,BNP的异常高表达,维持心肌细胞和心肌细胞线粒体正常形态,抑制心肌损伤。心肌肥厚的发生主要与体液刺激、细胞周期紊乱等有关,蛋白组学分析表明益心舒调控肥厚心脏中的组蛋白去乙酰化,对细胞周期具有重要意义。这说明益心舒胶囊同标准治疗药物(肾素血管紧张素受体抑制剂)联合给药会对心肌肥厚具有更好的改善作用,体现了中西医结合防治心血管疾病的重要性。
丹参是活血祛瘀的佳药,药用历史悠久,与心脑血管关系密切,研究发现,丹参中的主要活性成分丹参酮ⅡA可以通过上调Bcl-2/Bax比率和p53的表达以及抑制Cys-C/Wnt信号通路抑制自发性高血压引起的左室肥厚[23-24]。另有一些研究表明,丹参酮ⅡA的抗肥厚作用与其抑制原癌基因c-fos mRNA和c-jun mRNA的表达、MEK/ERK通路的抑制以及钙调磷酸酶/NFATc3通路有关[25-30]。丹参酮ⅡA对心肌肥厚的治疗作用充分体现了中药多靶点多途径治疗疾病的特点。
p38信号级联反应(p38MAPK)是心肌细胞中一条重要的信号通路,不单可以与其他信号通路相互调节,还可以作为重要的转录因子,参与心肌细胞的纤维化、氧化应激、炎症、细胞凋亡等多种过程,从而调节心血管功能。丹红注射液由丹参、红花、注射用水组成,具有活血化瘀,通脉舒络的功能。研究发现丹红注射液能通过抑制p38MAPK的活化和核因子κB(NF-κB)的核易位减轻异丙肾上腺素诱导的心肌肥厚[31]。
3.3 气阴两虚型心肌肥厚的中药治疗自噬除了在神经退行性疾病、代谢相关疾病中十分重要,也是心肌肥厚的重要机制。心肌肥厚时,心肌细胞长期处于压力超负荷状态,在缺氧和饥饿等情况下,p53/mTOR信号通路激活并促进其下游的膜型微管相关蛋白1的轻链3(LC3Ⅱ)和BECN1基因(Beclin-1)的表达,形成自噬小体,最终导致自噬性细胞死亡,加重心肌损伤。激活PI3K/AKT信号通路的激活可以使mTOR失活,从而抑制过度自噬。益气复脉注射剂对于各种心脏疾病具有保护作用,包括心脏肥大,研究表明益气复脉注射液可以通过激活PI3K/AKT/mTOR信号通路上调Bcl-2/Bax比率和降低天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)和p53在体外和体内的表达来抑制细胞凋亡以及通过下调LC3Ⅱ和Beclin-1表达和上调p62表达来调节自噬途径从而有效缓解主动脉弓缩窄和血管紧张素Ⅱ导致的心肌细胞肥大[32]。上述研究证实了益气复脉对心肌肥厚的作用及机制,也从侧面说明了mTOR信号通路在心肌肥厚的防治中的重要性,但其复方中的药效物质尚未明确,值得进一步研究。
生脉注射液是根据古方“生脉散”制成的中药注射剂,由红参、麦冬、五味子组成,主要功效为益气养阴,复脉固脱。Li等[33]通过体内和体外实验证明,生脉注射液可以通过激活AMPK信号通路上调CPT1、GLUT4和PPARγ/PGC-1α调节脂肪酸代谢、葡萄糖氧化和线粒体生物发生水平,来稳定线粒体膜电位,改善线粒体形态,进而改善心肌细胞肥大和凋亡。
麦冬皂苷D是中药复方参麦注射液的主要药理活性成分之一,已被证明具有多种药理活性。体内研究表明,麦冬皂苷D可以通过上调CYP2J3的表达,抑制磷酸化NF-κB抑制蛋白(p-IκBα)的表达来抑制NF-κB的表达,下调肥厚标志物ANP,BNP的异常高表达,改善血管紧张素Ⅱ导致的大鼠心肌肥厚和心肌纤维化[34]。麦冬皂苷D如何抑制炎症和肥大的整个分子机制尚未明确,值得进一步研究。同时,麦冬皂苷D作为参麦注射液治疗心肌肥厚的药效物质之一,可能对参麦注射液的进一步开发具有重要意义。
3.4 阳虚水泛型心肌肥厚的中药治疗芪苈强心胶囊由黄芪、人参、附子、丹参、葶苈子、泽泻、玉竹、桂枝、红花、香加皮、陈皮等中药组成具有益气温阳,活血通络,利水消肿的作用。临床常用于治疗冠心病、高血压病所致轻、中度充血性心力衰竭证属阳气虚乏,络瘀水停者。现代药理学研究表明,芪苈强心胶囊对于心肌肥厚的抑制作用主要与ErbB的激活、心脏L型Ca2+电流、PGC-1α、PPARγ、AT1、MiR-199a-5p表达的抑制等有关[35-39]。芪苈强心胶囊包含超过11种有成分,对心血管疾病的作用机制很复杂,而且机制研究尚不够深入、因此应该加强对药效物质和作用机制的探究。
复方贞术调脂胶囊为郭姣教授经10余年临床实践总结出的经验方,由女贞子、大蓟、白术、丹参、杜仲、佛手、三七、黄连组成,具有补肾调肝、健脾化浊、祛瘀降脂之功效。体内实验证明复方贞术调脂胶囊能抑制miR-214/SIRT3途径,抑制超氧化物歧化酶(SOD),HO-1,丙二醛(MDA)的异常高表达,改善压力超负荷所导致的氧化应激和脂质过氧化从而抑制心肌肥厚[40]。该研究表明MiR-214直接靶向SIRT3表达,且SIRT3线粒体功能障碍和能量代谢异常,这说明基于miR-214的干预可能是一种有前途的抗肥厚治疗新策略。由于复方贞术调脂胶囊成分的复杂性和多样性,其药效物质,以及药效物质如何调控miR-214等内容仍值得进一步探索。
黄芪是中药临床治疗缺血性心肌病的常用药物之一,具有补气固表,利尿排毒,扩张血管,改善微循环等功效。现代药理学研究表明,中药黄芪及主要成分如黄芪多糖可以通过调节TNF-α/PGC-1α信号介导的能量生物合成和Ca2+介导的钙调磷酸酶/NFATc3和CaMKII信号级联反应改善异丙肾上腺素导致的大鼠心肌肥厚[41-42]。黄芪甲苷可以通过Sirt3,Nrf2/HO-1信号通路,下调ROS水平,抑制氧化应激和心肌细胞能量代谢紊乱,改善心肌肥厚[43-44]。另有一些研究表明黄芪甲苷对心肌肥厚的抑制作用与Toll样受体4(TLR4)/NF-κB信号通路和Ca2+/CaN信号通路以及调节NF-κB/PGC-1α信号通路介导的能量合成有关。上述研究将能量代谢调控、炎症、氧化应激等疾病研究的热点应用于中药黄芪中药效物质预防和治疗心血管疾病的探索中,充分体现了中药在疾病治疗中多成分,多维度的作用优势。尽管黄芪中的多种物质均被证明具有抑制心肌肥厚、改善心功能的作用,但目前尚缺乏对黄芪中各种药效物质相互作用的研究。
4 总结与展望心肌肥厚过程中常伴随着心脏结构和功能的改变,可导致心力衰竭甚至猝死。近年来,相较于传统的西医治疗,中医药治疗心肌肥厚的优势逐渐显现。辨证论治是中医认识疾病和治疗疾病的基本原则,证能比症更全面、更深刻、更正确地揭示疾病的本质。
中西医对于心肌肥厚存在着不同的认识,其理论存在着极大的差异,但两者都认同心肌肥厚的治疗应活血化瘀,通脉舒络,从而改善其能量代谢或激素水平的调节,因此存在着某些联系。因此,从中医辨证论治的角度出发,认识并寻找心肌肥厚的治疗方法并结合西医的分子研究,以中药及其有效化合物为“桥梁”建立中西医之间的关联,为中医药治疗心肌肥厚提供西医佐证非常之重要。
研究表明,中医药治疗肥厚型心肌病具有抗纤维化、抗炎、抗氧化、改善心肌舒张功能和抗凋亡等作用,具有多成分,多途径,多靶点的改善患者心功能,延缓疾病进展的优势。益心舒胶囊、芪苈强心胶囊等中药复方临床常用于心肌肥厚的治疗,并能有效的提高冠状动脉血流量,抑制炎症反应,改善心室重构。中药成分黄芪、丹参、五味子等均对心肌肥厚的发展过程具有改善作用。目前虽然很多中药复方及单体应用于心血管疾病的预防和中医治疗中,但是中药复方成分复杂,药效物质难以明确,其研究很局限,缺乏对中药成分之间相互作用的研究,也缺乏对同一复方或同一药效物质对心肌肥厚不同作用方向的深入研究。因此,人们应努力研究探索,熟练应用液质联用技术及多组学分析或单细胞转录分析等技术,结合基础实验,明确中药复方和单体发挥抗心肌肥厚的作用机制和药效物质,充分体现中医药治疗的优势,为临床应用提供科学的依据,为心肌肥厚治疗和预防提供新的策略。
| [1] |
WU S Y, CHEN L L, ZHOU X. Circular RNAs in the regulation of cardiac hypertrophy[J]. Molecular Therapy Nucleic Acids, 2022, 27: 484-490. DOI:10.1016/j.omtn.2021.12.025 |
| [2] |
DORN G W 2nd. The fuzzy logic of physiological cardiac hypertrophy[J]. Hypertension, 2007, 49(5): 962-970. DOI:10.1161/HYPERTENSIONAHA.106.079426 |
| [3] |
NAKAMURA M, SADOSHIMA J. Mechanisms of physiological and pathological cardiac hypertrophy[J]. Nature Reviews Cardiology, 2018, 15(7): 387-407. DOI:10.1038/s41569-018-0007-y |
| [4] |
MOHAMMED S F, HUSSAIN S, MIRZOYEV S A, et al. Coronary microvascular rarefaction and myocardial fibrosis in heart failure with preserved ejection fraction[J]. Circulation, 2015, 131(6): 550-559. DOI:10.1161/CIRCULATIONAHA.114.009625 |
| [5] |
LIU X L, LOU X M, CHENG X L, et al. Impact of metoprolol treatment on mental status of chronic heart failure patients with neuropsychiatric disorders[J]. Drug Design, Development and Therapy, 2017, 11: 305-312. DOI:10.2147/DDDT.S124497 |
| [6] |
SHIMIZU I, MINAMINO T. Physiological and pathological cardiac hypertrophy[J]. Journal of Molecular and Cellular Cardiology, 2016, 97: 245-262. DOI:10.1016/j.yjmcc.2016.06.001 |
| [7] |
ZHU C S, WANG M, YU X G, et al. lncRNA NBR2 attenuates angiotensin Ⅱ-induced myocardial hypertrophy through repressing ER stress via activating LKB1/AMPK/Sirt1 pathway[J]. Bioengineered, 2022, 13(5): 13667-13679. DOI:10.1080/21655979.2022.2062527 |
| [8] |
KECHENG, TA NG. Phillyrin attenuates norepinephrine-induced cardiac hypertrophy and inflammatory response by suppressing p38/ERK1/2 MAPK and AKT/NF-kappaB pathways[J]. European Journal of Pharmacology, 2022, 927: 175022. DOI:10.1016/j.ejphar.2022.175022 |
| [9] |
CHEN-NIAN, X U. Melatonin ameliorates pressure overload-induced cardiac hypertrophy by attenuating Atg5-dependent autophagy and activating the Akt/mTOR pathway[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2020, 1866(10): 165848. |
| [10] |
ZHAO D, WANG W, WANG H, et al. PKD knockdown inhibits pressure overload-induced cardiac hypertrophy by promoting autophagy via AKT/mTOR pathway[J]. International Journal of Biological Sciences, 2017, 13(3): 276-285. DOI:10.7150/ijbs.17617 |
| [11] |
B A, LI NA. Allicin attenuates pathological cardiac hypertrophy by inhibiting autophagy via activation of PI3K/Akt/mTOR and MAPK/ERK/mTOR signaling pathways[J]. Phytomedicine, 2019, 58: 152765. DOI:10.1016/j.phymed.2018.11.025 |
| [12] |
CAO H, XIAO C G, HE Z X, et al. IgE and TGF-β signaling: from immune to cardiac remodeling[J]. Journal of Inflammation Research, 2021, 14: 5523-5526. DOI:10.2147/JIR.S332591 |
| [13] |
ZHANG X Y, ZHENG C T, GAO Z Q, et al. PKM2 promotes angiotensin-Ⅱ-induced cardiac remodelling by activating TGF-β/Smad2/3 and Jak2/Stat3 pathways through oxidative stress[J]. Journal of Cellular and Molecular Medicine, 2021, 25(22): 10711-10723. DOI:10.1111/jcmm.17007 |
| [14] |
MAGADUM A, SINGH N, KURIAN A A, et al. Therapeutic delivery of Pip4k2c-modified mRNA attenuates cardiac hypertrophy and fibrosis in the failing heart[J]. Advanced Science, 2021, 8(10): 2004661. DOI:10.1002/advs.202004661 |
| [15] |
中华中医药学会发布. 中医内科临床诊疗指南-第一册[M]. 北京: 中国中医药出版社, 2020. China Association of Chinese Medicine. Guide to clinical diagnosis and treatment of internal medicine of traditional Chinese medicine-Volume I[M]. Beijing: China Press of traditional Chinese medicine, 2020. |
| [16] |
THAM Y K, BERNARDO B C, OOI J Y Y, et al. Pathophysiology of cardiac hypertrophy and heart failure: signaling pathways and novel therapeutic targets[J]. Archives of Toxicology, 2015, 89(9): 1401-1438. DOI:10.1007/s00204-015-1477-x |
| [17] |
宋春花, 尹宝, 常欣峰, 等. 压力超负荷性心肌肥厚中医病机之管窥[J]. 江西中医药, 2019, 50(12): 76-78. SONG C H, YIN B, CHANG X F, et al. On the pathogenesis of pressure overload myocardial hypertrophy in traditional Chinese medicine[J]. Jiangxi Journal of Traditional Chinese Medicine, 2019, 50(12): 76-78. |
| [18] |
GUPTA S, DAS B, SEN S. Cardiac hypertrophy: mechanisms and therapeutic opportunities[J]. Antioxidants & Redox Signaling, 2007, 9(6): 623-652. |
| [19] |
徐健, 敖杰男. 浅谈痰淤互结证与胸痹的关系[J]. 时珍国医国药, 2008, 19(5): 1229-1230. XU J, AO J N. Discussion on the relationship between phlegm and blood stasis syndrome and chest obstruction[J]. Lishizhen Medicine and Materia Medica Research, 2008, 19(5): 1229-1230. |
| [20] |
CHENG L, MABOH R N, WANG H, et al. Naoxintong capsule activates the Nrf2/HO-1 signaling pathway and suppresses the p38α signaling pathway via estrogen receptors to ameliorate heart remodeling in female mice with postmenopausal hypertension[J]. Journal of Cardiovascular Pharmacology, 2022, 80(1): 158-170. DOI:10.1097/FJC.0000000000001285 |
| [21] |
ZHANG S J, WANG Y C, YU M, et al. Discovery of herbacetin as a novel SGK1 inhibitor to alleviate myocardial hypertrophy[J]. Advanced Science, 2022, 9(2): e2101485. DOI:10.1002/advs.202101485 |
| [22] |
ZHANG M Y, GUO F F, LI X Y, et al. Yi-Xin-Shu Capsule ameliorates cardiac hypertrophy by regulating RB/HDAC1/GATA4 signaling pathway based on proteomic and mass spectrometry image analysis[J]. Phytomedicine, 2022, 103: 154185. DOI:10.1016/j.phymed.2022.154185 |
| [23] |
JIANG F L, LEO S, WANG X G, et al. Effect of tanshinone ⅡA on cardiomyocyte hypertrophy and apoptosis in spontaneously hypertensive rats[J]. Experimental and Therapeutic Medicine, 2013, 6(6): 1517-1521. DOI:10.3892/etm.2013.1339 |
| [24] |
FENG J, CHEN H W, PI L J, et al. Protective effect of tanshinone ⅡA against cardiac hypertrophy in spontaneously hypertensive rats through inhibiting the Cys-C/Wnt signaling pathway[J]. Oncotarget, 2017, 8(6): 10161-10170. DOI:10.18632/oncotarget.14328 |
| [25] |
TAN X Y, LI J P, WANG X Y, et al. Tanshinone ⅡA protects against cardiac hypertrophy via inhibiting calcineurin/NFATc3 pathway[J]. International Journal of Biological Sciences, 2011, 7(3): 383-389. DOI:10.7150/ijbs.7.383 |
| [26] |
WENG Y S, WANG H F, PAI P Y, et al. Tanshinone ⅡA prevents Leu27IGF-Ⅱ-induced cardiomyocyte hypertrophy mediated by estrogen receptor and subsequent Akt activation[J]. The American Journal of Chinese Medicine, 2015, 43(8): 1567-1591. DOI:10.1142/S0192415X15500895 |
| [27] |
LI S S, FENG J, ZHENG Z, et al. Effect of sodium tanshinone ⅡA sulfonate on phosphorylation of extracellular signal-regulated kinase 1/2 in angiotensin Ⅱ-induced hypertrophy of myocardial cells[J]. Chinese Journal of Integrative Medicine, 2008, 14(2): 123-127. DOI:10.1007/s11655-008-0123-3 |
| [28] |
YANG L, ZOU X J, LIANG Q S, et al. Sodium tanshinone ⅡA sulfonate depresses angiotensin Ⅱ-induced cardiomyocyte hypertrophy through MEK/ERK pathway[J]. Experimental & Molecular Medicine, 2007, 39(1): 65-73. |
| [29] |
FENG J, ZHENG Z. Effect of sodium tanshinone ⅡA sulfonate on cardiac myocyte hypertrophy and its underlying mechanism[J]. Chinese Journal of Integrative Medicine, 2008, 14: 197-201. DOI:10.1007/s11655-008-0197-y |
| [30] |
ZHOU D, LIANG Q, HE X, et al. Changes of c-fos and c-Jun mRNA expression in angiotensin Ⅱ-induced cardiomyocyte hypertrophy and effects of sodium tanshinone ⅡA sulfonate[J]. Journal of Huazhong University of Science and Technology Medical Sciences, 2008, 28(5): 531-534. DOI:10.1007/s11596-008-0509-7 |
| [31] |
HAO-PING, M AO. Danhong Injection attenuates isoproterenol-induced cardiac hypertrophy by regulating p38 and NF-κB pathway[J]. Journal of Ethnopharmacology, 2016, 186: 20-29. DOI:10.1016/j.jep.2016.03.015 |
| [32] |
WAN M X, YIN K K, YUAN J, et al. YQFM alleviated cardiac hypertrophy by apoptosis inhibition and autophagy regulation via PI3K/AKT/mTOR pathway[J]. Journal of Ethnopharmacology, 2022, 285: 114835. DOI:10.1016/j.jep.2021.114835 |
| [33] |
LI Y P, RUAN X F, XU X W, et al. Shengmai Injection suppresses angiotensin Ⅱ-induced cardiomyocyte hypertrophy and apoptosis via activation of the AMPK signaling pathway through energy-dependent mechanisms[J]. Frontiers in Pharmacology, 2019, 10: 1095. DOI:10.3389/fphar.2019.01095 |
| [34] |
WANG Y, HUANG X Y, MA Z C, et al. Ophiopogonin D alleviates cardiac hypertrophy in rat by upregulating CYP2J3 in vitro and suppressing inflammation in vivo[J]. Biochemical and Biophysical Research Communications, 2018, 503(2): 1011-1019. DOI:10.1016/j.bbrc.2018.06.110 |
| [35] |
GAO R R, WU X D, JIANG H M, et al. Traditional Chinese medicine Qiliqiangxin attenuates phenylephrine-induced cardiac hypertrophy via upregulating PPARγ and PGC-1α[J]. Annals of Translational Medicine, 2018, 6(8): 153. DOI:10.21037/atm.2018.04.14 |
| [36] |
ZHANG H, LI S, ZHOU Q, et al. Qiliqiangxin attenuates phenylephrine-induced cardiac hypertrophy through downregulation of MiR-199a-5p[J]. Cell Physiol Biochem, 2016, 38(5): 1743-51. DOI:10.1159/000443113 |
| [37] |
WEI Y D, LIU X Y, HOU L, et al. Qiliqiangxin affects L type Ca2+ current in the normal and hypertrophied rat heart[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2012, 2012: 131830. |
| [38] |
ZOU Y Z, LIN L, YE Y, et al. Qiliqiangxin inhibits the development of cardiac hypertrophy, remodeling, and dysfunction during 4 weeks of pressure overload in mice[J]. Journal of Cardiovascular Pharmacology, 2012, 59(3): 268-280. DOI:10.1097/FJC.0b013e31823f888f |
| [39] |
YE Y, GONG H, WANG X X, et al. Combination treatment with antihypertensive agents enhances the effect of qiliqiangxin on chronic pressure overload-induced cardiac hypertrophy and remodeling in male mice[J]. Journal of Cardiovascular Pharmacology, 2015, 65(6): 628-639. DOI:10.1097/FJC.0000000000000230 |
| [40] |
ZHANG Y, SUN M, WANG D, et al. FTZ protects against cardiac hypertrophy and oxidative injury via microRNA-214/SIRT3 signaling pathway[J]. Biomedicine & Pharmacotherapy, 2022, 148: 112696. |
| [41] |
LUAN A, TANG F, YANG Y, et al. Astragalus polysaccharide attenuates isoproterenol-induced cardiac hypertrophy by regulating TNF-α/PGC-1α signaling mediated energy biosynthesis[J]. Environmental Toxicology and Pharmacology, 2015, 39(3): 1081-1090. DOI:10.1016/j.etap.2015.03.014 |
| [42] |
HONGLIANG, D AI. Astragalus polysaccharide inhibits isoprenaline-induced cardiac hypertrophy via suppressing Ca2+-mediated calcineurin/NFATc3 and CaMKⅡ signaling cascades[J]. Environmental Toxicology and Pharmacology, 2014, 38(1): 263-271. DOI:10.1016/j.etap.2014.05.008 |
| [43] |
熊朝刚, 周俊, 吕小会, 等. 黄芪甲苷通过激活Sirt3抑制血管紧张素Ⅱ诱导的心肌肥大及氧化应激[J]. 中南药学, 2019, 17(1): 34-37. XIONG C G, ZHOU J, LYU X H, et al. Astragaloside inhibits angiotensin Ⅱ-induced cardiomyocyte hypertrophy and oxidative response by activating Sirt3[J]. Central South Pharmacy, 2019, 17(1): 34-37. |
| [44] |
NIE P, MENG F J, ZHANG J G, et al. Astragaloside Ⅳ exerts a myocardial protective effect against cardiac hypertrophy in rats, partially via activating the Nrf2/HO-1 signaling pathway[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019: 4625912. |
2. Collage of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China;
3. Key Laboratory of Pharmacology of Traditional Chinese Medical Formulae, Tianjin 301617, China;
4. Haihe Laboratory of Modern Chinese Medicine, Tianjin 301617, China;
5. Chongqing University Cancer Hospital, Chongqing 400030, China
 2023, Vol. 40
2023, Vol. 40