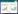文章信息
- 刘鑫, 刘甜甜, 张彦丽, 等.
- LIU Xin, LIU Tiantian, ZHANG Yanli, et al.
- 芪参益气滴丸对高脂饮食联合链脲霉素诱导糖尿病小鼠肝损伤的作用及机制
- Effect and mechanism of Qishen Yiqi Droplet on liver injury induced by high-fat diet combined with streptozotocin in diabetes mice
- 天津中医药, 2023, 40(7): 904-909
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(7): 904-909
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.07.15
-
文章历史
- 收稿日期: 2023-05-03
糖尿病慢性并发症已成为糖尿病致死、致残的主要原因[1]。糖尿病是一种胰岛素抵抗和血糖升高为特征的代谢紊乱性疾病[2]。持续高血糖及胰岛素抵抗造成脂代谢紊乱及脂质在肝脏积聚增多[3-4],而肝脏是糖类代谢的重要器官,长期慢性血糖升高超过肝脏清除能力时,引起氧化应激和炎性细胞因子分泌异常,进而导致糖尿病肝功能受损[5]。糖尿病肝损伤的发病机制尚不明确,目前治疗主要是基于糖尿病或者肝损伤本身,临床治疗肝损伤的药物虽有一定疗效,但此类药不良反应较多,尚无专门针对糖尿病肝损伤的特效药[6]。因而,探寻治疗糖尿病肝功能受损的药物具有一定意义。
中医肝络学说指出肝病的病理因素是“湿-毒-瘀-虚”,核心病机为肝络瘀阻、瘀血阻滞、痰浊凝滞、气阴两虚和湿毒内蕴[7],依据病因病机可采用益气活血、活血化瘀、滋阴养血、化痰活血、解毒通络等治法。芪参益气滴丸具有补气、活血、化瘀的功效,是益气活血法的代表方药,广泛用于心血管病的治疗。研究发现,芪参益气滴丸还能明显改善肝纤维化患者的临床疗效,减轻大鼠肝脏病变和肝纤维化损伤程度[8-9]。但目前关于芪参益气滴丸对糖尿病肝损伤的作用及机制鲜有报道。本研究旨在通过高脂饮食联合链脲霉素诱导糖尿病模型,探讨芪参益气滴丸对糖尿病小鼠肝损伤的效应靶点。
1 材料与方法 1.1 主要试剂与仪器60%脂肪供能高脂饲料(H10060)购自北京华阜康生物科技股份有限公司。血糖仪、血糖试纸购自德国Roche公司。总胆固醇(TC)、三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)试剂盒购自南京建成生物工程研究所。链脲霉素(Streptozocin)购自美国Sigma-aldrich试剂公司。改良油红O染色试剂盒购自上海碧云天生物技术有限公司。芪参益气滴丸购自天士力制药集团股份有限公司。EX-527购自上海阿拉丁生化科技股份有限公司。鼠源Sirt1抗体(货号:sc74465)、鼠源PGC-1α抗体(货号:sc518038)购自美国Santa公司。兔源AMPKα抗体(货号:2532S)、兔源磷酸化AMPKα(p-AMPKα)抗体(货号:2535S)购自美国CST公司。鼠源β-actin抗体(货号:GB12001)购自武汉塞维尔生物科技有限公司。Synergy H1型多功能微孔板检测仪购自美国BioTek公司。5424R高速冷冻离心机购自德国Eppendorf公司。Bx5型正置显微镜购自日本Olympus公司。
1.2 实验动物80只健康SPF级雄性C57BL/6J小鼠,6~8周龄,体质量17~20 g,由北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2021-0006。动物实验由北京中医药大学东方医院实验动物使用与管理委员会批准(伦理批号:DFYY202225M)。
1.3 实验分组及模型建立80只雄性小鼠,采用随机数字表法选取12只为对照组,14只为模型组,18只为芪参益气滴丸低剂量组(每日灌胃227.5 mg/kg,以下简称低剂量组),18只为芪参益气滴丸高剂量组(每日灌胃455 mg/kg,以下简称高剂量组),18只为EX-527抑制剂组(芪参益气滴丸低剂量每日227.5 mg/kg+EX-527 10 mg/kg,腹腔注射3 d,以下简称抑制剂组),EX-527为Sirt1的选择性抑制剂。小鼠适应性饲养1周,第2周开始除对照组继续喂养正常饲料外,其余4组均喂养高脂饲料至实验结束,第3周后模型组、芪参益气滴丸给药组、EX-527抑制剂组腹腔注射链脲霉素每日50 mg/kg,连续注射7 d,对照组腹腔注射等剂量生理盐水。10 d后,采用血糖仪检测小鼠空腹血糖值均 > 11.1 mmol/L,即为糖尿病小鼠,见表 1。4周后,随机选取5只糖尿病小鼠观察肝脏病理变化和肝功能参数,确定为糖尿病肝损伤[10-11]。第5周予低、高剂量和EX-527抑制剂干预2周后取材,注射链脲霉素后模型组死亡1只小鼠。
|
收集血液静置后,于4 ℃离心15 min,转速3 500 r,离心半径8.4 cm,取上清,依据试剂盒说明书步骤测定各组小鼠血清中AST、ALT、TC、TG水平。
1.5 肝脏病理染色实验结束后摘眼球取血,迅速摘取肝脏,将肝脏置于4%中性多聚甲醛固定液,进行组织脱水、包埋、切片。每组小鼠肝脏进行苏木精-伊红(HE)染色、Masson染色,每组选取6个切片进行油红O染色,中性树胶封片,显微镜下观察肝脏病理结构变化、胶原纤维沉积及肝脂肪变性情况。采用Image-Pro Plus软件半定量分析肝脏纤维面积比值。
1.6 肝脏TUNEL染色每组选取6个小鼠肝脏组织进行TUNEL染色,观察各组小鼠肝细胞凋亡变化。将固定好的组织切片与蛋白酶K孵育15~30 min,磷酸缓冲盐溶液(PBS)洗涤3次。将切片与TdT酶反应液在37 ℃避光孵育1 h,然后与辣根过氧化物酶(HRP)标记的抗体孵育30 min。DAB显色,苏木精复染核。于显微镜下随机选取10个视野,采用Image-Pro Plus软件统计棕褐色细胞核的面积比值。
1.7 肝脏Sirt1、AMPKα、p-AMPKα和PGC-1α蛋白表达检测取肝脏组织裂解、提取蛋白,BCA测试盒定量蛋白浓度。蛋白裂解物在10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上分离并转膜。采用5%脱脂牛奶室温封闭1 h,4 ℃冰箱孵育Sirt1、AMPK、p-AMPKα、PGC-1α和β-actin抗体过夜,次日TBST洗膜,室温孵育二抗1 h。化学发光成像系统检测蛋白条带,采用Quantity One软件统计相对蛋白灰度值。
1.8 统计学方法采用SPSS 20.0软件进行统计分析。各组数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法。P < 0.05表示差异具有统计学意义。
2 结果 2.1 芪参益气滴丸对糖尿病肝损伤小鼠肝功能的影响由于小鼠血清量较少,未能每只都进行肝功能参数检测,每组选取8只。与对照组比较,模型组小鼠血清的ALT、TC、TG含量均显著升高(P<0.01)。与模型组比较,低、高剂量组的ALT、TC、TG均显著降低(P<0.05或P<0.01)。与低剂量组相比,抑制剂组小鼠肝功能指标差异无统计学意义(P > 0.05)。各组之间的AST差异无统计学意义(P > 0.05)。见表 1。
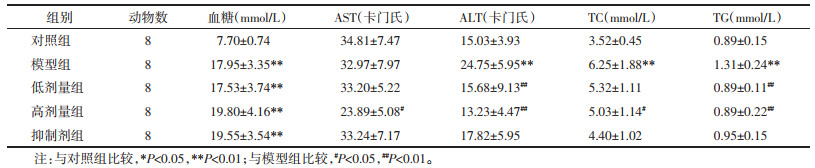
2.2 芪参益气滴丸对糖尿病肝损伤小鼠肝脏结构的影响对照组小鼠肝小叶结构完整,肝细胞呈放射状排列规则,未见变性和坏死。与对照组比较,模型组小鼠肝细胞肿胀,肝小叶结构紊乱,细胞核深染、固缩,局部有炎症细胞浸润。低、高剂量组的肝脏病理变化得到一定程度改善。与低剂量组相比,抑制剂组肝小叶结构不清,细胞核萎缩、深染,局部可见炎性细胞浸润。见图 1。

|
| 图 1 芪参益气滴丸对糖尿病小鼠肝脏病理形态的影响(×400,n=6) Fig. 1 Effect of Qishen Yiqi Droplet on liver pathological morphology of diabetes mice (×400, n=6) |
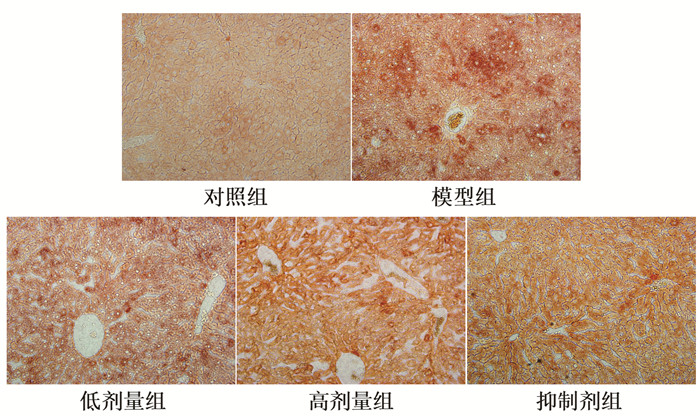
与对照组相比,模型组小鼠肝细胞内可见大量红色脂肪滴,呈显著脂肪变性。与模型组比较,低、高剂量组红色脂肪滴明显减少,脂肪轻度变性。与低剂量组比较,抑制剂组的脂肪滴无明显差异。见图 2。
|
| 图 2 芪参益气滴丸对糖尿病小鼠肝脂肪变性的影响(×400,n=6) Fig. 2 Effect of Qishen Yiqi Droplet on liver steatosis in diabetes mice (×400, n=6) |
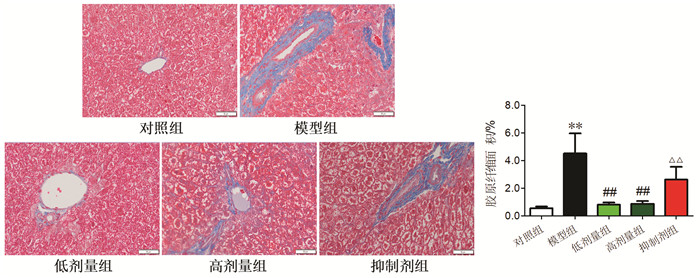
与对照组比较,模型组小鼠的蓝色胶原纤维沉积显著增加(P<0.01)。与模型组比较,低剂量组和高剂量组小鼠胶原纤维含量明显减少(P<0.01)。与低剂量组比较,抑制剂组的胶原纤维化水平显著增加(P<0.01)。见图 3。
|
| 注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与低剂量组比较,△△P<0.01。 图 3 芪参益气滴丸对糖尿病小鼠肝脏胶原纤维的影响(×400,x±s,n=6) Fig. 3 Effect of Qishen Yiqi Droplet on collagen fiber in liver of diabetes mice(×400, x±s, n=6) |
与对照组比较,模型组小鼠中棕褐色肝细胞凋亡数目明显增加(P<0.01)。与模型组比较,低剂量组和高剂量组肝细胞凋亡数量明显减少(P<0.01)。与低剂量组相比,EX-527抑制剂组的肝细胞凋亡数目显著增加(P<0.01)。见图 4。

|
| 注:与对照组比较,**P<0.01;与模型组比较,##P<0.01;与低剂量组比较,△△P<0.01。 图 4 芪参益气滴丸对糖尿病小鼠肝细胞凋亡影响(×400,x±s,n=6) Fig. 4 Effect of Qishen Yiqi Droplet on hepatocyte apoptosis in diabetes mice(×400, x±s, n=6) |
综合以上结果,小鼠低剂量组效果更好,所以选取低剂量组进行蛋白检测。与对照组相比,模型组小鼠肝脏中Sirt1和PGC-1α的表达明显增加(P < 0.05或P < 0.01),p-AMPKα/AMPKα水平明显降低(P < 0.01)。与模型组比较,低剂量组肝脏的Sirt1和p-AMPKα/AMPKα含量显著增加(P < 0.05或P < 0.01),PGC-1α表达显著降低(P < 0.01)。与低剂量组比较,抑制剂组的Sirt1表达降低,PGC-1α水平明显提升(P < 0.01),p-AMPKα/AMPKα水平差异无统计学意义。见图 5。
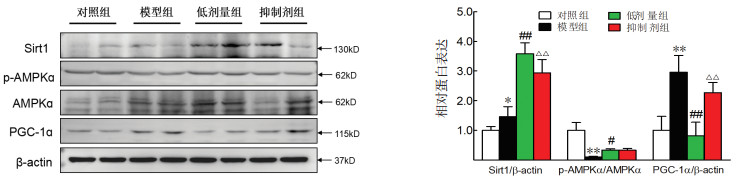
|
| 注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与低剂量组比较,△△P<0.01。 图 5 芪参益气滴丸对糖尿病小鼠肝脏Sirt1、AMPKɑ、PGC-1ɑ蛋白表达的影响(×400,n=6) Fig. 5 Effects of Qishen Yiqi Droplet on expression of Sirt1, AMPKɑ and PGC-1ɑ proteins in liver of diabetes mice(×400, n=6) |
糖尿病是脂肪肝的高危因素,糖尿病合并脂肪肝使肝脏中的脂肪沉积加重,增加微血管、大血管并发症几率,患者死亡风险增加[12]。糖尿病肝损伤主要表现为肝功能障碍和肝脏病理结构改变[13]。中医认为“瘀,热,毒,湿,痰,虚”是糖尿病肝病的发病原因。因此,活血化瘀法、益气养阴法是治疗糖尿病肝损伤的主要方向。本研究结果提示,芪参益气滴丸可以降低肝功能损伤,减轻肝脏炎性病变,抑制肝纤维化和肝细胞凋亡,而Sirt1抑制剂EX-527能部分抑制芪参益气滴丸的治疗作用,说明芪参益气滴丸改善糖尿病肝损伤的作用可能与Sirt1信号有关。
AST、ALT、TC、TG是评价肝功能损伤的敏感指标,当肝细胞和线粒体损伤,AST、ALT释放入血,使血清中AST、ALT含量显著升高,提示肝功能严重受损[14]。如果机体摄入过多脂肪,超量的脂肪会在肝脏转化、生成TC和TG,大量TG堆积于肝脏会导致肝功能障碍[15]。本研究显示,芪参益气滴丸明显降低糖尿病小鼠血清中AST、ALT、TC和TG水平,从而改善小鼠肝功能损伤,加入EX-527可以抑制芪参益气滴丸的作用。
肝脏脂肪变性主要是由于缺血、缺氧、中毒和感染等因素引起肝内细胞脂肪代谢失衡,导致胞内脂质累积[16]。轻微肝脂肪变性造成的损伤是可逆的,消除病因可恢复。严重肝脏脂肪变性,会导致胶原纤维化增生、肝细胞坏死、肝硬化和肝功能衰竭[17]。因此,抗肝细胞凋亡、逆转肝纤维化和肝脂肪变性、抑制脂代谢异常是治疗糖尿病肝损伤的重要方向。本实验结果显示,芪参益气滴丸能抑制糖尿病小鼠肝细胞凋亡和肝纤维化,降低肝脏脂肪变性程度,减轻脂质代谢紊乱,维持肝细胞结构完整。
Sirt1介导众多心血管效应,在细胞核,Sirt1与多转录因子相互作用,抑制核因子-κB(NF-κB)信号传导和促炎细胞因子表达。此外,Sirt1减少血浆Pcsk9水平,增加肝脏低密度脂蛋白胆固醇受体密度,进而降低血浆低密度脂脂蛋白胆固醇水平。AMPK参与维持细胞内能量平衡和脂质氧化代谢。线粒体毒素、缺氧条件、葡萄糖缺乏和运动均会导致AMPK激活,AMPK激活后重新连接代谢以减少合成代谢(即ATP消耗)和增加分解代谢(即ATP生产),恢复有利的能量平衡[18-19]。PGC-1α调控线粒体生成,是ATP合成调节的转录辅因子。研究发现,PGC-1α可与多种核激素受体及转录因子相互作用,介导相关基因转录激活,参与糖代谢、脂代谢和能量代谢[20]。本研究结果表明,芪参益气滴丸能上调肝组织Sirt1、AMPK表达,同时下调PGC-1ɑ含量。相反,Sirt1抑制剂则逆转芪参益气滴丸的作用,说明芪参益气滴丸改善糖尿病小鼠肝功能受损可能与Sirt1/AMPK/PGC-1α信号有关。
综上,芪参益气滴丸可能通过激活Sirt1/AMPK/PGC-1α信号,抑制糖尿病小鼠肝脏结构病变和纤维化增生,减轻肝脂肪变性和肝细胞凋亡,促进糖尿病肝功能修复。本研究初步证实了芪参益气滴丸改善糖尿病肝损伤的可能机制,为中医药防治糖尿病肝病提供实验依据。
| [1] |
DEMIR S, NAWROTH P P, HERZIG S, et al. Emerging targets in type 2 diabetes and diabetic complications[J]. Advanced Science, 2021, 8(18): 2100275. DOI:10.1002/advs.202100275 |
| [2] |
TAYLOR S I, YAZDI Z S, BEITELSHEES A L. Pharmacological treatment of hyperglycemia in type 2 diabetes[J]. The Journal of Clinical Investigation, 2021, 131(2): e142243. DOI:10.1172/JCI142243 |
| [3] |
PAFILI K, RODEN M. Nonalcoholic fatty liver disease (NAFLD) from pathogenesis to treatment concepts in humans[J]. Molecular Metabolism, 2021, 50: 101122. DOI:10.1016/j.molmet.2020.101122 |
| [4] |
KO C Y, LO Y M, XU J H, et al. Alpha-lipoic acid alleviates NAFLD and triglyceride accumulation in liver via modulating hepatic NLRP3 inflammasome activation pathway in type 2 diabetic rats[J]. Food Science & Nutrition, 2021, 9(5): 2733-2742. |
| [5] |
DEY A, LAKSHMANAN J. The role of antioxidants and other agents in alleviating hyperglycemia mediated oxidative stress and injury in liver[J]. Food & Function, 2013, 4(8): 1148-1184. |
| [6] |
ATHYROS V G, POLYZOS S A, KOUNTOURAS J, et al. Non-alcoholic fatty liver disease treatment in patients with type 2 diabetes mellitus; new kids on the block[J]. Current Vascular Pharmacology, 2020, 18(2): 172-181. DOI:10.2174/1570161117666190405164313 |
| [7] |
聂广, 张赤志, 唐智敏, 等. 拓展王伯祥教授"肝络瘀阻"学说构建中医肝病分期辨证体系[J]. 中西医结合肝病杂志, 2022, 32(9): 773-779, 786. NIE G, ZHANG C Z, TANG Z M, et al. Expanding Professor WANG Boxiang's theory of "stasis of liver collateral" and con-structing stage syndrome differentiation system of liver disease in traditional Chinese medicine[J]. Chinese Journal of Integrated Traditional and Western Medicine on Liver Diseases, 2022, 32(9): 773-779, 786. |
| [8] |
韩石蕊. 芪参益气滴丸治疗肝纤维化疗效研究[J]. 陕西中医, 2018, 39(4): 473-475. HAN S R. Clinical effect of Qishen Yiqi Dripping Pill in patients with hepatic fibrosis[J]. Shaanxi Journal of Traditional Chinese Medi- cine, 2018, 39(4): 473-475. |
| [9] |
朱跃科, 段钟平, 王宝恩, 等. 芪参益气滴丸抗大鼠肝纤维化的实验研究[J]. 中国中西医结合杂志, 2007, 27(3): 223-226. ZHU Y K, DUAN Z P, WANG B E, et al. Experimental study on effects of Qishen Yiqi Dropping Pill on liver fibrosis in rats[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2007, 27(3): 223-226. |
| [10] |
付媛, 王宇斐, 何金凤, 等. miR-31改善2型糖尿病小鼠的肝损伤[J]. 中国生物化学与分子生物学报, 2022, 38(9): 1226-1233. FU Y, WANG Y F, HE J F, et al. Ameliorative effect of miR-31 on liver injury in type 2 diabetic mice[J]. Chinese Journal of Biochemistry and Molecular Biology, 2022, 38(9): 1226-1233. |
| [11] |
吴堃, 蒋青松, 任凯强, 等. 苯扎贝特减轻小鼠糖尿病肝损伤[J]. 中国病理生理杂志, 2020, 36(3): 519-524. WU K, JIANG Q S, REN K Q, et al. Activation of PPARs is involved in effect of bezafibrate on diabetic hepa-topathy in mice[J]. Chinese Journal of Pathophysiology, 2020, 36(3): 519-524. |
| [12] |
陈曦阳光, 吴君. 中国糖尿病人群合并肝损伤相关危险因素Meta分析[J]. 肝脏, 2017, 22(9): 800-805. CHEN X Y G, WU J. Meta-analysis on risk factors of diabetes complicated with hepatic damage in China[J]. Chinese Hepatology, 2017, 22(9): 800-805. |
| [13] |
MAXIMOS M, BRIL F, PORTILLO SANCHEZ P, et al. The role of liver fat and insulin resistance as determinants of plasma aminotransferase elevation in nonalcoholic fatty liver disease[J]. Hepatology (Baltimore, Md), 2015, 61(1): 153-160. |
| [14] |
王丽艳, 孔凡刚. 肝病患者血清中AST/ALT比值的临床意义研究[J]. 中西医结合心血管病电子杂志, 2020, 8(30): 97-98. WANG L Y, KONG F G. Clinical significance of AST/ALT ratio in serum of patients with liver disease[J]. Cardiovascular Disease Journal of Integrated Traditional Chinese and Western Medicine (Electronic), 2020, 8(30): 97-98. |
| [15] |
辛鹏, 李静, 李昌昆, 等. 脂质比值TC/HDL-C、TG/HDL-C和LDL-C/HDL-C与胰岛素抵抗、糖尿病及糖尿病前期的关联性[J]. 中华疾病控制杂志, 2022, 26(5): 535-540. XIN P, LI J, LI C K, et al. Study on the association of three TC/HDL-C, TG/HDL-C and LDL-C/HDL-C lipid ratios with insulin resistance, diabetes and pre-diabetes[J]. Chinese Journal of Disease Control & Prevention, 2022, 26(5): 535-540. |
| [16] |
IPSEN D H, LYKKESFELDT J, TVEDEN-NYBORG P. Molecular mechanisms of hepatic lipid accumulation in non-alcoholic fatty liver disease[J]. Cellular and Molecular Life Sciences, 2018, 75(18): 3313-3327. |
| [17] |
孟文文, 刘慧茹, 张文光, 等. 中药防治酒精性肝病作用机制的研究进展[J]. 中草药, 2022, 53(3): 868-881. MENG W W, LIU H R, ZHANG W G, et al. Research progress on mechanism of traditional Chinese medicine in preventing and treating alcoholic liver disease[J]. Chinese Traditional and Herbal Drugs, 2022, 53(3): 868-881. |
| [18] |
WINNIK S, AUWERX J, SINCLAIR D A, et al. Protective effects of sirtuins in cardiovascular diseases: from bench to bedside[J]. European Heart Journal, 2015, 36(48): 3404-3412. |
| [19] |
HERZIG S, SHAW R J. AMPK: Guardian of metabolism and mitochondrial homeostasis[J]. Nature Reviews Molecular Cell Biology, 2018, 19(2): 121-135. |
| [20] |
CARLING D. AMPK signalling in health and disease[J]. Current Opinion in Cell Biology, 2017, 45: 31-37. |
 2023, Vol. 40
2023, Vol. 40