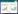文章信息
- 邬霄霞, 李焕敏, 孙丹, 等.
- WU Xiaoxia, LI Huanmin, SUN Dan, et al.
- 麻杏石甘汤“异病同治”肺炎支原体肺炎与支气管哮喘的网络药理学机制研究
- Research on the mechanism of network pharmacology of Maxing Shigan Decoction for "treating different diseases with the same treatment" in mycoplasma pneumoniae pneumonia and bronchial asthma
- 天津中医药, 2023, 40(7): 916-924
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(7): 916-924
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.07.17
-
文章历史
- 收稿日期: 2023-05-13
2. 国家中医针灸临床医学研究中心,天津 300193
肺炎支原体肺炎(MPP)是由肺炎支原体(MP)感染所引起的一类常见的呼吸系统疾病,其发病率占儿童社区获得性肺炎的20%~40%[1]。好发于学龄期及学龄前期儿童,近几年呈低龄化趋势。MPP初期多表现为持续高热与刺激性干咳,以肺部体征不明显、影像学表现较多为特征。西医治疗方法首选大环内酯类抗生素,但随之出现耐大环内酯类MPP、难治性MPP及重症MPP日益增多,且常有胃肠道等不良反应[2]。中医将该病归为“肺炎喘嗽”范畴。随着中医药与西医相结合,中医药在治疗MPP方面取得良好效果,可以明显缓解症状、缩短病程、减轻不良反应。
支气管哮喘(BA)是以反复发作的喘息、气急,伴或不伴胸闷或咳嗽等为主要临床表现,同时伴有气道高反应性、可变的气流受限及气道重塑的一种异质性慢性气道炎症性疾病[3]。目前西药治疗主要包括糖皮质激素、β2受体激动剂、白三烯受体拮抗剂等,可以控制气道炎症、减轻临床症状,但会出现不良反应且病情容易反复,不但影响患者身心健康、生活质量,还造成了严重的社会和经济负担[4]。中医将哮喘归为“哮病”范畴。随着中医药治疗哮喘的不断探索发现,中医药在改善哮喘症状、减少不良反应及复发等方面独具优势[5]。
《伤寒论》云:“汗出而喘,无大热者,可与麻黄杏仁甘草石膏汤。”麻杏石甘汤用于治疗太阳病,发汗未愈,风寒入里化热,“汗出而喘”者。由麻黄、苦杏仁、甘草、石膏4味中药组成,具有辛凉宣泄,清肺平喘之功。目前,麻杏石甘汤对新型冠状病毒肺炎(COVID-19)的治疗效果确切,对COVID-19的病毒复制和细胞因子风暴具有显著的调节作用[6-8]。麻杏石甘汤也是治疗MPP与BA的常用方剂。临床研究表明,运用麻杏石甘汤加减联合西药治疗MPP及BA可明显改善肺功能,提高临床疗效,且安全性良好[9-12],但作用机制尚不明确。网络药理学将生物学、多向药理学、网络分析等多学科融会贯通,通过构建药物-活性成分-潜在靶点-疾病网络,将药物与疾病的关系紧密联系起来,体现了中医辨证论治及整体观念[13]。本研究采用网络药理学方法通过对麻杏石甘汤主要活性成分进行筛选,分析其治疗MPP与BA的共同靶点和信号通路等,以期为临床“异病同治”理论提供参考。
1 材料与方法 1.1 筛选麻杏石甘汤相关活性成分及靶点利用中药系统药理学数据库和分析平台TCMSP(http://tcmspw.com/tcmsp.php),以麻杏石甘汤中麻黄、苦杏仁、甘草为关键词,以口服利用度(OB%≥30%)、类药性(DL≥0.18)为筛选条件[14],得到3味中药的有效成分及相关靶点。由于未检索到石膏的有效成分,故通过中国知识资源总库(CNKI)及相关资料确定石膏的成分及作用靶点。后通过Uniprot数据库(https://www.uniprot.org)对相关靶点名称进行规范,限定物种为人(homo sapiens),得到相应的基因名称。
1.2 筛选与MPP与BA潜在作用靶点利用GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)数据库,以“mycoplasma pneumoniae pneumonia”“mycoplasma pneumoniae pneumonia in children”“bronchial asthma”等进行检索并筛选,获得两种疾病的相关靶点,将两大数据库所得靶点分别合并去重,并通过Venny2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)获得麻杏石甘汤治疗MPP与BA的交集靶点。
1.3 药物-活性成分-潜在靶点-疾病网络图构建将麻杏石甘汤的药物组成、活性成分、药物治疗的潜在靶点及两种疾病靶点导入Cytoscape3.9.1构建“药物-活性成分-潜在靶点-疾病”网络关系图。
1.4 靶点蛋白互作网络将药物与疾病的共有靶点导入STRING数据库(https://string-db.org/),设定物种为人,选取intersection score≥0.4的数据,利用Cytoscape3.9.1软件构建蛋白相互作用(PPI)网络。其中节点代表靶点,边代表靶点之间的相互作用。共有靶点及核心靶点可以从生物信息学角度为“异病同治”提供科学依据。
1.5 GO功能富集及KEGG通络富集分析运用DAVID数据库(https://david.ncifcrf.gov/),将物种限定为人,筛选条件为P<0.05,分别对药物-疾病共有靶点进行GO富集分析与KEGG通路富集分析,导出“Gene Ontology”中的“BP、CC、MF”与“Pathways”中的“KEGG_PATHWAY”,按P值大小选取前20名进行可视化展示。
1.6 核心成分与关键靶点分子对接选取疾病-药物-成分-靶点网络的度值排名前5名的核心成分作为配体小分子,药物-疾病交集靶点PPI网络的度值和介数中心性都大于平均数的前5的关键靶点为受体蛋白,从PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库获取潜在活性成分3D结构的sdf文件,利用OpenBabel软件将其转化为pdb文件,在PDB(http://www.rcsb.org/)数据库中获取关键靶点3D结构的pdb文件,使用AutoDockTools对配体小分子和受体蛋白进行去水分子、添加非极性氢等操作,并输出为pdbqt格式文件。根据受体与配体结构大小设置适合的对接参数及对接盒子进行分子对接。根据受体与配体的结合能大小选取部分对接结果,使用Pymol进行可视化展示。
2 结果 2.1 药物相关活性成分及对应靶点利用中药系统药理学数据库和分析平台(TCMSP)进行检索并筛选获得麻杏石甘汤药物活性成分共135个,其中麻黄23个,苦杏仁19个,甘草92个,在TCMSP中无法检索到石膏的活性成分,故通过与CNKI文献查阅得到石膏的活性成分主要为CaSO4·2H2O,合并去重并删除没有靶基因的成分后共获得123个,对应的靶点共208个。
2.2 疾病靶点与药物-疾病交集靶点通过搜索GeneCards和OMIM数据库,去重后获的MPP靶点374个,BA靶点2 623个。利用Venny2.1将两种疾病与药物取交集,获得交集靶点共46个,结果见图 1。
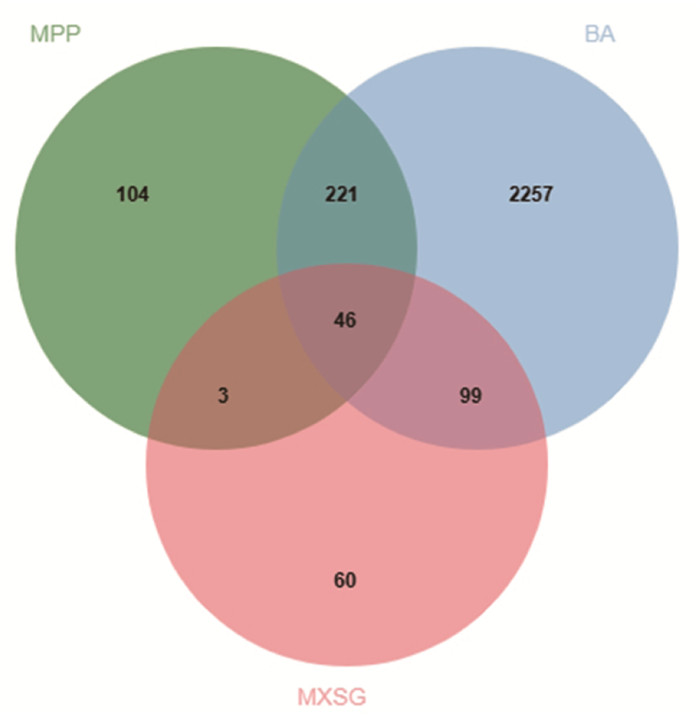
|
| 注:MPP.肺炎支原体肺炎;BA.支气管哮喘;MXSG.麻杏石甘汤。 图 1 药物-疾病交集靶点Venn图 Fig. 1 Venn diagram of drug-disease common targets |
利用Cytoscape3.9.1构建疾病-药物-成分-靶点网络,结果见图 2。图中共有327个节点,1 966条边,红色代表疾病,浅绿色节点代表药物,橘红色、橘黄色、绿色、粉色分别代表麻杏石甘汤中甘草、麻黄、苦杏仁、石膏主要活性化合物,紫色代表药物共同的活性成分,蓝色节点代表潜在靶点,每条边表示化合物和靶点之间的相互作用关系。根据节点度值筛选核心成分,结果见表 1。麻杏石甘汤治疗MPP与BA主要包括槲皮素、山柰酚、柚皮素、木犀草素、豆甾醇、光甘草啶、7-甲氧基-2-甲基异黄酮、β-谷甾醇、芒柄花黄素、甘草查耳酮A等可能的关键化合物。

|
| 注:正方形.疾病;正六边形.药物;圆形.活性成分;菱形.药物与疾病的共同靶点。 图 2 疾病-药物-活性成分-靶点网络 Fig. 2 Disease-drug-active ingredient-target network |
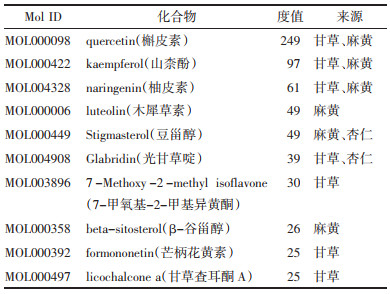
将46个交集靶点导入String数据库中进行网络分析,得到蛋白之间的相互作用关系后将数据以TSV格式保存并导入Cytoscape3.9.1中构建PPI网络图,结果见图 3。共有46个节点,1 074条边。其中节点表示蛋白,边表示节点间的相互作用关系,度值表示该点连接的边数。节点越大,颜色越深表示该节点度值越大,说明麻杏石甘汤活性成分通过该靶点发挥治疗MPP、BA的作用更多。得到Degree和Betweenness Centrality都大于平均数的前10个靶点分别为肿瘤坏死因子(TNF)、细胞肿瘤抗原p53(TP53)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、前列腺G/H合酶2(PTGS2)、血管内皮生长因子A(VEGFA)、白细胞介素-8(CXCL8)、信号转导及转录激活蛋白3(STAT3)、白细胞介素-10(IL-10)、基质金属蛋白酶-9(MMP-9),可能是麻杏石甘汤治疗MPP、BA的关键靶点,结果见表 2。
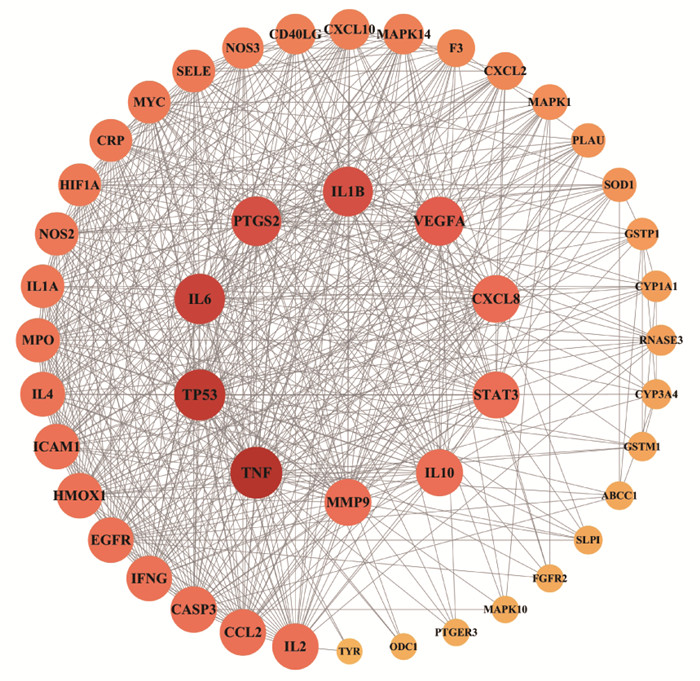
|
| 图 3 麻杏石甘汤治疗肺炎支原体肺炎与支气管哮喘靶点PPI网络 Fig. 3 PPI network of Maxing Shigan Decoction for treatment of mycoplasma pneumoniae pneumonia and bronchial asthma targets |
运用DAVID数据库对药物-疾病共同靶点进行GO功能富集分析,生物过程(BP)条目276个(P<0.05),主要包括细胞对脂多糖的反应、基因表达的正向调控、炎症反应、药物反应、凋亡过程的负调控、RNA聚合酶Ⅱ启动子对pri-miRNA转录的正向调控等;细胞组成(CC)条目15个(P<0.05),主要分布在细胞外空间、细胞外区域、小窝、细胞表面、大分子复合物等;分子功能(MF)条目33个(P<0.05),主要包括细胞因子活性、酶结合、血红素结合、蛋白结合、趋化因子的活性等,按P值大小选取前20进行可视化分析,结果见图 4。
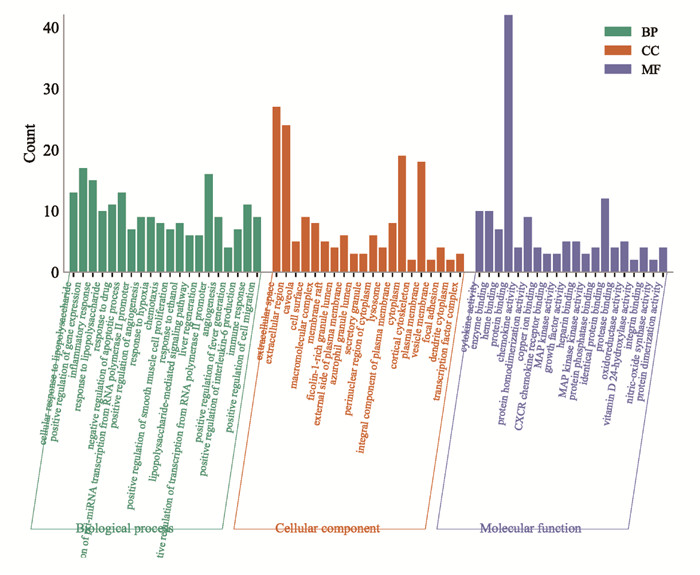
|
| 图 4 交集靶点GO富集分析 Fig. 4 GO enrichment analysis of common targets |
KEGG富集得到120条P<0.05的通路,用气泡图的形式呈现P值较小的20条通路。麻杏石甘汤治疗MPP、BA的主要通路包括了糖尿病并发症晚期糖基化终产物及其受体(AGE-RAGE)信号通路、白细胞介素-17(IL-17)信号通路、TNF信号通路、低氧诱导因子-1(HIF-1)信号通路等,结果见图 5。
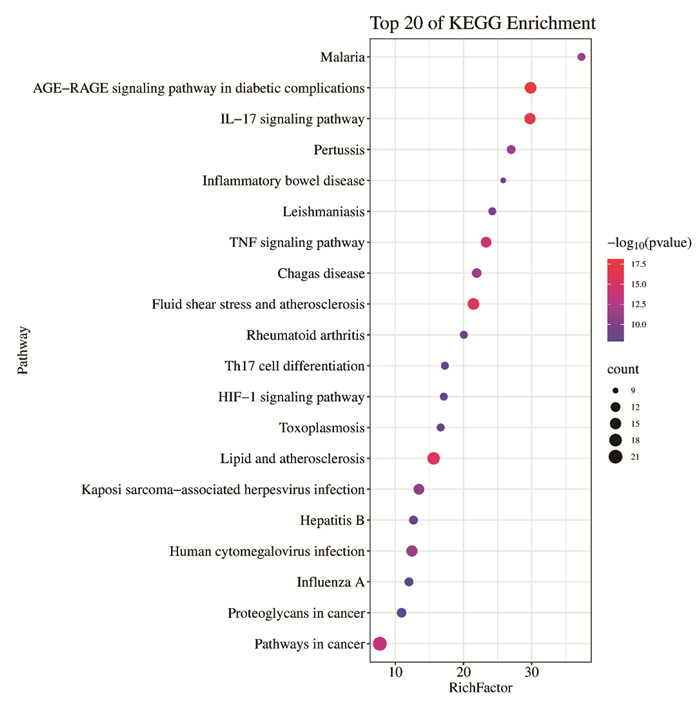
|
| 图 5 交集靶点KEGG信号通路分析 Fig. 5 KEGG signaling pathway analysis of common targets |
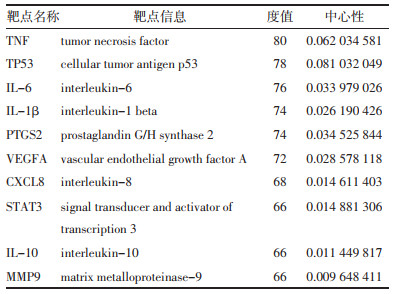
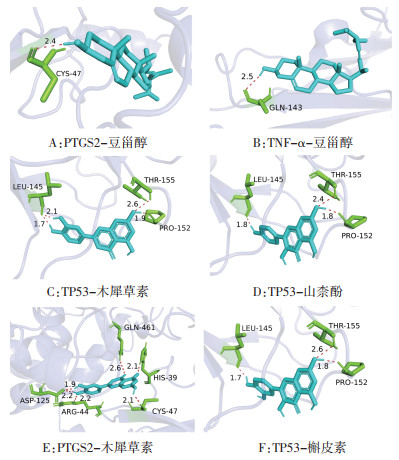
为进一步明确麻杏石甘汤治疗MPP与BA的分子机制,将核心成分与关键靶点进行分子对接,初步验证两者之间的结合活性,结果见表 3。研究显示蛋白受体与小分子配体之间的结合能 < -5.0 kcal/mol,表明两者之间结合活性较好[15]。对接结果显示排名前5的核心成分与关键靶点之间的结合能均 < -5.0 kcal/mol,其中PTGS2-豆甾醇、IL-1β-豆甾醇、TNF-α-豆甾醇、TP53-木犀草素之间的结合能均 < -8.0 kcal/mol。利用PyMOL软件对部分受体与配体进行分子对接可视化分析,结果见图 6,蓝色代表配体,绿色代表与配体对接的氨基酸残基,红色代表氢键。
|
| 注:蓝色.配体;绿色.与配体对接的氨基酸残基;红色.氢键。 图 6 部分核心成分与关键靶点的分子对接图 Fig. 6 Molecular docking diagram of some core ingredients and key targets |
近几年,中国儿童MPP及BA患病率呈明显上升趋势。MP是MPP的病原体,而有研究显示,MP感染后可能在支气管黏膜定植、损伤气道上皮,参与免疫反应,同时呼出气一氧化氮(FeNO)升高,气道高反应及气道重塑加重,诱发BA的发生[16-17]。所以MPP与BA在致病机制上存在一定相关性。中医“异病同治”源于《黄帝内经》,是中医辨证论治的重要组成部分之一。“异病同治”指不同的疾病,在其发展过程中,由于出现了大致相同的病机,因而采取大致相同的治法和方药的法则。MPP与BA均为儿科常见的呼吸系统疾病,两者的病位及病机存在着相似性与关联性,因而采用麻杏石甘汤以辛凉宣泄,清肺平喘。但具体作用机制尚不明确。
本研究采用网络药理学方法得到麻杏石甘汤活性成分123个,相关靶点208个,药物-疾病交集靶点46个,活性成分槲皮素、山柰酚、柚皮素、木犀草素、豆甾醇等,可能是麻杏石甘汤治疗MPP与BA的关键成分。其中槲皮素可通过TLR4/NF-κB信号通路调节病毒性呼吸道感染小鼠免疫功能,抑制炎症反应从而减轻肺损伤[18]。还可抑制LPS诱导中性粒细胞产生IL-6,在炎症早期通过对炎症因子负向调控发挥抗炎作用[19]。山柰酚具有抗炎、抗氧化和抑制NF-κB信号通路作用,对哮喘、急性气管炎和急性肺损伤等多种疾病具有抑制气道和肺实质炎症反应的作用[20]。柚皮素可以抑制炎症介质的释放,陈倩倩等[21]、王坚迪等[22]通过大鼠实验发现柚皮素可能通过下调VEGF信号通路来抑制Th2型炎症反应,改善哮喘大鼠肺组织的病理改变。木犀草素可以通过调控促炎介质、调节促炎基因表达及调节炎症小体来发挥抗炎作用[23]。吴力超等[24]通过细胞实验验证豆甾醇可通过介导MAPK3、PRKACA的mRNA和蛋白表达来调控细胞因子的释放起到抗炎的作用。以上表明麻杏石甘汤通过多种核心成分调节免疫、调控炎症介质发挥治疗MPP与BA的作用。
PPI网络拓扑分析获得的核心靶点主要包括TNF、TP53、IL-6、IL-1β、PTGS2、VEGFA、CXCL8、STAT3、IL-10、MMP9。其中炎症因子居多,如TNF、IL-6、IL-1β、CXCL8、IL-10。IL-6、IL-8、IL-10、TNF-α升高可以促进柱状上皮黏膜炎症反应,是支原体在感染时单核细胞所释放的关键炎症因子[1, 25]。TNF和TNF受体(TNFR)超家族(TNFSF/TNFRSF)在调节细胞功能中发挥重要作用,其中最关键的功能与免疫系统有关[26]。IL-6是炎症反应的关键细胞因子,参与肺部炎症病理过程,在体液免疫中发挥重要作用[27-28]。IL-1β是炎症反应的关键中介,对于宿主反应和抗病原体至关重要,加剧了慢性疾病和急性组织损伤的损害[29]。Marc-Malovrh等[30]研究发现BA患者痰中嗜酸性粒细胞增多,IL-8有可能刺激气道重塑,可能是哮喘患者第1秒用力呼气容积(FEV1)加速下降的标志物和治疗靶点。IL-10可以抑制促炎反应,限制炎症引起的不必要的组织破坏,在自身免疫和稳态等其他环境中发挥重要作用[31-32]。边红恩等[33]收治的165例MPP患儿研究发现治疗组与对照组患儿相比IL-10、IL-6、TNF-α明显降低(P<0.05)。得出麻杏石甘汤联合阿奇霉素可能通过降低促炎因子水平,改善患儿免疫功能使其治疗MPP患儿的疗效显著。以上显示麻杏石甘汤通过以上关键靶蛋白调节炎症因子水平,抑制炎症反应发生,提高机体免疫功能,改善气道重塑,减轻肺部损伤。
GO功能富集发现麻杏石甘汤主要通过细胞因子活性、酶结合、血红素结合等在细胞外空间、细胞外区域、小窝等发挥对脂多糖的反应、基因表达的正向调控、炎症反应等作用,起到治疗MPP与BA的作用。KEGG富集得到的主要通路包括糖尿病并发症AGE-RAGE、IL-17、TNF、HIF-1信号通路等。系统性自身免疫性疾病与炎症和氧化应激有关,有利于形成晚期糖基化终产物(AGE),能够通过激活晚期糖基化终产物受体(RAGE)来调节细胞功能。AGE与RAGE的相互作用导致细胞内信号传导,随后黏附分子、趋化因子、促炎细胞因子的表达以及RAGE自身的上调[34]。IL-17是Th17细胞分泌的主要促炎细胞因子,可以诱导组织炎症,参与多种自身免疫性疾病并在严重哮喘的发病机制中起着重要作用[35-36]。肿瘤坏死因子(TNF)是炎症反应中的核心细胞因子,TNF不仅通过诱导炎症基因表达直接驱动炎症反应,还通过诱导细胞死亡、引发炎症免疫反应和疾病发展间接驱动炎症反应[37]。TNF-α通过表达黏附分子参与白细胞与上皮细胞的黏附[38]。王志华等[39]通过临床观察发现麻杏石甘汤治疗儿童MPP疗效显著(P < 0.05),且对IL-17、TNF-α起到免疫调节作用。Du等[40]通过实验研究发现N5P可能通过HIF-1α等信号通路缓解急性肺损伤的炎症反应。通过产生HIF-1α,进而抑制NF-κB的表达来下调炎症因子TNF-α、IL-6、IL-8的表达,减轻炎症反应。有研究发现麻杏石甘汤除去麻黄上沫的煎煮法可以通过降低小鼠支气管肺泡灌洗液中MUC5AC、肺组织匀浆HIF-1α浓度来降低支气管哮喘气道黏液高分泌和改善急性低氧环境。以上说明麻杏石甘汤通过多条信号通路,多途径发挥“异病同治”MPP及BA的治疗作用。
分子对接结果显示配体与受体的结合能均为负值,且 < -5.0 kcal/mol,表明核心成分与关键靶点之间以氢键连接形成了稳定的构象,具有较好的结合活性。其中PTGS2-豆甾醇、IL-1β-豆甾醇、TNF-α-豆甾醇、TP53-木犀草素之间的结合能均 < -8.0 kcal/mol,两者之间结合更加稳定。初步验证了麻杏石甘汤的核心成分与MPP及BA的关键蛋白稳定结合可能是其发挥共同治疗作用的机制所在。
综上所述,通过网络药理学和分子对接分析验证了麻杏石甘汤中的槲皮素、山柰酚、柚皮素、木犀草素、豆甾醇等活性成分可能通过AGE-RAGE、IL-17、TNF、HIF-1等信号通路作用于TNF、TP53、IL-6、IL-1β、PTGS2等靶点发挥调节免疫功能、抑制炎症反应减少肺损伤等作用。预测结果与既往的部分临床试验与基础实验基本一致,表明麻杏石甘汤通过多成分、多靶点、多途径治疗MPP与BA,两者之间的机制存在一定联系。但由于仅从TCMSP数据库收集麻杏石甘汤的有效成分、从GeneCards、OMIM数据库筛选MPP与BA的潜在靶点及关键词的选取,可能存在信息不全使研究结果具有一定的局限性,后期需要检索更多数据库及结合液质联用(LC-MS)技术对麻杏石甘汤有效成分进行补充完善。另外研究了药物的主要成分,其他尚不明确没有靶点的化合物是否起到了治疗效果还有待深入研究探索;同时需要相关动物实验及临床试验进行验证,以期为临床“异病同治”提供参考依据。
| [1] |
YAN C, SUN H M, ZHAO H Q. Latest surveillance data on mycoplasma pneumoniae infections in children, suggesting a new epidemic occurring in Beijing[J]. Journal of Clinical Microbiology, 2016, 54(5): 1400-1401. DOI:10.1128/JCM.00184-16 |
| [2] |
谭丹, 姜之炎. 中医药治疗儿童肺炎支原体肺炎的机制研究进展[J]. 中华中医药学刊, 2018, 36(6): 1403-1406. TAN D, JIANG Z Y. Mechanisms of Chinese medicine for treating mycoplasma pneumoniae pneumonia in children[J]. Chinese Archives of Traditional Chinese Medicine, 2018, 36(6): 1403-1406. DOI:10.13193/j.issn.1673-7717.2018.06.030 |
| [3] |
中华医学会呼吸病学分会哮喘学组. 支气管哮喘防治指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(12): 1023-1048. Asthmatics Group, Division of Respirology, Chinese Medical Association. Guidelines for bronchial asthma prevent and management (2020 edition) asthma group of Chinese throacic society[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2020, 43(12): 1023-1048. DOI:10.3760/cma.j.cn112147-20200618-00721 |
| [4] |
NUNES C, PEREIRA A M, MORAIS-ALMEIDA M. Asthma costs and social impact[J]. Asthma Research and Practice, 2017, 3(1): 1. DOI:10.1186/s40733-016-0029-3 |
| [5] |
张合雷, 申晓华, 蔡萱, 等. 中医药治疗支气管哮喘的研究进展[J]. 西部中医药, 2021, 34(12): 155-158. ZHANG H L, SHEN X H, CAI X, et al. Research progress on treating bronchial asthma with traditional Chinese medicine[J]. Western Journal of Traditional Chinese Medicine, 2021, 34(12): 155-158. |
| [6] |
WU J, TANG F, ZHANG X Q, et al. Application of Jiawei Maxing Shigan Decoction in the treatment of COVID-19:an observational study[J]. Frontiers in Medicine, 2022, 9: 1028171. DOI:10.3389/fmed.2022.1028171 |
| [7] |
屈云飞, 方伟, 靳云洲, 等. 麻杏石甘汤加减联合西医常规治疗普通型新型冠状病毒肺炎40例[J]. 河南中医, 2020, 40(5): 666-669. QU Y F, FANG W, JIN Y Z, et al. Forty cases of common COVID-19 treated with Modified Maxing Shigan Decoction combined with Western medicine routine treatment[J]. Henan Traditional Chinese Medicine, 2020, 40(5): 666-669. DOI:10.16367/j.issn.1003-5028.2020.05.0167 |
| [8] |
张云, 杨卉, 何轩辉, 等. 麻杏石甘汤治疗新冠肺炎细胞因子风暴的网络药理学分析[J]. 世界中医药, 2020, 15(13): 1908-1913. ZHANG Y, YANG H, HE X H, et al. The curative mechanism of Maxing Shigan Decoction on cytokine storm of COVID-19 based on network pharmacology[J]. World Chinese Medicine, 2020, 15(13): 1908-1913. |
| [9] |
李桂凌, 郑婷婷, 李立佳. 麻杏石甘汤联合阿奇霉素治疗小儿肺炎支原体肺炎的临床观察[J]. 中华中医药学刊, 2021, 39(9): 73-75. LI G L, ZHENG T T, LI L J. Clinical observation and analysis of Maxing Shigan Decoction combined with azithromycin in treatment of pediatric mycoplasma pneumonia[J]. Chinese Archives of Traditional Chinese Medicine, 2021, 39(9): 73-75. DOI:10.13193/j.issn.1673-7717.2021.09.019 |
| [10] |
徐朝晖, 沈熔. 麻杏石甘汤加味联合阿奇霉素对肺炎支原体肺炎患儿血清C反应蛋白及临床疗效的影响[J]. 世界中医药, 2019, 14(12): 3257-3259, 3264. XU Z H, SHEN R. Comparative study on Maxing Shigan Decoction combined with azithromycin on serum C-reactive protein in children with mycoplasma pneumoniae pneumonia and its clinical efficacy[J]. World Chinese Medicine, 2019, 14(12): 3257-3259, 3264. DOI:10.3969/j.issn.1673-7202.2019.12.034 |
| [11] |
蔡成思, 王爱敏, 方芳, 等. 麻杏石甘汤加减联合孟鲁司特钠治疗儿童支气管哮喘的临床疗效[J]. 中华中医药学刊, 2020, 38(10): 255-258. CAI C S, WANG A M, FANG F, et al. Clinical efficacy of modified Maxing Shigan Decoction combined with montelukast sodium in children with bronchial asthma[J]. Chinese Archives of Traditional Chinese Medicine, 2020, 38(10): 255-258. |
| [12] |
马静维, 宫振华. 麻杏石甘汤加减结合常规疗法治疗邪热壅肺证支气管哮喘急性发作期的临床研究[J]. 天津中医药, 2019, 36(2): 148-152. MA J W, GONG Z H. Clinical research on treating acute bronchial asthma of evil heat obstructing lung with Maxing Shigan Decoction combined with conventional therapy[J]. Tianjin Journal of Traditional Chinese Medicine, 2019, 36(2): 148-152. |
| [13] |
刘志华, 孙晓波. 网络药理学: 中医药现代化的新机遇[J]. 药学学报, 2012, 47(6): 696-703. LIU Z H, SUN X B. Network pharmacology: new opportunity for the modernization of traditional Chinese medicine[J]. Acta Pharmaceutica Sinica, 2012, 47(6): 696-703. |
| [14] |
HUANG C, YANG Y, CHEN X T, et al. Large-scale cross-species chemogenomic platform proposes a new drug discovery strategy of veterinary drug from herbal medicines[J]. PLoS One, 2017, 12(9): e0184880. DOI:10.1371/journal.pone.0184880 |
| [15] |
赖思佳, 王达洋, 李天力, 等. 基于分子对接和网络药理学的五指毛桃-贯叶金丝桃治疗微血管性心绞痛的机制研究[J]. 中国中药杂志, 2021, 46(24): 6474-6483. LAI S J, WANG D Y, LI T L, et al. Mechanism of Ficus hirta-hypericum perforatum in treatment of microvascular angina based on network pharmacology and molecular docking[J]. China Journal of Chinese Materia Medica, 2021, 46(24): 6474-6483. |
| [16] |
柳云霞, 韩志英. 支气管哮喘与肺炎支原体关系的研究新进展[J]. 国际呼吸杂志, 2019, 39(22): 1756-1760. LIU Y X, HAN Z Y. New progress in the study of the relationship between asthma and mycoplasma pneumoniae[J]. International Journal of Respiration, 2019, 39(22): 1756-1760. |
| [17] |
唐文祥, 李淼. 肺炎支原体参与支气管哮喘发病机制的研究进展[J]. 国际儿科学杂志, 2021, 48(7): 478-482. TANG W X, LI M. Progress on mycoplasma pneumoniae in the pathogenesis of asthma[J]. International Journal of Pediatrics, 2021, 48(7): 478-482. |
| [18] |
许玲芬, 李英兰, 王佳斌, 等. 基于TLR4-NF-κB通路槲皮素对病毒性呼吸道感染小鼠免疫功能的影响及抑炎作用研究[J/OL]. 中药药理与临床, (2023-01-09)[2023-01-09]. https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0n9fL2suRadTyEVl2pW9UrhTDCdPD65LAyGDX49vZou4mqsWSbexRS4ur3jVRYFmI23Sa09Yy4BcZTXnmQaK&uniplatform=NZKPT. XU L F, LI Y L, WANG J B, et al. Quercetin improves immune function and alleviates inflammation in mice with viral respiratory tract infection via TLR4/NF-κB signaling pathway[J/OL]. Pharmacology and Clinics of Chinese Materia Medica, (2023-01-09)[2023-01-09]. https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C45S0n9fL2suRadTyEVl2pW9UrhTDCdPD65LAyGDX49vZou4mqsWSbexRS4ur3jVRYFmI23Sa09Yy4BcZTXnmQaK&uniplatform=NZKPT. |
| [19] |
李昕, 刘佳佳, 何浩, 等. 槲皮素对LPS诱导的中性粒细胞产生白细胞介素6的影响[J]. 免疫学杂志, 2006, 22(1): 40-42, 46. LI X, LIU J J, HE H, et al. Inhibitory effects of quercetin on LPS-stimulated IL-6 production by neutrophils[J]. Immunological Journal, 2006, 22(1): 40-42, 46. |
| [20] |
刘彩虹, 杨红辉, 卢俊娟. 山柰酚减轻慢性阻塞性肺疾病模型小鼠的炎症反应[J]. 中国病理生理杂志, 2021, 37(9): 1655-1661. LIU C H, YANG H H, LU J J. Kaempferol alleviates inflammatory response in chronic obstructive pul-monary disease model mice[J]. Chinese Journal of Pathophysiology, 2021, 37(9): 1655-1661. |
| [21] |
陈倩倩, 王荣丽. 柚皮素对急性肺损伤小鼠保护作用的机制研究[J]. 临床肺科杂志, 2022, 27(5): 711-715. CHEN Q Q, WANG R L. Mechanism of the protective effect of naringenin on mice with acute lung injury[J]. Journal of Clinical Pulmonary Medicine, 2022, 27(5): 711-715. |
| [22] |
王坚迪, 黄迪双, 沈蔚, 等. 柚皮素通过抑制VEGF信号通路改善哮喘大鼠气道损伤和炎症反应[J]. 中国药师, 2022, 25(12): 2131-2136, 2189. WANG J D, HUANG D S, SHEN W, et al. Naringenin alleviates airway damage and inflammation in rats with asthma via inhibiting VEGF signaling pathway[J]. China Pharmacist, 2022, 25(12): 2131-2136, 2189. |
| [23] |
韩宁馨, 孙雅丽, 盛帅, 等. 木犀草素对氧化应激和炎症的调控机制[J]. 动物营养学报, 2022, 34(5): 2856-2861. HAN N X, SUN Y L, SHENG S, et al. Regulatory mechanism of luteolin on oxidative stress and inflammation[J]. Chinese Journal of Animal Nutrition, 2022, 34(5): 2856-2861. |
| [24] |
吴力超, 李俊峰, 张婷婷, 等. 基于网络药理学和细胞实验探讨豆甾醇抗炎作用[J]. 中成药, 2022, 44(2): 609-615. WU L C, LI J F, ZHANG T T, et al. Discussion on anti-inflammatory effect of stigmasterol based on network pharmacology and cell experiment[J]. Chinese Traditional Patent Medicine, 2022, 44(2): 609-615. |
| [25] |
DENG M H, LIN C W, SUN Y N, et al. Role of E-selectin for diagnosing myocardial injury in paediatric patients with Mycoplasma pneumoniae pneumonia[J]. Annals of Clinical Biochemistry, 2017, 54(1): 49-54. |
| [26] |
DOSTERT C, GRUSDAT M, LETELLIER E, et al. The TNF family of ligands and receptors: Communication modules in the immune system and beyond[J]. Physiological Reviews, 2019, 99(1): 115-160. |
| [27] |
UNVER N, MCALLISTER F. IL-6 family cytokines: Key inflammatory mediators as biomarkers and potential therapeutic targets[J]. Cytokine & Growth Factor Reviews, 2018, 41: 10-17. |
| [28] |
曹岩, 刘红, 卢晟晔, 等. 儿童肺炎支原体肺炎血清中TNF-α、IL-6、IL-8和IL-10浓度测定及其临床意义的研究[J]. 中国妇幼保健, 2008, 23(18): 2575-2578. CAO Y, LIU H, LU S Y, et al. Study on the clinical significance of serum TNF-α, IL-6, IL-8 and IL-10 concentration in children patients with mycoplasma pneumonia[J]. Maternal and Child Health Care of China, 2008, 23(18): 2575-2578. |
| [29] |
LOPEZ-CASTEJON G, BROUGH D. Understanding the mechanism of IL-1β secretion[J]. Cytokine & Growth Factor Reviews, 2011, 22(4): 189-195. |
| [30] |
MARC-MALOVRH M, CAMLEK L, ŠKRGAT S, et al. Elevated eosinophils, IL-5 and IL-8 in induced sputum in asthma patients with accelerated FEV1 decline[J]. Respiratory Medicine, 2020, 162: 105875. |
| [31] |
OUYANG W J, RUTZ S, CRELLIN N K, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annual Review of Immunology, 2011, 29: 71-109. |
| [32] |
SARAIVA M, VIEIRA P, O'GARRA A. Biology and therapeutic potential of interleukin-10[J]. The Journal of Experimental Medicine, 2020, 217(1): e20190418. |
| [33] |
边红恩, 陈团营, 单海军. 麻杏石甘汤联合阿奇霉素对小儿支原体肺炎患者抗炎、促炎因子及免疫功能的影响[J]. 中国实验方剂学杂志, 2017, 23(22): 177-181. BIAN H E, CHEN T Y, SHAN H J. Effect of Maxing Shigan Decoction combined with azithromycin on anti-inflammatory, pro-inflammatory cytokines and immune function of mycoplasma pneumonia children[J]. China Industrial Economics, 2017, 23(22): 177-181. |
| [34] |
NIENHUIS H L A, WESTRA J, SMIT A J, et al. AGE and their receptor RAGE in systemic autoimmune diseases: an inflammation propagating factor contributing to accelerated atherosclerosis[J]. Autoimmunity, 2009, 42(4): 302-304. |
| [35] |
ZHANG Z R, TANG Z, MA X W, et al. TAOK1 negatively regulates IL-17-mediated signaling and inflammation[J]. Cellular & Molecular Immunology, 2018, 15(8): 794-802. |
| [36] |
WANG W J, LI Y, FAN J Q, et al. miR-365-3p is a negative regulator in IL-17-mediated asthmatic inflammation[J]. Frontiers in Immunology, 2022, 13: 953714. |
| [37] |
VAN LOO G, BERTRAND M J M. Death by TNF: a road to inflammation[J]. Nature Reviews Immunology, 2023, 23(5): 289-303. |
| [38] |
ZELOVÁ H, HOŠEK J. TNF-α signalling and inflammation: interactions between old acquaintances[J]. Inflammation Research, 2013, 62(7): 641-651. |
| [39] |
王志华, 孙健, 刘艳, 等. 麻杏石甘汤对儿童肺炎支原体肺炎血清IL-17、TNF-α的影响[J]. 天津中医药, 2018, 35(6): 419-421. WANG Z H, SUN J, LIU Y, et al. Effect of Maxing Shigan Decoction on the IL-17 and TNF-α in children with mycoplasma pneumoniae pneumonia[J]. Tianjin Journal of Traditional Chinese Medicine, 2018, 35(6): 419-421. |
| [40] |
DU N, LIN H M, ZHANG A Q, et al. N-phenethyl-5-phenylpicolinamide alleviates inflammation in acute lung injury by inhibiting HIF-1α/glycolysis/ASIC1a pathway[J]. Life Sciences, 2022, 309: 120987. |
2. National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300193, China
 2023, Vol. 40
2023, Vol. 40