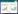文章信息
- 罗西, 安子正, 周雯, 等.
- LUO Xi, AN Zizheng, ZHOU Wen, et al.
- 水飞蓟宾丹酚酸衍生物的制备及成药性研究
- Preparation and pharmaceutical properties research of silybin phenolate derivatives
- 天津中医药, 2023, 40(7): 925-933
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(7): 925-933
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.07.18
-
文章历史
- 收稿日期: 2023-03-12
2. 天津药物研究院新药评价中心,天津 300301;
3. 天津医科大学药学院,天津市临床药物关键技术重点实验室,天津 300070;
4. 天津市河东区大王庄街社区卫生服务中心药剂科,天津 300171
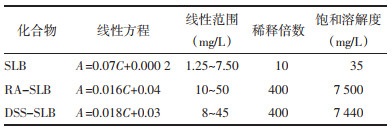
肝纤维化是大多数慢性肝病所共有的病理特征,也是慢性肝炎肝硬化等进一步发展、恶化的重要中间环节[1]。中医认为“血瘀”为肝纤维化基本的病理变化,活血化瘀、养血安神,是肝纤维化治疗中运用药物及方剂最多的一种治法[2],代表药物如丹参注射液、血府逐瘀汤等。水飞蓟宾(SLB),具有抗氧自由基、抗过氧化、保护肝细胞膜、抗肝纤维化等作用,从而提高肝脏的解毒能力,保护肝脏[3]。稳定的水飞蓟宾结构见图 1[4]。临床上有将SLB和丹参制剂,如复方丹参滴丸、复方丹参注射液等,联合用于治疗慢性肝炎和肝纤维化等疾病,疗效显著[3]。但是值得注意的是,由于SLB微溶于水,在水中的溶解速度慢,并且SLB为脂不溶性药物,在大鼠肠道上皮细胞中渗透不良,胃肠道吸收差[5],生物利用度低,从而影响了临床疗效。丹酚酸类成分同样也具有稳定性差、生物利用度低等缺点。也有研究者采用多种促吸收技术以期增加SLB的治疗效果等[6],不过这些技术仅仅增加了SLB在水中的溶解性,但是否对药效学产生影响,尚缺少研究数据。
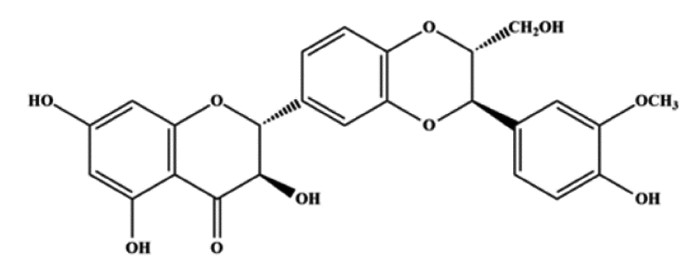
|
| 图 1 SLB化学结构式 Fig. 1 Chemical structural formula of silybin |
研究按照孪药设计的原理,将SLB分别与丹酚酸类化合物[7-8],如药材中含量较高的迷迭香酸(RA)和丹参素(DSS)等,通过酯化反应依次得到水飞蓟宾迷迭香酸酯(RA-SLB)和水飞蓟宾丹参素酯(DSS-SLB)等水飞蓟宾丹酚酸酯衍生物。由于RA能显著降低小鼠血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)活性、三酰甘油(TG)含量以及肝匀浆丙二醛(MDA)含量,对肝质量增大有抑制作用,使肝组织变性明显减轻[9]。DSS通过降低肠源性内毒素水平改善肝脏微循环障碍,从而减轻急性重型肝损伤[10]。水飞蓟宾丹酚酸酯衍生物通过体内的水解酶作用可以代谢出的两种原型药物共同作用,达到多靶点协同起效的目的[11]。
1 实验材料 1.1 仪器安捷伦1260-DAD(安捷伦科技有限公司);岛津UV-3600i Plus紫外分光光度计(岛津仪器公司);Bruker 400MHz核磁共振仪(布鲁克仪器公司);AB Sciex X500R型LC-Q-TOF/MS质谱仪(AB仪器公司);Shimadzu LC-30A液相色谱系统与AB5500型液质联用仪(AB仪器公司);Mettler XS205DU十万分之一电子分析天平(梅特勒托利多)。
1.2 试剂与药物水飞蓟宾购自江苏天士力帝益药业有限公司,批号H20210608,含量98%;迷迭香酸购自北京建强伟业科技有限公司,批号256775,含量96%,丹参素购自北京建强伟业科技有限公司,批号178497,含量95%。
1.3 动物SPF级雄性ICR小鼠,体质量(20±2)g;雄性Wistar大鼠,体质量(260±20)g;北京维通利华实验动物技术有限公司提供,许可证号SCXK(京)2021-0006。本实验经天津药物研究院新药评价中心动物伦理委员会批准,审批编号IACUC 2022011102。
2 实验方法 2.1 水飞蓟宾丹酚酸酯衍生物的制备氮气保护下,向干燥的反应瓶中,依次加入SLB 16.0 g(33.3 mmol)、RA 10.0 g(27.7 mmol)、碳二亚胺6.9 g和羟基苯并三唑4.9 g,用200 mL N,N-二甲基甲酰胺溶解,缓慢滴加三乙胺8 g,室温搅拌48 h。停止反应后,将反应液倾入500 mL冰水中,析出大量固体,固体抽滤干燥后经硅胶柱层析(洗脱剂为正己烷/甲醇=40/1)纯化两次得到RA-SLB,黄色固体,4.5 g,产率25%。工艺路线见图 2。
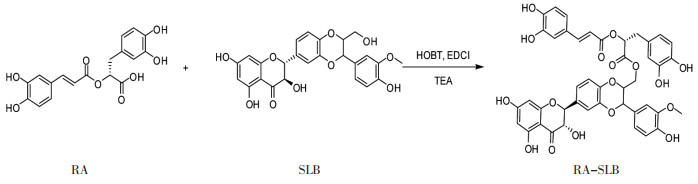
|
| 图 2 RA-SLB合成路线 Fig. 2 Synthetic route of RA-SLB |
同上相似的制备方法,得到DSS-SLB,黄色固体,5.2 g,产率26%。工艺路线见图 3。
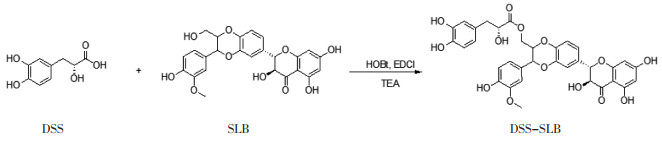
|
| 图 3 DSS-SLB合成路线 Fig. 3 Synthetic route of DSS-SLB |
上述所得两种物质分别进行氢谱、碳谱和高分辨质谱结构确证。
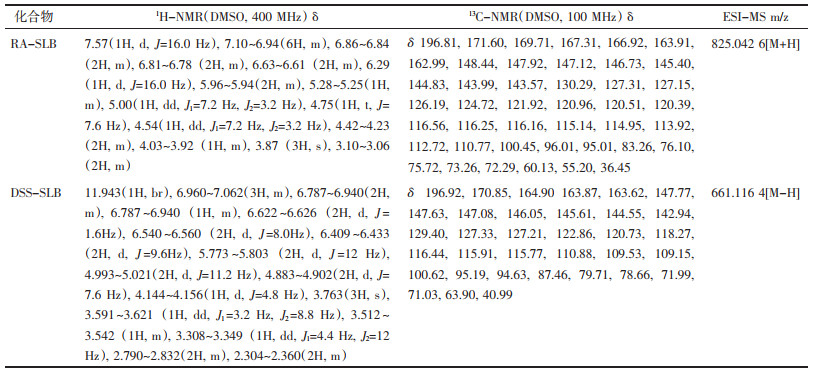
2.2 水飞蓟宾丹酚酸酯类衍生物的溶解度在25 ℃下,分别将SLB、RA-SLB和DSS-SLB制备一系列浓度(C)的水溶液,在280 nm波长处测定吸光度值(A),以浓度为横坐标,吸收值为纵坐标,绘制标准曲线。然后分别制备过饱和水溶液,静置24 h,用0.22 μm滤膜过滤,取滤液稀释合适的倍数,测定吸光度值,计算浓度。
2.3 SLB衍生物的稳定性采用高效液相色谱仪对SLB、RA-SLB和DSS-SLB水溶液中的稳定性进行考察。
2.3.1 供试品溶液制备分别精密称取SLB、RA-SLB和DSS-SLB各适量,用水制备成每1 mL中各约含0.1 mg的溶液。各溶液分别在0、2、8、12、24、36、48、60、72 h取10 μL依次进行分析,记录分析各峰面积。
2.3.2 色谱条件色谱柱:Agilent TC-18(150 mm×4.6 mm,5 μm);流动相:乙腈-水(含0.1%甲酸,5 mmol/L甲酸铵)=70∶30(V/V);流速:1.0 mL/min,检测波长:288 nm。
2.4 对刀兰球蛋白(ConA)引起急性免疫性肝损伤的保护实验SPF级雄性ICR小鼠,体质量(20±2)g,适应环境后随机分为11组,空白对照组,乙硫氨酸模型组,阳性对照药双环醇组(200 mg/kg),SLB组(226 mg/kg),RA组(206 mg/kg),DSS-SLB组(307 mg/kg),DSS(307 mg/kg),RA-SLB组剂量分别为(150、212、307、453 mg/kg),每组动物10只。受试物组于造模前10 d开始灌胃给药,每日给药1次,共给药10 d,双环醇组于造模前1日的下午,造模当日的上、下午各灌胃给药1次,空白对照组及乙硫氨酸模型组动物给予相同量的0.5%羧甲基纤维素钠。于末次给药后2 h,除空白对照组,各组小鼠尾静脉注射20 mg/kg ConA 1次。小鼠禁食不禁水16 h后,处死小鼠,取血制备血清,全自动生化分析仪检测检测ALT、AST、LDH含量,10%甲醛固定肝大叶。
2.5 对DL-乙硫氨酸诱导小鼠脂肪肝的保护实验[12]ICR小鼠,适应环境后随机分为11组,分别为空白对照组,乙硫氨酸模型组,SLB组(226 mg/kg)、RA组(206 mg/kg)、DSS-SLB组(307 mg/kg)、DSS组(307 mg/kg)、RA-SLB组剂量分别为(77.0、150、212、307 mg/kg)及双环醇组(200 mg/kg),每组10~11只动物。受试物组于造模前9 d开始灌胃给药,每日给药1次,共给药9 d。双环醇组于造模前1日的下午,造模当天的上、下午各灌胃给药1次。空白对照组及乙硫氨酸模型组动物给予相同量的0.5%羧甲基纤维素钠。于末次给药后2 h,除空白对照组,各组小鼠腹腔注射250 mg/kg乙硫氨酸1次(给药量20 mL/kg)。动物正常喂养,24 h后,处理动物。
肝指数的测定:肝脏指数(%)=100×肝脏质量(g)/体质量(g)。
生化指标测定:小鼠断头取血,血液样本静置1~1.5 h,置于半径为13.5 cm台式离心机中以4 000 r/min离心10 min,分离血清,全自动生化分析仪检测血清中ALT、AST、TG、TC含量。开胸取肝脏,用4 ℃生理盐水冲洗,剪取小块肝组织,制备成10%肝组织匀浆,4 ℃ 3 500 r/min离心15 min,取上清液,测定肝组织内TG含量。
形态学观察:取相同部位肝大叶标本,甲醛固定,冰冻切片,进行油红O脂肪染色,光镜检查肝脏病理状态并照相。
2.6 大鼠体内药代动力学实验 2.6.1 给药方案考察RA-SLB在大鼠体内药代动力学特征,同时SLB、RA联合给药后在大鼠体内药动学特征进行对比。10只雄性Wistar大鼠,实验前随机均分为A、B两组并禁食12 h。A组按SLB 100 mg/kg(0.207 mmol/L/kg),同时RA 74 mg/kg(0.205 mmol/L/kg)灌胃给药,B组按照SLB-RA 170 mg/kg [0.206 mmol/(L·kg)]灌胃给药,即两组药物采取等摩尔给药方式。
2.6.2 血浆采集A、B两组给药后,采集5、15、30 min和1、1.5、2、3、4、6、8、12 h的血样,置于半径为13.5 cm(下同)离心机中3 500 r/min下离心15 min,分离血浆,将血浆置于-20 ℃冰箱中保存备用。
2.6.3 血浆样本处理方法向50 μL血浆(或空白血浆)中加入50 μL甲醇和100 μL内标溶液(10 mg/L),涡旋1 min后12 000 r/min离心10 min,取上清液110 μL置于内插管中,4 ℃ 12 000 r/min离心10 min,进样10 μL进行分析,记录分析结果。
2.6.4 色谱条件色谱柱:Agilent Zorbax-XDB C18柱(2.1 mm×50 mm,3.5 μm);流动相:0.1 %甲酸-水:0.1%甲酸-乙腈;流速:0.5 mL/min;柱温:室温;进样量:10 μL。
2.6.5 质谱条件ESI源负离子检测模式;卷帘气:15 psi;碰撞气:6 psi;喷雾电压:-8 000 V;源温度:450 ℃;Gas1:50 psi;Gas2:80 psi;入口电压:10 V;碰撞出口电压:10 V;离子扫描模式为SIM,水飞蓟宾检测离子为m/z 481.121 9,RA-SLB检测离子为m/z 824.042 5,DSS-SLB检测离子为660.114 5。
2.6.6 统计学处理主要药动学参数Cmax和tmax均为实测值表示,AUC0→t以梯形法计算。数据以均数±标准差(x±s)表示。组间比较采用单因素方差分析,组间两两比较采用SNK法,以P < 0.05表示差异有统计学意义。
3 结果 3.1 水飞蓟宾丹酚酸酯衍生物波谱数据RA-SLB和DSS-SLB的氢谱、碳谱及质谱数据见表 1,证明制备的两个目标化合物均与预期结构一致。
水飞蓟宾丹酚酸酯衍生物溶解度结果见表 2。从结果可以看出,SLB在与丹酚酸类化合物衍生后,溶解度明显得到改善。
水飞蓟宾丹酚酸酯衍生物水溶液稳定性结果见图 4。从结果可以看出,SLB衍生物的水溶液稳定性良好。
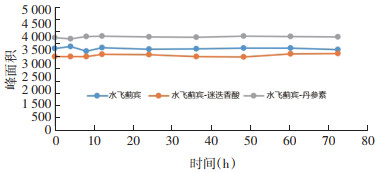
|
| 图 4 水飞蓟宾丹酚酸酯衍生物稳定性 Fig. 4 Stability of silybin salvianolate derivatives |
血清ALT、AST是肝损伤生物标记物,其含量与肝损伤程度成正比,血清LDH含量也能反应肝损伤的水平,因此以血清ALT、AST、LDH含量为判断肝损伤状况的指标,结果见表 3。
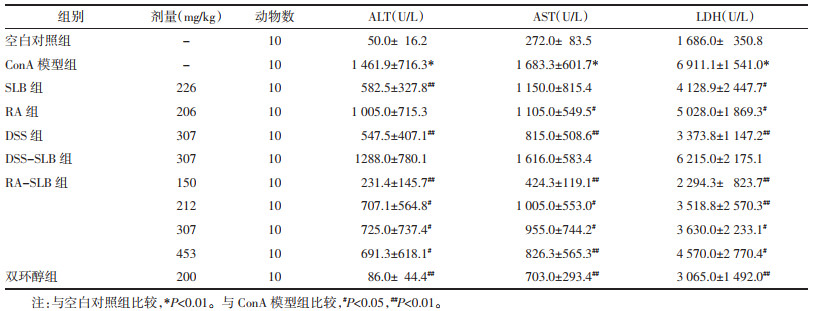
|
ConA能引起小鼠急性肝损伤,血清ALT、AST、LDH含量较空白对照组显著升高。各给药组对ConA引起的免疫性肝损伤均有一定的抑制活性,其中SLB能显著降低血清ALT水平,RA能显著血清AST水平,DSS对ALT、AST及LDH均有显著降低活性。DSS-SLB组对刀兰球蛋白引起的肝损伤在本实验方案有改善肝功能的趋势,但与模型组比较差异无统计学意义。
RA-SLB 4个剂量组均能抑制ConA引起的肝损伤,但未显示良好量效关系,低剂量150 mg/kg组活性最优,对血清ALT、AST、LDH含量升高均有显著降低作用,307 mg/kg组显著降低血清LDH含量,453 mg/kg组显著降低血清AST和LDH含量,对ALT亦有明显降低作用。阳性对照药双环醇对ConA引起肝损伤显示显著抑制活性。
3.4.2 病理检查结果苏木精-伊红(HE)染色结果显示,与空白对照组比较,ConA模型组动物肝细胞局灶性坏死,胞浆着色呈浅粉红色,胞浆空虚,胞膜薄,胞核多崩解,碎裂或降解,呈液化性坏死。同时可见肝细胞呈凋亡样坏死,肝细胞固缩、胞浆深、红染、胞核固缩,有的可见凋亡小体。所有标本均可见门静脉内白细胞聚集,白细胞黏附血管内壁,内皮细胞脱落坏死,并可见汇管区炎细胞浸润,见图 5。

|
| 图 5 各受试物给药组动物肝组织病理代表性照片(HE,×200) Fig. 5 Representative photos of liver tissue pathology of animals in each test substance administration group (HE, ×200) |
ConA诱发的为免疫性肝损伤,在抑制炎症浸润方面,RA-SLB 150、212、453 mg/kg组均表现显著的活性,分别仅有30.0%、77.8%和50.0%的动物肝脏组织出现轻度肝间质炎症浸润,而模型组动物100.0%存在肝间质炎症浸润。SLB 226 mg/kg、RA 206 mg/kg和DSS-SLB 307 mg/kg给药组对ConA引起的肝组织内炎症浸润均有一定的抑制作用,能减轻炎症程度。阳性对照药双环醇对ConA引起的肝组织病理损伤有一定的改善作用,见表 4。

|
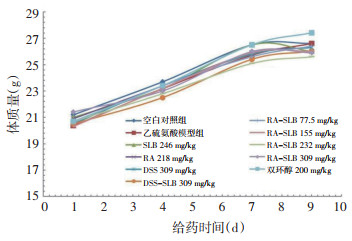
在乙硫氨酸诱导的小鼠脂肪肝模型,RA-SLB组155、232、309 mg/kg各剂量组连续给药9 d,动物体质量较模型组有降低趋势,其中232 mg/kg组动物体质量与模型组比较有统计学差异。其他各受试物连续给药9 d,动物体质量无降低或仅有弱的降低趋势,与模型组比较差异无统计学意义。各组动物状态均良好,无动物死亡。结果见图 6。
|
| 图 6 在乙硫氨酸诱导脂肪肝小鼠模型各受试物连续给药9 d对动物体质量的影响(n=10) Fig. 6 Effect of each test substance on the body weight of mice with ethionine induced fatty liver after continuous administration for 9 days (n=10) |
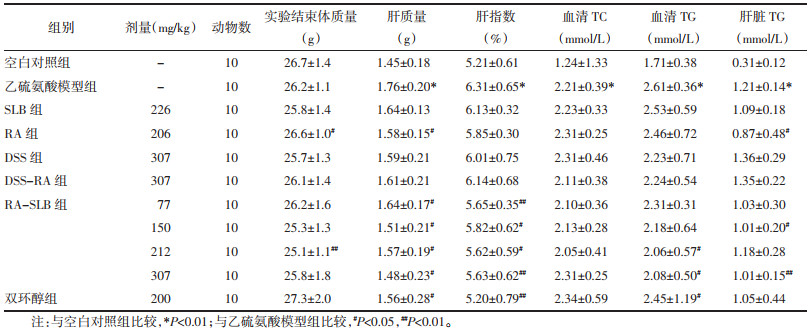
从肝质量及肝指数指标来看,乙硫氨酸模型组动物肝质量显著升高,肝指数亦显著升高,与空白对照组比较均有统计学差异。各受试物给药组均能降低肝指数,减轻肝脏质量,RA-SLB 4个剂量组均能显著降低肝指数,显著减轻肝质量,与模型组比较差异有统计学意义。RA-SLB各剂量组与迷迭香酸组比较作用相对更优。双环醇200 mg/kg有增加肝质量的作用,与在其他研究中的结果一致。见表 5。
|
从血清生化指标来看,乙硫氨酸诱发小鼠急性脂肪肝,乙硫氨酸模型组血清TG、TC及肝组织TG含量较空白对照组均显著升高,血清ALT、AST含量无明显变化。RA-SLB组212、307 mg/kg剂量组能显著降低血清中的TG含量;RA-SLB组150、307 mg/kg剂量组能显著降低肝组织中的TG含量,与模型组比较有统计学差异。其他各受试物给药组对血清TG含量和肝脏TG含量的升高无显著影响。阳性对照药双环醇对乙硫氨酸引起的血脂增加和肝脂增加无改善作用。
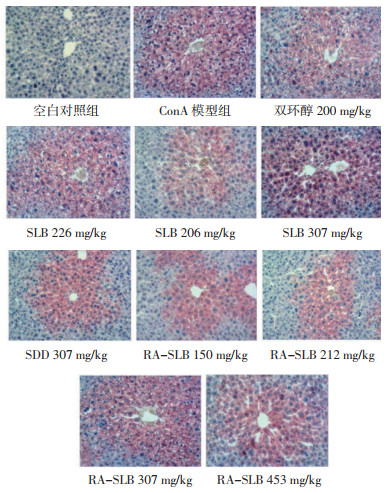
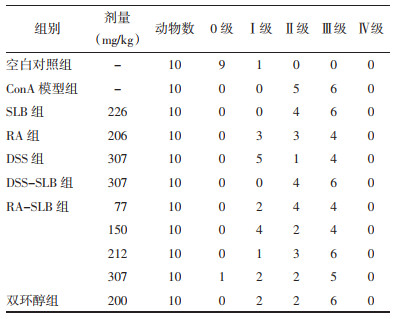
3.5.3 病理检查结果空白对照组动物肝组织标本有1例在中央静脉附近肝细胞胞浆内出现散在的少量油红O染色阳性细胞,其他标本均未见油红O染色。乙硫氨酸模型组11例肝组织标本均发生脂肪变性,油红O染色均为阳性,其中有5例脂肪变性达到Ⅱ级,6例脂肪变性达到Ⅲ级。RA-SLB组77、150、212和307 mg/kg组均能降低肝脏脂肪的病变程度,其中307 mg/kg组有1只动物未发现油红O染色阳性细胞。SLB 226 mg/kg、DSS-SLB 307 mg/kg给药组对乙硫氨酸诱导肝组织脂肪变性的改善作用不显著。阳性对照药双环醇仅有弱的改善作用。见图 7、表 6。
|
| 图 7 各受试物给药组动物肝组织病理代表性照片(油红O染色) Fig. 7 Representative photos of liver tissue pathology of animals in each test substance administration group (Oil Red O staining solution) |
| 只 | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
分析方法的专属性、灵敏度、线性和范围、精密度、准确度、耐用性及溶液稳定性均满足方法验证可接受标准。
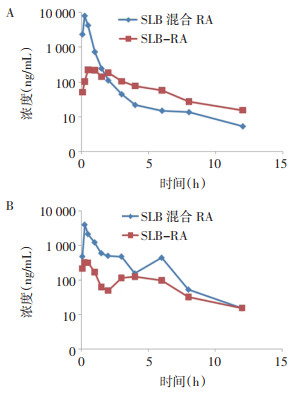
3.6.2 药代动力学参数评价1组大鼠SLB、RA联合给药(蓝色)和1组大鼠SLB-RA单独给药(红色)后,血浆中SLB浓度-时间曲线见图 8A。1组大鼠SLB、RA联合给药(蓝色)和1组大鼠SLB-RA单独给药(红色)后,血浆中RA的浓度-时间曲线见图 8B,5、15、30 min和1、1.5、2、3、4、6、8、12 h取血样检测。
|
| 注:A.血浆中SLB浓度-时间曲线;B.血浆中RA的浓度-时间曲线。 图 8 两组大鼠给药后SLB和RA的平均药-时曲线(n=10) Fig. 8 Mean drug time curve of silybin and rosmarinic acid in rats of two groups after administration (n=10) |
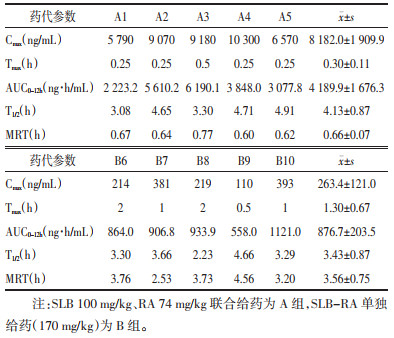
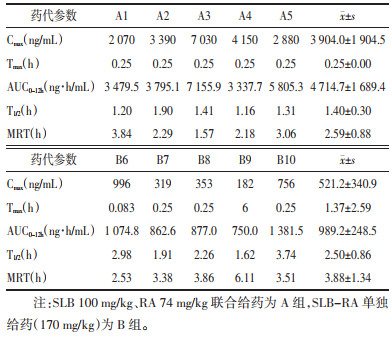
两组大鼠分别给药后,测定SLB、RA的主要药动学参数,经DAS 3.0药动学软件计算得到结果,见表 7、8。结果显示,给药前后统计结果差异无统计学意义。
|
|
本研究将水溶性差和体内吸收慢的SLB分别与丹参活性成分RA和DSS,采用酯化反应依次得到RA-SLB和DSS-SLB,并通过质谱和核磁谱对其结果进行确证。在水溶液中,RA-SLB和DSS-SLB的溶解度均比先导化合物水飞蓟宾提高了200倍。采用高效液相色谱的方法对水飞蓟宾衍生物在水中的稳定性进行了考察,实验结果表明,在70 h内SLB衍生物的水溶液稳定性良好。
本研究的药效学实验中,RA-SLB在免疫性肝损伤模型中,低剂量150 mg/kg组活性最优,对血清ALT、AST、LDH含量升高均有显著降低作用,307 mg/kg组显著降低血清LDH含量,453 mg/kg组显著降低血清AST和LDH含量,对ALT亦有明显降低作用。抑制炎症浸润方面,150、212、453 mg/kg组均表现显著的活性,分别仅有30.0%、77.8%和50.0%的动物肝脏组织出现轻度肝间质炎症浸润。RA-SLB在DL-乙硫氨酸诱导的脂肪肝模型中,RA-SLB的4个剂量77、150、212、307 mg/kg组均能显著降低肝指数,显著减轻肝质量。212 mg/kg组、307 mg/kg组能显著降低血清中的TG含量;150 mg/kg组和307 mg/kg组能显著降低肝组织中的TG含量。降低肝脏脂肪的病变程度方面,77、150、212、307 mg/kg组均能降低肝脏脂肪的病变程度。与单体SLB和RA相比,显示出优效的特点,明显降低肝酶活性,抑制肝组织内炎性浸润,改善肝损伤;降低肝脏器指数,改善血清生化指标,抑制肝脏脂肪化进程。
本研究药代动力学实验中,RA-SLB前药灌胃给药后可以快速吸收入血,部分代谢为SLB和RA两个原型药物协同起效,实现了孪药的设计理念;由于前药本身存在各种代谢途径,体内代谢过程中体现了优于SLB的特点。增加了药物的水溶性,有利于增加体内药物吸收;前药给药较两种原型药物在大鼠体内的药物暴露量下降数倍,前药物的达峰时间明显延长4~5倍,比迷迭香酸的半衰期延长1倍,有利于保持体内有效药物浓度,扩大治疗时间窗;另外,前药物兼具两单体药物特性,可以独立起效,可以增加治疗靶点,相对减少服药量,增加用药安全性,具有良好的开发前景。后续将结合药效学结果对该前药进行系统的成药性评价,以推动其尽快进入新药临床前开发。
| [1] |
水飞蓟制剂肝病临床应用专家委员会. 水飞蓟制剂肝病临床应用专家共识[J]. 中国肝脏病杂志(电子版), 2016, 8(3): 5-9. Committee of Experts on Silymarin Therapy in Patients with Liver Diseases. Experts consensus on silymarin therapy in patients with liver diseases[J]. Chinese Journal of Liver Diseases (Electronic Version), 2016, 8(3): 5-9. |
| [2] |
ZHENG Y Y, WANG M, ZHENG P Y, et al. Systems pharmacology-based exploration reveals mechanisms of anti-steatotic effects of Jiangzhi Granule on non-alcoholic fatty liver disease[J]. Scientific Reports, 2018, 8: 13681. DOI:10.1038/s41598-018-31708-8 |
| [3] |
孙东, 胡仕琦, 王宇明. 水飞蓟药理作用及其在肝病中的临床应用[J]. 中国全科医学, 2007, 10(22): 1891-1893. SUN D, HU S Q, WANG Y M. Pharmacological action of Silybum marianum and its clinical application in live diseases[J]. Chinese General Practice, 2007, 10(22): 1891-1893. |
| [4] |
张华丽. 模拟胃肠液中水飞蓟宾的溶解度研究[D]. 苏州: 苏州大学, 2006. ZHANG H L. Study on solubility of silybin in simulated gastrointestinal fluid[D]. Suzhou: Soochow University, 2006. |
| [5] |
XIAO Y Y, SONG Y M, CHEN Z P, et al. The preparation of silybin-phospholipid complex and the study on its pharmacokinetics in rats[J]. International Journal of Pharmaceutics, 2006, 307(1): 77-82. DOI:10.1016/j.ijpharm.2005.10.001 |
| [6] |
闫鹏举, 苏瑾, 王璐璐. 水飞蓟宾的肝保护机制及促吸收技术研究[J]. 中国医药生物技术, 2020, 15(6): 630-634. YAN P J, SU J, WANG L L. Study on liver protection mechanism and absorption-promoting technology of silibinin[J]. Chinese Medicinal Biotechnology, 2020, 15(6): 630-634. |
| [7] |
中华人民共和国卫生部药典委员会. 中国药典[S]. 一部. 北京: 2020: 77. Committee of Pharmacopoeia of The People's Republic of China. Pharmacopoeia of The People's Republic of China[S]. Part Ⅰ. Beijing: 2020: 77. |
| [8] |
许红蕾, 王庭芳, 张川. 丹参素及其衍生物药理作用机制和应用研究进展[J]. 中国现代应用药学, 2021, 38(2): 237-243. XU H L, WANG T F, ZHANG C. Research advances in pharmacological mechanism and application of danshensu and its derivatives[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(2): 237-243. |
| [9] |
王虹, 刘红梅, 王磊. 迷迭香酸对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中成药, 2009, 31(3): 354-358. WANG H, LIU H M, WANG L. Protective effect of rosmarinic acid on acute liver injury induced by carbon tetrachloride in mice[J]. Chinese Traditional Patent Medicine, 2009, 31(3): 354-358. |
| [10] |
周鑫, 韩德五, 尹镭, 等. 丹参素保护肝损伤作用及其作用机制的实验研究[J]. 山西医药杂志, 2006, 35(2): 108-110, 186. ZHOU X, HAN D W, YIN L, et al. Protective role of Danshensu in liver injury rats and its pathogenesis[J]. Shanxi Medical Journal, 2006, 35(2): 108-110, 186. |
| [11] |
巫秀美, 刘光明, 冯玉冰, 等. 水飞蓟宾类黄酮木质素衍生物的研究进展[J]. 国际药学研究杂志, 2010, 37(3): 187-197. WU X M, LIU G M, FENG Y B, et al. Silybin-derived flavonolignans and their structure-activity relationships: research advances[J]. Journal of International Pharmaceutical Research, 2010, 37(3): 187-197. |
| [12] |
齐玉娟, 张靖溥. 硫代乙酰胺诱导的斑马鱼急性肝损伤模型[J]. 药物分析杂志, 2014, 34(5): 782-789. QI Y J, ZHANG J P. A zebrafish model of acute liver injury induced by thioacetamide[J]. Chinese Journal of Pharmaceutical Analysis, 2014, 34(5): 782-789. |
2. TIPR New Drug Evaluation Center, Tianjin 300301, China;
3. School of Pharmacy, Tianjin Medical University, Tianjin Key Laboratory of Technologies Enabling Development of Clinical Therapeutics and Diagnostics, Tianjin 300070, China;
4. Parmacy Department, Tianjin Hedong District Dawangzhuang Street Community Health Service Center, Tianjin 300171, China
 2023, Vol. 40
2023, Vol. 40