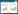文章信息
- 李昱芃, 臧超越.
- LI Yupeng, ZANG Chaoyue.
- 温胆汤对代谢相关脂肪性肝病小鼠脂质代谢的影响
- Effects of Wendan Decoction on lipid metabolism in mice with metabolism-related fatty liver disease
- 天津中医药, 2023, 40(8): 1035-1042
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(8): 1035-1042
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.08.16
-
文章历史
- 收稿日期: 2023-04-18
2. 天津中医药大学第一附属医院, 天津 300381
代谢相关脂肪性肝病(MAFLD)曾经被称为非酒精性脂肪性肝病(NAFLD),据不完全统计,MAFLD是世界肝病患者并发症及死亡的主要原因之一[1-3]。近几十年来,随着生活水平的不断提高,人类生活节奏和饮食习惯发生明显改变,使全球MAFLD的患病率急剧上升[4-5],因此,MAFLD已经成为了全球普遍关注的医学难题。尽管现代医学已经对MAFLD的病因和分子机制进行了相关的研究,证实脂肪沉积可能是MAFLD发病的重要原因[6-7],但目前为止,国家尚无针对MAFLD治疗的有效药物批准上市。随着中医药研究的不断深入和发展,中医治疗MAFLD的潜力和优势表现得越发明显[8-9]。但是,目前中药及其有效成分改善MAFLD脂质代谢的机制研究仍然非常少[10]。而中药复方温胆汤具有理气化痰,清胆和胃的理想功效,并且在临床实践中发现温胆汤可通过降低患者肝功能血清酶和血脂等方法治疗MAFLD[11-12],但对于温胆汤治疗MAFLD的分子药理机制仍然未知,故在前期研究的基础上,结合动物和分子生物学实验,深入探究温胆汤对MAFLD小鼠脂质代谢的影响。
1 材料与方法 1.1 实验材料 1.1.1 实验动物选用清洁级无菌雄性健康C57BL/6J小鼠44只,体质量(22±5) g,所有小鼠均购自北京斯贝福实验动物科技有限公司[许可证号:SCXK(京)2016-0002]。在开始正式实验前,将小鼠分笼适应性喂养1周,环境温度控制在(23±2) ℃,相对湿度控制在(55±5)%[13],饲养室每天自然光照12 h,所有小鼠自由饮水,进食,并保持饲养室通风及清洁卫生。动物实验遵循《实验动物护理和使用指南》,并经过天津市中医药研究院附属医院动物伦理委员会批准,动物实验伦理审查号:IACUC of AMMS-04-2020-016。
1.1.2 药品与试剂温胆汤由法半夏12 g,竹茹12 g,枳实12 g,陈皮12 g,茯苓12 g,生姜12 g,灸甘草6 g等中药组成,均由天津市中医药研究院附属医院制剂室提供,按照4:4:4:5:4:4:2的比例配制。温胆汤复方煎煮第1次加10倍量蒸馏水浸泡30 min,先用大火煎至沸腾后改至小水煎煮,煎煮时间为1 h,将温胆汤复方过滤,去除药渣,然后将温胆汤浓缩至每1 mL药液含生药2 g(即浓度是2 g原药材/mL药液),将温胆汤经过高压灭菌冷却后,置于4 ℃冰箱冷藏备用,在实验使用时将温胆汤复方母液稀释至所需实验浓度。小鼠的用药剂量根据《药理实验方法学》中人和动物间的等效计量计算确定[14]。实验中使用的BCA蛋白浓度测定试剂盒,丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒,均购于上海碧云天生物技术有限公司。实验中所用的固醇调节元件结合蛋白-1c(SREBP-1c)、脂肪酸合成酶(FAS)、二酰基甘油酰基转移酶2(DGAT-2)、硬脂酰辅酶A去饱和酶1(SCD-1)、脂酰辅酶A氧化酶(ACO)蛋白抗体均购于武汉博士德生物技术有限公司。
1.1.3 仪器全自动血生化分析仪,购自美国贝克曼有限公司;酶标仪和蛋白检测曝光仪,均购自中国天能仪器有限公司。
1.2 实验方法 1.2.1 小鼠分组44只雄性小鼠适应性饲养1周后,随机分为6组:空白组、模型组、温胆汤低剂量治疗组(低剂量组)、温胆汤中剂量治疗组(中剂量组)、温胆汤高剂量治疗组(高剂量组)、吡咯列酮治疗组(吡咯列酮组)。
1.2.2 小鼠MAFLD模型建立及药物干预处理小鼠按自由随机的方法,分为2组,空白组8只,模型组36只,组间小鼠的体质量和状态无统计学差异。空白组给予普通饲料,模型组给予高脂饲料。全部小鼠喂养持续8周。8周后,分别从空白组和模型组的小鼠中随机挑选1只,测量其体质量、肝质量,并取2只小鼠的肝脏组织做病理切片观察。小鼠MAFLD造模成功的判定标准为:空白组的小鼠进食生长状态正常,皮毛整洁干净,毛色润泽,小鼠活动度良好,体质量持续增长并且无死亡记录,肝色鲜红,组织边缘锐利,质韧;模型组的小鼠反应相对迟钝,毛色呈灰暗,无光泽,体质量明显增加,肝外观呈异常的奶黄色或红黄相间状态,肝脏体积明显肥大,组织边缘变钝,质地变软,组织切面具有显著的油腻感,这些特征证实小鼠MAFLD模型建立成功[15]。
去掉为验证MAFLD模型的1只小鼠,再将模型组其余35只小鼠随机分为5组:模型组、低剂量组、中剂量组、高剂量组、吡咯列酮组各7只。根据《药理实验方法学》中人和动物间等效计量法确定实验中小鼠的用药剂量。通过换算发现,小鼠每日所需的药物用量=0.052 g/20 g=2.6 g/kg。将此小鼠等效药物剂量定为中剂量组,低剂量组用药剂量为中剂量组减半处理即1.3 g/kg,高剂量组用药剂量为中剂量组2倍处理即5.2 g/kg。而吡格列酮组按照2.6 mg/kg处理。各干预治疗组小鼠均灌胃给药处理6周,每日1次。灌胃体积为0.01 mL/g。空白组及模型组的小鼠每日灌胃等剂量的蒸馏水。同时,每周对各组小鼠进行称质量,仔细观察并记录小鼠的精神状态,体质量,进食情况,毛发光泽度,粪便情况,活动度,死亡数量等特征。
1.2.3 样本采集与处理从动物造模开始计算,第14周末当晚将全部小鼠禁食,但不禁水,末次上午将小鼠称体质量后,用10%水合氯醛腹腔注射麻醉,固定全部小鼠,剖开腹腔,采用真空采血管腹主动脉取血保存,迅速游离并提取小鼠的肝脏组织。用生理盐水冲洗新鲜的肝脏组织,去除组织薄膜,称取肝组织湿质量,用于计算小鼠的肝指数。在小鼠的肝右叶离边缘1 cm处,横切一块肝组织(取材体积约为3 mm×3 mm×5 mm),用10%多聚甲醛固定,苏木精-伊红(HE)染色法观察,剩余肝组织放于-80 ℃保存备用。真空采血管的新鲜血样于4 ℃静置2 h后,3 000 r/min离心10 min,离心半径8 cm,分装入无菌微型离心管,立即进行小鼠的肝功能和血脂检测。
1.2.4 HE染色法观察肝组织病理形态将肝组织切片依次放入二甲苯无水乙醇和75%乙醇中漂洗,进行连续脱水处理,然后用自来水冲洗。随后将组织切片放入苏木素染液漂染5 min,分化液分化,返蓝。随后,将组织切片放入85%和95%的乙醇进行连续漂洗,各5 min。再放入伊红染液中漂染5 min。随后,将组织切片进行脱水透明化处理。最后,采用中性树胶进行组织切片封片,光学显微镜观察病理切片并采集相应的组织图像。
1.2.5 全自动生化分析仪测血清转氨酶及肝脏脂肪含量检测血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)和γ-谷氨酰基转移酶(GGT)水平,肝组织的三酰甘油(TG)和总胆固醇(TC)的含量。
1.2.6 比色法检测MDA和SOD水平BCA蛋白浓度测定试剂盒用于小鼠肝脏组织的蛋白定量,制作相应的标准曲线,采用丙二醛(MDA)和超氧化物歧化酶(SOD)检测试剂盒,用酶标仪和比色法检测肝组织样本的MDA和SOD的水平。
1.2.7 实时荧光定量(RT-qPCR)法测定脂质代谢重要基因的表达量取各组小鼠的肝组织100 mg,采用Trizol法提取小鼠肝组织的总RNA,具体步骤按照组织总RNA提取试剂盒说明书操作,NanoDrop®ND-2000仪检测提取的组织总RNA的浓度及质量,利用Prime-ScriptRT Enzyme Mix试剂盒将组织的总RNA逆转录成cDNA,加入PCR扩增反应体系中,运用实时荧光定量PCR法进行扩增,40个循环反应结束后用2-ΔΔCt法进行相对定量的计算和分析,检测全部目的基因mRNA的相对表达水平。以β-actin基因为内参基因,全部基因的RT-qPCR引物序列见表 1。
取各组小鼠肝组织100 mg,提取实验动物的肝组织总蛋白,利用BCA蛋白浓度测定试剂盒对肝组织总蛋白进行定量。各取60 μg蛋白样本进行SDS凝胶电泳,湿转膜法进行PVDF转膜、5%脱脂牛奶进行封闭、一抗(ACO一抗稀释比例:1:500;DGAT2一抗稀释比例1:500;FAS一抗稀释比例:1:800;SCD1一抗稀释比例:1:500;SREBP-1C一抗稀释比例:1:1 000)过夜孵育和二抗(羊抗兔IgG-HRP二抗稀释比例:1:3 000;羊抗小鼠IgG-HRP二抗稀释比例:1:3 000)室温孵育后,用增强型化学发光法进行蛋白曝光,蛋白扫描仪扫描蛋白条带。以GAPDH蛋白为内参蛋白。
1.3 统计学处理采用统计学软件SPSS 24.0进行数据分析,实验数据以均数±标准差(x±s)表示。多组间的比较采用单因素分析组间两两比较采用LSD-t检验。P < 0.05认为差异具有统计学意义。
2 结果 2.1 各组小鼠的整体情况比较在实验过程中,所有小鼠均无死亡现象,空白组小鼠饮食情况良好,活动度理想,毛发光洁亮泽;而模型组小鼠的饮食食欲明显减退,体质量明显下降,反应相对迟钝,活动度下降,毛发灰暗无光泽。低剂量组、中剂量组、高剂量组和吡咯列酮组小鼠整体情况较模型组有所改善,高剂量组和吡咯列酮组的小鼠整体情况接近于空白组。
2.2 温胆汤可改善MAFLD模型小鼠的肝异常指数模型组较空白组小鼠的肝异常指数明显升高,两组间比较,差异性具有统计学意义(P < 0.05);各干预治疗组与模型组比较,小鼠的肝异常指数均不同程度的出现降低,并且高剂量组和吡格列酮组的肝异常指数降低最为显著,差异性均具有统计学意义(P < 0.05),提示温胆汤可明显改善MAFLD模型小鼠的肝指数,并且高剂量的温胆汤和吡咯列酮疗效接近,具有更佳的治疗效果。见图 1。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 1 各组小鼠肝指数的比较 Fig. 1 Comparison of liver index in each group |
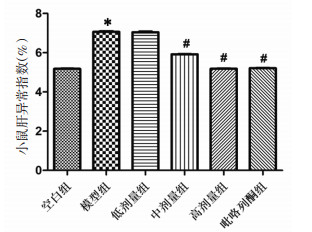
通过组织病理学的观察发现,空白组小鼠的肝小叶组织结构完整,细胞核分布均匀,且肝细胞大小一致,无明显的病变;模型组小鼠出现明显的弥漫性的肝细胞脂肪变性,细胞核分布明显不均,肝细胞大小不一。各干预治疗组与模型组小鼠比较,仍然存在一定程度的脂肪细胞浸润,但是,脂肪变性程度降低和脂肪空泡化程度降低,其中高剂量组和吡咯列酮组的小鼠肝组织脂肪变性程度最低,脂肪空泡数量最少。见图 2。
|
| 图 2 各组小鼠肝组织病理学变化比较(HE,×100) Fig. 2 Comparison of liver histopathological changes in each group (HE, ×100) |
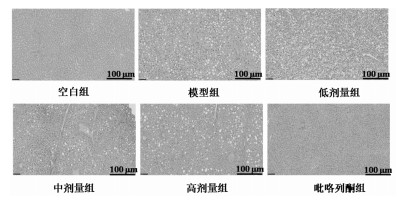
通过数据的统计分析,与空白组小鼠比较,模型组小鼠血清中ALT、AST、ALP和GGT的水平明显升高,差异性均具有统计学意义(P < 0.05);各治疗组与模型组比较,血清中ALT、AST、ALP和GGT水平均有不同程度的降低,其中以高剂量组和吡咯列酮组最为明显,差异性均具有统计学意义(P < 0.05)。该研究结果提示,温胆汤可显著改善MAFLD模型小鼠的肝功能,并且高剂量的温胆汤和吡咯列酮的疗效接近,具有更佳的治疗效果。见图 3。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 3 各组小鼠肝功能指标的比较 Fig. 3 Comparison of liver function indicators in each group |
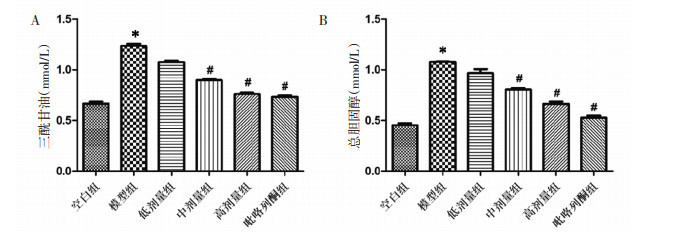
通过数据的统计分析,与空白组小鼠比较,模型组小鼠的TG和TC水平明显升高,差异性均具有统计学意义(P < 0.05);各治疗组与模型组比较,TG和TC水平均有不同程度的降低,其中以高剂量组和吡咯列酮组最为明显,差异性均具有统计学意义(P < 0.05)。结果表明,温胆汤可显著降低MAFLD模型小鼠的肝脏脂肪沉积,并且高剂量的温胆汤和吡咯列酮疗效接近,具有更佳的治疗效果。见图 4。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 4 各组小鼠肝脏组织脂肪沉积水平比较 Fig. 4 Comparison of lipid deposition levels in liver tissues of mice in each group |
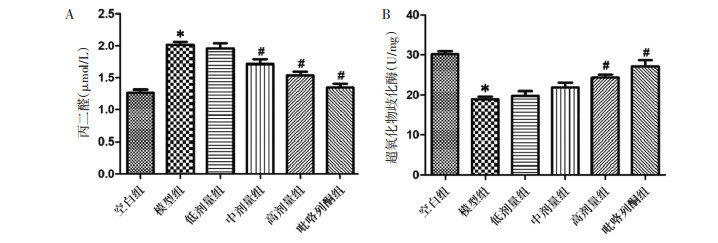
通过数据的统计分析,与空白组小鼠比较,模型组小鼠肝组织丙二醛(MDA)水平明显升高,SOD水平明显降低,差异性均具有统计学意义(P < 0.05);各干预治疗组与模型组比较,肝组织MDA水平均有不同程度的降低,超氧化物歧化酶(SOD)水平均有不同程度的升高,其中以高剂量组和吡咯列酮组最为明显,差异性均具有统计学意义(P < 0.05)。结果表明,温胆汤可显著降低MAFLD模型小鼠的脂质过氧化水平,改善脂质过氧化损伤,并且高剂量的温胆汤和吡咯列酮疗效接近,具有更佳的治疗效果。见图 5。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 5 各组小鼠肝组织脂质过氧化水平比较 Fig. 5 Comparison of lipid peroxidation levels in liver tissues of mice in each group |
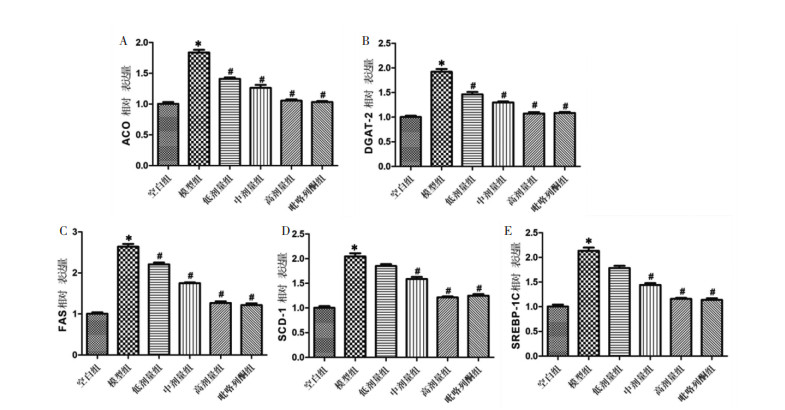
固醇调节元件结合蛋白1c(SREBP-1c)、脂肪酸合成酶(FAS)、二脂酰甘油酰基转移酶2(DGAT-2)、硬脂酰2辅酶A去饱和酶(SCD-1)、1-氨基环丙烷-1-羧酸氧化酶基因(ACO)均为重要的脂质代谢基因。与空白组小鼠比较,模型组肝组织的所有脂质代谢通路重要基因的表达水平均升高,差异性均具有统计学意义(P < 0.05);各治疗组与模型组比较,肝组织的所有脂质代谢通路重要基因的表达水平均有不同程度的降低,其中以高剂量组和吡咯列酮组最为明显,差异性均具有统计学意义(P < 0.05)。该研究结果提示,温胆汤可显著降低MAFLD模型小鼠的的脂质代谢重要基因的表达水平,并且高剂量的温胆汤和吡咯列酮疗效接近,具有更佳的治疗效果。见图 6。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 6 各组小鼠脂质代谢重要基因表达水平比较 Fig. 6 Comparison of the expression levels of important genes in lipid metabolism in each group |
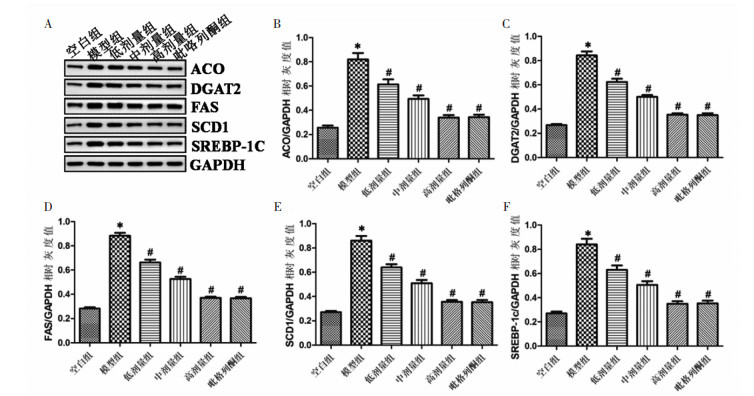
通过数据的统计分析,与空白组小鼠比较,模型组小鼠肝组织的所有脂质代谢重要蛋白的表达水平均升高,差异性均具有统计学意义;各治疗组与模型组比较,肝组织的所有脂质代谢重要蛋白的表达水平均有不同程度的降低,其中以高剂量组和吡咯列酮组最为明显,差异性均具有统计学意义。结果表明,温胆汤可显著降低MAFLD模型小鼠的的脂质代谢重要蛋白的表达水平,并且高剂量的温胆汤和吡咯列酮疗效接近,具有更佳的治疗效果。见图 7。
|
| 注:与空白组比较,*P < 0.05;与模型组比较,#P < 0.05。 图 7 各组小鼠脂质代谢重要蛋白表达水平比较 Fig. 7 Comparison of the expression levels of important proteins in lipid metabolism in each group |
在西医学治疗中,MAFLD通常是在病因针对性治疗、饮食调理性治疗、运动及心理治疗和行为修正治疗的基础上,采用患者保肝处理,并督促患者坚持服用降酶、降脂药物,促进患者肝内脂肪沉积和炎症的逐渐消失,对于MAFLD患者的肝细胞坏死和肝纤维化具有一定的疗效[16-17]。但遗憾的是,迄今为止,并无治疗MAFLD的针对性特效临床药物。故国内外不少专家学者冀希望于利用中医辨证论治来寻求治疗MAFLD的新方法和新药物[18-19]。虽然经过几代人的努力,中药治疗MAFLD取得了一定程度的进展,但目前中药及其有效成分改善MAFLD脂肪沉淀和脂质代谢的分子机制尚不清楚[20]。该研究为中药治疗MAFLD提供了很好的研究依据。在中医研究中,针对MAFLD“痰,湿,瘀,积”这一基本的临床病理[21],应用理气化痰、清胆和胃的温胆汤,取得理想的临床治疗效果,但温胆汤治疗MAFLD的具体分子机制仍是未知的。因此,团队在前期温胆汤治疗MAFLD的临床研究基础上进行了深入探究。通过动物和分子生物学实验,以脂质代谢角度为切入点,提出“温胆汤可以预防肝脂肪变性,抑制血清中脂肪,磷脂,过氧化脂质,调节肝内胆固醇,调节脂肪代谢来保护肝细胞,促进肝脏的修复,总而言之,温胆汤通过调节脂质代谢,进而产生MAFLD治疗效应”的科学假说[22-23],探索并明确温胆汤治疗MAFLD小鼠的最佳药物剂量,进一步揭示温胆汤治疗MAFLD的潜在分子机制,将有助于明确中医药治疗MAFLD的作用机制和临床应用的可能,对于临床防治MAFLD具有重要的理论价值和临床意义,对中药新药的开发有积极作用和推动效应,为MAFLD患者的早期康复带来福音。
团队前期的研究发现在动物模型及脂肪肝患者中,肝组织的脂质过氧化水平是明显增加的。目前,人体内的游离脂肪酸通常被认为是脂肪肝患者激活氧化应激的直接来源,且与肝脏疾病的严重程度是成正相关的。因此,患者肝组织的MDA和SOD含量是反映MAFLD患者抗氧化能力和水平的重要参数,通过MDA和SOD含量可以有效反映机体的氧化应激的程度,更能间接反映患者肝组织过氧化的损伤程度[24]。该研究通过对小鼠的检测,发现温胆汤可以明显改善肝组织的过氧化损伤,进一步揭示了温胆汤通过调节脂质代谢治疗MAFLD患者的分子机制。
SREBP-1c,FAS,DGAT22和SCD1都是机体内脂质代谢通路的重要因子,调控机体内脂质合成。目前的研究表明,机体内的脂质过量合成或者脂质代谢异常可能是MAFLD的主要致病因素。研究通过RT-qPCR和Western Blot实验,从分子和蛋白水平证实了温胆汤对MAFLD的治疗作用存在明显的剂量依赖性。而中剂量和高剂量组可以明显抑制脂质合成基因SREBP-1c,FAS,DGAT22和SCD1的表达,并且高剂量组与阳性药吡格列酮的治疗效果几乎一致,但是,吡格列酮的不良反应很大,MAFLD患者长时间服用可能会造成患者水肿,上呼吸道感染,头痛,咽炎,鼻窦炎或者低血糖等症状,对于MAFLD患者的治疗和身体恢复存在明显弊端,而温胆汤在临床中的不良反应很小且治疗效果理想,因此,认为温胆汤治疗MAFLD可以成为未来的主要治疗策略。
长时间的饮用高脂饲料促进MAFLD发生发展的主要机制为高脂进一步紊乱小鼠机体的脂质代谢,导致MAFLD的发生发展。该研究经不同剂量的温胆汤进行药物干预治疗后,小鼠肝细胞脂肪变性均有一定程度的减轻,各干预治疗组小鼠肝细胞结构排列更加整齐,脂滴和空泡化明显减少,肝异常指数明显下降,血清转氨酶及肝脏脂肪水平显著降低,过氧化物MDA水平明显降低,SOD的水平明显升高,脂质代谢重要基因和蛋白的表达水平明显下调。温胆汤可以明显减轻MAFLD小鼠肝损伤及脂质沉积,可能与调节小鼠体内脂质过氧化水平和脂质代谢重要基因和蛋白的表达水平,降低MDA水平,提高SOD水平有关,这一新的分子作用机制有望为MAFLD的临床治疗提供一种全新的治疗理论和治疗选择。
| [1] |
FOUAD Y, WAKED I, BOLLIPO S, et al. What's in a Name? renaming "NAFLD" to "MAFLD"[J]. Liver International, 2020, 40(6): 1254-1261. DOI:10.1111/liv.14478 |
| [2] |
COTTER T G, RINELLA M. Nonalcoholic fatty liver disease 2020:the state of the disease[J]. Gastroenterology, 2020, 158(7): 1851-1864. DOI:10.1053/j.gastro.2020.01.052 |
| [3] |
PAIK J M, GOLABI P, YOUNOSSI Y, et al. Changes in the global burden of chronic liver diseases from 2012 to 2017:the growing impact of NAFLD[J]. Hepatology, 2020, 72(5): 1605-1616. DOI:10.1002/hep.31173 |
| [4] |
KWON S Y, PARK J, PARK S H, et al. MAFLD and NAFLD in the prediction of incident chronic kidney disease[J]. Scientific Reports, 2023, 13(1): 1796. DOI:10.1038/s41598-023-27762-6 |
| [5] |
PERDOMO C M, FRÜHBECK G, ESCALADA J. Impact of nutritional changes on nonalcoholic fatty liver disease[J]. Nutrients, 2019, 11(3): 677. DOI:10.3390/nu11030677 |
| [6] |
LIM S, KIM J W, TARGHER G. Links between metabolic syndrome and metabolic dysfunction-associated fatty liver disease[J]. Trends in Endocrinology and Metabolism: TEM, 2021, 32(7): 500-514. DOI:10.1016/j.tem.2021.04.008 |
| [7] |
FEI N, BRUNEAU A, ZHANG X J, et al. Endotoxin producers overgrowing in human gut microbiota as the causative agents for nonalcoholic fatty liver disease[J]. mBio, 2020, 11(1): e03263-e03219. |
| [8] |
KARIMKHANLOO H, KEENAN S N, BAYLISS J, et al. Mouse strain-dependent variation in metabolic associated fatty liver disease (MAFLD): a comprehensive resource tool for pre-clinical studies[J]. Scientific Reports, 2023, 13(2): 4711. |
| [9] |
ALBILLOS A, DE GOTTARDI A, RESCIGNO M. The gut-liver axis in liver disease: pathophysiological basis for therapy[J]. Journal of Hepatology, 2020, 72(3): 558-577. DOI:10.1016/j.jhep.2019.10.003 |
| [10] |
TILG H, EFFENBERGER M. From NAFLD to MAFLD: When pathophysiology succeeds[J]. Nature Reviews Gastroenterology & Hepatology, 2020, 17(7): 387-388. |
| [11] |
XU B T, TENG F Y, WU Q, et al. Bdh1 overexpression ameliorates hepatic injury by activation of Nrf2 in a MAFLD mouse model[J]. Cell Death Discovery, 2022, 8(1): 49. DOI:10.1038/s41420-022-00840-w |
| [12] |
SHEPARD C R. TLR9 in MAFLD and NASH: at the intersection of inflammation and metabolism[J]. Frontiers in Endocrinology, 2021, 11(2): 613639. |
| [13] |
NUCERA S, RUGA S, CARDAMONE A, et al. MAFLD progression contributes to altered thalamus metabolism and brain structure[J]. Scientific Reports, 2022, 12(1): 1207. DOI:10.1038/s41598-022-05228-5 |
| [14] |
ESLAM M, EL-SERAG H B, FRANCQUE S, et al. Metabolic (dysfunction)-associated fatty liver disease in individuals of normal weight[J]. Nature Reviews Gastroenterology & Hepatology, 2022, 19(10): 638-651. |
| [15] |
YE Q, LIU Y, ZHANG G J, et al. Deficiency of gluconeogenic enzyme PCK1 promotes metabolic-associated fatty liver disease through PI3K/AKT/PDGF axis activation in male mice[J]. Nature Communications, 2023, 14(1): 1402. DOI:10.1038/s41467-023-37142-3 |
| [16] |
MORI K, TANAKA M, HOSAKA I, et al. Metabolic dysfunction-associated fatty liver disease is associated with an increase in systolic blood pressure over time: linear mixed-effects model analyses[J]. Hypertension Research: Official Journal of the Japanese Society of Hypertension, 2023, 46(5): 1110-1121. DOI:10.1038/s41440-023-01179-0 |
| [17] |
LYU H F, JIANG Y M, ZHU G L, et al. Liver fibrosis is closely related to metabolic factors in metabolic associated fatty liver disease with hepatitis B virus infection[J]. Scientific Reports, 2023, 13(1): 1388. DOI:10.1038/s41598-023-28351-3 |
| [18] |
CARPINO G, DEL BEN M, PASTORI D, et al. Increased liver localization of lipopolysaccharides in human and experimental NAFLD[J]. Hepatology, 2020, 72(2): 470-485. DOI:10.1002/hep.31056 |
| [19] |
KONG C, GAO R Y, YAN X B, et al. Probiotics improve gut microbiota dysbiosis in obese mice fed a high-fat or high-sucrose diet[J]. Nutrition, 2019, 60(6): 175-184. DOI:10.3969/j.issn.1004-7484.2019.06.158 |
| [20] |
SHI C W, CHENG M Y, YANG X, et al. Probiotic Lactobacillus rhamnosus GG promotes mouse gut microbiota diversity and T cell differentiation[J]. Frontiers in Microbiology, 2020, 11(3): 607735. |
| [21] |
REN T Y, LI X Y, FAN J G. Probiotics for treatment of nonalcoholic fatty liver disease: it is worth a try[J]. Clinical and Molecular Hepatology, 2021, 27(1): 83-86. DOI:10.3350/cmh.2020.0298 |
| [22] |
LI M W, CHI X W, WANG Y, et al. Trends in insulin resistance: Insights into mechanisms and therapeutic strategy[J]. Signal Transduction and Targeted Therapy, 2022, 7(1): 216. DOI:10.1038/s41392-022-01073-0 |
| [23] |
LIU L, WANG C F, WANG J G, et al. Association between non-alcoholic fatty liver disease and metabolically healthy deterioration across different body shape phenotypes at baseline and change patterns[J]. Scientific Reports, 2022, 12(1): 14786. DOI:10.1038/s41598-022-18988-x |
| [24] |
ABEDI F, DAVARAN S, HEKMATI M, et al. An improved method in fabrication of smart dual-responsive nanogels for controlled release of doxorubicin and curcumin in HT-29 colon cancer cells[J]. Journal of Nanobiotechnology, 2021, 19(1): 18. DOI:10.1186/s12951-020-00764-6 |
2. The First Affiliated Hospital of Tianjin University of Tradition Chinese Medicine, Tianjin 300381, China
 2023, Vol. 40
2023, Vol. 40