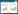文章信息
- 路美娟, 杨培丽, 刘毅.
- LU Meijuan, YANG Peili, LIU Yi.
- 补阳还五汤通过干预肠道菌群改善阿司匹林致消化道损伤作用及机制研究
- Study on the effect and mechanism of Buyang Huanwu Decoction on improving aspirin induced gastrointestinal injury by intervention of intestinal microflora
- 天津中医药, 2023, 40(8): 1043-1051
- Tianjin Journal of Traditional Chinese Medicine, 2023, 40(8): 1043-1051
- http://dx.doi.org/10.11656/j.issn.1672-1519.2023.08.17
-
文章历史
- 收稿日期: 2023-03-18
2. 天津中医药大学研究生院, 天津 301617
阿司匹林、氯吡格雷等传统抗血小板药物通过抑制血小板活化、聚集等功能发挥抗血小板作用,是心脑血管疾病的一、二级预防用药[1]。但这些药物往往伴随不同程度的消化道损伤和出血事件,包括胃溃疡、十二指肠溃疡、糜烂性胃炎、慢性浅表性胃炎等,使许多患者无法耐受[2]。这些不良反应与药物破坏胃黏膜保护屏障、增加黏膜出血风险、增加细胞毒性物质形成等机制有关[3]。研究发现一些活血化瘀类中药及复方具有抗血小板和改善消化道黏膜损伤的双重作用[4],或许能达到抗血栓形成与防治出血的潜在平衡。补阳还五汤为气血双调经典方剂,攻补兼施,临床上联合传统抗血小板药物防治心脑血管疾病效果明显[5]。方中赤芍、川芎、红花等活血药可通血脉之瘀滞,具有抗血小板聚集、调节脂质代谢、降低血管阻力等作用[6]。而且补阳还五汤重用黄芪补正气之虚,使祛瘀而不伤正。现代药理研究显示黄芪具有保护肠黏膜、抗炎、调节免疫、修复黏膜损伤等作用[7],提示补阳还五汤在发挥抗血小板作用的同时兼有保护消化道黏膜之效。
许多研究证实肠道菌群是阿司匹林类抗血小板药物引起肠道炎症的关键因素,通过参与肝肠循环和激活先天免疫系统,在肠道损伤和修复中发挥双重作用,可以作为修复抗血小板药所致肠道损伤的切入点[8]。中药因其多种类、多成分、多靶点等特点发挥对肠道菌群的调节作用,可通过调节肠道菌群丰富度和多样性稳态,保护消化道结构和功能的稳定[9]。鉴此,该研究通过对比补阳还五汤与西医传统抗血小板药物以及活血化瘀经方--血府逐瘀汤的抗血小板功效,探究补阳还五汤的“祛瘀之力”;另一方面,从肠道菌群入手,探讨补阳还五汤对阿司匹林诱导的消化道损伤模型大鼠肠道菌群的影响,明确补阳还五汤“扶正之功”用于改善消化道损伤的效果及作用机制,以期为传统抗血小板药物不耐受患者提供安全有效的用药方案。
1 材料 1.1 动物75只体质量在200~220 g的SPF级健康雄性SD大鼠,于北京华阜康生物科技股份有限公司购买,合格证号为SCXK(京)2019-0008;饲养于温度(25±2) ℃、湿度50 %~65 %的SPF级实验动物房,喂养普通饲料。
1.2 主要药物与试剂补阳还五汤、血府逐瘀汤按原方配伍于天津中医药大学第二附属医院购买;阿司匹林(上海源叶生物,批号:J07J11Q107646),硫酸氢氯吡格雷片[赛诺菲(杭州)制药有限公司,批号:ca683],大鼠水合氯醛(天津易生源,批号:2021S922),羧甲基纤维素钠(上海源叶生物,批号:Y24S11x12),4%组织细胞固定液(天津易生源,批号:20211201001),PBS缓冲液(北京索莱宝,批号:20211124)。
1.3 主要仪器电子天平[奥豪斯仪器(常州)有限公司,型号:STX123ZH],液氮罐(东亚,型号:YDS-30L),低温高速离心机(北京新时代北利医疗仪器设备有限公司,型号:GTR16-2),DNA提取试剂盒(型号M5636-02,广州飞扬生物),PCR扩增仪(型号2702,赛默飞世尔科技),酶标仪(型号FLx800,公司BioTek)。
2 方法 2.1 分组、造模及给药方法适应性喂养1周后,按随机数表法分为对照组、模型组、补阳还五汤组、血府逐瘀汤组、双抗组,每组15只,分组方法使用随机数表法,组内编号,称质量给药。除对照组外其余4组制备阿司匹林所致消化道损伤模型。造模方法:通过查阅资料,分别使用10.41、50、300 mg/kg阿司匹林制剂进行预实验,以大鼠出现便潜血阳性、肠黏膜组织病理切片出现结构破坏和炎症反应为造模成功的判断标准,选出制备消化道损伤模型最适宜的剂量,最终以300 mg/kg阿司匹林制剂灌胃给药制备模型。每日上午,除对照组灌胃生理盐水外,其余各组灌胃阿司匹林制剂300 mg/kg,每日1次;每日下午,补阳还五汤组、血府逐瘀汤组、双抗组分别灌胃相应药物,补阳还五汤给药剂量为12.2 g/kg;血府逐瘀汤给药剂量为6.5 g/kg;氯吡格雷给药剂量为6.5 mg/kg,每日1次,给药体积均为10 mL/kg,共计2周。
2.2 检验指标及方法 2.2.1 体质量变化每日上午灌胃前记录大鼠体质量,通过计算实验前后大鼠体质量变化差值获得体质量增加量。
2.2.2 消化道出血于当日上午灌胃前收集大鼠粪便,采用胶体金法检测便隐血。
2.2.3 体外凝血时间测定末次给药1 h后,用断尾法测定大鼠体外凝血时间。
2.2.4 血清花生四烯酸(AA)、血小板膜糖蛋白GPⅡb/Ⅲa、血栓素B2(TXB2)测定禁食不禁水12 h,无菌操作收集各组大鼠粪便于离心管中,置于液氮保存。取眼内眦血3 mL左右后,水合氯醛麻醉大鼠,腹主动脉采血。用酶联免疫吸附剂测定(ELISA)法分别检测大鼠血清AA、GPⅡb/Ⅲa、TXB2,具体操作步骤按照说明书进行。
2.2.5 肠黏膜病理组织学检查粪便、血液采集后剖腹,取各组大鼠相同部位同等面积的回肠组织,置于4%组织细胞固定液中固定,然后进行石蜡包埋、切片,苏木精-伊红(HE)染色。显微镜下观察各组大鼠回肠黏膜形态结构差异,并拍照。
2.2.6 肠道菌群多样性检测取对照组、模型组、补阳还五汤组、血府逐瘀汤组大鼠粪便样品,每组6只,依据说明使用试剂盒提取总DNA,扩增16SrDNA的V3-V4区,引物序列为:上游ACTCCTACGGGAGGCAGCA,下游GGACTACHVGGGTWTCTAAT。扩增产物用Quant-iT染色,酶标仪进行定量。再将纯化的扩增产物进行等量混合,加上测序仪所需的接头、测序引物和index序列,构建文库。使用IlluminaHiSeq2500 PE 250测序平台进行上机测序,然后按照index和Barcode信息,将通过初筛的原始序列进行划分,并去除barcode序列;按照QIIME2 dada2分析流程进行序列去噪。使用R语言进行数据统计分析。
2.3 统计学方法采用SPSS 25.0软件统计分析。计量资料符合正态用均数±标准差(x±s)描述,采用单因素方差分析;不符合正态用中位数[M(QL,QU)]描述,数据采用非参数检验。计数资料用百分率(%)描述,组间比较采用卡方检验。以P<0.05为差异有统计学意义。
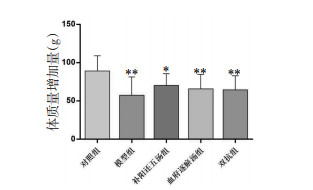
3 结果 3.1 各组大鼠体质量变化实验前后,每组大鼠体质量增加量明显不同(P<0.05),与对照组相比,模型组大鼠体质量增加量明显降低(P<0.01);补阳还五汤组体质量增加量(70.27±15.42) g与模型组(57.50±23.73) g、血府逐瘀汤组(65.79±18.70) g、双抗组(64.64±18.22) g的体质量增加量比较差异无统计学意义(P>0.05)。见图 1。
|
| 注:对照组比较,*P<0.05;**P<0.01。 图 1 各组大鼠体质量变化 Fig. 1 Weight change of rats in each group |
模型组便潜血阳性率为46.7%,证明造模成功。经卡方检验发现,各组之间消化道出血阳性率比较著差异有统计学意义(χ2=23.219,P<0.01)。进一步组间比较发现,与对照组相比,模型组、血府逐瘀汤组、双抗组便潜血阳性率降低(P<0.01);与双抗组相比,补阳还五汤组便潜血阳性率降低(P<0.01)。见表 1。
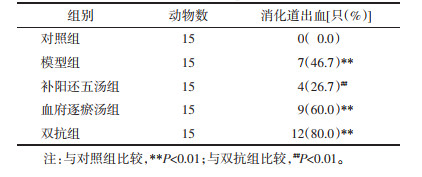
与对照组相比,模型组和双抗组体外凝血时间明显延长(P<0.05);补阳还五汤组凝血时间与对照组延长,较模型组、血府逐瘀汤组及双抗组差异无统计学意义(P>0.05)。见表 2。
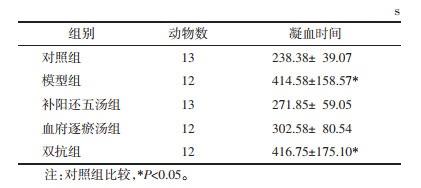
与模型组相比,双抗组AA含量显著降低(P<0.01),补阳还五汤组、血府逐瘀汤组AA含量差异无统计学意义(P>0.05);与模型组相比,双抗组TXB2含量降低(P<0.05),补阳还五汤组、血府逐瘀汤组差异无统计学意义(P>0.05);与双抗组相比,补阳还五汤组、血府逐瘀汤组AA含量显著增加(P<0.01);与对照组相比,补阳还五汤组、模型组GPⅡb/Ⅲa含量显著降低(P<0.01);与双抗组相比,补阳还五汤组GPⅡb/Ⅲa含量差异无统计学意义(P>0.05)。见表 3。
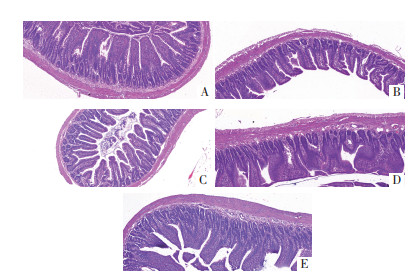
对照组肠黏膜结构基本正常,绒毛规则排列,完整无缺损;其余各组结构异常,有炎性细胞浸润,绒毛形态不规则,伴有不同程度缺失,并且间质可见水肿和出血。其中以双抗组和血府逐瘀汤组肠黏膜结构缺失及炎性反应最严重;与其他处理组对比,补阳还五汤组损伤最小、炎性细胞浸润最轻。见图 2。
|
| 注:A.对照组;B.模型组;C.补阳还五汤组;D.血府逐瘀汤组;E.双抗组。 图 2 光镜下各组肠黏膜组织病理切片(HE,×100) Fig. 2 Pathological sections of intestinal mucosal histopathology in each group under light microscopy (HE, ×100) |
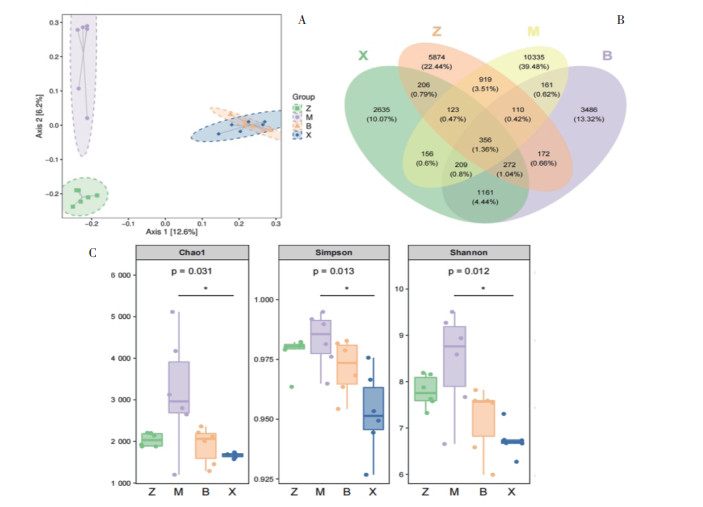
使用主坐标分析(PCoA),研究各个样本间的组成距离关系。如图 3A所示,各组样本PCoA分析结果显示各组区分明显,表明阿司匹林和补阳还五汤干预可显著影响肠道菌群的丰度和结构。使用韦恩图展示分组之间的操作分类单元(OTU),即OTU的共有或者特有信息。根据图 3B可知,对照组、模型组、补阳还五汤组、血府逐瘀汤组总OTU数分别为8 032、12 369、5 927、5 118。
|
| 注:a. PCoA分析的样本二维排序图;b. otu韦恩图(重叠部分表示各组共有的OTU数);c:Alpha多样性指数的分组箱线图。Z为对照组、M为模型组、B为补阳还五汤组、X为血府逐瘀汤组、L为双抗组,其余下表、下图相同。 图 3 各组大鼠肠道菌群整体变化 Fig. 3 Overall changes of intestinal flora in each group |
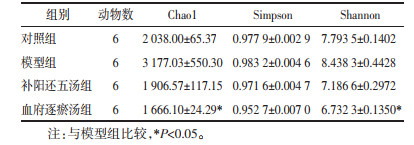
如图 3C所示,Chao1表示预测的OTU个数,Simpson指数、Shannon指数与群落多样性成正相关。结果见表 4,各组数据方差不齐,使用Kruskal-Wallis秩和检验作为检验。如图 3C所示,Alpha多样性表明,各组大鼠肠道菌群的丰富度和多样性存在差异(P<0.05);与模型组相比,血府逐瘀汤组Chao1、Simpson、Shannon指数均显著降低(P<0.05)。见表 4。
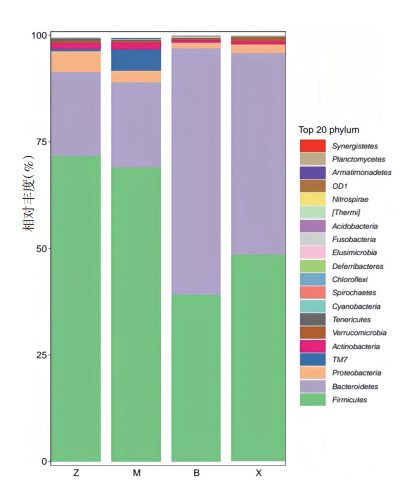
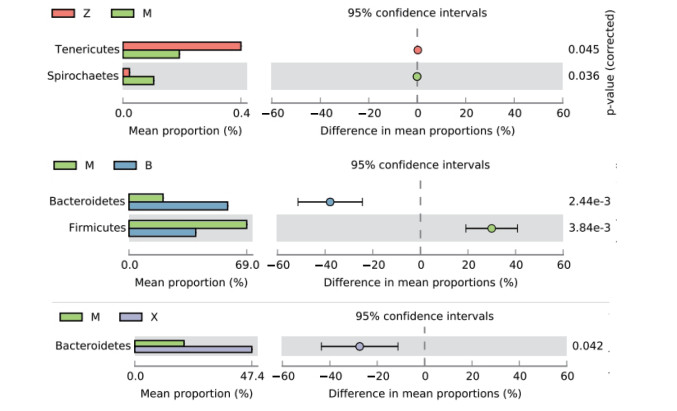
如图 4所示,在门水平丰度前20的物种中,各组优势菌群(排在前3位,占比90%以上)均为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和变形菌门(Proteobacteria),其中厚壁菌门的占比最大,其次是拟杆菌门。采用t检验寻找组间差异显著的物种。如图 5所示,与对照组对比,模型组柔膜菌门(Tenericutes)显著下降,螺旋体门(Spirochaetes)显著上升;与模型组相比,补阳还五汤组拟杆菌门显著上升,厚壁菌门显著下降;与模型组,血府逐瘀汤组拟杆菌门显著上升。各组中厚壁菌门与拟杆菌门丰度比值(即F/B值)由低到高依次为:补阳还五汤组(0.676) < 血府逐瘀汤组(1.025) < 模型组(3.461) < 对照组(3.619)。
|
| 图 4 各组门水平物种分布堆叠图 Fig. 4 Stacked horizontal species distribution of each group of phyla |
|
| 图 5 各组差异菌门 Fig. 5 Differential phylums for each group |
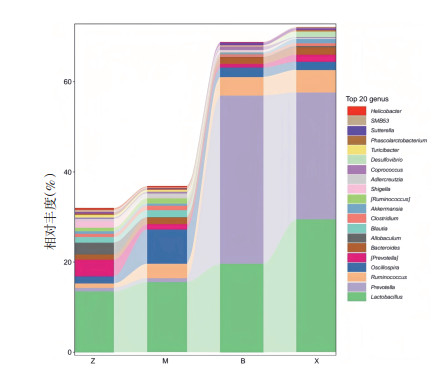
如图 6所示,在属水平丰度前20的物种中,对照组中瘤胃球菌属(Ruminococcus)(15.92%)丰度最高,其次为乳杆菌属(Lactobacillus)(13.47%)、S24-7菌属(13.02%)、毛螺菌属(Lachnospiraceae)(9.3%)。模型组中乳杆菌属(15.58%)丰度最高,其次为S24-7属(14.89%)、瘤胃球菌属(9.55%)、颤螺旋菌属(Oscillospira)(7.67%)。补阳还五汤组中普氏菌属(Prevotella)(37.37%)丰度最高,其次为乳杆菌属(19.59%)、S24-7菌属(17.00%)、梭菌属(6.67%)。血府逐瘀汤组中占比最高的为乳杆菌属(29.50%),其次为普氏菌属(28.09%)、S24-7菌属(15.06%)、瘤胃球菌属(5.05%)。
|
| 图 6 各组属水平物种分布堆叠图 Fig. 6 Horizontal species distribution stacked by genera group |
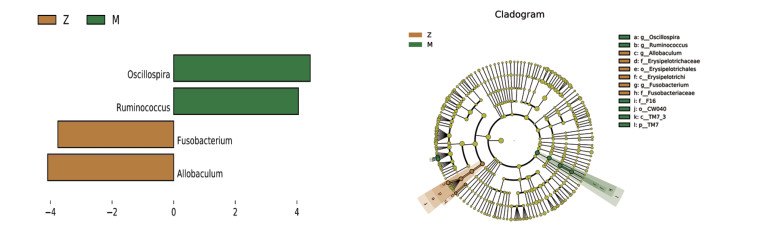
使用LEfSe分析挖掘各组间属水平之间的差异,如图 7所示,与对照组对比,模型组有4个菌属表现出显著差异,Allobaculum、梭杆菌属(Fusobacterium)显著增加,颤螺旋菌属(Oscillospira)、瘤胃球菌属显著下降。如图 8所示,与模型组对比,补阳还五汤组普氏菌属、红球菌属(Rhodococcus)、韦荣氏菌属(Veillonella)显著上升,瘤胃球菌属、丹毒丝菌属(Holdemania)、02d06、Adlercreutzia、Anaerotruncus、Blautia显著下降。如图 9所示,与模型组对比,血府逐瘀汤组普罗维登斯菌属(Providencia)、乳杆菌属、红球菌属、Odoribacter、普氏菌属显著上调,Adlercreutzia、Blautia、瘤胃球菌属显著下降。
|
| 注:左图是LDA直方图,显示了不同组别标志物种。直方图的长度表示不同物种的差异。LDA筛选结果大于等于3.5。右图是进化分支图,节点大小对应于该分类单元的平均相对丰度;空心节点表示组间差异不大的分类单元,而其他颜色的节点表示这些分类单元反映了组间的显著差异,且在所代表分组样本中丰度较高。 图 7 对照组与模型组两组间菌群显著差异图 Fig. 7 Significant differences in microbiota between the control group and the model group |
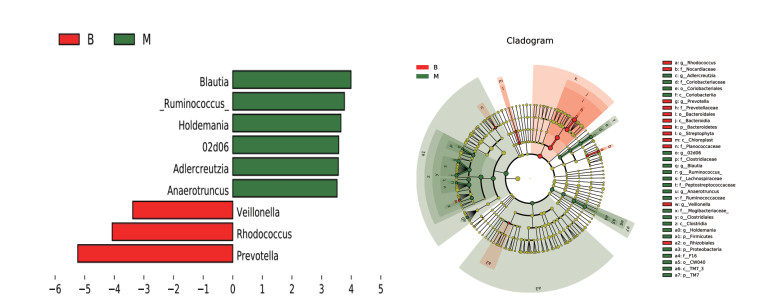
|
| 图 8 模型组与补阳还五汤组两组间菌群显著差异图 Fig. 8 Significant differences in microbiota between the model group and the five decoction groups |
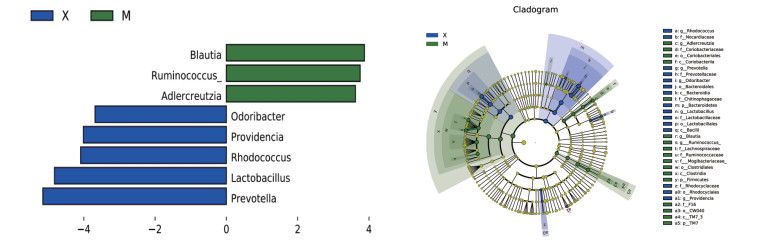
|
| 图 9 模型组与血府逐瘀汤组两组间菌群显著差异图 Fig. 9 Significant differences in microbiota between the model group and the Xuefu Zhuoyu Decotion group |
血小板活化和聚集等功能异常是心脑血管疾病发生的关键因素,血小板功能相关指标GPⅡb/Ⅲa、AA、TXB2可以用于评价疾病的危险程度[10]。既往研究发现,补阳还五汤可以明显降低高脂血症大鼠血液黏度水平,同时减少血浆TXB2的形成发挥抗血小板作用,用于防治血栓形成[11]。研究结果显示,补阳还五汤组AA、TXB2含量较模型组有降低趋势,这与既往实验相符,提示补阳还五汤可抑制AA、TXB2活性达到一定抗血小板聚集效果,但由于样本量较少,未能明确具体差异程度。另外,研究发现与血府逐瘀汤组和对照组相比,补阳还五汤组GPⅡb/Ⅲa的含量显著降低,GPⅡb/Ⅲa含量与血小板活化密切相关,纤维蛋白原交联GPI形成稳定的凝块常作为血小板聚集的最终途径,因此,抑制GPⅡb/Ⅲa活性可有效抑制血小板聚集[12]。这证实补阳还五汤具有抗血小板聚集作用,可增强阿司匹林的功效,也提示与GPⅡb/Ⅲa相关的血小板聚集途径可能是补阳还五汤发挥抗血小板功能的靶点。
机体凝血系统与抗凝系统之间的协调平衡保证血液正常运行,任意一方失调都会造成血栓形成或出血风险。传统抗血小板药物通过抑制血小板活化防治血栓,往往会造成抗凝系统相对亢进增加出血风险。研究发现补阳还五汤组凝血时间较对照组延长,较模型组、双抗组、血府逐瘀汤组缩短,表明相较于传统抗血小板药物,补阳还五汤联合阿司匹林在发挥抗血小板作用的同时,能够降低出血风险,提示补阳还五汤与阿司匹林联合应用可以达到抗血栓形成与防止出血之间的潜在平衡。
4.2 补阳还五汤通过影响肠道菌群物种丰富度与多样性改善消化道损伤阿司匹林通过抑制血小板活化的AA途径发挥抗血小板作用,广泛应用于心脑血管疾病防治,但长期服用阿司匹林使患者发生消化道出血的风险约增加0.3%[13]。实验使用高剂量阿司匹林灌胃给药,同时给予补阳还五汤、血府逐瘀汤、氯吡格雷干预,通过对比各组之间消化道黏膜的损伤程度,从而突出补阳还五汤的治疗效果。结果显示,补阳还五汤组便潜血阳性率明显降低,证实补阳还五汤干预后,削弱了阿司匹林对消化道的损伤,证实补阳还五汤对阿司匹林导致的消化道损伤具有显著的改善作用。
服用抗血小板药物导致消化道出血的患者需要及时使用质子泵抑制剂(PPI)等进行修复黏膜和抑酸治疗,但研究表明PPI虽然可以改善抗血小板药物引起的消化道症状,同时也削弱了抗血小板作用并增加血栓事件发生率,而补气活血类中药既可以抑制血小板活化又能保护消化道黏膜、减轻局部炎症反应[14]。研究发现除对照组外,补阳还五汤组大鼠体质量增加量最大,这可能与进食量多有关,反映补阳还五汤组大鼠食欲好、消化道不良反应相对较轻,进一步对比各组大鼠肠黏膜病理切片发现,补阳还五汤组肠道黏膜损伤最轻,组织结构相对完整,细胞排列规则、境界清楚,炎性程度最小,证实补阳还五汤对消化道黏膜有一定保护和修复作用,对于有消化道症状的心血管疾病患者,配合补阳还五汤进行抗血小板治疗是一个新选择。
以细菌为主的肠道微生态系统也被称为肠道菌群。根据与宿主之间的关系,肠道菌群主要分为有益菌、致病菌、过路菌,它们通过调节免疫、代谢、结构和神经系统,共同维持着肠道内外环境的稳态[15],而当消化道损伤时又会影响菌群的种类、数量、代谢等。因此,肠道菌群常常作为切入点,用于探究消化道疾病发生发展进程中的具体机制和治疗靶点。肠道微生态的稳定与肠道菌群比例的动态平衡有关,与益生菌种类和数量无关,如果益生菌的过度增殖反而会对机体造成伤害。肠道菌群多样性和OTU分析表明,各组大鼠粪便优势菌群均为厚壁菌门、拟杆菌门和变形菌门,这与正常人类肠道优势菌门相似[16]。进行阿司匹林干预后,模型组大鼠肠道菌群物种丰富度与多样性上升,这一结果与此前的一项研究结果相对应,服用非甾体抗炎药的老年人的微生物总数高于未服用非甾体抗炎药的个体[17]。提示阿司匹林可能通过影响肠道菌群物种丰富度与多样性,进而导致肠道代谢紊乱、破坏肠道微生态,引起消化道损伤。同时,研究发现服用补阳还五汤后,菌群物种丰富度与多样性下降,恢复至与正常类似的水平,这可能是补阳还五汤发挥消化道黏膜保护作用的原因,但需进一步结合丰富度和多样性的变化进行分析。
从门水平对大鼠肠道菌群丰富度和多样性的变化分析,发现补阳还五汤治疗后拟杆菌门显著上升,厚壁菌门明显下降。拟杆菌门和厚壁菌门占肠道菌群总数的90 %以上,与机体能量代谢、脂肪存储等过程密切相关。其中,拟杆菌门是健康肠道中的益生菌群,可以为身体提供营养,并参与机体代谢、免疫等过程[18]。另有研究发现[19],当消化道出现炎症反应及病理损伤时,厚壁菌门有增加趋势,提示肠道损伤可能与厚壁菌门增加有关。因此,F/B值被认为是反应菌群紊乱的重要参数,该比值越低则肠道菌群越稳定。各组中,补阳还五汤组值为0.676,明显低于模型组的3.461,基于实验结果,推测模型组大鼠肠道厚壁菌门与拟杆菌门的丰度比值降低,可能是阿司匹林导致消化道损伤重要因素,补阳还五汤通过调整肠道细菌比例失衡在一定程度上改善消化道损伤。
从属水平进行分析,发现经过补阳还五汤干预后,普氏菌属、乳杆菌属等有益菌显著上调并占主要优势,这与相关报道相一致[20]。普氏菌属和乳杆菌属能抑制有害微生物生长,产生短链脂肪酸,发挥抗炎、保护消化道黏膜、调节激素分泌和肠道免疫反应等作用[21]。另外,与对照组相比,补阳还五汤治疗后属水平上瘤胃球菌属显著降低,瘤胃球菌属于厌氧菌,与短链脂肪酸产生同样有关,可以保护肠黏膜正常的结构和功能,并有抗炎作用,因此瘤胃球菌有助于控制消化道损伤,该实验结果与理论情况不一致,笔者推测可能是测序误差,而且肠道菌群是一个微生态系统,重点并不在于某类菌属的多少,而在于维系整个系统的动态平衡。
5 结论研究发现补阳还五汤能显著降低大鼠血清GPⅡb/Ⅲa水平,同时降低AA、TXB2水平,证实补阳还五汤具有抗血小板作用GPⅡb/Ⅲa含量显著降低提示与GPⅡb/Ⅲa相关的血小板聚集途径可能是补阳还五汤发挥抗血小板功能的靶点;另外,研究发现补阳还五汤可以降低阿司匹林导致的消化道出血风险,保护并修复消化道黏膜损伤,这一作用可能与影响消化道菌群的丰富度和多样性、调整肠道细菌比例失衡有关。补阳还五汤不仅具有抗血小板作用,也能保护消化道黏膜。与传统抗血小板药物联用,既能到达与双抗药物类似的抗血小板效果,又能降低传统抗血小板药物的不良反应,为心脑血管疾病提供新的用药方案。但是该研究上有不足之处:体质量增加指数、AA、TXB2水平等指标呈明显改善趋势,但统计学意义不明显,考虑与样本量不足有关;此外,肠道菌群检测的样本量也较少,需进一步探究。
| [1] |
孙双勇, 靳京, 孔晓华, 等. 抗血小板药物研究进展及新靶点药物的发现[J]. 药物评价研究, 2021, 44(1): 213-221. SUN S Y, JIN J, KONG X H, et al. Research progress and discovery of new targets in antiplatelet drugs[J]. Drug Evaluation Research, 2021, 44(1): 213-221. |
| [2] |
SWAN D, LOUGHRAN N, MAKRIS M, et al. Management of bleeding and procedures in patients on antiplatelet therapy[J]. Blood Reviews, 2020, 39(3): 100619. |
| [3] |
赖双阳. 肠溶阿司匹林引发冠心病患者上消化道出血不良反应分析[J]. 临床合理用药杂志, 2018, 11(31): 56-58. LAI S Y. Analysis of adverse reactions of upper gastrointestinal bleeding caused by enteric aspirin in patients with coronary heart disease[J]. Chinese Journal of Clinical Rational Drug Use, 2018, 11(31): 56-58. |
| [4] |
柴华, 曲华, 杜健鹏, 等. 活血化瘀中药与抗血小板药物联合应用进展[J]. 中国中西医结合杂志, 2020, 40(11): 1396-1399. CHAI H, QU H, DU J P, et al. Progress in application of Chinese medicine for activating blood and removing stasis combined with antiplatelet drugs[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2020, 40(11): 1396-1399. DOI:10.7661/j.cjim.20200306.218 |
| [5] |
王金会, 周新福, 殷晓宁. 补阳还五汤联合阿司匹林和氯吡格雷治疗心肌梗死的疗效[J]. 世界中西医结合杂志, 2020, 15(4): 678-681. WANG J H, ZHOU X F, YIN X N. Effect of Buyang Huanwu Decoction combined with aspirin and clopidogrel on myocardial infarction[J]. World Journal of Integrated Traditional and Western Medicine, 2020, 15(4): 678-681. DOI:10.13935/j.cnki.sjzx.200424 |
| [6] |
LEE Y S, WOO S C, KIM S Y, et al. Understanding the multi-herbal composition of Buyang Huanwu Decoction: a review for better clinical use[J]. Journal of Ethnopharmacology, 2020, 255(7): 112765. |
| [7] |
常艺, 米刘悦, 张相安, 等. 基于细胞信号通路探讨黄芪多糖治疗溃疡性结肠炎研究进展[J]. 辽宁中医药大学学报, 2023, 25(4): 166-171. CHANG Y, MI L Y, ZHANG X A, et al. Research progress in the treatment of Astragalus polysaccharide in the treatment of ulcerative colitis based on cell signaling pathway[J]. Journal of Liaoning University of Traditional Chinese Medicine, 2023, 25(4): 166-171. |
| [8] |
张嘉峻, 李文璇, 崔馨方, 等. 肠道菌群在炎性肠病中的研究进展[J]. 医学综述, 2022, 28(13): 2537-2542. ZHANG J J, LI W X, CUI X F, et al. Research progress of gut microbiota in inflammatory bowel disease[J]. Medical Recapitulate, 2022, 28(13): 2537-2542. DOI:10.3969/j.issn.1006-2084.2022.13.007 |
| [9] |
於李龙, 陈文华, 秦路平, 等. 中药与肠道菌群相互作用的研究进展[J]. 浙江中西医结合杂志, 2022, 32(9): 881-884. YU L L, CHEN W H, QIN L P, et al. Research progress on the interaction between traditional Chinese medicine and intestinal flora[J]. Zhejiang Journal of Integrated Traditional Chinese and Western Medicine, 2022, 32(9): 881-884. |
| [10] |
TURNBULL R E, SANDER K N, TURNBULL J, et al. Profiling oxylipins released from human platelets activated through the GPVI collagen receptor[J]. Prostaglandins & Other Lipid Mediators, 2022, 158(12): 106607. |
| [11] |
卞敬琦, 张玉昆, 冯月男, 等. 补阳还五汤对高脂血症大鼠血液流变学和血小板聚集作用的影响[J]. 中国医药导报, 2021, 18(28): 40-43, 47. BIAN J Q, ZHANG Y K, FENG Y N, et al. Effect of Buyang Huanwu Decoction on hemorheology and platelet aggregation in hyperlipidemia rats[J]. China Medical Herald, 2021, 18(28): 40-43, 47. |
| [12] |
CAPODANNO D, MILLUZZO R P, ANGIOLILLO D J. Intravenous antiplatelet therapies (glycoprotein Ⅱb/Ⅲa receptor inhibitors and cangrelor) in percutaneous coronary intervention: from pharmacology to indications for clinical use[J]. Therapeutic Advances in Cardiovascular Disease, 2019, 13(2): 1753944719893274. |
| [13] |
ZHENG S L, RODDICK A J. Association of aspirin use for primary prevention with cardiovascular events and bleeding events: a systematic review and meta-analysis[J]. JAMA, 2019, 321(3): 277-287. |
| [14] |
ZHANG C H, SU X L, LIU Y Y, et al. Study on the effect of antiplatelet and gastric mucosal protection of traditional Chinese medicine invigorating qi and hemostasis[J]. Journal of Inflammation Research, 2021, 14(1): 3023-3037. |
| [15] |
ADAK A, KHAN M R. An insight into gut microbiota and its functionalities[J]. Cellular and Molecular Life Sciences, 2019, 76(3): 473-493. |
| [16] |
Modulating composition and metabolic activity of the gut microbiota in IBD patients[J]. International Journal of Molecular Sciences, 2016, 17(4): 578.
|
| [17] |
MÄKIVUOKKO H, TⅡHONEN H, TYNKKYNEN H, et al. The effffect of age and non-steroidal antiinflflammatory drugs on human intestinal microbiota composition[J]. The British Journal of Nutrition, 2010, 103(2): 227-234. |
| [18] |
LUIS A S, BRIGGS J, ZHANG X Y, et al. Dietary pectic glycans are degraded by coordinated enzyme pathways in human colonic Bacteroides[J]. Nature Microbiology, 2017, 3(2): 210-219. |
| [19] |
杨淑惠, 李成曦, 李建萍, 等. 基于肠道菌群测序及非靶向脂质组学分析黄蜀葵花对炎症性肠病小鼠菌群稳态及脂质代谢的影响[J]. 药学学报, 2022, 57(12): 3546-3556. YANG S H, LI C X, LI J P, et al. Regulatory effect of Flos Abelmoschus manihot in mice with inflammatory bowel disease based on gut microbiota sequencing and untargeted lipidomics[J]. Acta Pharmaceutica Sinica, 2022, 57(12): 3546-3556. |
| [20] |
曹晖, 吴东升, 张彧, 等. 基于高通量测序技术研究芍药汤对溃疡性结肠炎大鼠肠道菌群的影响[J]. 中国中医药信息杂志, 2021, 28(1): 61-66. CAO H, WU D S, ZHANG Y, et al. Effects of Shaoyao Decoction on intestinal flora of ulcerative colitis rats based on high-throughput sequencing technology[J]. Chinese Journal of Information on Traditional Chinese Medicine, 2021, 28(1): 61-66. |
| [21] |
田小平, 夏军, 卫静雯, 等. 基于16S rDNA测序研究当归芍药散调控肠道菌群改善SAMP8小鼠认知能力的作用机制[J]. 中国实验方剂学杂志, 2022, 28(24): 26-34. TIAN X P, XIA J, WEI J W, et al. Mechanisms of Danggui Shaoyao San in improving cognitive ability in SAMP8 mice by regulating gut microbiota via 16S rDNA sequencing[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2022, 28(24): 26-34. |
2. Graduate School, Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
 2023, Vol. 40
2023, Vol. 40